
Stężenie procentowe
roztworów

Podstawowe pojęcia
Roztwór
Roztwór
Jednorodna mieszanina co najmniej dwóch substancji, przy
czym składników nie można rozróżnić gołym okiem.
Roztwory rzeczywiste odróżnia się od koloidów, gdyż
zwierają cząstki (cząsteczki lub jony), tak małe, że nie
rozpraszają padającego światła.
Rozpuszczalnik
Rozpuszczalnik
Ciecz zdolna do tworzenia roztworu po zmieszaniu z ciałem
stałym, inną cieczą lub gazem.
Najbardziej znanym rozpuszczalnikiem jest woda.

Rozpuszczalniki zachowują się względem substancji
rozpuszczanych zgodnie z zasadą „ podobne rozpuszcza
się w podobnym”
To znaczy:
- jeśli w substancji występują tylko wiązania niepolarne , to
rozpuszcza się ona tylko w rozpuszczalnikach
niepolarnych;
- jeśli w cząsteczkach są tylko wiązania polarne, substancje
mogą rozpuszczać się tylko w rozpuszczalnikach o
charakterze polarnym
Przykłady:
Alkany rozpuszczają się w czterochlorku węgla.
Chlorek sodu rozpuszcza się w wodzie.

Stężenie roztworu
Stężenie roztworu
Ilościowe określenie składu roztworu wyrażające
zawartość substancji rozpuszczonej w określonej ilości
lub objętości roztworu.
Najczęściej stosuje się następujące sposoby określania
stężenia:
-
- stężenie molowe
-
- stężenie procentowe
Gęstość roztworu [d]
Gęstość roztworu [d]
Masa jednostkowej objętości roztworu.
Równa jest stosunkowi masy roztworu do jego objętości.
roztworu
roztworu
V
m
d

masa
roztworu
= masa
substancji rozpuszczonej
+masa
rozpuszczalnika
W przypadku roztworów wodnych
masa
rozpuszczalnika
= m
H2O
m
r
= m
s
+ m
H2O
d
r
∙V
r
= m
s
+
m
H2O
Stężenie
Stężenie
procentowe roztworu
procentowe roztworu
Określa liczbę gramów substancji rozpuszczonej zawartej w
100 gramach roztworu, czyli procent wagowy substancji w
stosunku do masy roztworu, którą przyjmuje się za 100%
Stężenie procentowe obliczmy dzieląc masę substancji
rozpuszczonej przez masę roztworu w którym się znajduje i
wyrażamy w procentach.
%
100
r
s
p
m
m
C
%
100
r
s
p
m
m
C
%
100
r
r
s
p
V
d
m
C
C
p
– stężenie
m
s
- masa
substancji
m
r
– masa roztworu
%
100
2
O
H
s
s
p
m
m
m
C

Jak interpretować zapis C
p
= a % ?
W 100g tego roztworu znajduje się
a
gramów substancji
rozpuszczonej.
Aby otrzymać 100 g tego roztworu należy
a
gramów
substancji rozpuścić w m
H2O
= (100 g – a g) wody.
Przykłady:
C
p
= 15%
W 100 g tego roztworu znajduje się 15 g substancji
rozpuszczonej.
Aby otrzymać 100 g 15% roztworu należy 15 g substancji
rozpuścić w 85 g wody (m
H2O
= 100g – 15g = 85 g).

Jaka ilość substancji rozpuszczonej znajduje się w 300 g tego
roztworu ?
15 g substancji ― 100 g roztworu
x g substancji ― 300 g roztworu
x = 15 g ∙ 300 g ∕ 100 g
x = 45 g
Jaką jego część stanowi woda?
m
H2O
= 300 g – 45 g = 255 g
W jakiej ilości tego roztworu znajduje się 7,5 g substancji
rozpuszczonej?
15 g substancji ― 100 g roztworu
7,5 g substancji ― x g roztworu
x = 7,5 g ∙ 100 g ∕ 15 g
x = 50 g

Obliczenia z wykorzystaniem wzoru
Wiedząc, że w 450 g roztworu znajduje się 90g substancji
rozpuszczonej określ stężenie procentowe tego roztworu.
Dane:
m
s
= 90 g
m
r
= 450g
C
p
= x
C
p
= 90 g ∕ 450 g ∙ 100%
C
p
= 900 ∕ 45 %
C
p
= 20 %
Odp. Jest to roztwór 20%
%
100
r
s
p
m
m
C

W 200 g wody rozpuszczono 40 g substancji.
Oblicz stężenie procentowe otrzymanego roztworu.
Dane:
m
H2O
= 200 g
m
s
= 40 g
C
p
= x
%
100
2
O
H
s
s
p
m
m
m
C
m
r
= 200 g + 40 g = 240 g
C
p
= 40 g ∕ 240 g ∙ 100 %
C
p
= 16,78 %
Odp. Otrzymano roztwór o stężeniu 16,78 %

Ile należy wziąć 30 % roztworu, aby było w nim 9 g
substancji rozpuszczonej?
Dane:
C
p
= 30%
m
s
= 9 g
m
r
= x
%
100
r
s
p
m
m
C
C
p
∙ m
r
= m
s
∙ 100%
m
r
= m
s
∙ 100% ⁄ C
p
m
r
= 9 g ∙100% ∕
30%
m
r
= 30 g
Odp. Należy wziąć 30 g tego roztworu.
I sposób
30 g ― 100 g
9 g ― x
x = 900 g ⁄ 30
x = 30 g
I sposób
30 g ― 100 g
9 g ― x
x = 900 g ⁄ 30
x = 30 g

Jaka ilość substancji rozpuszczonej znajduje się w 0,2 kg 36 %
roztworu?
Dane:
C
p
= 36%
m
r
= 0,2 kg = 200 g
m
s
= x
%
100
r
s
p
m
m
C
C
p
∙ m
r
= m
s
∙ 100%
m
s
= Cp ∙ m
r
∕ 100 %
m
s
= 36 % ∙ 200 g ⁄ 100%
m
s
= 72 g
Odp. W 200 g tego roztworu znajdują się 72 g
substancji rozpuszczonej.
I sposób
36 g ― 100 g
x g ― 200g
x= 200 g ∙ 36 g ∕
100 g
x = 72 g
I sposób
36 g ― 100 g
x g ― 200g
x= 200 g ∙ 36 g ∕
100 g
x = 72 g

Obliczenia z wykorzystaniem gęstości
Oblicz stężenie procentowe roztworu, wiedząc, że w 500
cm
3
znajduje się 15 g substancji rozpuszczonej. Gęstość
tego roztworu wynosi 1,2 g ∕ cm
3
Dane:
d = 1,2 g ∕ cm
3
Vr = 500 cm
3
m
s
= 15 g
%
100
r
s
p
m
m
C
m
r
= d ∙Vr
m
r
= 1,2 g ∙ 500 cm
3
= 600 g
Cp = 15 g ⁄ 600 g ∙100%
Cp = 2,5 %
Odp. Jest to roztwór o stężeniu 2,5 %

Mieszanie roztworów o różnych stężeniach
Po rozcieńczeniu roztworu czystym
rozpuszczalnikiem lub po zmieszaniu roztworów tej
samej substancji o różnych stężeniach otrzymuje się
nowy roztwór, w którym ilość substancji
rozpuszczonej jest sumą jej ilości w roztworach
wyjściowych, a masa roztworu równa sumie mas
roztworów wyjściowych.
C
p1
, m
s1
, m
r1
– dane dla pierwszego roztworu
C
p2
, m
s2
, m
r2
– dane dla drugiego roztworu
C
pk
,
m
sk
=
m
s1
+
m
s2
;
m
rk
=
m
r1
+
m
r2

Stężenie otrzymanego roztworu
%
100
rk
sk
pk
m
m
C
%
100
2
1
2
1
r
r
s
s
pk
m
m
m
m
C

300g 15% roztworu pewnej substancji zmieszano z 200g jej
30% roztworu. Jakie będzie stężenie procentowe
otrzymanego roztworu?
Dane:
Roztwór I
C
p1
= 15%; m
r1
= 300g; m
s1
= x g;
Roztwór II
C
p2
= 30%; m
r2
= 200g; m
s2
= y g
Roztwór końcowy
C
pk
= ? m
sk
= x + y; m
rk
= 300g + 200g
Obliczamy:
1. m
s1
15g/100g = x / 300g
x = 45 g
2. m
s2
30g/ 100g = y / 200g
y = 60g

%
100
2
1
2
1
r
r
s
s
pk
m
m
m
m
C
C
pk
= (45g + 60 g) ∙100% ∕ 500g
C
pk
= 105 ⁄ 5 %
C
pk
= 21 %
Odp. Uzyskano 21% roztwór.
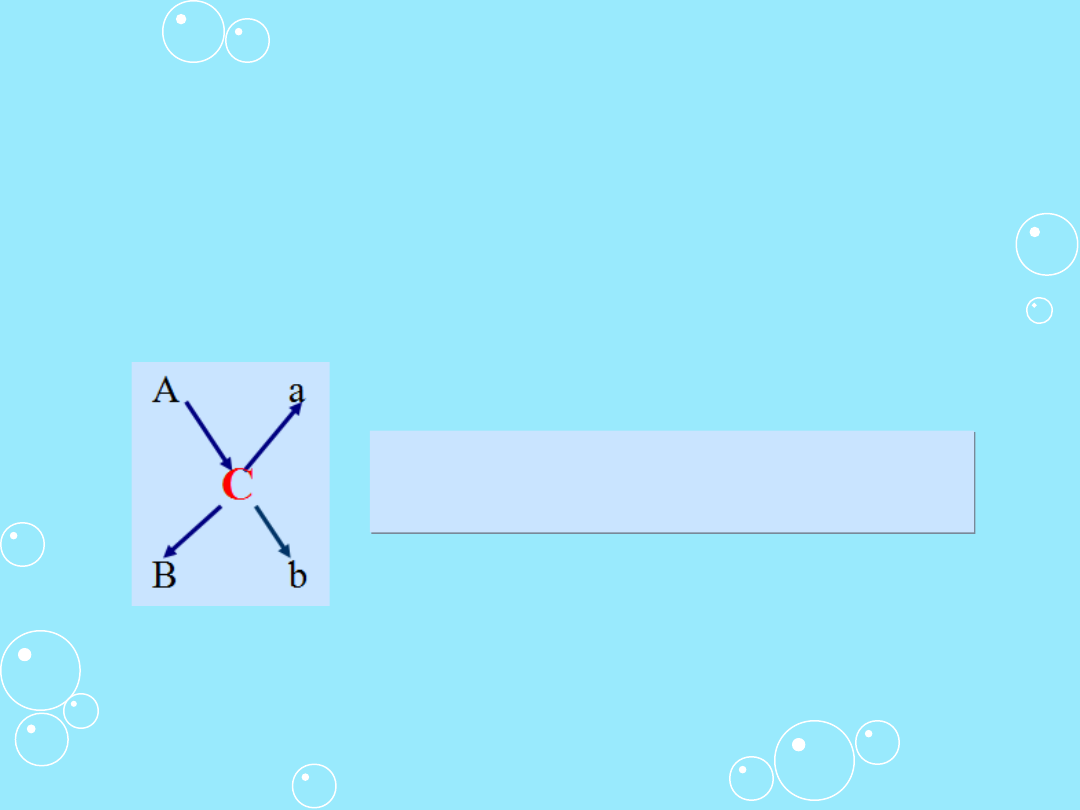
Metoda krzyżowa
Jeśli z dwóch roztworów o danym stężeniu procentowym A i
B chcemy otrzymać roztwór o wymaganym stężeniu C, to
stosunek wagowy roztworów A i B, które należy ze sobą
zmieszać, można wyliczyć metodą krzyżową.
b = ilość wagowa B% r-ru = A - C
A = ilość wagowa A % r-ru = C - B
b = ilość wagowa B% r-ru = A - C
A = ilość wagowa A % r-ru = C - B
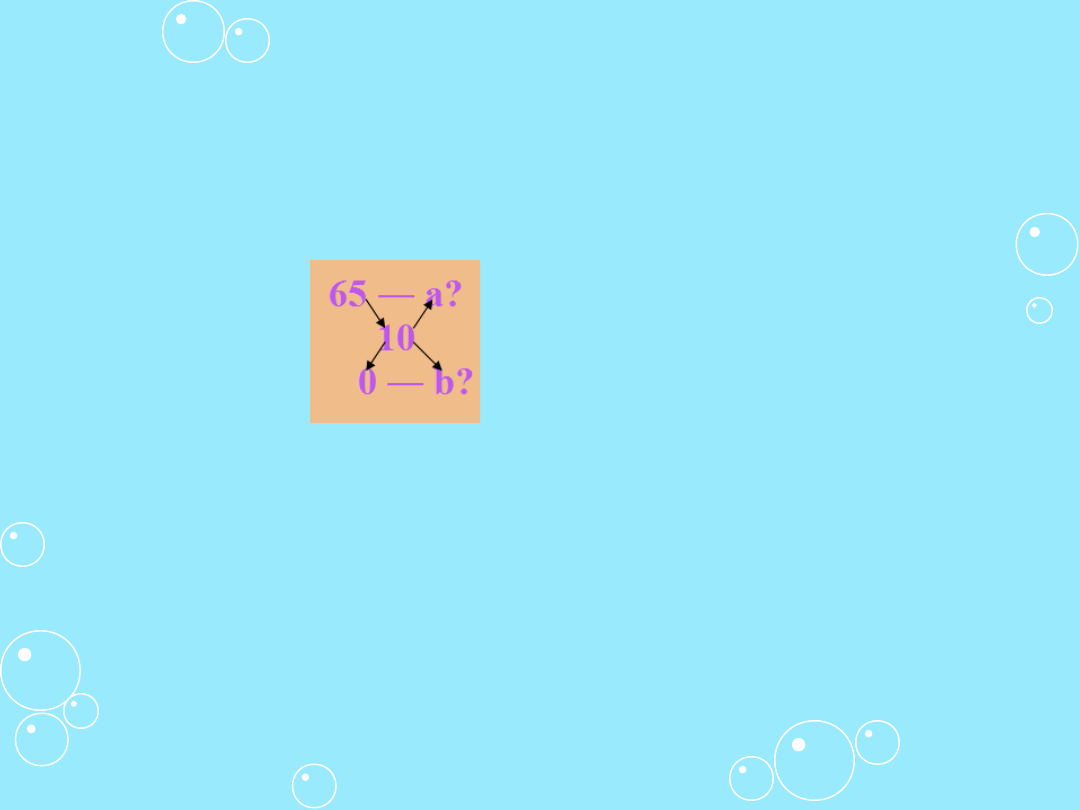
Przykład I
Dysponując 65% kwasem siarkowym i czystą wodą należy
otrzymać 10% kwas siarkowy. W jakim stosunku wagowym
należy zmieszać wodę z 65% kwasem?
Dane:
A = 65%
B = 0%
C = 10%
b = 65 – 10 = 55
a = 10 – 0 = 10
a / b = 10 / 55 = 2 / 11
Przez zmieszanie 2 części wagowych 65% roztworu z 11
częściami wagowymi wody otrzymujemy 13 części
wagowych 10% roztworu.
10 g 65% roztworu dodane do 55 g wody da nam 65g
10% roztworu.
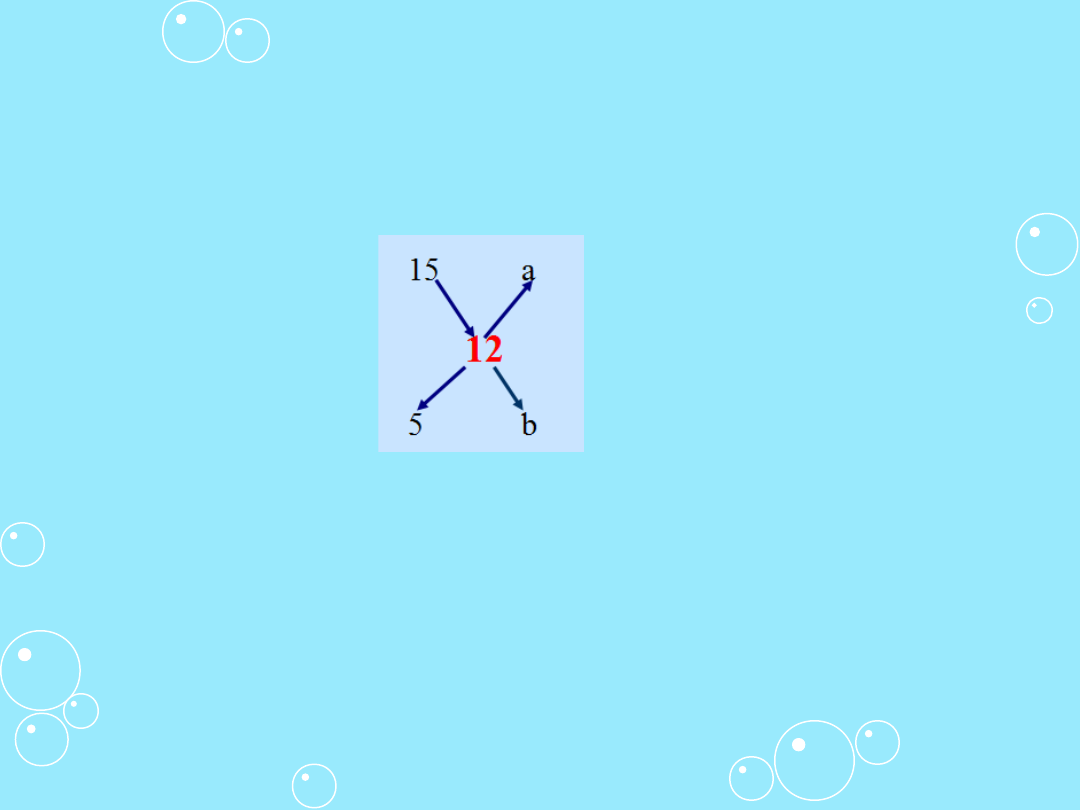
Przykład II
W jaki sposób można otrzymać 12% roztwór kwasu solnego
dysponując 15% i 5% roztworami tego kwasu ?
A = 15%
B = 5%
C = 12%
a = ?
b = ?
a = 12 - 5 = 7
b = 15 - 12 = 3
Przez zmieszanie 7 g 15% kwasu solnego i 3 g 5% kwasu
solnego otrzymuje się 10 g 12% roztworu tego kwasu.

Przykład II ( bez wykorzystania metody krzyżowej )
A = 15%
B = 5%
C = 12%
a = ?
b = ?
Przyjmijmy, że mamy otrzymać 100 g 12% roztworu
x oznacza masę roztworu o stężeniu A = 15%
y oznacza masę roztworu o stężeniu B = 5%
czyli
x + y = 100g
1.
W 100g 12% roztworu znajduje się 12 g czystego kwasu
a + b = 12 g
2.
Wyznaczamy ile czystego kwasu znajduje się x g 15%
roztworu
15 g ― 100g
a g
―
x g
a = 15 x / 100

3.
Wyznaczamy ile czystego kwasu znajduje się y g 5%
roztworu
5 g ― 100g
b g ― y g
b = 5y / 100
4.
Zależność z punktu
1
przedstawiamy w postaci:
15x/100 + 5y/100 = 12
5.
Rozwiązujemy układ równań
x + y = 100
15x/100 + 5y/100 = 12

x = 100 – y
15 (100 – y)
⁄
100 + 5y ⁄ 100 = 12
x = 100 – y
1500 – 15y + 5y = 1200
x = 100 – y
10y = 300
y = 30g
x = 70g
Roztwór 15% z roztworem 5% należy zmieszać w stosunku
wagowym 7/3.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
cp, Stężenie procentowe roztworów
STĘŻENIE PROCENTOWE ROZTWORÓW, Farmacja(0)
Stężenie procentowe roztworu i współczynnik załamania, dc, GPF, Fizyka lab, Ćw. 3
stezenia procentowe roztworow nauka
scen. - zmiana stężenia procentowego roztworów, chemia, scenariusze lekcji
Stężenie Procentowe Roztworów – Rozcieńczanie Roztworu
05 6 Stężenie procentowe roztworów zadania do lekcji nr 2
05 7 Stężenie procentowe roztworów zadania do lekcji nr 3
05 7 Stężenie procentowe roztworów zadania do lekcji nr 4
05 6 Stężenie procentowe roztworów Zamek Króla Wód
4 Stężenie procentowe roztworu
05 7 Stężenie procentowe roztworów zadania do lekcji nr 5
10.roztwory-stężenie procentowe
stezenie molowe roztworow wodnych 2
stezenie procentowe
¦CIˇGA - CHEMIA WYJ¦CIÓWKA cz[1].2, STĘŻENIE PROCENTOWE
stezenie procentowe receptura
Stężenie normalne roztworu to
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
więcej podobnych podstron