
Wewnątrznaczyniowy
katabolizm
lipoprotein.
Internalizacja LDL.

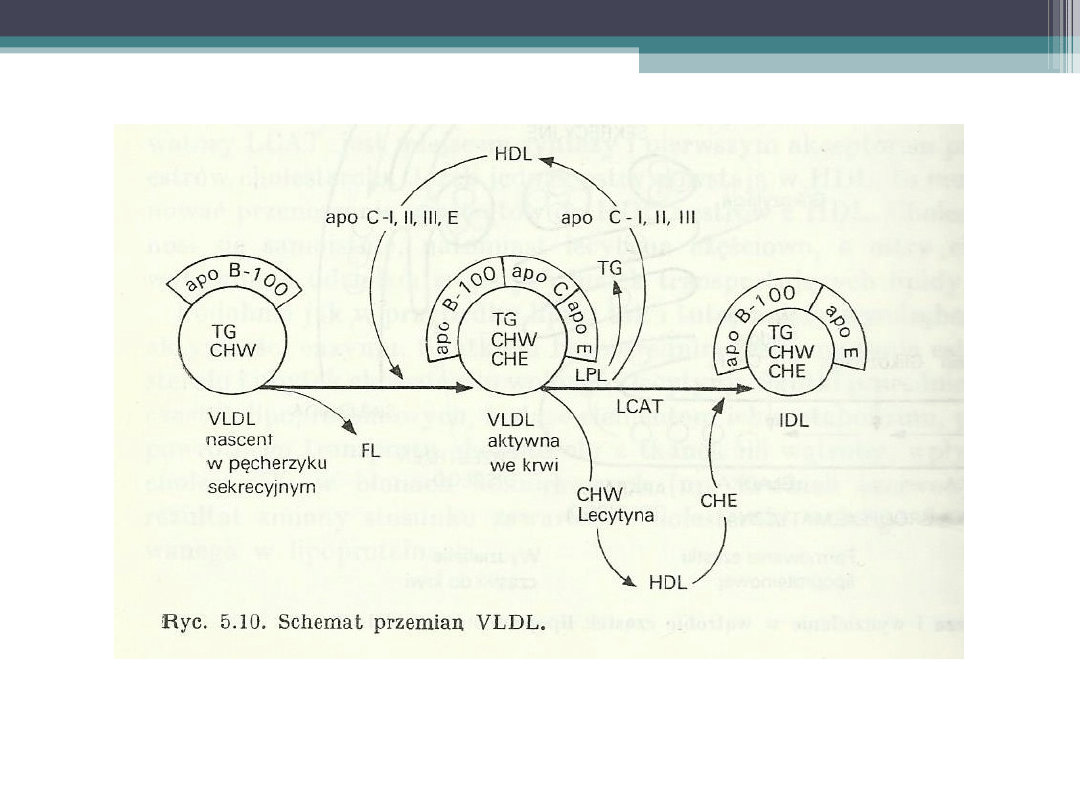
Katabolizm VLDL

VLDL
•
Cząstki o dużej zawartości triglicerydów, i
średnicy 30-80 nm;
•
Charakteryzuje je zawartość
apolipoproteiny B-100 oraz zdolność do
przekształcenia się w cząstki LDL.

•
Cząstki VLDL w pęcherzykach
wydzielniczych hepatocytów zawierają
apoB-100 i nieco apoE, ale nie ma w nich
już prawie apoC
•
Po wejściu do przestrzeni
okołozatokowych, i później w świetle
naczyń, tracą część fosfolipidów, a zyskują
apoC i apoE.

•
ApoC-I aktywuje LCAT, apoC-II jest
niezbędny do aktywacji lipazy
lipoproteinowej(LPL), a apoC-III jej
inhibitorem
•
Inną funkcją apoC-III jest czasowe
zakrywanie apoE. W miarę lipolizy
triglicerydów i utraty apoC, a w tym apoC-
III, jest odsłaniana apoE, co czyni cząstkę
rozpoznawalną przez receptory apoE.

•
Pozyskanie przez VLDL apoC-III
zapoczątkowuje kaskadę lipolizy, która
przebiega w dwóch etapach: od VLDL do IDL i
od IDL do LDL.
•
Etap pierwszy jest uzależniony przede
wszystkim od lipazy lipoproteinowej i LCAT;
cząstki tracą większość triglicerydów i apoC;
wykształcają się cząstki IDL
•
W drugim etapie IDL przekształcają się w
obecności lipazy wątrobowej-LH (która nie
wymaga apoC-II) w cząstki LDL, jednak część
IDL (do 40%) jest wychwytywana
bezpośrednio przez receptory apoE wątroby i
w mniejszym stopniu przez receptory apoB/E.

β-VLDL
•
Cząstki o takiej samej gęstości jak VLDL,i
o ruchliwości elektroforetycznej takiej jak
β-lipoproteiny, zawierają więcej estrów
cholesterolu i mają zwiększony stosunek
zawartości tych estrów do triglicerydów.

β-VLDL- katabolizm
•
Makrofagi/monocyty posiadają swoiste
receptory dla β-VLDL, odrębne od
receptorów apoB/E i apoE.
•
Komórki te gromadzą estry cholesterolu w
środowisku zawierającym β-VLDL, co nie
zmniejsza się w przypadku zwiększenia
zawartości cholesterolu w komórce.

•
Na β-VLDL składają się cząstki resztkowe
(remnanty) pochodzenia wątrobowego,
zawierające apoB-100 (remnanty VLDL), i
cząstki resztkowe pochodzenia jelitowego,
które zawierają apoB-48 (remnanty
chylomikronów).
•
W hiperlipoproteinemii typu III nie
nagromadzają się w osoczu resztkowe
VLDL, natomiast upośledzony jest
wychwyt β-VLDL pochodzących od
chylomikronów.

•
Β-VLDL są sumą cząstek resztkowych
pochodzących z VLDL i chylomikronów.
•
Wiążą je swoiste receptory makrofagów, a
także receptory hepatocytów.
•
Ponieważ istnieją dowody, że apoB-48 nie
jest ligandem dla żadnego receptora, więc
jest wysuwana hipoteza, że apoB-48
utrudnia wiązanie resztkowych CHM
przez receptory apoB/E, natomiast apoB-
100 utrudnia wiązanie remnantów VLDL
przez receptory apoE.

Katabolizm
chylomikronów

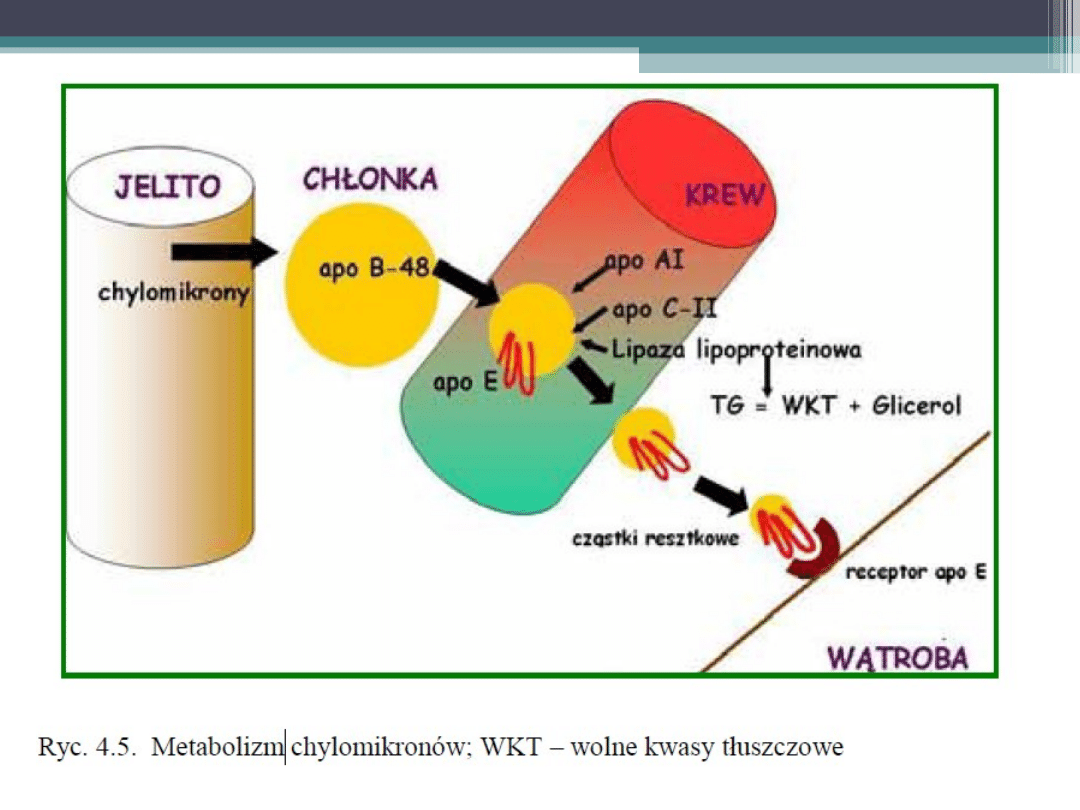
Chylomikrony
•
duże lipoproteiny występujące w osoczu
•
kuliste cząstki o wielkości 0,3–1,5 μm
•
powstają w ścianie jelita cienkiego, w
enterocytach, kosztem ATP
•
ich metabolizm chylomikronów jest krótki,
trwa od 0,5 do 1,5 h

•
Ze względu na hydrofobowy charakter
cząstek lipidów, w tym trójglicerydów oraz
cholesterolu, nie mogą one być
transportowane bezpośrednio w
środowisku wodnym krwi. Aby transport
mógł być możliwy, powstają kompleksy
lipoproteinowe np. chylomikrony, których
otoczka jest hydrofilowa, a cała cząstka
jest rozpuszczalna w wodzie.
•
Chylomikrony transportują, pochodzące z
pokarmu m.in. trójglicerydy, fosfolipidy i
cholesterol, z jelita cienkiego do wątroby i
mięśni.

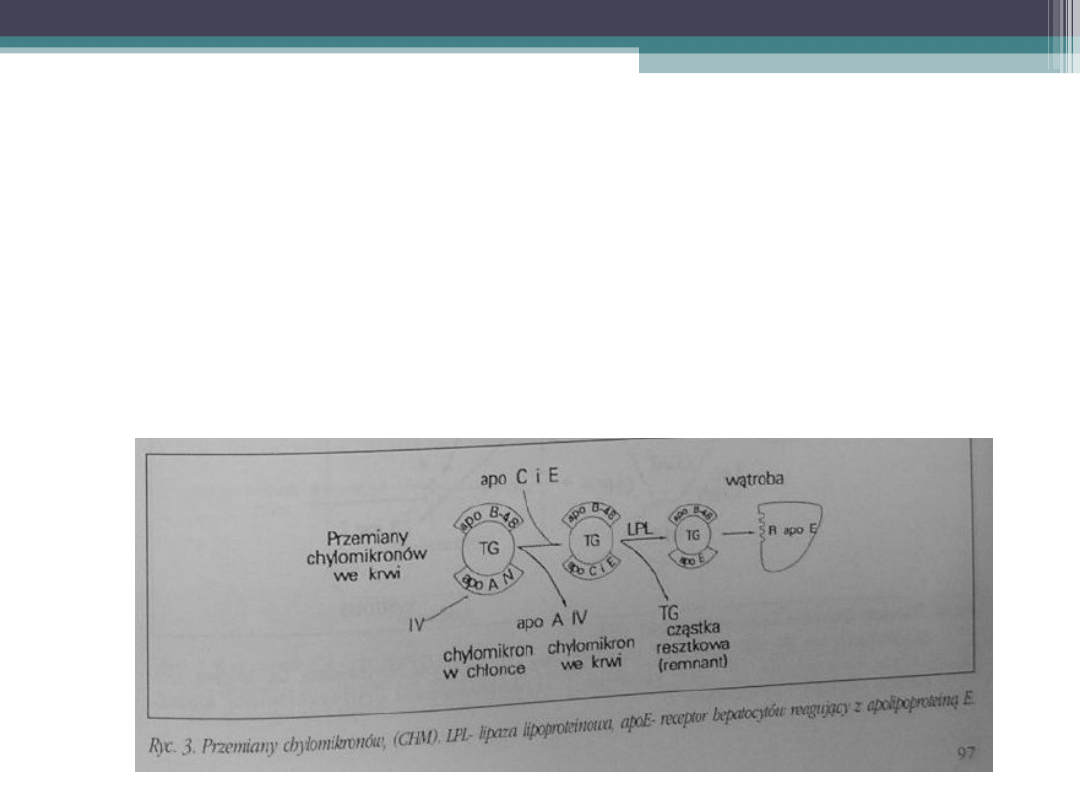
Katabolizm chylomikronów
•
Tłuszcze pokarmowe po ich emulsyfikacji,
hydrolizie i micelizacji ulegają wchłonięciu
do enterocytów jelita cienkiego.
•
Następuje resynteza lipidów, głównie
triglicerydów, a także synteza
apolipoprotein B-48 i A-IV.
•
Uformowane chylomikrony przechodzą do
chłonki, a następnie do krwi.
•
We krwi chylomikrony zyskują apoC, apoE
i apo A-I.
•
W tak zmienionych chylomikronach lipaza
lipoproteinowa powoduje szybką hydrolizę
większości triglicerydów. Powstają
znacznie mniejsze cząstki resztkowe
(remnanty), w których komponent
białkowy stanowią tylko apolipoproteiny B
– 48 i E.

Apolipoproteina E reaguje z receptorami E
hepatocytów, co powoduje wycofanie
cząstek resztkowych z krwi.
W rezultacie rano na czczo chylomikronów
we krwi nie ma, natomiast kwasy
tłuszczowe triglicerydów znajdują się
głównie w tkance tłuszczowej, a
cholesterol w wątrobie.
Obecność chylomikronów rano na czczo
wskazuje na zakłócenie w przebiegu ich
przemian (chylomikronemia).

•
Ocenia się, że jedna cząstka chylomikronowa
przebywa we krwi 7 – 10 minut.
•
Szybki katabolizm i stopniowe pojawianie się
chylomikronów we krwi sprawiają, że po
posiłku w normalnych warunkach utrzymuje
się przez pewien czas stosunkowo niewielka
ilość chylomikronów we krwi, co objawia się
umiarkowanym wzrostem TG (lipemia
pokarmowa).
•
W zaburzeniach chylomikronów poziom TG
we krwi jest bardzo wysoki, wzrasta też
stężenie cholesterolu.

Internalizacja LDL

Endocytoza przy udziale receptorów
•
Cząsteczki klatryny-triskeliony mają trzy ramiona, które
polimeryzując tworzą pięcio- i sześcioboki, tworzące
„klateczkę" o średnicy ok. 200nm. Agregacja klatryny na
powierzchni pęcherzyka zachodzi samoczynnie, ale nie jest
bezpośrednia i wymaga udziału innych białek.
•
Etapy endocytozy przy udziale pęcherzyków okrytych
klatryną:
•
- Powstanie dołeczków na powierzchni błony
•
W dołeczkach receptory mogą być zgromadzone (np. dla
LDL,), lub są tam wprowadzane dopiero po przyłączeniu się
ligandu, (np. dla receptory dla czynników wzrostowych)
•
- Dołeczki zagłębiają się i po 30 sek. stają się pęcherzykami
okrytymi- później tracą okrywę i przechodząc w pęcherzyki
nieokryte. Te ostatnie zlewają się ze sobą tworząc przedział
endosomowy.

•
Cząsteczki LDL (Iow density lipoproteins)
składają się z ok. 500 cz. cholesterolu
zlokalizowanego wewnętrznie, oraz
pokrywy zewnętrznej składającej się z
białek. Generalnie komórka może albo
syntetyzować cholesterol (w RE
g
i) albo
pobierać go przez błonę. W warunkach
dostatecznej podaży cholesterolu
przeważa jego pobieranie, a synteza
uruchamiań jest przy niedoborze
cholesterolu.

•
Receptor dla LDL znajduje się w dołeczku
i rozpoznaje białka warstwy zewnętrznej
LDL. Po rozpoznaniu białka lipoproteiny,
formuje się pęcherzyk najpierw okryty, a
później odkryty, który dalej łączy się z
przedziałem endosomowym, gdzie
dochodzi do odłączenia ligandu (tutaj
LDL) który zostaje skierowywany do
lizosomów i tam strawiony.

Defekt
•
Warunkiem rozpoznania LDL jest
obecność tzw. motywu rozpoznawczego,
którego defekt prowadzi do tego, że LDL
jest nie wychwytywany, co często
prowadzi do podniesionego poziomu HDL
i samego cholesterolu we krwi, co dalej
predysponuje do miażdżycy naczyń.

Głównym typem komórek wychwytujących umiejscowione pod
śródbłonkiem lipoproteiny są makrofagi. Pochodzą one z tych
krążących monocytów, które wniknęły do ściany naczyń w
odpowiedzi na chemokiny. Chemokiny są uwalniane przez komórki
śródbłonka w odpowiedzi zarówno na gromadzące się pod
powierzchnią lipoproteiny, jak i pod wpływem cytokin
pochodzących z komórek T. Pod wpływem innych cząsteczek
uwalnianych przez komórki śródbłonka, przede wszystkim
czynnika stymulującego monocyty (macrophage colony stimulating
factor – MCSF), monocyty różnicują się w makrofagi. Te z kolei
kontaktują się z podśródbłonkowymi lipoproteinami i wychwytują
je, gromadząc w ten sposób pochodzący z nich cholesterol.
Gromadząc go wewnątrzkomórkowo w postaci kropli
zawierających estry cholesterolu, zamieniają się w komórki
piankowate (foam cells). Są one oznaką rozwoju wczesnej
miażdżycy, ale występują także w zmianach zaawansowanych.

•
O cholesterolu lipoprotein podległych internalizacji przez
makrofagi decydują procesy zachodzące na powierzchni
komórek i receptory. W badaniach in vitro hodowli
komórkowych wykazano, że natywne LDL podlegają
internalizacji przez makrofagi znacznie słabiej niż w ścianie
naczyń. Stąd wzięła się koncepcja o modyfikacji LDL
ułatwiającej wychwyt LDL przez te komórki. Spośród różnych
propozycji dwa sposoby modyfikacji LDL wydają się
najbardziej istotne: utlenianie i agregacja.
•
W uszkodzeniach miażdżycowych stwierdza się obecność
utlenionych cząsteczek LDL (oxy-LDL). Wiadomo też, że
makrofagi wychwytują utlenione LDL znacznie szybciej i
łatwiej niż inne postaci LDL. W wychwycie tym uczestniczą
receptory zmiatające klasy A, B (np. CD 36) oraz podobny do
lektyny receptor utlenionych LDL typu 1 (lectin- like oxidized
LDL receptor-1 – LOX-1). Jest jednak mało prawdopodobne,
aby ten tor metabolizmu LDL, jakkolwiek bardzo istotny w
powstawaniu uszkodzenia miażdżycowego, był jedynym.

Bibliografia
•
„Biochemia kliniczna” S. Angielski, Z.
Jakubowski, M. Dominiczak
•
„Rola lipidów w powstawaniu miażdżycy”
Anna Skoczyńska, Katedra i Klinika Chorób
Wewnętrznych, Zawodowych i Nadciśnienia
Tętniczego Akademii Medycznej we
Wrocławiu
Dziękujemy za uwagę ;)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
Wykład katabolizm azotu aminokwasów
uklad wewnatrzwydzielniczy
zakazenia wewnatrzbrzuszne szpit
Zakażenia wewnątrzszpitalne
PREZENTACJA wewnatrzwydzielniczy
metodyka katabolozm
LIPIDY I LIPOPROTEINY OSOCZA(1)
BKiIg sem 3 wykład 2 Transport wewnątrzkomórkowy
Patogeny wewnatrzkomorkowe
ANALIZA DOKUMENTÓW WEWNĄTRZSZKOLNYCH, Dokumenty(1)
Zespoły gruczolakowatości wewnątrzwydzielniczej
Diagramy relacji wewnątrzrodzinnych
Rój trzęsień ziemi zarejestrowany wewnątrz krateru wulkanu Katla, W ஜ DZIEJE ZIEMI I ŚWIATA, ●txt RZ
Kontrapulsacja wewnątrzaortalna
ZEWNĄTRZSZKOLNE I WEWNĄTRZSZKOLNE FORMY DOSKONALENIA
Wewnątrzszkolny System Oceniania
Ks. M. Poradowski Kościół od wewnątrz zagrożony, Kościół
Wewnatrzszkolny system doradztwa zawodowego, Zawodoznawstwo
więcej podobnych podstron