
Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Ból pooperacyjny.
Inwazyjne monitorowanie chorego
przebywającego na OIT
1. Ból pooperacyjny
1.1. Czynniki wpływające na natężenie i czas trwania bólu pooperacyjnego
2. Pielęgnowanie chorego z zaburzeniami oddechowymi
2.1. Tlenoterapia
2.2. Wentylacja mechaniczna
2.3. Monitorowanie w niewydolności oddechowej
3. Pielęgnowanie chorego z niewydolnością układu krążenia
4. Pielęgnowanie chorego we wstrząsie
5. Rola pielęgniarki w enteralnym i parenteralnym żywieniu chorych
5.1. Żywienie enteralne
5.1.1. Skład mieszanek do żywienia enteralnego
5.2. Żywienie pozajelitowe
Słownik
Bibliografia
Literatura podstawowa
Literatura dodatkowa
1

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
1. Ból pooperacyjny
Rozwój medycyny spowodował, że średnia wieku wydłuża się, chociaż choroby wciąż są
przyczyną wielu zgonów. Przykładem takim jest sepsa, która prowadzi do niewydolności
wielonarządowej. Jest ona jednym z największych zagrożeń życia człowieka i wyzwań dla
współczesnej medycyny. W postępowaniu z chorym na sepsę priorytetowe znaczenie ma
inwazyjne monitorowanie. W tym module skoncentrowano się na problemach
hemodynamicznych pacjentów intensywnej terapii oraz na udziale pielęgniarki
w monitorowaniu chorego, a także na roli pielęgniarki w żywieniu ciężko chorych.
Wiele uwagi poświęcono bólowi, który jest integralną składową każdego zabiegu
operacyjnego i zazwyczaj licznych chorób, jest także dziś łatwiej akceptowany, gdyż ma
charakter przejściowy i jest konsekwencją działań leczniczych. Wiemy, że boleć wcale nie
musi, należy tylko odpowiednio zaplanować i wdrożyć postępowanie przeciwbólowe.
W tym wypadku dużą rolę odgrywa pielęgniarka, ponieważ to ona najdłużej przebywa
z pacjentem.
Z bólem spotkał się każdy, istnieje wiele jego definicji. Z całą pewnością ból to jest to, co
pacjent nazywa bólem.
Nikt nie prowadzi badań nad częstotliwością występowania bólu, nie ma też szczegółowej
statystyki, pozwalającej scharakteryzować dolegliwości bólowe. Prawdopodobnie w takim
rejestrze musielibyśmy się znaleźć wszyscy, bo nie ulega wątpliwości, że ból jest
najczęstszym objawem większości chorób. Jest doznaniem zarówno fizycznym, jak
i zmysłowym. Każdy przeżywa go inaczej — na swój sposób.
Faktem jest, że corocznie na całym świecie operuje się miliony pacjentów. Z urazem
operacyjnym — tak jak z każdym urazem — związany jest ból. Ból pooperacyjny to
specjalny rodzaj bólu — w pełnym znaczeniu tego słowa jest to ból ostry, nocyceptywny
,
powstający w następstwie uszkodzenia tkanek.
Tylko 30% poddanych zabiegom chirurgicznym pacjentów nie cierpi z powodu bólu po
zabiegu. Oznacza to, że większość chorych narażona jest na niepotrzebne cierpienie.
Można opanować ból dzięki odpowiedniemu postępowaniu przeciwbólowemu. Postęp
medycyny oraz rozwój badań neurofizjologicznych i neurofarmakologicznych pozwoliły
poznać mechanizmy działania wszelkich procesów związanych z powstawaniem bólu.
2

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Postęp ten dotyczy również mechanizmów działania poszczególnych leków i metod
stosowanych w postępowaniu analgetycznym.
Racjonalne przesłanki uzasadniające potrzebę uśmierzania bólu pooperacyjnego:
1. Humanitarna — wynikająca z pobudek deontologicznych, oparta na starej sentencji
sedare dolorem opus divinum est.
2. Medyczna — wynikająca z doświadczeń laboratoryjnych i klinicznych:
⎯ zniesienie bólu znacznie zmniejsza, a nawet znosi reakcję na jatrogenny uraz,
⎯ zniesienie bólu poprawia efektywność leczenia w okresie pooperacyjnym przez
obniżenie ryzyka wystąpienia powikłań, szczególnie ze strony układu oddechowego
i krążenia.
3. Ekonomiczna — brak powikłań oznacza prawidłowy przebieg okresu pooperacyjnego
i krótszą hospitalizację. W efekcie daje zmniejszenie kosztów dziennego pobytu
i skrócenie pobytu pacjenta w szpitalu.
4. Ułatwienie procesu zdrowienia.
W przypadku braku skutecznej terapii przeciwbólowej utrzymujący się ostry ból powoduje
narastanie zmian patofizjologicznych w ośrodkowym układzie nerwowym. Ta postać bólu
może przekształcić się w przewlekły zespół bólowy, tzw. przewlekły ból pooperacyjny.
Mimo że dzisiejsza wiedza, środki i metody terapeutyczne umożliwiają skuteczne leczenie
bólu pooperacyjnego, to jego uśmierzenie jest niewystarczające — u ok. 2/3
operowanych pacjentów ból staje się powodem niepotrzebnego cierpienia, ale należy
pamiętać, że tak być nie musi — obecna wiedza, technika i leki, jakimi dysponujemy,
umożliwiają całkowite zniesienie bólu.
W Polsce postępowanie przeciwbólowe prowadzone jest w sposób tradycyjny, według
powielanych nawyków stosowanych od lat na oddziałach chirurgicznych. Najczęściej
bywają to środki podawane po zgłoszeniu bólu przez pacjenta w iniekcji domięśniowej.
Bywa i tak, że pacjent — zamiast skutecznego postępowania analgetycznego —
otrzymuje informację: „po zabiegu boleć musi”. Pogląd ten wynika z przekonania, że ból
jest integralną i naturalną składową okresu pooperacyjnego, ale został on
zdyskredytowany przez współczesną wiedzę i potrzeby operowanych chorych.
3

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
1.1. Czynniki wpływające na natężenie i czas trwania bólu pooperacyjnego
Do czynników wpływających na natężenie i czas trwania bólu pooperacyjnego należą:
⎯ zabieg operacyjny — umiejscowienie i rozległość rany operacyjnej, stopień i rodzaj
uszkodzenia tkanki oraz czas trwania operacji,
⎯ technika anestezji — a zwłaszcza stosowanie opioidów i blokady aferentnej w czasie
zabiegu,
⎯ jakość opieki pooperacyjnej — pozbawienie długiego i spokojnego snu, ogólny hałas,
drażniące i niepokojące dźwięki, brak lub niedostateczny kontakt osobisty personelu
z chorym.
Bezbolesny przebieg pooperacyjny jest czynnikiem mającym duże znaczenie dla
satysfakcji pacjenta ze świadczonych usług zdrowotnych. Następstwa bólu przedłużają
pobyt pacjenta w szpitalu — tym samym wzrastają koszty leczenia i maleje zadowolenie
pacjenta z wykonanej usługi, jaką jest zabieg operacyjny.
Badania nad anatomią i fizjologią bólu nadal trwają. Wiadomo jednak, że za odczuwanie
bólu odpowiedzialne są: bodziec bólowy, receptory, nerwy, ośrodki rdzeniowe, drogi
nerwowe, ośrodki podkorowe i korowe.
Nocycepcja (łac. nocere — uszkadzać) jest procesem rozpoznawania uszkodzenia
tkanek wywołanego przez różnego typu bodźce. Informacje o uszkodzeniu lub zagrożeniu
uszkodzeniem (noxa) powstają poprzez podrażnienie zakończeń nerwowych
wyspecjalizowanej sieci włókien układu nocyceptywnego. Nocyceptory rozmieszczone są
zazwyczaj w skórze, tkance podskórnej, okostnej, stawach, mięśniach i trzewiach. Do tej
pory najlepiej zostały poznane zakończenia nerwowe skórne.
Nocyceptory posiadają wysoki próg bólu, czyli reagują dopiero wtedy, gdy działający na
nie bodziec mechaniczny, chemiczny lub termiczny staje się czynnikiem uszkadzającym.
Ból pourazowy, pooperacyjny oddziałuje nie tylko na naszą psychikę, ale także na układ
ruchowy, współczulny i wewnątrzwydzielniczy.
Odczyn ustroju na ten bodziec uzależniony jest od lęku (im silniejszy lęk, tym wyższe
oceny bólu), bólu (czasu trwania bólu przed operacją), wieku (osoby starsze zgłaszają
relatywnie mniejszy ból), płci (kobiety zgłaszają silniejszy ból), stanu ogólnego,
przygotowania do zabiegu operacyjnego (oczekiwania na zabieg), głodzenia, rodzaju
i miejsca trwania operacji, rozległości i uszkodzenia tkanek, zmniejszenia objętości krwi
4

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
krążącej, niedotlenienia i niedokrwienia, sposobu anestezji i zastosowanych do niej
środków, unieruchomienia, zakażenia.
Odczyn ten można zminimalizować. Jest on mniejszy w świadomym urazie, tzn. pacjent
powinien zostać poinformowany, jak rozległy będzie zakres przygotowania
przedoperacyjnego i jak długo ono potrwa, gdzie się obudzi (w sali pooperacyjnej, na
swojej sali), kiedy będzie można go odwiedzić, powinien dowiedzieć się o podawanych
lekach, o pozycji, w jakiej będzie ułożony po zabiegu i dlaczego, o umieszczonych w ranie
pooperacyjnej drenach, sączkach, o podłączonej aparaturze, powinien także znać powód
częstego pomiaru ciśnienia tętniczego i innych specjalnych obserwacji czy zabiegów,
należy mu wyjaśnić, dlaczego przez pewien czas będzie musiał pozostać na diecie.
Odpowiednio przygotowany pacjent odzyskuje kontrolę nad własną sytuacją, odbudowuje
autonomię, uczestniczy w podejmowaniu decyzji w procesie terapeutycznym,
współodpowiada za efekty leczenia.
Informowanie i rozmawianie z chorym pełni funkcję prewencji w zapobieganiu
zaburzeniom emocjonalnym. Ból jest doświadczeniem wysoce subiektywnym
i indywidualnym, powoduje odpowiedź fizjologiczną organizmu, którą można
zaobserwować w napadach lęku. Ból i lęk mają podobny wzór reakcji fizjologicznej,
często występują razem i trudno je zmierzyć.
Zabieg operacyjny jest ingerencją w nasz organizm, jego efekty trudno przewidzieć.
Uczucie bólu pojawia się wtedy, gdy przestaje działać analgezja śródoperacyjna. Jego
patomechanizm jest związany z uszkodzeniem tkanek, raną pooperacyjną i powstającym
wokół niej odczynem zapalnym. Ból pooperacyjny jest zjawiskiem samoograniczającym
się, o największym natężeniu w pierwszej dobie po operacji, a znacznie mniejszym
w następnych. Zasięg bólu jest proporcjonalny do wielkości urazu operacyjnego, chociaż
reakcję bólową modelują poprzednie doświadczenia bólowe, stan zdrowia oraz
uwarunkowania środowiskowe i osobowościowe.
Ból jest integralną i naturalną składową okresu pooperacyjnego, niekorzystnie wpływa
na:
⎯ psychikę,
⎯ układ ruchowy,
⎯ układ współczulny,
⎯ układ wewnątrzwydzielniczy.
5

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Ból pooperacyjny ma charakter ostry, ulega zaostrzeniu przy próbach wykonania ruchów,
kaszlu. Źródłem przypominającym o bólu są ciała obce (szwy, dreny, krwiaki), które
pobudzają mechanoreceptory czucia nocyceptywnego. Nieleczony prawidłowo ból
pooperacyjny zaburza podstawowe procesy fizjologiczne, doprowadzając do poważnych
powikłań i zagrożeń.
Może stać się źródłem nadciśnienia tętniczego, które jest czynnikiem ryzyka
występowania choroby niedokrwiennej serca, niewydolności krążenia, udaru mózgu. Ból
po zabiegu operacyjnym może stać się jednym z czynników niewydolności krążenia,
zaostrzenia choroby wieńcowej, infekcji, niedodmy, infekcji płuc, obniżenia odporności
organizmu, opóźnienia procesów gojenia, powikłań zakrzepowo-zatorowych oraz
nudności i wymiotów.
Ból nasila się podczas oddychania, wywołuje lęk oraz niechęć do głębokiego oddechu
i odksztuszania zalegającej wydzieliny, powoduje „usztywnienie” klatki piersiowej i mięśni
brzusznych. Pacjenci oddychają płytko, a zmniejszoną objętość oddechową kompensują
przyspieszonym oddechem. Ból powoduje też wzmożone napięcie mięśni szkieletowych —
z tego względu pacjenci mają tendencję do leżenia nieruchomo, wolą unikać zmiany
pozycji w obawie przed nasileniem bólu. Skutkiem takiego zachowania jest zwolnienie
krążenia żylnego, a nawet zastój w obrębie kończyn dolnych, co sprzyja powstawaniu
powikłań zakrzepowo-zatorowych. W ośrodkowym układzie nerwowym dochodzi do
możliwości utrwalania bólu („pamięć bólu”) — powstają wtedy pooperacyjne zespoły
bólowe.
W Polsce uśmierzanie bólu pooperacyjnego jest niewystarczające, często prowadzone
w sposób tradycyjny. Jak już wspomniano, u ok. 2/3 chorych operowanych ból staje się
powodem niepotrzebnego cierpienia, chociaż nie musi tak być. W Polsce nie ma — tak jak
w Stanach Zjednoczonych, Holandii czy Szwecji — odrębnej specjalności dla lekarzy
chcących zajmować się terapią przeciwbólową. W większości problemem tym zajmują się
anestezjolodzy i neurolodzy. Zastosowanie różnych technik analgetycznych wymaga
odpowiednich uprawnień organizacyjnych, odpowiednich schematów postępowania,
a także opracowań skutecznych metod zapobiegania i leczenia powikłań terapii
przeciwbólowej. W krajach rozwiniętych rośnie też liczba zespołów lekarskich
i pielęgniarskich zajmujących się leczeniem ostrego bólu. W Polsce tego typu działalność
ma dotąd charakter pojedynczych, lokalnych inicjatyw. Należy podjąć działania
popularyzujące zorganizowane systemy leczenia bólu pooperacyjnego jako standardowy
6

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
zakres usług okołooperacyjnych wśród pracowników opieki zdrowotnej i społeczeństwa.
Zakres usług, który obejmuje kompleksowe działanie, pozwala kontrolować ból.
W Polsce właściwie nie istnieją zespoły zwalczania bólu, rzadko pomiar natężenia bólu
jest mierzony i zapisywany na karcie obserwacji obok pomiaru ciśnienia, tętna czy
temperatury.
Zastosowanie różnych technik analgetycznych wymaga odpowiednich uprawnień
organizacyjnych, odpowiednich schematów postępowania, a także opracowań
skutecznych metod zapobiegania i leczenia powikłań terapii przeciwbólowej.
W naszym kraju w ciągu ostatnich dziesięciu lat dokonał się postęp w rozumieniu bólu
i organizacji leczenia przeciwbólowego. W Stanach Zjednoczonych wszystkie szpitale
posiadają zespoły leczenia bólu pooperacyjnego, w skład których wchodzą
anestezjolodzy, specjalnie przeszkolone pielęgniarki i farmaceuci. Istnieją odpowiednie
skale oceny bólu pooperacyjnego, np.:
1. Skala oceny liczbowej (numeryczna) — chory określa, jak silny jest ból, wskazując
na odpowiednią cyfrę w skali od 0 do 10, przy czym:
0 — nie ma bólu, 10 — najgorszy ból, jaki można sobie wyobrazić
1
2
3
4
5
6
7
8
9
10
2. Skala wzrokowo-analogowa (Vas-Visual Analog Scale) jest podobna do
numerycznej. Pacjent zaznacza odczuwany przez siebie ból na odcinku o długości
10 centymetrów. Początek odcinka określany jest jako całkowity brak bólu, koniec
oznacza najsilniejszy możliwy do wyobrażenia ból (nie najsilniej przeżyty lub
przeżywany). Wynik zapisywany jest w postaci liczby, która oznacza długość
wskazanego odcinka. Skalę tę graficznie przedstawić można na różne sposoby:
0
minimum
10
maksimum
0--------------------------------------------10
0 — nie ma bólu
10 — najsilniejszy ból, jaki pacjent może sobie wyobrazić
7

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Odwołuje się do doświadczeń i wyobraźni chorego, jednocześnie pozwala zapisać wynik
w sposób liczbowy i porównać wyniki w czasie kolejnych badań. Posługując się tą skalą,
należy upewnić się, czy chory rozumie, co oznaczają wartości skrajne, a także zwrócić
uwagę na to, że nie każdy chory jest w stanie wybrać odpowiedni dla siebie punkt na
linii.
W podobny sposób — za pomocą wszystkich wymienionych skal — można ocenić wyniki
stosowanego leczenia, należy wtedy zamiast wartości oznaczających nasilenie bólu
umieścić określenia opisujące różne stopnie poprawy stanu zdrowia, np.:
0 — nie ma ulgi w dolegliwościach
10 — całkowita ulga
0--------------------------------------------10
Pooperacyjne postępowanie przeciwbólowe powinno być zarówno skuteczne, jak
i bezpieczne. Dzięki temu pacjent powinien mieć zapewniony komfort.
Istnieje szereg środków i możliwości doboru odpowiedniej metody postępowania
analgetycznego. Można je stosować różnymi drogami:
1. Dożylną:
⎯ przez pojedyncze, powtarzane iniekcje,
⎯ przez ciągłą infuzję.
2. Centralnie:
⎯ zewnątrzoponowo,
⎯ podpajęczynówkowo,
⎯ pojedynczymi dawkami lub ciągłą infuzją.
3. Doodbytniczo.
4. Przezskórnie.
5. Analgezją sterowaną przez pacjenta (PCA):
⎯ dożylną,
⎯ domięśniową,
⎯ podskórną,
⎯ zewnątrzoponową,
⎯ podpajęczynówkową.
8

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Zastosowanie metody PCA (Patient Controlled Analgesia), w której chory w chwili
pojawienia się minimalnego bólu — przez naciśnięcie odpowiedniego przycisku — sam
reguluje dopływ środka analgetycznego do krwi, stwarza optymalne warunki
natychmiastowego uśmierzania bólu pooperacyjnego i realizację powyższej strategii.
PCA pozwala pacjentowi przejąć kontrolę nad podawaniem niewielkich dawek środka
analgetycznego w celu leczenia bólu. Podstawowym warunkiem skutecznego stosowania
tej metody jest zrozumienie zasady działania urządzenia. Pacjent sam naciska przycisk
urządzenia, kiedy konieczne jest uwolnienie się od bólu. Jeżeli aktualny czas i granica
dawki nie są przekroczone, aktywacja wymaganego mechanizmu powoduje podanie
dawki do krążenia systemowego lub dokręgowo. Bezpieczeństwo i skuteczność uzyskuje
się poprzez prawidłowe zaprogramowanie parametrów pompy PCA.
Zarówno do przestrzeni podpajęczynówkowej, jak i zewnątrzoponowej można wprowadzić
cewnik — dzięki temu stało się możliwe wydłużenie analgezji na okres pooperacyjny.
Analgezja regionalna oferuje wiele korzyści w leczeniu bólu pooperacyjnego. Przede
wszystkim bezbolesny okres pooperacyjny, poprawę wyników leczenia poprzez
zmniejszenie powikłań pooperacyjnych, wcześniejsze wypisanie ze szpitala. Tendencja
skracania przeciętnej długości pobytu chorego w szpitalu nadal się utrzymuje.
W 1999 roku statystyczny pacjent przebywał w szpitalu ogólnym przez 9,3 dni,
a w 2000 roku — 8,9 dni. Na oddziale chirurgicznym pobyt chorego zmniejszył się nawet
do 8 dni. Z pewnością jest to wynik dążeń do obniżenia kosztów leczenia przez
maksymalne skrócenie pobytu chorego w szpitalu.
Wiadomo, że domowa atmosfera i stała obecność bliskich osób mają szczególny wpływ
na samopoczucie rekonwalescenta. Również właściwa organizacja zespołu zajmującego
się leczeniem bólu pooperacyjnego stanowi najlepszy warunek zapewniania
bezpieczeństwa i zapobiegania powikłaniom. W przypadku ich wystąpienia (najczęściej są
to spadek ciśnienia tętniczego oraz depresja oddychania) pozwala na znaczne
zmniejszenie zagrożenia chorego.
W Stanach Zjednoczonych wszystkie szpitale posiadają zespoły leczenia bólu
pooperacyjnego, w skład których wchodzą anestezjolodzy, specjalnie przeszkolone
pielęgniarki i farmaceuci. Organizacja takich zespołów oparta jest na opiece
pielęgniarskiej nadzorowanej przez anestezjologów. Dobrze zorganizowany zespół
leczenia bólu zapewnia wysokie bezpieczeństwo stosowania terapii przeciwbólowej.
9

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
W przypadku stosowania opioidów do analgezji pooperacyjnej, a w szczególności przy
podaży tych środków dokanałowo, przy każdym pacjencie jest przygotowany Nalokson
oraz protokół standardowego postępowania w razie wystąpienia objawów ubocznych
i powikłań. Chorzy podlegają wzmożonej obserwacji na sali pooperacyjnej, a zespół
leczący ból powinien prowadzić protokół analgezji.
Protokół prowadzenia analgezji
1. Nazwa leku: stężenie.
2. Droga podania.
3. Wielkość dawki wstępnej (loading dose).
4. Wielkość wlewu podstawowego.
5. Wielkość pojedynczej dawki (bolus).
6. Przerwa między podaniami dawki (lockout time).
7. Gdy brak odpowiedniej analgezji po dwóch godzinach, należy zwiększyć wlew
podstawowy o 50%.
8. Nie należy podawać innych narkotyków ani leków działających depresyjnie na
ośrodkowy układ nerwowy.
9. Przy łóżku chorego Nalokson — ampułki 0,4 mg.
10. Gdy wystąpią objawy niepożądane:
⎯ skala sedacji wg skali Ramseya i częstość oddechów <10/min — podać Nalokson
dożylnie 0,2 mg i powiadomić lekarza,
⎯ nudności i wymioty — podać dożylnie 10 mg Metoclopramidu lub 4 mg Zofranu,
⎯ uporczywy świąd — podać dożylnie 2 mg Clemastinum,
⎯ zatrzymanie moczu — należy założyć cewnik do pęcherza moczowego
(jednorazowo) lub podać dożylnie Nalokson 0,2 mg.
N i k t — p o z a z e s p o ł e m l e c z e n i a o s t r e g o b ó l u — n i e m a p r a w a
p r z e r w a ć a n a l g e z j i .
Skala sedacji wg Ramseya
Stopień 1 — pobudzony, niespokojny.
Stopień 2 — współpracujący, zorientowany i spokojny.
Stopień 3 — przysypiający, odpowiadający na pytania.
Stopień 4 — śpiący, żywo reagujący na głos lub lekkie puknięcie w czoło.
Stopień 5 — śpiący, leniwie reagujący na głos lub lekkie puknięcie w czoło.
Stopień 6 — śpiący, niereagujący na głos lub lekkie puknięcie w czoło.
10
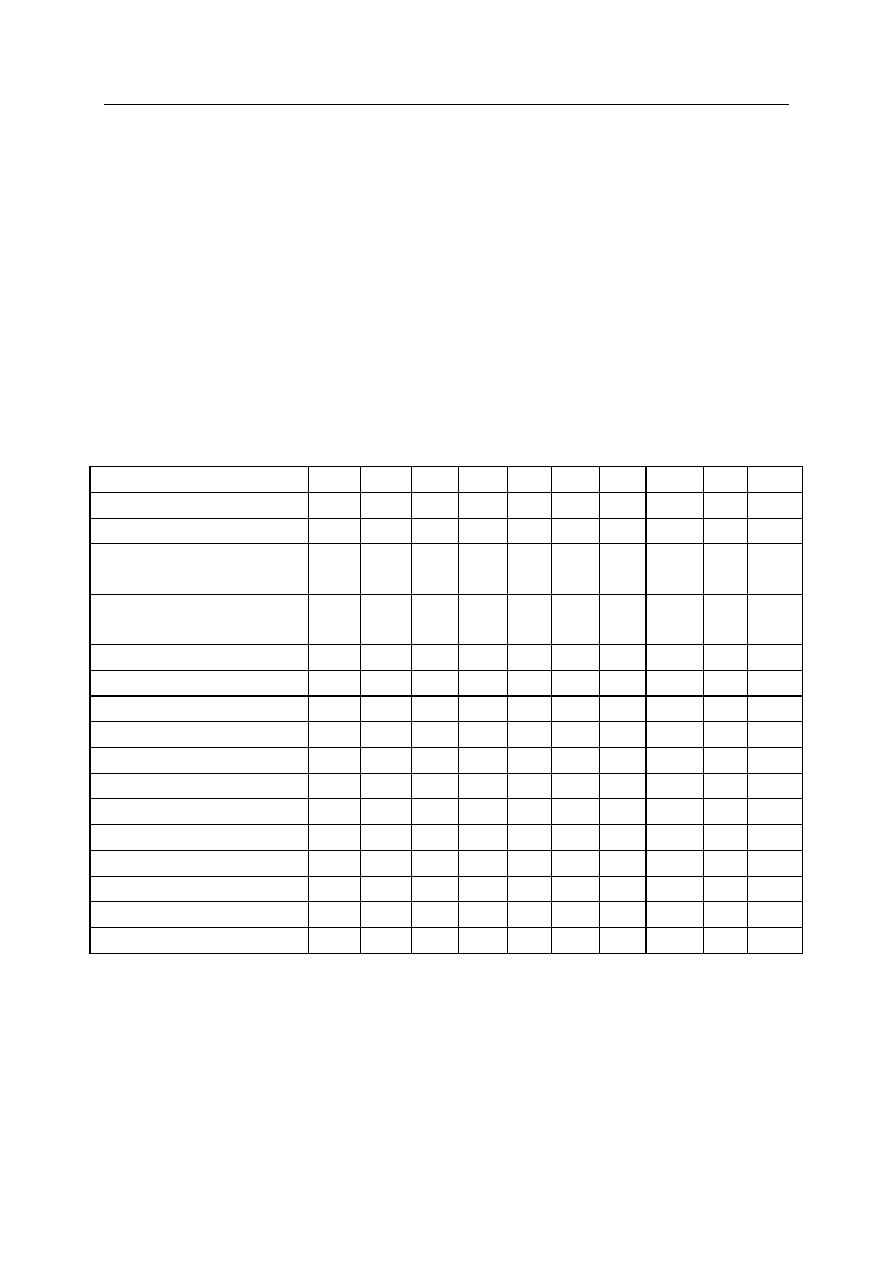
Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Zorganizowanie opieki medycznej zajmującej się leczeniem dolegliwości bólowych
w okresie pooperacyjnym jest działalnością mało znaną. Możliwość prowadzenia takiej
opieki powinna być przedstawiona chorym przed zabiegiem operacyjnym oraz
popularyzowana wśród społeczeństwa. Pacjentem po zabiegu operacyjnym zajmuje się
pielęgniarka — to ona monitoruje postępowanie przeciwbólowe, prowadzi kartę analgezji
pooperacyjnej.
Imię i nazwisko chorego: .............................. Data ..................
Nr historii choroby ........................
Tabela 1. Projekt karty analgezji pooperacyjnej
Czas po operacji
0
1h
2h
3h
4h
8h
12h
16h
20h
24h
Godzina
HR — tętno
SAP — ciśnienie tętnicze
skurczowe
DAP — ciśnienie tętnicze
rozkurczowe
F — częstość oddechów
SpO
2
VAS
Sedacja wg Ramseya
Bóle głowy
Bóle pleców
Nudności
Wymioty
Świąd skóry
Zatrzymanie moczu
Niedrożność cewnika
Wysunięcie cewnika
Analgezja z wyprzedzeniem (Preemptive Analgesia)
Analgezja z wyprzedzeniem obejmuje oddziaływanie w okresie przedoperacyjnym na
rozwój procesów nocycepcji. Okołooperacyjny przepływ informacji nocyceptywnej ma
charakter dwufazowy. Pierwsza faza związana jest ze stymulacją nocyceptywną,
towarzyszącą uszkodzeniu tkanek w okresie operacji. Druga występuje w okresie
11

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
pooperacyjnym, jest wynikiem działania odczynu zapalnego w uszkodzonych tkankach
i wywołanych przez fazę pierwszą zmian w strukturach nocyceptywnych OUN.
Podstawowym celem „analgezji z wyprzedzeniem” jest poprawa jakości pooperacyjnej
analgezji, która prowadzi do wcześniejszego uruchomienia chorego, prewencji powikłań
płucnych i krążeniowych, jak również skrócenia pobytu w szpitalu.
W praktyce klinicznej w prowadzeniu „analgezji z wyprzedzeniem” stosuje się różne
grupy leków. Leki znieczulenia miejscowego i techniki znieczulenia przewodowego,
opioidy zapobiegające rozwojowi ośrodkowej sensytyzacji, niesterydowe leki
przeciwzapalne, jony magnezu.
Zastosowanie techniki „analgezji z wyprzedzeniem” zwiększa możliwość skutecznego
uśmierzania bólu pooperacyjnego w myśl zasady, że lepiej zapobiegać niż leczyć.
12

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
2. Pielęgnowanie chorego z zaburzeniami oddechowymi
Niewydolność oddechowa, niezależnie od rodzaju, to stan, który charakteryzuje się
zaburzoną wymianą gazów w płucach. Dochodzi wówczas do spadku prężności tlenu
(hipoksemii) lub spadku prężności tlenu i wzrostu dwutlenku węgla (hiperkapni) we krwi
tętniczej. Taki stan upośledzonej wymiany gazowej w płucach może być wynikiem
zaburzeń wentylacyjnych, dyfuzyjnych lub nieprawidłowego stosunku perfuzji do
wentylacji.
Prawidłowa wymiana gazowa w płucach jest zależna od równowagi między wentylacją
pęcherzykową a przepływem włośniczkowym, wyrażaną najczęściej stosunkiem
wentylacji do perfuzji. Jej wynikiem końcowym jest odpowiednia prężność tlenu
i dwutlenku we krwi tętniczej. Dynamiczny rozwój zaburzeń wymiany gazowej prowadzi
do hipoksemii i kwasicy. W pierwszym okresie ostrej niewydolności oddechowej dominują
duszność, niepokój, utrudnienie fonacji, przyspieszenie i spłycenie oddechu, tachykardia,
uruchomienie dodatkowych mięśni oddechowych, ruchomość skrzydełek nosa. Progresja
objawów prowadzi do nadmiernego pobudzenia, zaburzeń świadomości, sinicy,
pociągania tchawicy, oddechu, w czasie którego wdechowy ruch przepony powoduje
wydechowe ustawienie klatki piersiowej. Terapią usprawniającą wymianę gazową jest
tlenoterapia — pielęgniarka bierze w niej czynny udział.
2.1. Tlenoterapia
Stężenie tlenu w powietrzu wdychanym powinno być utrzymane poniżej 50%, aby
zminimalizować toksyczność działania tego gazu. Układy dostarczające tlen ogólnie
można podzielić na nisko- i wysokoprzepływowe. Niskoprzepływowe to cewniki
donosowe, maski twarzowe, maski z workiem rezerwuarowym. Układy niskoprzepływowe
mają odpowiednie zbiorniki tlenu, którym pacjent może oddychać. Jeśli dojdzie do
sytuacji, kiedy całkowita wentylacja u danego pacjenta przekracza objętość tego
zbiornika, wdycha on wówczas powietrze otaczające. Stężenie wdychanego tlenu FiO
2
zależy od szybkości napełniania gazem zbiornika, rozmiaru zbiornika, wentylacji
minutowej pacjenta. Cewniki donosowe zapewniają dopływ tlenu do dróg oddechowych,
które pełnią rolę zbiornika tlenu — ich przeciętna objętość to 50 ml. Są proste w użyciu
i dobrze tolerowane przez pacjentów. Ich wadą jest zmienna wartość FiO
2
, uzależniona
od sposobu oddychania pacjenta, a także niemożność osiągnięcia wysokich wartości FiO
2
13

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
u pacjentów, którzy tego wymagają. Częstość oddechów tutaj ulega zmianie od 10 do 40
na minutę, natomiast przepływ tlenu przez cewnik i objętość oddechowa pozostają stałe.
Maski tlenowe mają rezerwuar tlenowy objętości 100–200 ml, zapewniają przepływ tlenu
5–10 l/min. Nie przylegają ściśle do twarzy, co umożliwia pobieranie powietrza
z zewnątrz. Posiadają takie same wady jak cewnik nosowy.
Maski tlenowe z workiem rezerwuarowym — w zależności od rozmiarów worka —
posiadają zbiornik z tlenem 600–1000 ml. Worek jest stale napełniany, pacjent może
wdychać tylko znajdujący się tam gaz. Zaletą tych masek jest większa możliwość
kontrolowania stężenia wydychanego gazu. Maski te bardzo ściśle przylegają do twarzy,
co uniemożliwia karmienie także przez sondę żołądkową. Niemożliwe jest również
podawanie leków w aerozolu.
Stosując tlenoterapię, należy pamiętać, że tlen ma działanie toksyczne, ale jego brak
może stwarzać ryzyko niedotlenienia tkanek. U pacjentów intensywnej terapii każda
wartość FiO
2
powyżej 0,21 nie jest bezpieczna, natomiast optymalna wartość
umożliwiająca prowadzenie bezpiecznej tlenoterapii nie powinna przekraczać FiO
2
0,6.
Stosowanie agresywnej tlenoterapii powoduje zmiany w miąższu płucnym do złudzenia
przypominające zmiany w ARDS. Precyzyjne określenie progu toksyczności stężenia tlenu
jest niemożliwe, wartość ta zależy od wieku, stanu odżywienia, wydolności
antyoksydacyjnych mechanizmów obronnych i zaburzeń endokrynnych.
Układy wysoko przepływowe zapewniają stałą wartość FiO
2
. Jest to możliwe dzięki
dostarczeniu tlenu z szybkością przewyższającą maksymalny przepływ wdechowy
pacjenta lub zastosowaniu urządzeń umożliwiających pobieranie powietrza otaczającego
w określonych proporcjach. Przykładem będzie tutaj wysoko przepływowa maska
tlenowa. Bez względu na zastosowaną wielkość przepływu proporcje mieszaniny
oddechowej znajdującej się w masce nie zmieniają się.
2.2. Wentylacja mechaniczna
Wentylacja mechaniczna wymaga intubacji dotchawiczej. Wykonuje się ją zazwyczaj
przez usta lub przez nos, można także zastosować tracheostomię.
Pielęgnując pacjenta wentylowanego mechanicznie, należy zwrócić uwagę na głębokość
położenia rurki intubacyjnej — nie jest to standardem, ale wskazane jest oznakowanie
14

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
miejsca położenia markerem. Istotną rzeczą przy pielęgnacji jest utrzymanie
prawidłowego ciśnienia w mankiecie uszczelniającym. Substancje płynne mogą
przesuwać się wokół mankietu w dół, podobnie gazy tą samą drogą mogą przemieszczać
się ku górze. Przeciek wokół mankietu można wykryć dzięki swoistym dźwiękom
wydobywającym się z dróg oddechowych, słyszalnym w trakcie rozprężania płuc (jest to
dźwięk gazów przeciskających się przez struny głosowe). Ten słyszalny przeciek można
zmierzyć, porównując objętość wdychanych gazów do objętości wydychanych, wartość ta
jest również wyświetlana na ekranie respiratora. Najczęstszą przyczyną występowania
przecieku jest nierównomierne przyleganie mankietu do ścian tchawicy. Słyszalny
przeciek należy zlikwidować, wypełniając mankiet rurki intubacyjnej lub tracheostomijnej
powietrzem do chwili zaniku tego charakterystycznego odgłosu. Jeśli oddział wyposażony
jest w manometry do pomiaru ciśnienia, to wartość powinna wynosić 20 cm
3
H
2
O.
2.3. Monitorowanie w niewydolności oddechowej
Gazometria krwi tętniczej jest związana z równowagą kwasowo-zasadową. Wartości
tych badań są określane łącznie. Materiałem badawczym jest tutaj heparynizowana krew
tętnicza. Pielęgniarka — pobierając krew na to badanie — powinna odpowiednio
przygotować strzykawkę. Należy nabrać 0,5 ml heparyny, przepłukać strzykawkę i resztę
usunąć. Ta odrobina heparyny, która pozostanie w strzykawce, wystarcza do
zahamowania procesu krzepnięcia. Użycie jej w większych ilościach mogłoby wpłynąć
negatywnie na prawidłowość wyników, ponieważ ma ona kwaśny odczyn.
Krew tętniczą można pobrać z:
⎯ tętnicy promieniowej,
⎯ tętnicy ramiennej,
⎯ tętnicy udowej,
⎯ również — gdy sytuacja tego wymaga — z tętnic łokciowej, grzbietowej stopy,
piszczelowej tylnej, skroniowej.
W praktyce pacjenci przebywający na oddziale intensywnej terapii mają na stałe
umieszczoną kaniulę (najczęściej w tętnicy promieniowej). Umożliwia ona również pomiar
ciśnienia tętniczego metodą bezpośrednią. Pobieranie materiału do badań jest łatwe
(pielęgnację miejsca założenia wkłucia tętniczego opisano w module 5).
15

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Pobierając próbkę krwi na to badanie, należy zwrócić uwagę na niebezpieczeństwo
dostania się pęcherzyków krwi i możliwość zafałszowania wyniku. Analiza krwi powinna
być wykonana natychmiast po pobraniu, gdyż pobrana krew nadal zużywa tlen,
a wytwarza dwutlenek węgla. Gdy jest to niemożliwe, próbkę można umieścić
w temperaturze 4ºC (by obniżyć zużycie tlenu we krwi) i przechowywać ją do 2 h.
Zawartość gazów we krwi można określić, pobierając krew włośniczkową. Warunkiem
dokładności badania jest prawidłowe ukrwienie okolicy nakłucia i brak centralizacji
krążenia. W praktyce klinicznej — na oddziale intensywnej terapii — metody tej się nie
wykorzystuje.
Pulsoksymetria — monitoruje wysycenie krwi tętniczej tlenem za pomocą czujnika,
który rejestruje światło przechodzące przez pulsujące naczynia krwionośne — tętnice.
Źródłem światła w pulsoksymetrze jest dioda imitująca monochromatyczne światło,
sygnał świetlny przetwarzany jest na elektryczny przy użyciu krzemowej fotodiody.
Urządzenie to działa liniowo w zakresie obu długości fal. Intensywność światła zmienia się
wraz ze zmianami w objętości krwi. Spektrofotometryczna metoda pulsoksymetrii opiera
się na prawie Lamberta-Beera, które definiuje zależność między cząsteczkowym
współczynnikiem absorbancji substancji składowych przy specyficznej długości fali
świetlnej. W przypadku pulsoksymetrii bierzemy pod uwagę dwie różnej długości fale
świetlne dla hemoglobiny i oksyhemoglobiny.
Zabarwienie skóry może znacznie wpływać na dokładność pomiaru pulsoksymetrii. Kolor
niebieski, zielony lub czarny na płytce paznokciowej może zmniejszać wartość SaO
2
o 3–5%, również zbyt długie paznokcie utrudniają prawidłowe umiejscowienie czujnika.
Pigmentacja skóry często wpływa na zakłócenia pomiaru saturacji (im ciemniejsza
karnacja, tym częstsze zakłócenia). Poza tym wpływ na wysycenie hemoglobiny tlenem
mają następujące czynniki:
⎯ niedostateczna pulsacja — może być spowodowana czynnikami chorobowymi, np.
wysokim obwodowym oporem, czyli skurczem naczyń obwodowych, hipotermią
(spadek temperatury prowadzi do błędnych odczytów), niedokrwistością i hemodylucją
(poprzez obniżenie stężenia hemoglobiny prowadzi do błędów w pomiarze),
⎯ czynnikami technicznymi — ucisk tętnic przez mankiet do pomiaru ciśnienia tętniczego
zaburza jakość sygnalizacji pulsoksymetru, artefakty ruchowe prowadzą do
zwiększenia się odstępu pomiędzy diodą a odbiorcą — zakłócają w ten sposób odczyt
wartości,
⎯ zawartość błękitu metylenowego we krwi prowadzi do zaniżonych wartości.
16
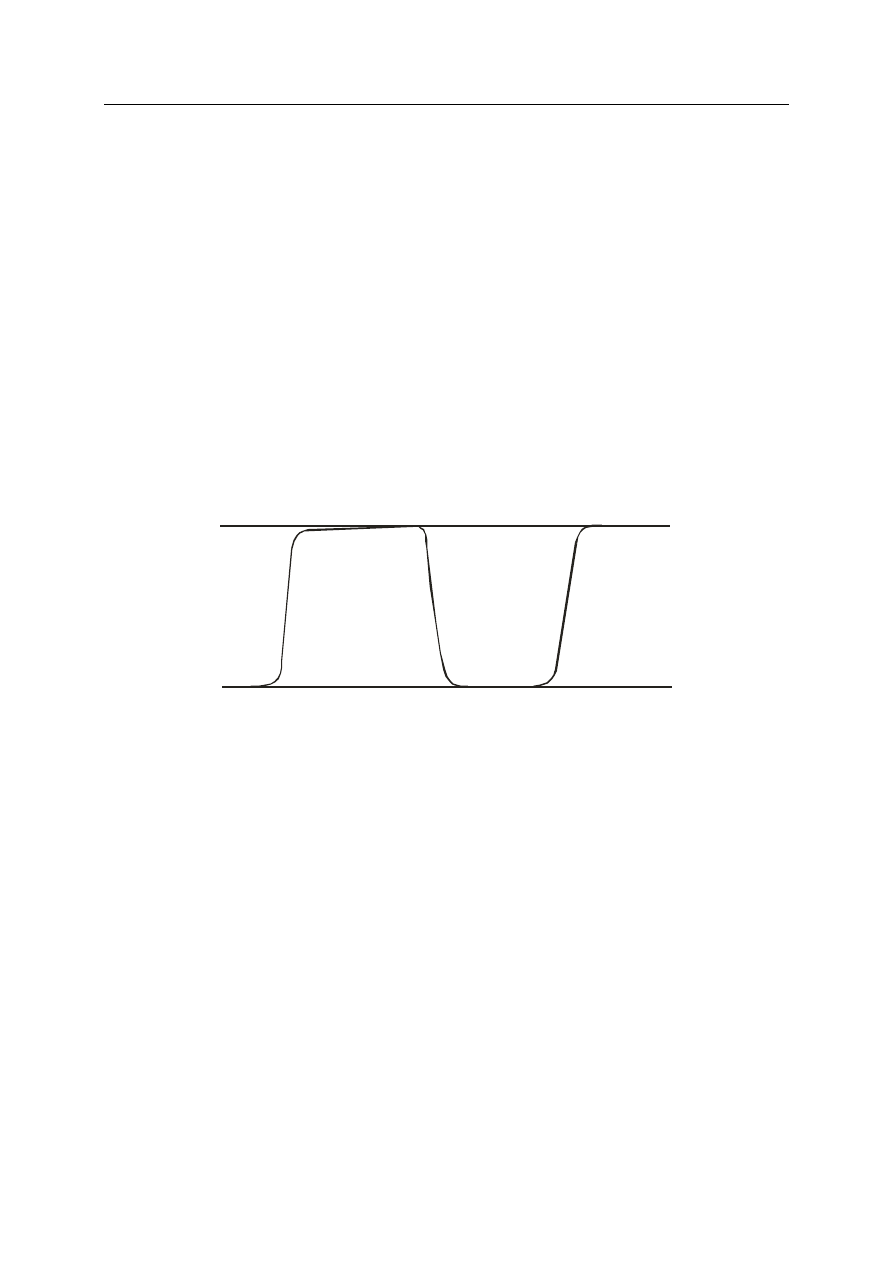
Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Pulsoksymetria jest priorytetowym, nieinwazyjnym i ciągłym pomiarem wysycenia krwi
tętniczej tlenem. Błąd pomiaru wg danych różnych producentów wynosi 2+–3% (Larsen,
2003: 667). Jej wyższość nad okresowym pomiarem gazów jest znaczna, ponieważ
w szybki i łatwy sposób można wykryć stan hipoksemii, natomiast stanu hipoksji nie
można wychwycić za pomocą pulsoksymetru, ale poprzez bezpośredni pomiar tętniczego
pO
2
(prężności tlenu we krwi tętniczej).
Kapnometria — jest to badanie pozwalające określić stężenie dwutlenku węgla
w powietrzu wydechowym. Kapnometr mierzy procentowy udział CO
2
w mieszaninie
gazów wydechowych i pokazuje jej wartość cyfrową, natomiast w przypadku kapnografii
dodatkowo jest rejestrowana krzywa całego cyklu oddechowego.
1
2
3
4
1–2 — wzrost stężenia CO
2
po rozpoczęciu wdechu;
2–3 plateau — to maksimum stężenia CO
2
w powietrzu pęcherzykowym przed następnym wdechem, jest to
końcowo wydechowe CO
2
. Jego wartość wynosi od 35 do 45 mmHg.
3–4 — stromy spadek stężenia CO
2
.
Rysunek 1. Prawidłowy kapnogram
Pomiar dokonywany jest metodą spektrometryczną, w której CO
2
absorbuje światło
podczerwieni. Określa się wówczas różnice w absorpcji między gazem testowym
a powietrzem końcowowydechowym w określonym różnym stężeniu CO
2
. Ilość
absorbowanych promieni podczerwieni jest wprost proporcjonalna do liczby cząsteczek
CO
2
, a czas reakcji wynosi 0,25 s. Przed pomiarem kapnometr należy kalibrować gazem
próbnym o znanym stężeniu CO
2
. W praktyce klinicznej kalibracji dokonuje pielęgniarka
zgodnie z instrukcją obsługi monitora.
17

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Pomiar końcowowydechowego CO
2
metodą spektrometrii może odbywać się w strumieniu
głównym lub pobocznym. Podczas pomiaru w strumieniu głównym czujnik pomiarowy
znajduje się między rurką intubacyjną a łącznikiem z układem oddechowym pacjenta.
Czujnik jest podgrzewany do temperatury 39ºC, by para wodna nie skraplała się na nim.
Zwilżenie układu pomiarowego prowadzi do błędów w pomiarze.
W strumieniu pobocznym niewielka ilość gazu wydechowego jest zasysana w sposób
ciągły za pomocą pompy przez cienki wężyk z układu oddechowego pacjenta do
urządzenia pomiarowego. Metodą tą możemy dokonywać pomiaru również u pacjentów
niezaintubowanych. Pobór gazu może następować z przedsionka nosa. Zakładając taki
czujnik, należy pamiętać, że wężyk doprowadzający ma najczęściej długość ok. 3 m. Nie
może być dłuższy, gdyż spowoduje możliwość mieszania się gazów z kolejnych cykli
oddechowych. Obecność wody w wężu doprowadzającym również utrudnia pomiar.
Bronchofiberoskopia i pobranie bronchoaspiratu — to inwazyjne badanie, które
wykonywane jest także na oddziale intensywnej terapii, przy czynnym udziale
pielęgniarki. Badanie to polega na bezpośrednim wziernikowaniu tchawicy i oskrzeli
z użyciem urządzeń optycznych sztywnego bronchoskopu lub giętkiego
bronchofiberoskopu. U chorych przebywających na oddziale intensywnej terapii badanie
to służy do wykonania niektórych zabiegów terapeutycznych, np. miejscowego podania
leku, odessania z zalegającej wydzieliny oskrzelowej. Istnieje również możliwość —
zarówno przy bronchoskopii, jak i bronchofiberoskopii — wprowadzenia dodatkowego
oprzyrządowania, tj. specjalnych kleszczyków czy cewnika, w celu pobrania materiału do
badania.
18

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
3. Pielęgnowanie chorego z niewydolnością układu krążenia
Choroby układu krążenia są w Europie przyczyną 40% wszystkich zgonów osób powyżej
75. roku życia. Dane pochodzą z projektu badawczego Światowej Organizacji Zdrowia
z 2003 roku.
Niewydolność krążenia to patologiczne zmniejszenie się przepływu krwi przez tkanki
i narządy organizmu.
Bezpośrednią przyczyną niewydolności krążenia może być:
⎯ zmniejszenie objętości minutowej serca w stosunku do zapotrzebowania tkanek —
niewydolność krążenia pochodzenia sercowego,
⎯ zaburzenie mechanizmów zapewniających należyty przepływ krwi w naczyniach
krwionośnych zarówno układu tętniczego, jak i żylnego — niewydolność krążenia
pochodzenia obwodowego.
Niedotlenienie jest pierwszym i głównym objawem każdej niewydolności krążenia.
Również niedokrwienie powoduje zmniejszenie dowozu do komórek substancji
odżywczych oraz zabezpieczających homeostazę (np. hormony). Równocześnie
upośledzeniu ulega usuwanie produktów przemiany komórek, tkanek i narządów. Przy
niedotlenieniu produkty gromadzą się w tkankach, a nieprawidłowy, beztlenowy proces
spalania tkankowego prowadzi do rozwoju kwasicy.
Wtórnym następstwem rozwijającej się niewydolności krążenia jest uruchomienie
wyrównawczych mechanizmów homeostazy organizmu (nerwowych i humoralnych),
których celem jest zapewnienie prawidłowego przepływu krwi przez najważniejsze
życiowo narządy, tj. ośrodkowy układ nerwowy i serce.
Niewydolność pochodzenia sercowego to niewydolność serca, czyli stan, w którym serce
(albo jedna z jego komór) nie jest w stanie przetoczyć odpowiedniej ilości krwi.
Klinicznie niewydolność serca dzielimy na:
⎯ ostrą,
⎯ przewlekłą,
⎯ prawokomorową,
⎯ lewokomorową,
⎯ niewydolność obu komór.
19

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Bezpośrednią przyczyną niewydolności krążenia pochodzenia sercowego jest mniejsza —
w stosunku do aktualnych potrzeb — wydajność pracy serca jako pompy wyrzucającej
krew do elastycznego tętniczego łożyska naczyniowego. Wydajność ta określana jest
wielkością objętości minutowej i jej pochodnymi: objętością wyrzutową, pracą serca,
pracą wyrzutu.
Objętość wyrzutową serca determinują cztery podstawowe czynniki:
1. Kurczliwość mięśnia sercowego.
2. Obciążenie wstępne (preload).
3. Obciążenie następcze (afterload).
4. Częstość i miarowość czynności serca.
Kurczliwość mięśnia sercowego jest zależna od sprawności poszczególnych włókien
kurczliwych, ich liczby oraz sekwencji pobudzania elektrycznego i mechanicznego ścian
jam serca. Obciążenie wstępne w praktyce klinicznej to ciśnienie w naczyniach płucnych
włosowatych. Jest ono wprost proporcjonalne do ilości krwi krążącej i wielkości powrotu
żylnego, a odwrotnie proporcjonalne do frakcji wyrzutowej. Wynika z tego, że skurcz
naczyń żylnych może zwiększać obciążenie wstępne, a ich rozszerzenie — zmniejszać.
Obciążenie następcze jest mierzone wielkością ciśnienia skurczowego w komorach, aorcie
lub tętnicy płucnej. Jest uzależnione głównie od oporów mechanicznych stawianych krwi
wyrzucanej przez lewą lub prawą komorę, od stopnia kurczliwości tętnic obwodowych lub
płucnych, od ilości krążącej krwi i jej lepkości.
Następstwem rozwijającej się niewydolności krążenia jest uruchomienie wyrównawczych
mechanizmów homeostazy organizmu podobne do tych, jakie dostosowują przepływ krwi
w czasie obciążenia wysiłkiem w warunkach zdrowia.
Wśród czynników wyrównawczych w niewydolności krążenia należy wymienić:
⎯ pobudzenie układu adrenergicznego (wzrost napięcia układu współczulnego i amin
katecholowych we krwi),
⎯ wzrost oporu naczyń tętniczych,
⎯ skurcz żył i zmniejszenie ich pojemności,
⎯ retencję sodu i wody w organizmie,
⎯ przyspieszenie rytmu serca,
⎯ wzmożenie oddychania.
20

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Dzięki temu dochodzi do wyrównania objętości minutowej serca i utrzymania średniego
ciśnienia tętniczego na optymalnym poziomie. Te mechanizmy wyrównawcze prowadzą
do rozstrzeni jam i przerostu mięśnia sercowego.
Klasyfikacja czynnościowa stopnia niewydolności krążenia zaproponowana
przez Nowojorskie Towarzystwo Kardiologiczne
NYHA — New York Heart Association:
1. Stopień I — zwykłe codzienne czynności nie wyzwalają objawów niewydolności
krążenia.
2. Stopień II — mały wysiłek fizyczny nie powoduje dolegliwości. Przeciętny wysiłek
powoduje zmęczenie, duszność, ból dusznicowy.
3. Stopień III — dolegliwości pojawiają się w przypadku nawet umiarkowanego wysiłku,
ale nie występują w spoczynku.
4. Stopień IV — dolegliwości występują przy każdym wysiłku i często w spoczynku.
Występuje bardzo znaczne ograniczenie wydolności fizycznej.
U pacjentów oddziałów intensywnej terapii znacznie częściej występuje niewydolność
prawokomorowa. Charakterystyczne są dla niej trzy objawy:
⎯ powiększenie światła prawej komory,
⎯ segmentowe zaburzenia kurczliwości po prawej stronie,
⎯ paradoksalne ruchy przegrody międzykomorowej.
Najlepszymi wykładnikami prawokomorowej niewydolności serca są mierzone za pomocą
cewnika założonego do tętnicy płucnej:
⎯ frakcja wyrzutowa prawej komory (RVEF — Right-Ventricular Ejection Fraction),
⎯ objętość końcowo-rozkurczowa (RVEDV — Right-Ventricular End-Diastolic Volume),
⎯ ciśnienie zaklinowania w tętnicy płucnej (PCWP — Pulmonary Capilary Wedge
Pressure).
Cewnik Swana-Ganza (Pulmonary Artery — PA) jest bardzo istotny dla monitorowania
układu sercowo-naczyniowego. Został wprowadzony do praktyki klinicznej w latach 70.
ubiegłego stulecia. Jego największą zaletą jest możliwość pomiaru dużej liczby
(mierzalnych i wyliczalnych) parametrów hemodynamicznych. Są to:
⎯ ośrodkowe ciśnienie żylne,
⎯ ciśnienie zaklinowania włośniczek płucnych,
⎯ wskaźnik sercowy,
21

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
⎯ wskaźnik objętości wyrzutowej,
⎯ wskaźnik pracy wyrzutowej lewej komory,
⎯ wskaźnik pracy wyrzutowej prawej komory,
⎯ frakcja wyrzutowa prawej komory,
⎯ objętość późnorozkurczowa prawej komory,
⎯ wskaźnik naczyniowego oporu obwodowego,
⎯ wskaźnik naczyniowego oporu płucnego.
W krajach rozwiniętych zawał jest jedną z głównych przyczyn zgonów. Dynamiczny
rozwój współczesnej medycyny, a zwłaszcza kardiologii interwencyjnej rozpowszechnił
inwazyjną diagnostykę kardiologiczną, poczynając od planowej koronarografii, przez
koronaroplastykę, udrożnienie naczynia zamkniętego w świeżym zawale, na
nieoperacyjnym leczeniu wrodzonych wad serca kończąc. Inwazyjna diagnostyka
kardiologiczna odbywa się w pracowni hemodynamicznej, najważniejszy element
pracowni to aparat RTG. Za jego pomocą ustala się położenie cewnika (tor wizyjny),
rejestruje wstrzyknięcia środka cieniującego (tor filmowy), wykonuje się różnorodne
projekcje, aby móc optymalnie uwidocznić różne odcinki naczyń i struktury serca.
Ochrona radiologiczna
W czasie wykonywanych badań personel musi przestrzegać środków bezpieczeństwa:
⎯ nosić fartuchy z gumy ołowiowej grubości 0,5 mm,
⎯ nosić kołnierze z gumy ołowiowej osłaniające tarczyce,
⎯ nosić okulary ochronne ze szkła ołowiowego.
Stosując się do tych zaleceń, możemy aż stukrotnie zmniejszyć dawkę promieniowania,
ale należy podkreślić, że nawet rygorystyczne przestrzeganie przepisów nie chroni
całkowicie przed ryzykiem choroby popromiennej. Ustawowo przyjęto, że dla osób
narażonych zawodowo na promieniowanie dopuszczalne dawki wynoszą 100 mrem
w ciągu tygodnia lub 60 rem w ciągu roku. Dla ogółu ludności maksymalna dopuszczalna
dawka to 3 mrem w ciągu tygodnia i 1,5 rem w ciągu roku.
22

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
4. Pielęgnowanie chorego we wstrząsie
Sepsa jest główną przyczyną śmierci na oddziałach intensywnej terapii, sięga co
najmniej 28–50%. Ponad 750 tys. Amerykanów rocznie zapada na tę chorobę. Wskaźniki
te rosną na całym świecie z powodu wzrostu liczby pacjentów z osłabionym systemem
immunologicznym i wzrostu liczby pacjentów w podeszłym wieku. Nie bez znaczenia dla
rozwoju sepsy jest także pojawienie się wśród drobnoustrojów szczepów
antybiotykoopornych oraz wzrastająca liczba pacjentów z zaburzeniami odporności (np.
chorzy z nowotworami, AIDS, biorcy przeszczepów czy chorzy z chorobami powodującymi
wyniszczenie, cierpiący na cukrzycę, alkoholicy).
Sepsa określana jest jako ogólnoustrojowa odpowiedź zapalna, wywołana przez infekcje,
której towarzyszy upośledzenie czynności narządów lub zaburzenia perfuzji tkankowej.
U pacjentów z ciężką sepsą zazwyczaj stwierdza się triadę objawów — ogólnoustrojowy
stan zapalny, skazę zakrzepową oraz upośledzenie fibrynolizy. Sepsa rozwija się
niezależnie od inicjującego ją zakażenia.
Zespół ogólnoustrojowej odpowiedzi zapalnej (Systemic Inflammatory Response
Syndrome, SIRS) pojawia się w czasie, gdy organizm nie jest w stanie „utrzymać”
procesu zapalnego w miejscu jego powstania. Charakteryzuje się objawami wynikającymi
z ogólnoustrojowego działania cytokin pozapalnych:
⎯ temperatura powyżej 38ºC lub poniżej 36ºC,
⎯ tętno powyżej 90 uderzeń na minutę,
⎯ częstość oddechów powyżej 20 na minutę,
⎯ wysoka leukocytoza.
Rozpoznanie sepsy wymaga stwierdzenia co najmniej dwóch kryteriów SIRS oraz
zakażenia, które obejmuje odpowiedź zapalną na obecność drobnoustrojów, dysfunkcję
narządów, hipoperfuzję tkankową lub spadek ciśnienia tętniczego o więcej niż 40 mmHg
w stosunku do wartości wyjściowych.
Zespół niewydolności wielonarządowej (Multiple Organ Disfunction Syndrome —
MODS) stanowi końcowy efekt działania czynników bakteryjnych, mediatorów stanu
zapalnego, uszkodzenia śródbłonka naczyniowego, zaburzeń krzepnięcia i upośledzenia
mikrokrążenia. Pierwszym objawem niewydolności wielonarządowej jest upośledzenie
czynności układu krążenia i układu oddechowego najczęściej pod postacią ostrych
23

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
zaburzeń oddechowych ARDS, następnie występuje dysfunkcja wątroby, zaburzenia
czynności układu pokarmowego, niewydolność nerek i zaburzenia czynności ośrodkowego
układu nerwowego.
Rokowanie w sepsie ściśle wiąże się z liczbą uszkodzonych narządów, u chorych
z dysfunkcją jednego narządu wynosi 20%, wraz ze wzrastającą liczbą narządów
objętych procesem chorobowym rośnie.
Należy jak najszybciej zdiagnozować źródło infekcji i rozpoznać przyczyny niewydolności
wielonarządowej. W tym celu niezbędna jest szeroka diagnostyka, w której bierze udział
pielęgniarka, dbając o właściwe pobranie i dostarczenie badań laboratoryjnych, które
uzależnione są od badania fizykalnego i ogólnego stanu klinicznego chorego. Zazwyczaj
są to morfologia, liczba płytek, pełny profil biochemiczny, czas protrombinowy, APTT,
gazometria oraz badanie ogólne i posiew moczu. Posiew krwi należy pobrać z dwóch
nakłuć, gdy chory ma założony cewnik wielokanałowy. Logicznym miejscem pobrania
próbek jest kanał proksymalny, jeśli nie jest możliwe pobranie krwi ze wszystkich świateł
cewnika. Wskazany jest posiew z końcówki cewnika, natomiast posiew z płynu
infuzyjnego nie. Wykonujemy również posiew z wydzieliny z dróg oddechowych. By
zidentyfikować sepsę, często określa się cały szereg markerów biochemicznych. Choć nie
są one niezbędne do rozpoznawania sepsy, niektórzy badacze klinicyści postulują ich
zastosowanie jako kryteriów włączenia chorych do badań klinicznych nad ciężką sepsą.
Elementy pielęgnacji pacjenta z ciężką sepsą
Pacjent z sepsą powinien być leczony na oddziale intensywnej terapii. Parametry życiowe
powinny być ciągle monitorowane i odnotowywane w określonych odstępach czasu,
podobnie aktywność i pozycja ciała pacjenta. Regularnie należy zmieniać pozycje z boku
na bok w celu uniknięcia odleżyn i powstania ognisk niedodmy. Gdy istnieje możliwość,
wskazane jest zastosowanie pozycji na brzuchu lub zastosowanie łóżka rotacyjnego.
Czynności pielęgniarskie obejmują pielęgnację założonych cewników i drenów, higienę
jamy ustnej, u chorych zaintubowanych — pielęgnację układu oddechowego, pomiar
masy ciała, bilans płynów, dokładne monitorowanie parametrów życiowych, żywienie
przez sondę żołądkową lub dwunastniczą.
Obok podstawowego monitorowania w sepsie istotny jest pomiar OCŻ, który stanowi
odzwierciedlenie objętości krwi. Dokładniejszym pomiarem jest ciśnienie zaklinowania
w tętnicy płucnej, identyfikuje on etiologię wstrząsu, monitoruje wypełnienie łożyska
24

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
naczyniowego, pomiaru rzutu serca, CO i wskaźnika sercowego CI oraz prężność tlenu
i saturację hemoglobiny w mieszanej krwi żylnej.
Wstrząs septyczny
W przebiegu sepsy rozwija się wstrząs, rozpoczyna się w mikrokrążeniu z powodu
przedostawania się podczas uogólnionej infekcji endotoksyn bakterii. Występują dwie
postacie wstrząsu septycznego:
⎯ hiperdynamiczna,
⎯ hipodynamiczna.
Początkowo wstrząs septyczny hiperdynamiczny przebiega ze wzrostem częstości akcji
serca i pojemności minutowej, obniżającym się ciśnieniem tętniczym. W późniejszym
okresie zwiększa się opór obwodowy, pojemność minutowa serca maleje, co jest
następstwem upośledzenia czynności mięśnia sercowego.
Wstrząs septyczny hipodynamiczny przebiega z obniżoną pojemnością minutową serca,
niskim ciśnieniem tętniczym krwi i podwyższonym oporem obwodowym. Towarzyszy mu
rozsiane wykrzepianie wewnątrznaczyniowe.
25

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
5. Rola pielęgniarki
w enteralnym i parenteralnym żywieniu chorych
5.1. Żywienie enteralne
Bardzo istotnym elementem leczenia chorego w OIT jest dostarczenie substancji
odżywczych dostosowanych do jego indywidualnego zapotrzebowania. Nabłonek jelitowy
jest jedną z najważniejszych struktur przewodu pokarmowego, stanowi też barierę
zapobiegającą inwazji mikroorganizmów chorobotwórczych, dzięki pobieraniu
i przetwarzaniu substancji odżywczych. Pokarm wprowadzony do przewodu
pokarmowego zapewnia nie tylko dostarczenie substancji odżywczych do narządów, ale
wzmaga siły obronne organizmu przeciwko chorobom zakaźnym.
Przewód pokarmowy ciężko chorego spełnia rolę immunomodulacyjną. Stymulacja
przewodu pokarmowego zmniejsza odpowiedź na stres, zmniejsza nasilenie zmian
atroficznych w błonie śluzowej, umożliwia fizjologiczne wydzielanie hormonów
enteralnych. Dostarczane tą drogą mieszanki zawierające glutaminę, argininę, kwasy
tłuszczowe zapewniają niezbędne składniki dla właściwego funkcjonowania układu
immunologicznego. Obecnie używa się coraz częściej określenia immunonutrition, gdyż
takie żywienie poprawia fagocytozę oraz czynność limfocytów, zmniejsza liczbę zakażeń,
poprawia gojenie ran, ogranicza liczbę stosowanych antybiotyków i skraca czas
hospitalizacji.
W żywieniu enteralnym do zadań pielęgniarki należy:
⎯ założenie sondy żołądkowej,
⎯ sprawdzenie prawidłowości jej położenia,
⎯ kontrola ilości zalegającej treści pokarmowej,
⎯ obserwacja w kierunku wystąpienia powikłań — zatkanie sondy, aspiracja treści
pokarmowej do dróg oddechowych,
⎯ przygotowanie posiłku o określonej konsystencji, temperaturze i wartości kalorycznej.
Grube sondy żołądkowe nie są polecane ze względu na dyskomfort, jaki powodują
u pacjentów. Obecnie używa się sond cieńszych i bardziej giętkich (8–10 F), dlatego też
czasami istnieje konieczność zastosowania sztywnych prowadników w celu wprowadzenia
ich do przewodu pokarmowego. Zazwyczaj sondy żołądkowe wprowadzane są do żołądka
26

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
lub dwunastnicy przez nozdrza lub rzadziej przez jamę ustną. Odległość od nozdrzy do
żołądka można określić, mierząc odległość od końca nosa do płatka ucha i od ucha do
wyrostka mieczykowatego. Podczas zakładania sondy przez usta odległość mierzymy
analogicznie. Prawidłowe położenie sondy można sprawdzić, osłuchując nadbrzusze
podczas wdmuchiwania powietrza przez sondę. Metoda ta jest bardzo często
wykorzystywana w praktyce, choć mało wiarygodna, ponieważ dźwięk pochodzący
z sondy znajdującej się w dolnych drogach oddechowych może być słyszalny również
w nadbrzuszu.
Przypadkowe wprowadzenie zgłębnika — zwłaszcza małej średnicy — do tchawicy jest
często bezobjawowe, np. u chorych z zaburzeniami świadomości, po podaniu leków
uspokajających, u chorych z nieprawidłowym odruchem kaszlowym. Z tych właśnie
względów zaleca się po każdym wprowadzeniu sondy ustalenie jej położenia za pomocą
zdjęcia radiologicznego klatki piersiowej.
Obecnie w żywieniu enteralnym stosuje się ponad 80 rodzajów płynnych mieszanek
odżywczych, mieszanki już prawie całkowicie wyparły kleiki i diety płynne
przygotowywane w kuchniach oddziałowych.
5.1.1. Skład mieszanek do żywienia enteralnego
Wartość kaloryczna
Wartość kalorii w mieszance zależy od ilości węglowodanów. Istnieją mieszanki
niskoenergetyczne i wysokoenergetyczne. Większość mieszanek dostarcza od
1 do 2 kcal/l roztworu.
Osmolarność
Osmolarność mieszanek żywieniowych uzależniona jest od zawartości węglowodanów,
wynosi 280–1100 mOsm/kg H
2
O.
Zawartość białek
W płynnych mieszankach żywieniowych zawartość białek wynosi 35–40 g/l. Preparaty
posiadające wysoką zawartość białka — nawet o 20% większą niż w standardowym
składzie — posiadają przyrostek HN — High Nitrogen. Najczęściej są to całe cząsteczki
białek, które rozkładane są na aminokwasy w górnym odcinku przewodu pokarmowego.
Istnieją też mieszanki wzbogacone w peptydy, co ułatwia ich absorpcję, ponieważ są
wchłaniane szybciej niż aminokwasy ze światła przewodu pokarmowego. Mogą być także
stosowane u pacjentów z zaburzeniami wchłaniania jelitowego.
27

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Tłuszcze
Tłuszcze stosowane w żywieniu enteralnym zawierają dużą ilość długołańcuchowych
trójglicerydów otrzymywanych z olejów roślinnych. Tłuszcze stanowią bogate źródło
energii, trzykrotnie większe niż węglowodany. Podawanie dużej objętości tłuszczów do
przewodu pokarmowego wywołuje biegunkę, z tego względu zawartość tłuszczów
w większości diet jest ograniczona do 30% całkowitego zapotrzebowania kalorycznego.
Dodatki
G l u t a m i n a jest źródłem energii dla śluzówki przewodu pokarmowego. Produkowana
jest przez mięśnie szkieletowe, a jej zapas obniża się w stanach hipermetabolizmu
i dlatego u chorych przebywających na oddziale intensywnej terapii jest konieczna jej
suplementacja.
B ł o n n i k jest to składnik żywności roślinnej nierozkładany przez enzymy trawienne
człowieka. Błonniki ze względu na właściwości fermentujące dzieli się na:
⎯ błonniki pokarmowe fermentujące,
⎯ błonniki pokarmowe niefermentujące.
Zadaniem błonnika jest ograniczenie występowanie biegunek podczas żywienia
enteralnego.
Powikłania:
⎯ aspiracja treści pokarmowej do dróg oddechowych,
⎯ biegunka,
⎯ zatkanie sondy.
Pielęgnując pacjenta leżącego żywionego enteralnie, należy pamiętać, aby podczas
karmienia unieść głowę pacjenta pod kątem ok. 45º — pozycja ta zmniejsza ryzyko
aspiracji. Zatkanie sondy najczęściej jest spowodowane wytrąceniem się białek
z roztworu pod wpływem znajdującego się w świetle zgłębnika kwasu żołądkowego,
skutecznie można temu zapobiec, przepłukując sondę co 4 h i po każdym podaniu leków
10–30 ml wody. Biegunki to częsty problem żywienia enteralnego, w ok. 30%
przypadków ich przyczyną nie jest skład pożywienia, lecz sorbitol zawarty w lekach,
używany w celu poprawy ich smaku. Dlatego w walce z biegunką ustalenie zawartości
sorbitolu w podawanych lekach powinno być pierwszym krokiem.
28

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
5.2. Żywienie pozajelitowe
Jeśli z różnorodnych względów niemożliwe jest żywienie za pomocą sondy, należy
rozważyć możliwość zastosowania żywienia pozajelitowego — parenteralnego.
Roztwory wykorzystywane w żywieniu dożylnym zawierają:
⎯ roztwory glukozy,
⎯ aminokwasy,
⎯ glutaminę,
⎯ emulsje tłuszczowe,
⎯ elektrolity, witaminy,
⎯ pierwiastki śladowe.
Stosowanie żywienia pozajelitowego wymaga kaniulacji żyły centralnej, ponieważ
hiperosmolarne roztwory glukozy i aminokwasów powinny być podawane do dużych
naczyń.
Dochodzi tutaj problem hiperglikemii, wynikający ze skłonności insuliny do absorpcji na
powierzchniach plastikowych worków i szklanych butelek. Ilość zaabsorbowanej insuliny
wynosi średnio 20–30%.
W wyniku toksycznych efektów podawania tłuszczów powstaje również zwiększone
ryzyko uszkodzenia komórek spowodowanym utlenianiem.
Obwodowe żywienie pozajelitowe
Preparaty żywieniowe podawane do żył obwodowych nie powinny przekraczać 900
mOsm/l, co chroni ściankę naczyń przed uszkodzeniem. Najczęściej podaję się tą drogą
rozcieńczone roztwory aminokwasów glukozy i tłuszcze.
W przypadku stosowania żywienia parenteralnego najczęściej pojawiają się powikłania ze
strony układu pokarmowego. Są to:
⎯ atrofia błony śluzowej jelita,
⎯ bezkamicze zapalenie pęcherzyka żółciowego.
Aby temu przeciwdziałać, należy — jeśli tylko jest to możliwe — jak najwcześniej wdrożyć
żywienie enteralne.
29

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Słownik
Koloidy — wielocząsteczkowe substancje służące do zastępowania osocza oraz do
wyrównania strat objętości wewnątrznaczyniowej. Są to dekstrany i roztwory żelatyny.
Konikotomia — utworzenie dostępu do tchawicy poprzez więzadło pierścienno-tarczowe
między chrząstką pierścieniowatą a tarczowatą. Dostęp ten tworzy się poprzez nacięcie
skalpelem albo nakłucie igłą (konikopunkcja).
Krystaloidy — roztwory elektrolitowe lub niskocząsteczkowych węglowodanów,
najczęściej w praktyce klinicznej stosowane są roztwory soli kuchennej, roztwory Ringera
i jego modyfikacje, 5% roztwór glukozy.
Osmolarność — określa stosunek wody do rozpuszczonych w niej cząsteczek. Jest to
liczba moli rozpuszczonych cząsteczek w 1 l roztworu.
Perfuzja — utrzymanie przepływu krwi.
Tracheotomia — operacyjne otwarcie tchawicy i wprowadzenie rurki — rozcięcie.
30

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Bibliografia
1. Anestezjologia i intensywna terapia dla studentów medycyny: podręcznik, 2000:
(red.) B. Kamiński, A. Kübler, PZWL, Warszawa.
2. Brzeziński T., 2000: Historia medycyny, PZWL, Warszawa.
3. Choroby wewnętrzne, 2005: (red.) F. Kokot, PZWL, Warszawa.
4. Larsen R., 2003: Anestezjologia, Wydawnictwo Medyczne Urban & Partner, Wrocław.
5. Marino P. L., 2007: Intensywna terapia, Wydawnictwo Medyczne Urban & Partner,
Wrocław.
6. Poloński L., Opolski G., Filipiak K., 2002: Ostre zespoły wieńcowe, Wydawnictwo
Medyczne Urban & Partner, Wrocław.
7. Saint-Maurice C., Miller A., Meynadier J., 1998: Ból, diagnostyka, leczenie
i prewencja, Warszawa.
8. Wytyczne 2005 resuscytacji krążeniowo-oddechowej, 2005: (red.) J. Andres, Polska
Rada Resuscytacji, Kraków.
31

Ból pooperacyjny.
Inwazyjne monitorowanie chorego przebywającego na OIT
Literatura podstawowa
1. Anestezjologia i intensywna terapia dla studentów medycyny: podręcznik, 2000:
(red.) B. Kamiński, A. Kübler, PZWL, Warszawa.
Literatura dodatkowa
1. Choroby wewnętrzne, 2005: (red.) F. Kokot, PZWL, Warszawa.
2. Poloński L., Opolski G., Filipiak K., 2002: Ostre zespoły wieńcowe, Wydawnictwo
Medyczne Urban & Partner, Wrocław.
32
Document Outline
Wyszukiwarka
Podobne podstrony:
bol nowotworowy id 74986 Nieznany (2)
bol ratownictwo id 75004 Nieznany (2)
bol w klacie tabela id 91615 Nieznany
3 Bol id 33031 Nieznany
bol biotech materialy id 74968 Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
więcej podobnych podstron