ABSORPCYJNA SPEKTORFOTOMETRIA CZĄSTECZKOWA
(Oznaczanie chromu i kobaltu obok siebie)
Politechnika Gdańska; opracowała: mgr inż. M. Wasielewska
1
WPROWADZENIE
Metody spektroskopowe są to metody opierające się na oddziaływaniu promieniowania
elektromagnetycznego
z
materią.
Polegają
na
absorpcji
lub
emisji
promieniowania
elektromagnetycznego przez próbkę badanej substancji. W metodach spektroskopowych dokonuje
się pomiaru natężenia promieniowania przechodzącego w funkcji długości fali. Stanowią one zespół
technik instrumentalnych, w których do celów analitycznych wykorzystuje się przejścia energetyczne
zachodzące w cząsteczkach na skutek oddziaływania promieniowania elektromagnetycznego w
zakresie UV – VIS – IR.
Promieniowanie elektromagnetyczne przechodzące przez dany ośrodek może ulec odbiciu,
rozproszeniu, przejściu przez materię oraz absorpcji. Zarówno zjawiska odbicia jak i rozproszenia
mogą zostać wyeliminowane podczas porównywania próbki badanej z próbką odniesienia, natomiast
warunkiem koniecznym wystąpienia zjawiska absorpcji jest konieczność równości energii padającego
promieniowania i energii odpowiadającej różnicy występującej pomiędzy skwantowanymi poziomami
energetycznymi danej cząsteczki.
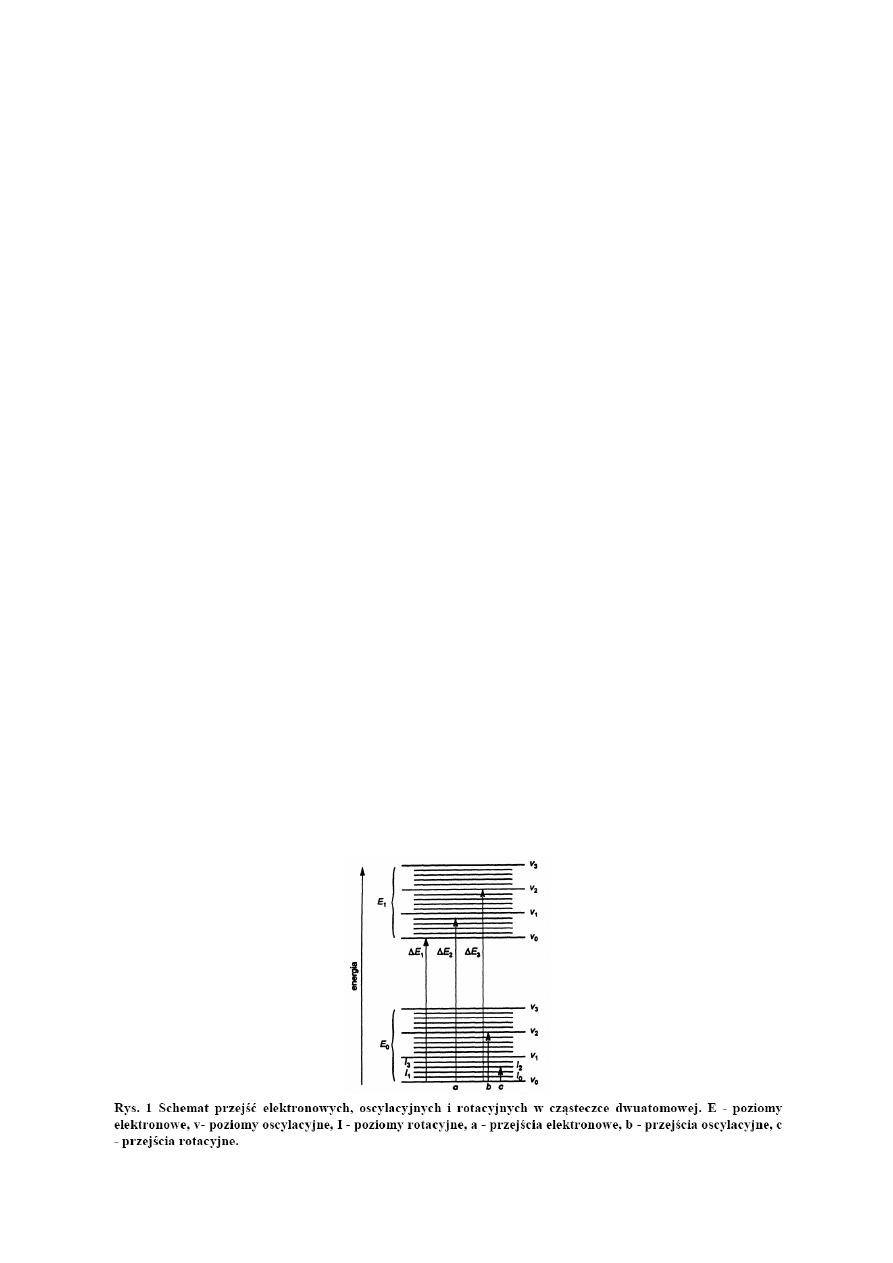
Spektroskopia cząsteczkowa obejmuje badanie widm cząsteczkowych. W ujęciu ogólnym, na każde
widmo cząsteczkowe przypadają trzy rodzaje promieniowania elektromagnetycznego: widmo
rotacyjne, widmo oscylacyjno – rotacyjne oraz widmo elektronowo – oscylacyjno –rotacyjne (Rys. 1).
Stosunek wartości energii elektronowej do energii oscylacyjnej oraz do energii rotacyjnej jest w
przybliżeniu równy 1000 : 10 : 1. Różnice pomiędzy poziomami elektronowymi wynoszą kilka
elektronowoltów, pomiędzy poziomami oscylacyjnymi dziesiąte i setne części eV, a pomiędzy
poziomami rotacyjnymi tysięczne części eV. Znaczne różnice wartości poszczególnych rodzajów
energii powodują, że odpowiednie widma pojawiają się w różnych zakresach spektralnych.

Pochłoniecie kwantów promieniowania z zakresu dalekiej podczerwieni (30 – 1000 μm) jako
najmniej energetycznego może powodować jedynie zmiany energii rotacyjnej. Zaabsorbowana
energia nie wystarcza do zmiany energii oscylacyjnej ani energii elektronowej, w związku z czym na
skutek absorpcji promieniowania z zakresu dalekiej podczerwieni może powstać jedynie widmo
rotacyjne. Promieniowanie z zakresu bliskiej podczerwieni (0,78 – 5 μm) powoduje przejścia między
poziomami oscylacyjnymi. Ponieważ zmianom energii oscylacyjnej towarzyszą zmiany energii
rotacyjnej, powstają widma oscylacyjno – rotacyjne. Zmiany energii elektronowej może wywołać
jedynie zaabsorbowanie promieniowania z zakresu widzialnego (380 – 780 nm) i nadfioletu (UV, 200
– 380 nm), czego efektem jest widmo elektronowo – oscylacyjno – rotacyjne.
2
PODZIAŁ METOD SPEKTROFOTOMETRYCZNYCH
Za podstawę podziału metod spektroskopowych przyjmuje się następujące trzy kryteria:
a.
formę wymiany energii miedzy promieniowaniem i materią,
•
zwiększenie energii układu w wyniku pochłaniania promieniowania - spektroskopia
absorpcyjna;
•
oddanie części energii przez układ drogą emisji promieniowania - spektroskopia
emisyjna;
b.
istoty badanych przemian zachodzących w składnikach materii,
•
spektroskopia jądrowa,
•
spektroskopia atomowa,
•
spektroskopia cząsteczkowa,
c.
zakres promieniowania odpowiadający wielkości fotonu, który jest pochłaniany lub
emitowany, a tym samym obszar w którym jest zawarte badane widmo:
•
spektroskopia rentgenowska,
•
spektroskopia optyczna,
•
radiospektroskopia: mikro, krótko i długofalowa.
3
SPEKTROFOTOMETRIA UV-VIS
Metodą spektrofotometrii UV-VIS można oznaczyć substancje organiczne (np. związki posiadające
wiązanie π lub elektrony n, w tym węglowodory aromatyczne, aldehydy, ketony, kwasy, aminy) i
nieorganiczne (np. pierwiastki ziem rzadkich - rodzina 17 pierwiastków chemicznych, w skład której
wchodzą lantan, 14 lantanowców: cer, prazeodym, neodym, promet, samar, europ, gadolin, terb,
dysproz, holm, erb, tul, iterb i lutet ponadto skand i itr, które współwystępują w minerałach
zawierających lantanowce i mają podobne właściwości chemiczne oraz ozon i tlenki siarki)
wykazujące absorpcję w nadfiolecie, związki absorbujące promieniowanie w zakresie widzialnym (w
tym barwne związki organiczne i barwniki) i barwne sole metali (np. KMnO
4
, CuSO
4
) oraz substancje,
których formy absorbujące promieniowanie uzyskuje się na drodze reakcji chemicznych. Do celów
tych najczęściej wykorzystuje się reakcje kompleksowania, jak w przypadku oznaczania kationów
metali w formie barwnych związków kompleksowych z ligandami organicznymi.
4
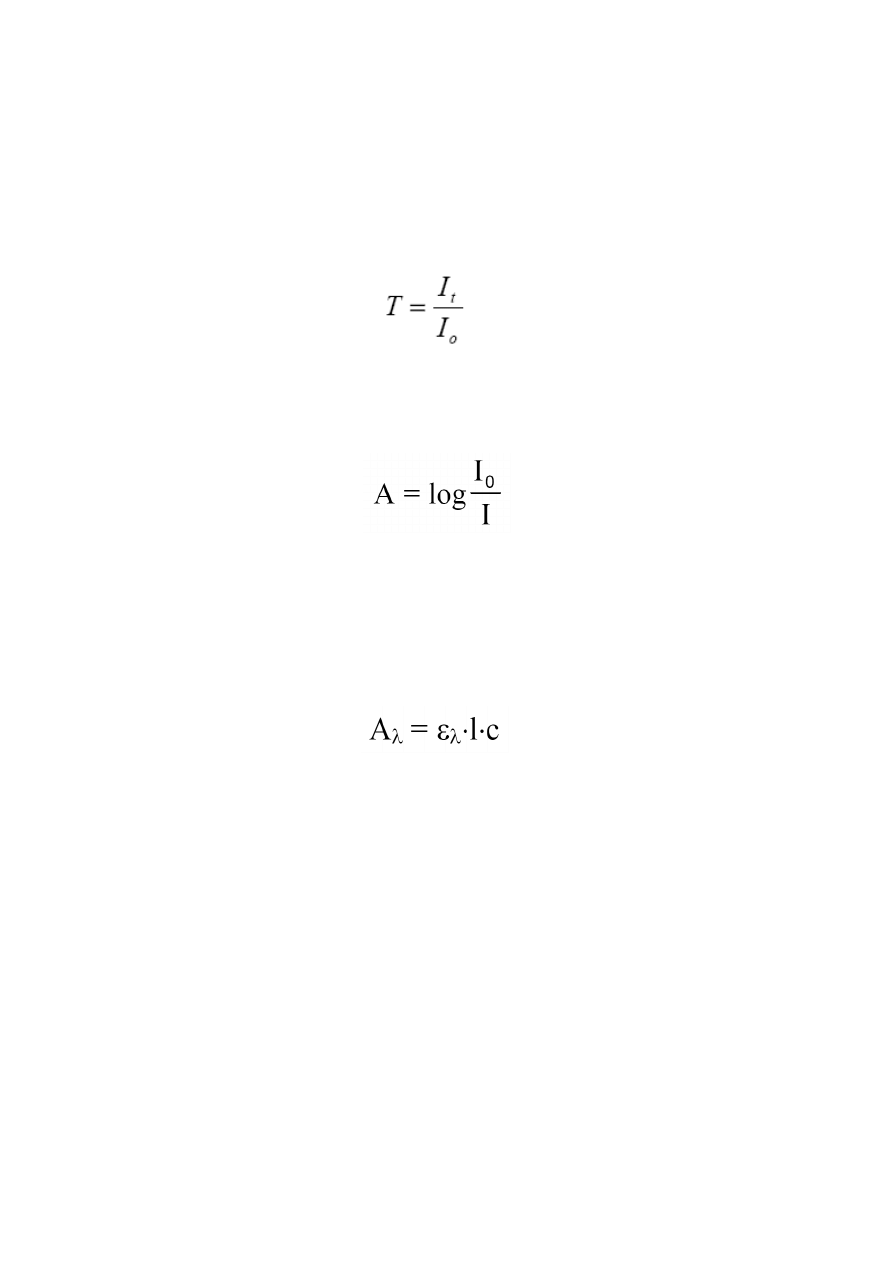
PODSTAWOWE PRAWA ABSORPCJI
Stosunek natężenia promieniowania przechodzącego przez próbkę
(I
t
)
do natężenia promieniowania
padającego na próbkę
(I
0
)
(równego natężeniu promieniowania przechodzącego przez odnośnik),
nazywa się transmitancją lub przepuszczalnością i oznacza:
(1)
Natężenie promieniowania zaabsorbowanego zależy od stężenia roztworu i od grubości warstwy
absorbującej. Matematycznie zależność tę opisuje prawo Lamberta-Beera, które w postaci
logarytmicznej definiuje się jako:
(2)
gdzie
I
0
to natężenie promieniowania padającego na ośrodek absorbujący a
I
to natężenie
promieniowania po przejściu przez ośrodek absorbujący.
Prawo Lamberta – Beera odnosi się do pomiaru absorbancji na skutek absorpcji promieniowania
przez roztwory, w których znajdują się anality zdolne do absorpcji promieniowania o określonej
długości fali. Zgodnie z prawem Lambera – Beera absorbancja opisywana jest zależnością:
(3)
gdzie
ε
jest współczynnikiem absorpcji przy długości fali
λ
,
l
jest grubością warstwy absorbującej, a
c
stężeniem analitu w badanym roztworze.
Prawo Lamberta – Beera dotyczy absorpcji promieniowania przez roztwory i można je sformułować
następująco: jeżeli współczynnik absorpcji rozpuszczalnika
ε
jest równy zeru, to absorbancja wiązki
promieniowania monochromatycznego
A
przechodzącej przez jednorodny roztwór jest wprost
proporcjonalna do stężenia
c
roztworu i do grubości warstwy absorbującej
l
.
Prawo Lamberta – Beera odnosi się do przypadku, gdy w roztworze znajduje się jedna substancja
absorbująca. Jeżeli w badanym roztworze znajduje się kilka składników, oznaczanie
spektrofotometryczne można wykonać poprawnie tylko wtedy, gdy spełnione jest prawo
addytywności absorbancji, wg którego absorbancja mieszaniny jest równa sumie absorbancji
poszczególnych składników, a absorbancja pojedynczego składnika jest taka, jakby tylko on jeden
znajdował się w badanej próbce. Matematycznie prawo to określają następujące wzory:
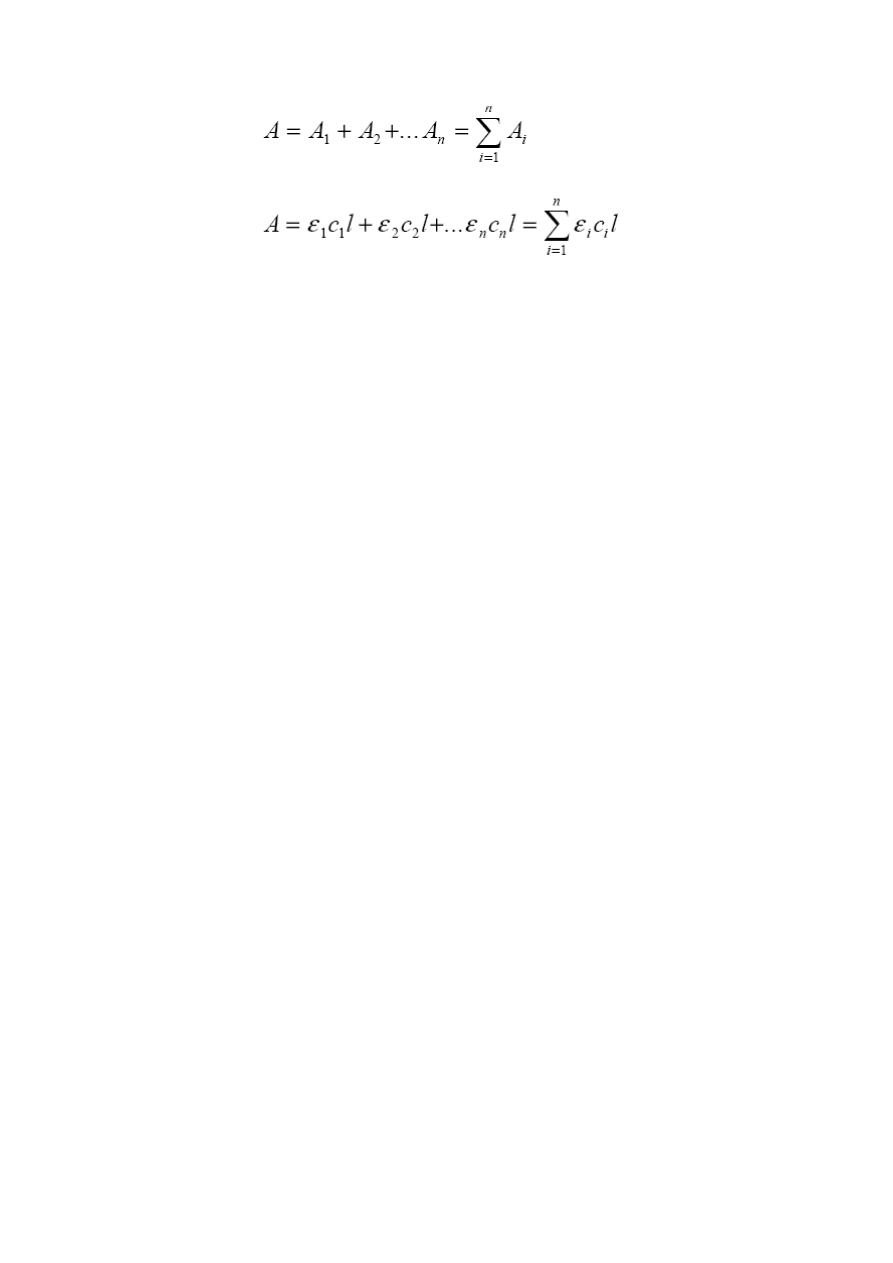
(4)
(5)
Gdzie
ε
1
,
ε
2
i
ε
n
to współczynniki absorpcji odpowiednich substancji obecnych w roztworze,
c
1
,
c
2
i
c
n
oznaczają stężenia tych substancji, a
l
jest grubością warstwy absorbującej. Powyższa zależność to
prawo addytywności absorbancji, z którego korzysta się w spektrofotometrycznej analizie układów
wieloskładnikowych.
5
ODSTĘPSTWA OD PRAWA LAMBERTA – BEERA
Prawo Lamberta – Beera stosuje się do roztworów rozcieńczonych. Przy większych stężeniach
wartość współczynnika absorpcji zależy zwykle od stężenia oznaczanej substancji. Na wykresie
obrazującym zależność absorbancji roztworu od jego stężenia uwidacznia się to w zakrzywieniu linii
kalibracyjnej w zakresie wyższych stężeń w górę lub w dół, które określa się odpowiednio jako
dodatnie lub ujemne odstępstwa od prawa Lamberta – Beera. Odstępstwa te mogą być natury
chemicznej lub instrumentalnej.
Odstępstwa chemiczne pojawiają się na skutek oddziaływań zachodzących w roztworze:
- cząsteczki substancji rozpuszczonej oddziaływują pomiędzy sobą – dysocjacja, asocjacja,
- cząsteczki substancji rozpuszczonej oddziaływują z cząsteczkami rozpuszczalnika lub ze sobą –
kondensacja, polimeryzacja, hydroliza, kompleksowanie.
Zasadniczym czynnikiem aparaturowym powodującym odstępstwa od prawa jest niedostateczna
monochromatyzacja promieniowania.
6
ANALIZA ILOŚCIOWA I JAKOŚCIOWA
Analiza ilościowa metodą spektrofotometrii UV-VIS oparta jest na pomiarze absorbancji badanego
roztworu przy określonej długości fali i wykorzystaniu prawa Lamberta – Beera.
Zależność pomiędzy absorbancją a stężeniem analitu, w warunkach gdy badany układ spełnia prawo
Lamberta –Beera, ma charakter prostoliniowy i można ją wykorzystać do wyznaczenia stężenia
analitu w próbce.
W spektrofotometrii absorpcji cząsteczkowej do wyznaczenia stężenia oznaczanej substancji
wykorzystuje się zwykle pomiar absorbancji roztworu zawierającego dany analit. W zależności od
środowiska chemicznego, w którym znajduje się analit, jak również ustalonych warunków
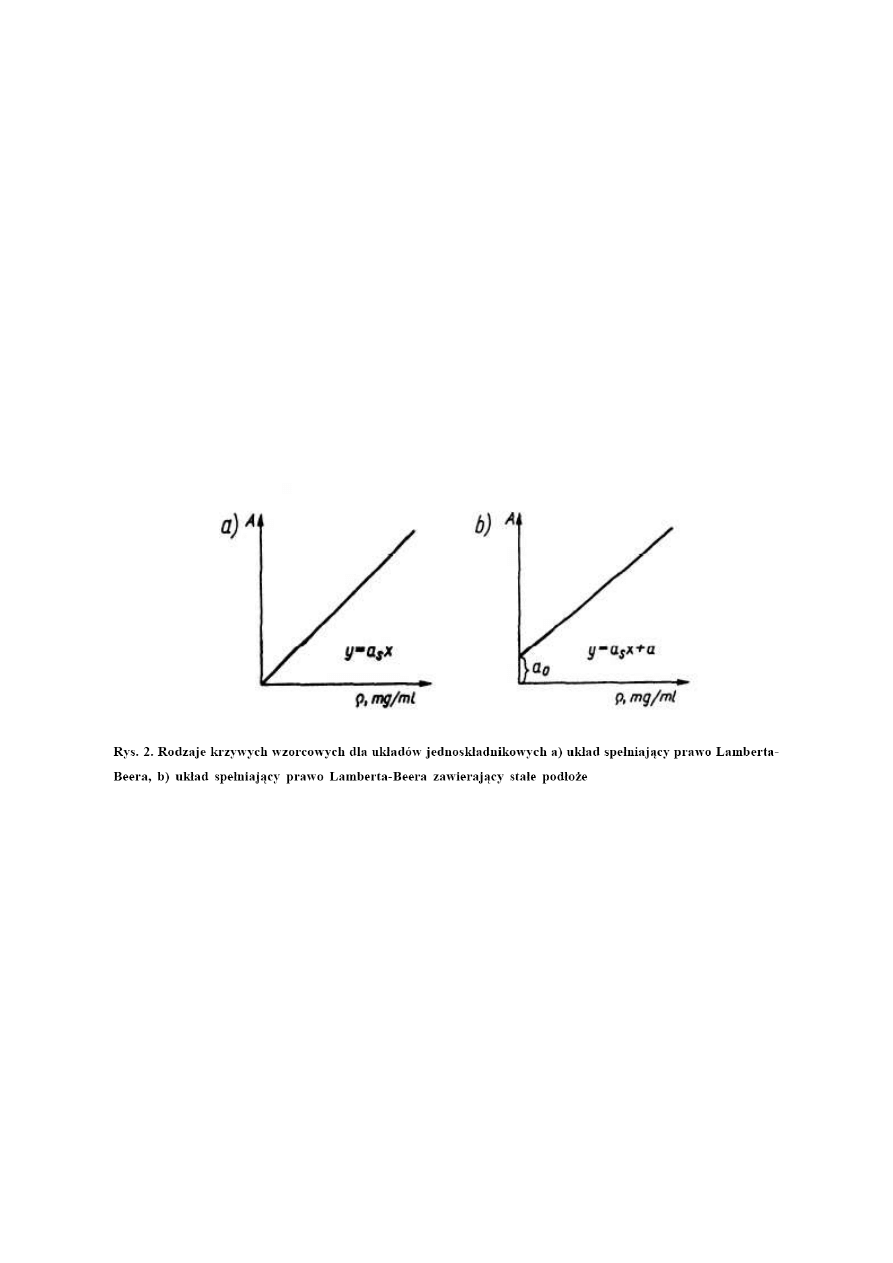
pomiarowych wartość sygnału mierzonego dla danego stężenia analitu może ulegać zmianie i nie
może na tej podstawie jednoznacznie wnioskować o ilości analitu w próbce. Konieczne jest, w
związku z tym, przeprowadzenie kalibracji danego oznaczenia.
Do najczęściej stosowanych metod kalibracji należy metoda krzywej wzorcowej. Krzywą wzorcową
nazywa się przedstawioną graficznie zależność absorbancji od stężenia substancji wzorcowej. W celu
wykreślenia krzywej wzorcowej przygotowuje się 5 - 6 roztworów wzorcowych o znanych, ściśle
ustalonych stężeniach analitu, tak dobranych, aby różniły się o około 30 % i obejmowały swym
zakresem stężenia agalitów w oznaczanych roztworach. Nie wystarczy jednorazowe sporządzenie
krzywej wzorcowej. Zmiany warunków pracy i temperatury, partii odczynników oraz charakterystyki
detektora powodują przesunięcie się krzywej lub zmianę kąta jej nachylenia. W zależności od tego jak
duże są te odchylenia, należy każdorazowo sporządzać krzywą pracy w danym dniu pomiaru, albo
korzystać z jednej krzywej wyznaczonej na podstawie kilku serii pomiarów.
Krzywa wzorcowa może przechodzić lub nie przechodzić przez początek układu współrzędnych (Rys.
2).
Po wykonaniu tych pomiarów, otrzymane wyniki przedstawia się w układzie współrzędnych: sygnał
(w przypadku spektrofotometrii absorpcji czastecakowej jest to zazwyczaj absorbancja) – stężenie
analitu, a następnie dopasowuje się do nich określoną funkcję (zazwyczaj linię prostą). Pomiary
wykonuje się zwykle przy określonej długości fali, najczęściej odpowiadającej maksimum absorpcji
oznaczanej substancji oraz względem roztworu odniesienia (tzw. ślepej próby), czyli roztworu
przygotowanego analogicznie jak roztwory wzorcowe i roztwór próbki, lecz nie zawierającego analitu.
Prostoliniowy przebieg zależności A=f(c) świadczy o spełnieniu przez badany układ prawa Lamberta –
Beera. Wyznaczenie współczynnika kierunkowego prostej umożliwia obliczenie współczynnika
absorpcji oznaczanej substancji. W celu wyznaczenia stężenia analitu w próbce rejestruje się
odpowiadający jej sygnał i odnosi się go do krzywej kalibracyjnej. Roztwór próbki powinien być
przygotowany w taki sposób, by maksymalny zakres stężeń analitu w roztworach wzorcowych
obejmował przewidywane jego stężenie w próbce.
Analizy jakościowej dokonuje się na podstawie długości fali, przy której następuje maksymalna
absorbancja dla każdej substancji indywidualnie. Jednak wybór analitycznej długości fali nie zawsze
dotyczy długości fali, przy której następuje maksymalna absorbancja. Przy pomiarach prowadzonych
dla układów dwubarwnych, gdy obok badanego kompleksu oznaczanego pierwiastka dominuje
odczynnik barwny, bądź gdy rozpuszczalnik posiada zdolność do absorpcji promieniowania o
podobnej długości fali, wybiera się taką długość fali, przy której absorpcja rozpuszczalnika lub
związku przeszkadzającego jest najmniejsza. Podobnie postępuje się w przypadku, gdy przyrząd
pomiarowy cechuje niska monochromatyzacja promieniowania, wówczas wybiera się taką długość
fali, przy której błędy tym spowodowane będą miały jak najmniejszy wpływ na pomiar absorbancji. W
przypadku oznaczeń śladowych ilości substancji, za analityczną długość fali wybiera się taką długość,
która zapewni możliwie wysoką wykrywalność. Każdy związek chemiczny posiada zdolność absorpcji
promieniowania o ściśle określonej długości fali, dzięki czemu możliwa jest jego identyfikacja.
7
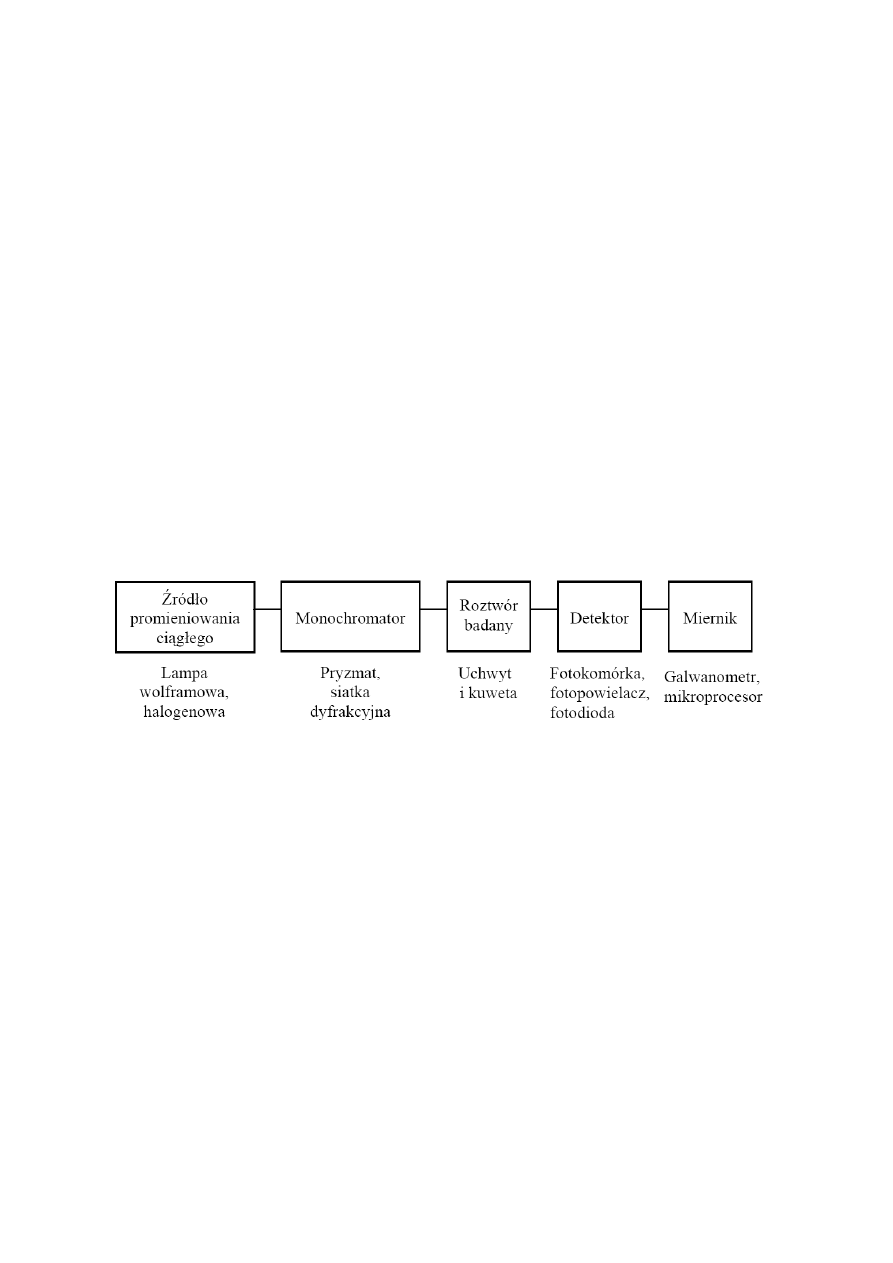
APARATURA
Do badania absorpcji promieniowania elektromagnetycznego w nadfiolecie i zakresie widzialnym
widma służą spektrofotometry jednowiązkowe UV-VIS. Schemat blokowy spektrofotometru
przedstawiono na Rysunku 3.
Rys. 3 Schemat blokowy spektrofotometru optycznego
Pomiary wykonywane będą przy użyciu spektrofotometru Spekol 11 firmy Carl Zeiss Jena. Spekol 11
wyposażony jest w wolframową żarówkę projektorową stanowiącą źródło promieniowania,
monochromatorem jest precyzyjna siatka dyfrakcyjna (650 szczelin/mm), zaś do detekcji
promieniowania służą dwie fotokomórki: niebieskoczuła (340-620 nm) oraz czerwonoczuła (620-850
nm). Wartość absorbancji wskazywana jest przez wskaźnik cyfrowy.
Zasada działania spektrofotometru polega na rejestrowaniu monochromatycznego promieniowania
emitowanego przez źródło promieniowania. Źródłem promieniowania w zakresie widzialnym jest
lampa z elektrycznie żarzonym włóknem wolframowym, która dostarcza wiązkę światła białego o
widmie ciągłym i odpowiednim natężeniu. Natężenie wiązki reguluje się za pomocą przesłony
irysowej lub regulowanej szczeliny.
Za wydzielenie ze światła złożonego promieniowania o określonej długości fali odpowiada
monochromator zbudowany z dwóch szczelin, wejściowej (regulującej natężenie wiązki
promieniowania pochodzącego ze źródła promieniowania) i wyjściowej (umożliwiającej
wyodrębnienie z widma wiązki promieniowania o wybranej długości fali i określonej szerokości

spektralnej). Ponadto, monochromator posiada jako element dyspersyjny precyzyjną siatkę
dyfrakcyjną. Siatka dyfrakcyjna to wypolerowana płytka szklana lub metalowa z dużą ilością
równoległych rys położonych bardzo blisko siebie. Siatki mogą być odbiciowe – o wygrawerowanych
liniach na powierzchni lustrzanej, profilowe – o określonym kącie błysku, replikowe i holograficzne.
Siatka dyfrakcyjna umożliwia otrzymanie światła praktycznie monochromatycznego (0,1-2 nm) na
skutek ugięcia promieniowania na wąskich szczelinach. Światło ugięte na siatce dyfrakcyjnej trafia na
szczelinę wyjściową o szerokości 11 nm. Obrót siatki dyfrakcyjnej powoduje skierowanie do szczeliny
wyjściowej światła o dowolnej długości fali z zakresu od 330 nm do 850 nm.
Monochromatyczna wiązka światła dociera do kuwety z próbką. W zależności od zakresu stosowania,
kuwety wykonane mogą być z kwarcu (UV) lub ze szkła (VIS). Na skutek załamania na ściankach
naczynia wychodząca wiązka promieniowania różni się od wiązki wchodzącej. Kuwety powinny
zapewniać dokładnie znaną grubość warstwy absorbującej, wykazywać odporność na działanie
analizowanych substancji chemicznych oraz zapewniać w maksymalnym stopniu transmitancję
promieniowania.
W
niektórych
przyrządach
(tzw.
spektrofotometrach
dwuwiązkowych)
promieniowanie wychodzące z monochromatora jest dzielone na dwie wiązki o jednakowym
natężeniu, z których jedna przechodzi przez kuwetę z badaną próbką a druga przez kuwetę z próbką
odniesienia.
Obiektywną ocenę intensywności zabarwienia i bezpośredni pomiar natężenia promieniowania
umożliwia detektor. Detektor przetwarza energię promieniowania elektrycznego na energię
elektryczną. Właściwie dobrany detektor powinien charakteryzować się szerokim zakresem
liniowości wskazań, czyli proporcjonalnością przetwarzania sygnałów oraz dobrą czułością, czyli min.
niskim poziomem szumów własnych. Wymagania te spełnia min. komórka fotoelektryczna składająca
się z dwóch elektrod metalowych, zatopionych w bańce szklanej pozbawionej powietrza. Katodą jest
metalowa blaszka ze srebra, antymonu lub bizmutu, pokryta warstewką substancji zdolnej do
emitowania elektronów pod wpływem promieniowania. Warstewkę tą stanowić mogą metale
alkaliczne, ich tlenki lub zasady, np.: cez, sód, potas. Promieniowanie padające na fotokomórkę
doprowadza do wyemitowania elektronów, które przyciągane są przez anodę. Natężenie
przepływającego prądu fotoelektrycznego rejestrowane jest przez galwanometr.
8
WADY, ZALETY, WYKORZYSTANIE - MOŻLIWOŚCI I OGRANICZENIA
Bardzo małe stężenia substancji barwnej w roztworze są oznaczane z dużym błędem, gdyż
przepuszczalność roztworu badanego jest podobna do przepuszczalności roztworu odniesienia i
najczęściej bliska 100 %. W przypadku intensywnie zabarwionych roztworów tylko mała część
promieniowania przechodzi przez roztwór, co powoduje zwiększenie błędów wyników pomiaru. W
celu wyboru najkorzystniejszego stężenia warstwy absorbującej należy znaleźć takie wartości A (T),
aby przy danym błędzie ΔA (ΔT) błąd względny wyznaczenia stężenia Δc/c był najmniejszy.
Czułość metody definiuje się jako najmniejsze oznaczalne stężenie substancji lub najmniejszą różnicę
w stężeniach substancji, które można oznaczyć za pomocą danej metody. Dla metod
spektrofotometrycznych obiektywnym, liczbowym wyrażeniem czułości jest molowy współczynnik
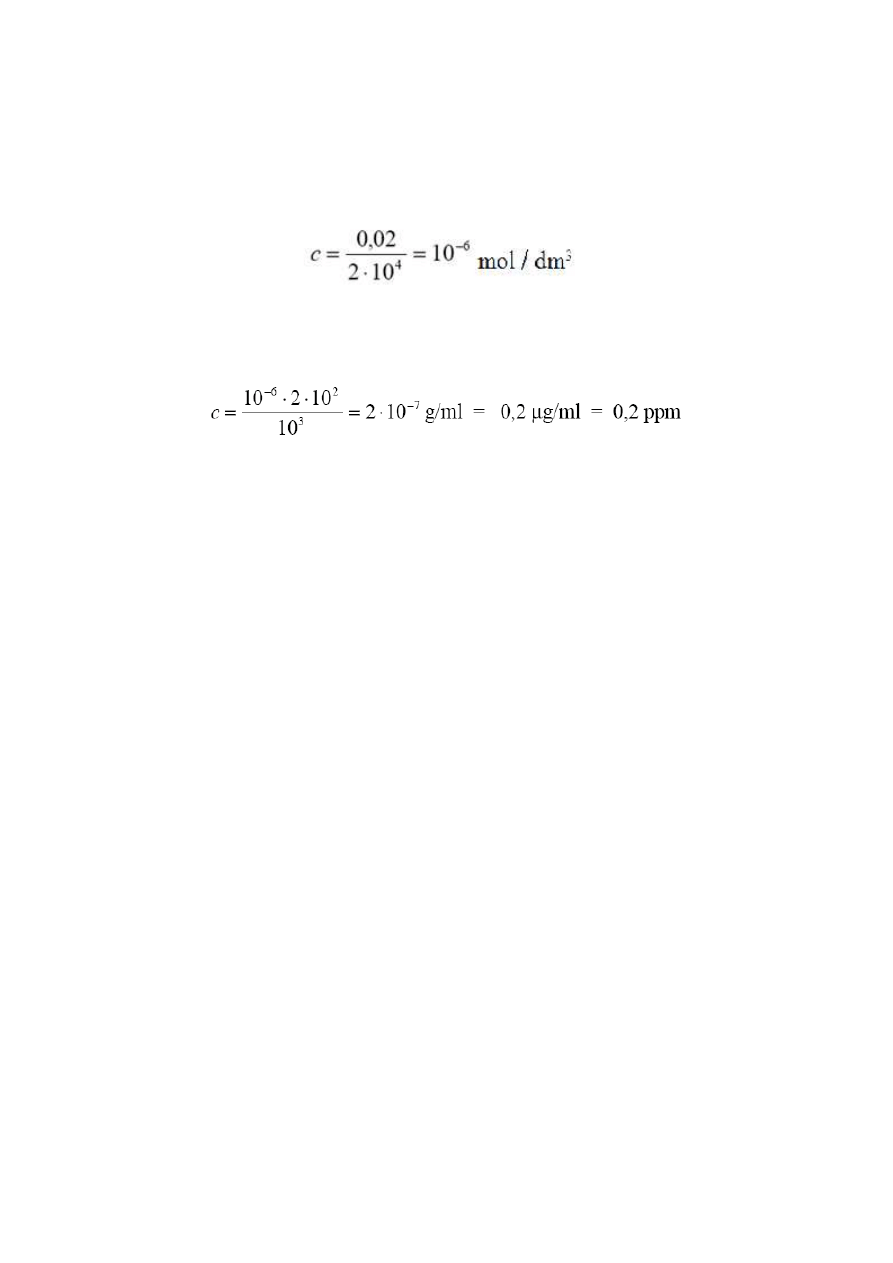
absorpcji (ε). Molowy współczynnik absorpcji nie może przekroczyć wartości 1,5 x 10
5
(ta wartość
wynika z teorii). Najmniejsze stężenie substancji (mol/l) oznaczalne spektrofotometrycznie można
obliczyć ze wzoru Lamberta-Beera. Przy założeniu, że A = 0,02 (minimalna absorbancja, którą można
zmierzyć), l = 2 cm (grubość kuwety), a ε = 10
4
(molowy współczynnik absorpcji średnio czułej metody
spektrofotometrycznej), stężenie można wyliczyć ze Wzoru !.
(6)
Jeśli przyjąć masę molową substancji jako przykładowo równą 200 g/mol to minimalne oznaczalne
stężenie tej substancji (dla średnio czułej metody, ε = 10
4
, i klasycznego spektrofotometru) wyniesie:
Metoda może być stosowana do oznaczania zawartości śladowych oraz do oznaczania czystości
głównego składnika (rejestracja zmian stężenia w czasie).
Metody spektroskopowe znajdują zastosowanie w oznaczaniu bardzo szerokiej gamy związków.
Umożliwiają jednoczesne oznaczanie kilku analitów obok siebie. Anality, których nie można oznaczać
spektrofotometrycznej to, przede wszystkim, gazy szlachetne.
Technika pomiarów w zakresie UV/VIS jest prosta, a aparatura łatwo dostępna. Większość
stosowanych rozpuszczalników jest tania i łatwa do oczyszczenia (typowe z nich to heksan, metanol i
woda).
Zasadniczą wadą tej metody jest duży błąd względny, który przeciętnie wynosi 5 – 10 %, a podczas
oznaczania zawartości śladowych (do 10-15 %), dla metod ze wstępnym zagęszczaniem wielkość
błędu może wynosić do 30 %.
OBOWIĄZUJĄCY ZAKRES MATERIAŁU:
Metody spektroskopowe
Rodzaje promieniowania elektromagnetycznego
Jakie związki można oznaczać metodą spektrofotometrii UV – VIS
Na czym opiera się spektroskopowa analiza ilościowa i jakościowa
Prawo addytywności i odstępstwa od niego
Spekrofotometr: podział, schemat blokowy, zasada działania
Zalety i wady metod spektrofotometrycznych
Wykorzystanie metod spektrofotometrycznych w analityce
Metody oznaczania żelaza w wodzie (głównie metoda rodankowa)
Literatura:
„Chemia analityczna III” J. Minczewski, Z. Marczenko
www.pg.gda.pl/Dydaktyka/Analityczna
„Metody spektroskopowe w chemii analitycznej” A. Cygański
„Spektrofotometryczne oznaczanie pierwiastków” Z. Marczenko

Absorpcyjna Spektometria Cząsteczkowa
- sprawozdanie z oznaczania chromu i kobaltu obok siebie-
•
METODY OZNACZANIA ŻELAZA W WODZIE – wymienić i w kilku zdaniach opisać
•
OZNACZANIE ŻELAZA METODĄ RODANKOWĄ – opisać dokładnie, wymienić
substancje przeszkadzające w oznaczaniu żelaza
•
ŻELAZO, KOBALT, CHROM – w jaki sposób ich obecność w wodach wpływa na
środowisko, dlaczego istotne jest ich oznaczanie
1. Cel ćwiczenia
Oznaczanie zawartości chromu i kobaltu (jednocześnie) w próbce wodnej, metodą absorpcyjnej
spektrometrii cząsteczkowej, przy użyciu spektrofotometru SPEKOL 11
Szkło laboratoryjne:
- 10 kolbek pojemności 50 ml,
- 2 kolbki pojemności 25 ml,
- zlewka,
- cylinder,
- 2 pipety.
2. Przebieg ćwiczenia
Roztwory podstawowe:
-Co(NO
3
)
2
·6H
2
O, c = 65 [g/dm
3
]
-Cr(NO
3
)
3
·9H
2
O, c = 120 [g/dm
3
]
1.Przygotowanie roboczych roztworów wzorcowych
Do wyznaczenia zależności kalibracyjnej należy przygotować 5 kolbek pomiarowych pojemności 50,00
mL. Do każdej z nich odpipetowć odpowiednie objętości roztworów podstawowych i uzupełnić wodą
destylowaną do kreski. Roztwory dokładnie wymieszać, następnie kolejno przelać do kuwety aby
wyznaczyć analityczne długości fali w celu sporządzenia krzywych kalibracyjnych.
Zakres badanych długości fal: 460 < λ < 590
-dla chromu maksymalna długość fali wynosiła …
-dla kobaltu maksymalna długość fali wynosiła …
Krzywe kalibracyjne dla Co i Cr wykonane przy wybranej długości fali
(Załącznik nr 1)
Przykładowe obliczenie stężeń oczekiwanych Co i Cr
(Załącznik nr 2)

Lp.
Co
2+
Lp.
Cr
3+
V
[ml]
C
[mol/dm
3
]
A
V
[ml]
C
[mol/dm
3
]
A
λ
Co2+
=____ λ
Cr3+
=____
λ
Co2+
=____ λ
Cr3+
=____
1
0,5
1
5
2
1,5
2
10
3
2,5
3
15
4
3,5
4
20
5
4,5
5
25
Lp.
Co
2+
Lp.
Cr
3+
V
[ml]
C
[mol/dm
3
]
A
V
[ml]
C
[mol/dm
3
]
A
λ
Co2+
=____ λ
Cr3+
=____
λ
Co2+
=____ λ
Cr3+
=____
1
0,5
1
5
2
1,5
2
10
3
2,5
3
15
4
3,5
4
20
5
4,5
5
25
Lp.
Co
2+
Lp.
Cr
3+
V
[ml]
C
[mol/dm
3
]
A
V
[ml]
C
[mol/dm
3
]
A
λ
Co2+
=____ λ
Cr3+
=____
λ
Co2+
=____ λ
Cr3+
=____
1
0,5
1
5
2
1,5
2
10
3
2,5
3
15
4
3,5
4
20
5
4,5
5
25

2. Sporządzenie roztworów A i B w kolbach pojemności 25 cm
3
za pomocą danych
zawartych w tabeli:
Roztwory podstawowe
Roztwór A
Roztwór B
V [cm
3
]
V [cm
3
]
Co(NO
3
)
2
· 6H
2
O
65 [g/dm
3
]
0,5
4
Cr(NO
3
)
3
· 12H
2
O
120 [g/dm
3
]
2,5
10
3. Sprawdzenie działania prawa addytywności dla roztworów A i B – przy długościach fal,
dla których następuje maksymalna absorbancja dla Co
2+
i Cr
3+
Roztwory
podstawowe
Roztwór A
Roztwory
podstawowe
Roztwór B
V
[ml]
C
[mol/dm
3
]
V [ml]
V
[ml]
C
[mol/dm
3
]
A
λ
Co2+
=
λ
Cr3+
=
λ
Co2+
=
λ
Cr3+
=
Co
2+
Co
2+
Cr
3+
Cr
3+

3. Obliczenia
1.Obliczenie na podstawie prawa addytywności i krzywych wzorcowych, stężeń jonów
Co
2+
i
Cr
3+
w próbkach A i B
(Załącznik nr 3)
2.Porównanie otrzymanych wyników z wartością oczekiwaną
3.Wyznaczenie stężenia jonów
Co
2+
i Cr
3+
w nieznanej próbce X
1
(Załącznik nr 4)
4.Podsumowanie i wnioski
Wyszukiwarka
Podobne podstrony:
Sprawozdania, Spektrofotometria absorpcyjna, Spektrofotometria absorpcyjna
Podstawy spektroskopii cząsteczkowej
12 Spektroskopia czasteczkowa
chemia analityczna absorpcyjna spektrometria atomowa, chromatografia, analityka chemiczna
Absorpcyjna spektrometria atomowa, Absorpcyjna spektrometria atomowa, AAS, z angielskiego Atomic Abs
Absorpcyjna spektrofotometria atomowa ASA
Budowa i badania spektrofotometrów i fotometrów absorpcyjnych
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
57. Pomiar widm absorpcji i oznaczanie stężenia ryboflawiny w roztworach wodnych za pomocą spektrofo
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
SPEKTROFOTOMETRIA ABSORPCYJNA W ŚWIETLE WIDZIALNYMpat, Chemia 1
Pomiar widma absorpcji barwników w roztworach za pomocą spektrofotometru
05 Spektrofotometria absorpcyjna (kolorymetria)
sprawozdanie Spektroskopia absorpcyjna w podczerwieni, spektroskopia
więcej podobnych podstron