
Ćw ic zeni e nr 1
REFRAKTOMETRIA
Cel em ćwi czen ia j est sp rawdzen ie wł aś ciwoś ci add yt ywn ych refrak cji n a
prz ykł adzie p rost yc h su bst an cji organi czn ych o raz ukł ad u d wus kładni koweg o –
- wo dn ego roztwo ru ch lorku pot as owego .
Apa ra tura i szkł o: Od czynniki :
Refrakt ometr, acet on, chlo ro fo rm, tolu en ,
Piknom et r, n - but an ol, m et anol,
Kroplom ierze KCl – stał y,
Kolb a miaro wa o poj . 10 0 cm
3
roztwó r KCl o n i ezn an ym st ężeniu,
alk ohol et ylo w y do p rzem ywania
p r yzm ató w refraktom etru
WYKO NANIE ĆWI CZENI A:
1. Przep ro wadzi ć pom iar y ws pół cz yn nik a załam ani a światł a dla tolu en u, acet onu,
chl oro fo rm u, n-but anolu i m et anol u. Dl a d an ej su bst an cji pomi ar n al eż y w yk o nać
trz yk rot nie i do obli czeń wzi ąć warto ść ś redni ą.
2.
W ys uszon ą kol b ę miarową zważ yć n a wadze an ali t ycz nej, ws yp ać ok . 15 g KCl
i pono wni e zważ yć. Rozpuś ci ć sól w wod zie des t ylo wan ej, uz upełni ć wo dą d o kres ki i
zważ yć.
3.
Zważ yć: pust y pi knom et r; napeł ni on y wod ą dest yl o waną; napeł nio n y
spo rządzo n ym roztworem KCl; napełnio n y roztwo rem KCl o n iezn an ym st ężeniu.
4.
Przeprowadzi ć
po miar y
współ cz yn ni ka
zał am ani a
ś wi atł a
dl a
wo d y
dest yl o wan ej, spo rządzonego rozt wo ru KCl oraz rozt wo ru KC l o n iezn an ym s tęż en iu.
O PRACO WANIE W YNI KÓW :
1. Obli cz yć st ęż eni e p rocent owe s po rządzon ego roztwo ru KCl .
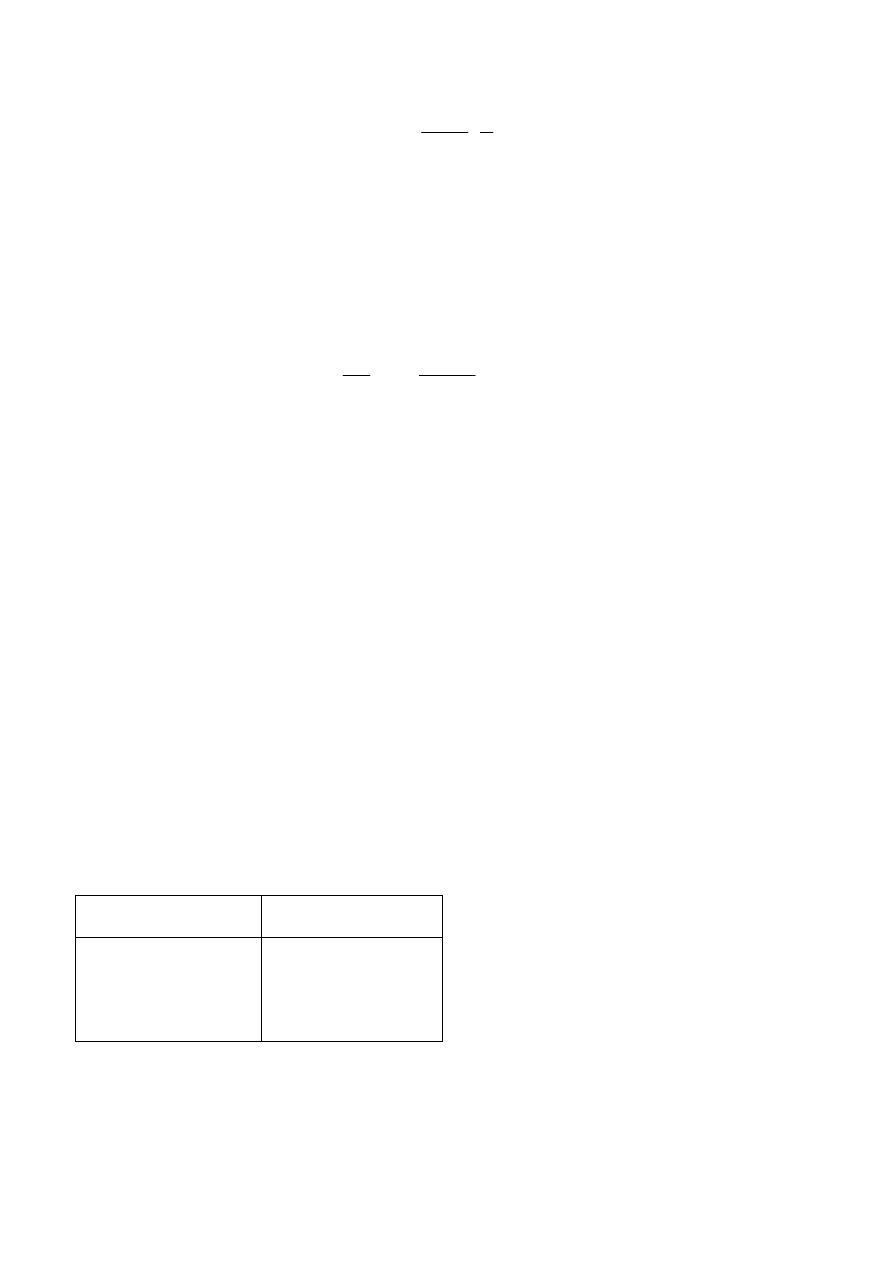
2. Obli cz yć gęst oś ć t ego roztwo ru o raz rozt wo ru o ni ezn an ym st ężeniu z e wzoru:
d =
0
1
0
2
g
g
g
g
−
−
d
0
,
gdzie: g
o
– cięż ar pu stego p ikn ometru,
g
1
– ci ężar pikn om etru z wo dą,
g
2
– ci ężar pikn om etru z rozt wo rem,
d
o
– gęstoś ć wo d y w tem peratu rze pom iaru.
3. Obli cz yć warto ść refrakcji dl a spo rz ądzo nego roztworu KCl z e wzoru:
r
r
=
2
1
2
2
+
−
n
n
d
1
(1)
gdzie: n – wsp ółcz yn nik z ałamania ś wiatł a,
d – gęstoś ć .
W anal o gi czn y s po sób obl icz yć refrakcj ę wł aś ci wą dla wod y i roztworó w
o ni ezn an ym st ężeni u.
4. Dla rozt wo ru o zn an ym stęż eni u obl i cz yć wart oś ć refrakcji wł aś ciwej KCl
ze wzo ru:
r
r
=
100
P
r
s
+
100
100
P
−
r
w
, (2 )
gdzie: P – p ro cent wago w y KCl w roztwo rze,
r
r
– refrak cja wł aś ci wa roztwo ru ,
r
s
– refrakcj a wł aś ci wa KCl ,
r
w
– refrak cja wł aś ci wa wod y.
5. Znając wart oś ć refrakcji właści wej KCl z ró wn ani a (2 ), obli cz yć s tęż eni e
pro cent owe badaneg o roztwo ru .
6. Z ró wn an ia (1 ) o b licz yć wartoś ci refrakcji wł aś ci w ych bad an ych zwi ązkó w
organi czn ych , a nast ępn ie z równania:
R = r M ,
gdzie: R – refrakcja molo wa,
M – m as a cz ąst eczk o wa,
obli cz yć wartoś ci refrakcji mo low ych. Gęstoś ci związk ów po d ano w tab eli 1 .
Poró wn ać ot rz ym an e wart oś ci z wart oś ciami obli czo n ymi z refrakcji atom ow ych ,
pod an ych w t ab eli 2.
Tab el a 1
Zwi ązek o rgani czn y
Gęstoś ć w 20
o
C,
[g/ cm
3
]
Tolu en
Aceto n
Chloroform
Alko hol n-but yl o w y
Met ano l
0,86 00
0,79 60
1,49 04
0,80 80
0,79 20
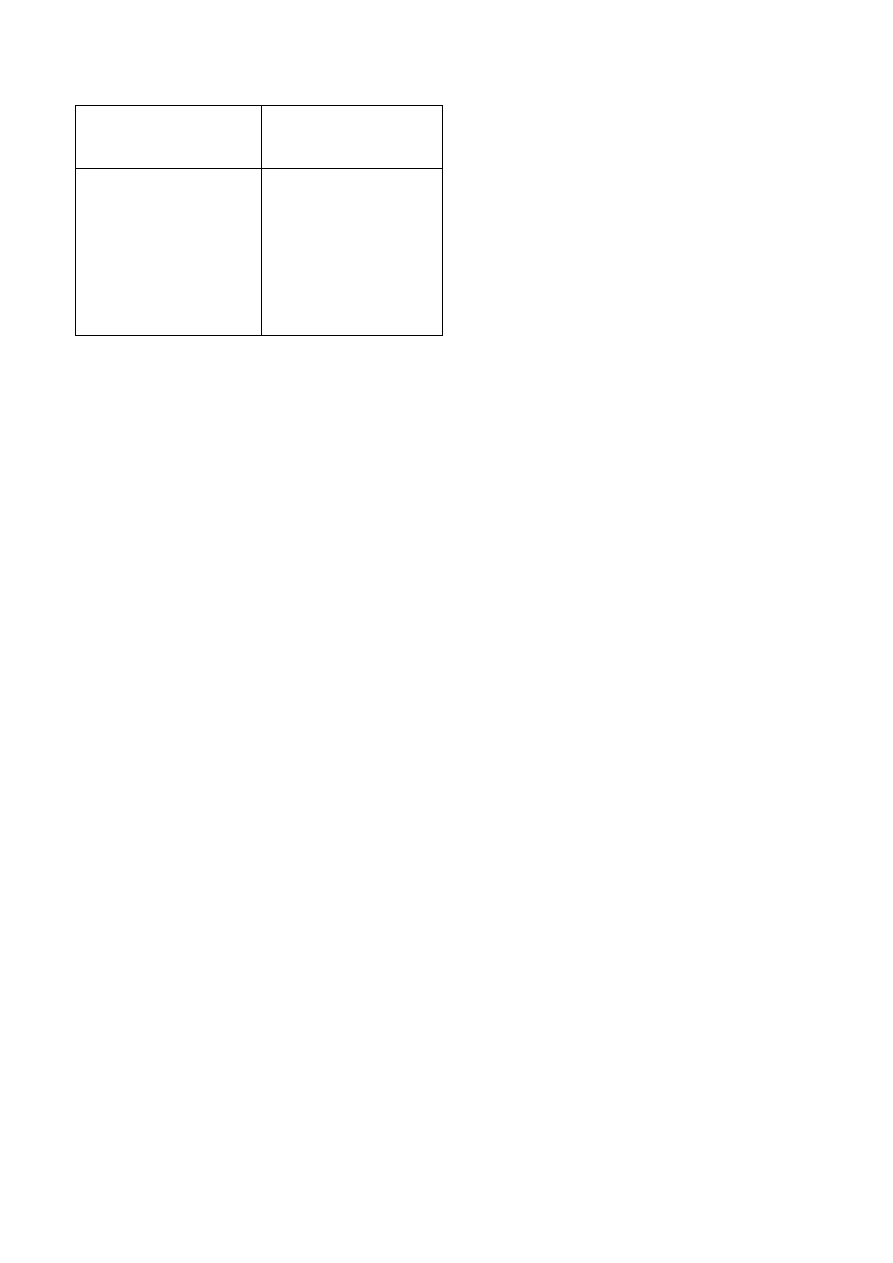
Tab el a 2
Rodzaj at omu
lub wi ązani a
Refrak cj a atom owa
lub wi ązani a,
[cm
3
/mol]
Węgi el
Wodór
Tlen
Tlen (w grupi e C O)
Tlen (w grupi e OH)
Chlor
Wiązani e po dwó jn e
Wiązani e pot rój ne
2,91 8
1,10 0
1,64 3
2,21 1
1,52 5
5,96 7
1,73 3
2,39 8
Instrukcja obsłu gi refrak to metru l abo rato ry jn ego typu RL
1. Po ods łoni ęciu oki enka oś wi etl ającego (3 ) n al eż y o dch yli ć całko wi ci e p r yzm at
górn y (4 ).
2. Watą zwilżo ną et ano lem ocz yś cić po wi erzchni ę pr yzm at ów.
3. Za pom ocą wk rapl acza n ani eś ć na do ln y pr yzm at (5 ) – 3 -4 k ropl e b ad an ej ci ecz y.
4. Zam kn ąć p r yzm at.
5. Zwi erci ad eł ko (6 ), z naj duj ące si ę p od dol n ym p r yzm at em, po winn o b yć od słon ięt e.
6. Oki enk o (3), oś wietlaj ące p r yzm at n ak r ywko w y (gó rn y), nal eż y sk iero wać n a
naj bliższe źró dło świ atł a.
7. Od ch yl ić zwi erciadełko (7), znaj duj ące s ię n a bo czn ej ś cian ce refrakt om etru tak,
ab y oś wi etl eni e s k ali b yło j ak naj lepsze.
8. Przez ob rót p ok rętła (8) m ożna uz ysk ać ostre i b ezb arwn e ro zgrani czen ie j asn ego
i ci emn ego pol a wid zeni a.
9. Za p omo cą po krętł a (9 ) n ap rowadzić li nię p odzi ału p ol a j asn ego i ciem n ego
dokł ad nie n a ś ro dek sk rz yż owani a ni ci p aj ęcz ych , wido czn yc h w gó rn ym o ki enk u
okul aru (1 ).
10. Piono wa li nia sk ali wsk aże w yn ik po miaru na po dział ce gó rn ej, p rzezn acz on ej d la
warto ści li czbo w ych wspó łcz yn ni ka zał am ani a.
11. Ost roś ć ob razu u stawić za pom ocą pi erś ci eni a (2 ).
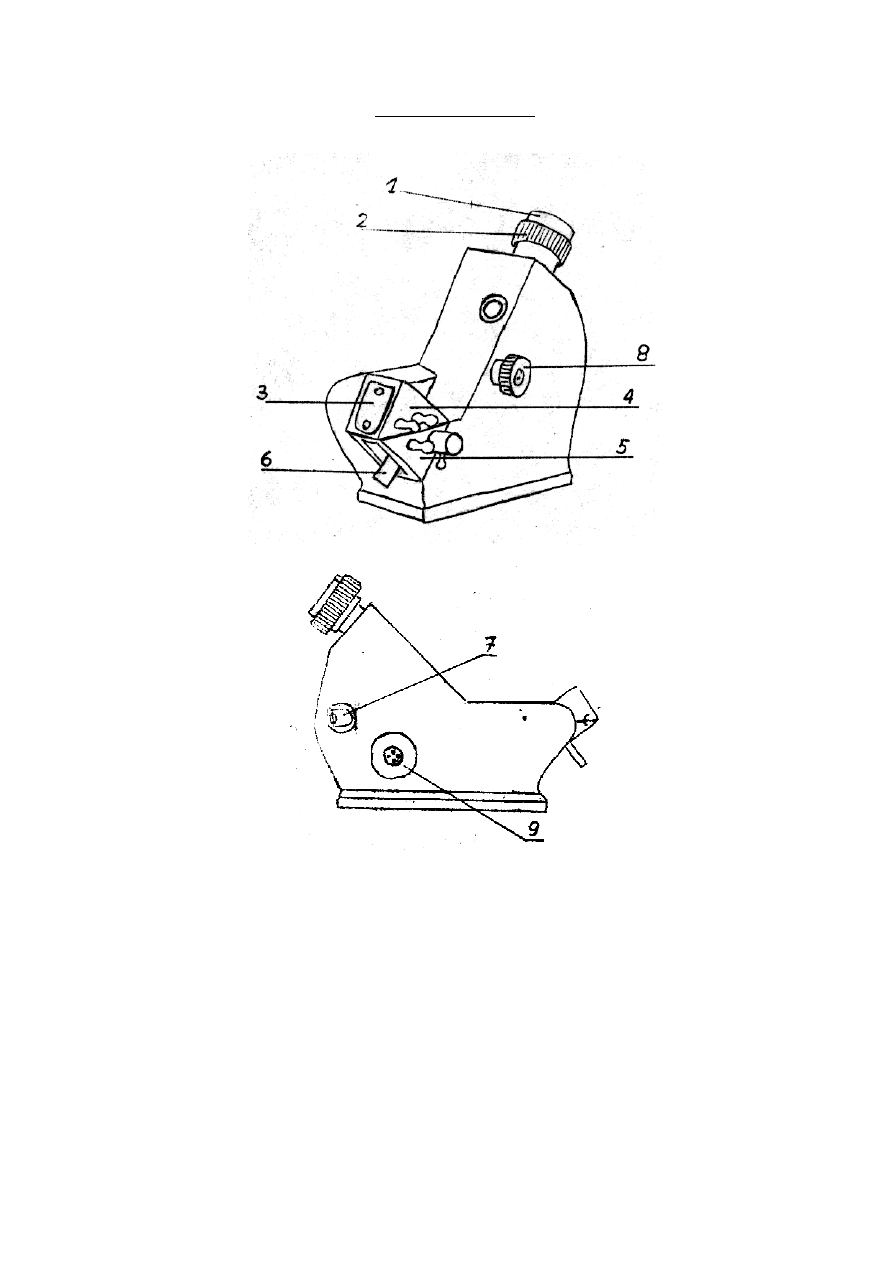
Refraktometr RL

Ćw ic zeni e nr 3
ADS ORPCJ A KWASU OCT OWEGO
NA WĘGLU AKTYWNYM
Cel em ćwi cz eni a j est w yzn aczenie izot erm y adso rp cji k wasu oct owego n a
węglu ak t ywn ym o raz w yst ęp uj ąc ych w równ ani u Freund licha stał ych,
ch arak ter ys t ycz n ych dla ukł ad u C H
3
OOOH – węgi el akt ywn y.
Szkło : O dczynniki:
Kolb y mi aro we o poj . 10 0 cm
3
– 6 szt ., 3 N CH
3
COOH,
But el ki z ko rk ami o poj. 200 cm
3
– 6 szt. , 0,1 N NaOH,
Erl enm aj erki o p oj. 100 cm
3
– 1 2 szt. , węgi el akt ywn y,
Lej ki – 6 szt., fenolo ft al ein a
Biu ret a o po j. 50 cm
3
WYKO NANIE ĆWI CZENI A:
1. W sześci u kolb ach miarow ych o poj . 10 0 cm
3
nal eż y p rz ygo tować rozt wor y kwas u
oct owego o st ężen iach: 0, 3; 0 ,2; 0, 15; 0,10; 0 ,08; 0, 05 N, prz ez o dpo wi edni e
rozcieńcz eni e 3 N CH
3
COOH. Dokł adn e stęż eni a roz two ró w w yz nacz yć
miareczku jąc j e mianowan ym roztworem 0,1 N NaOH wob ec fenolo ft al ein y. Z
kolb ek z awieraj ąc ych kwas o st ęż eniach: 0, 3; 0 ,2; 0,15 N pob rać d o
miareczko wani a p ró bki o ob jęt oś ci 10 cm
3
, a z pozost ał ych o objętoś ci
25 cm
3
.
2. Do sześci u but el ek z awi erając ych p o 2 g, odważon ego wcz eśn iej węgl a akt ywn ego,
odpip et ować p o 50 cm
3
k ażd ego z prz ygoto wan ych rozt wo rów k wasu o cto wego .
But el ki zatk ać kork ami i wyt rząsać i ch zawartoś ć p rzez 3-4 minut y. P o ads orpcj i
roztwor y p rzesącz yć i po brać do mi areczkowani a t aki e s ame ich ilo ści, j ak p rz y
w yzn acz ani u st ęż eń pocz ątk ow ych .
W yn iki z est awić w t ab eli, któ rej wzó r zamiesz czono po niżej .
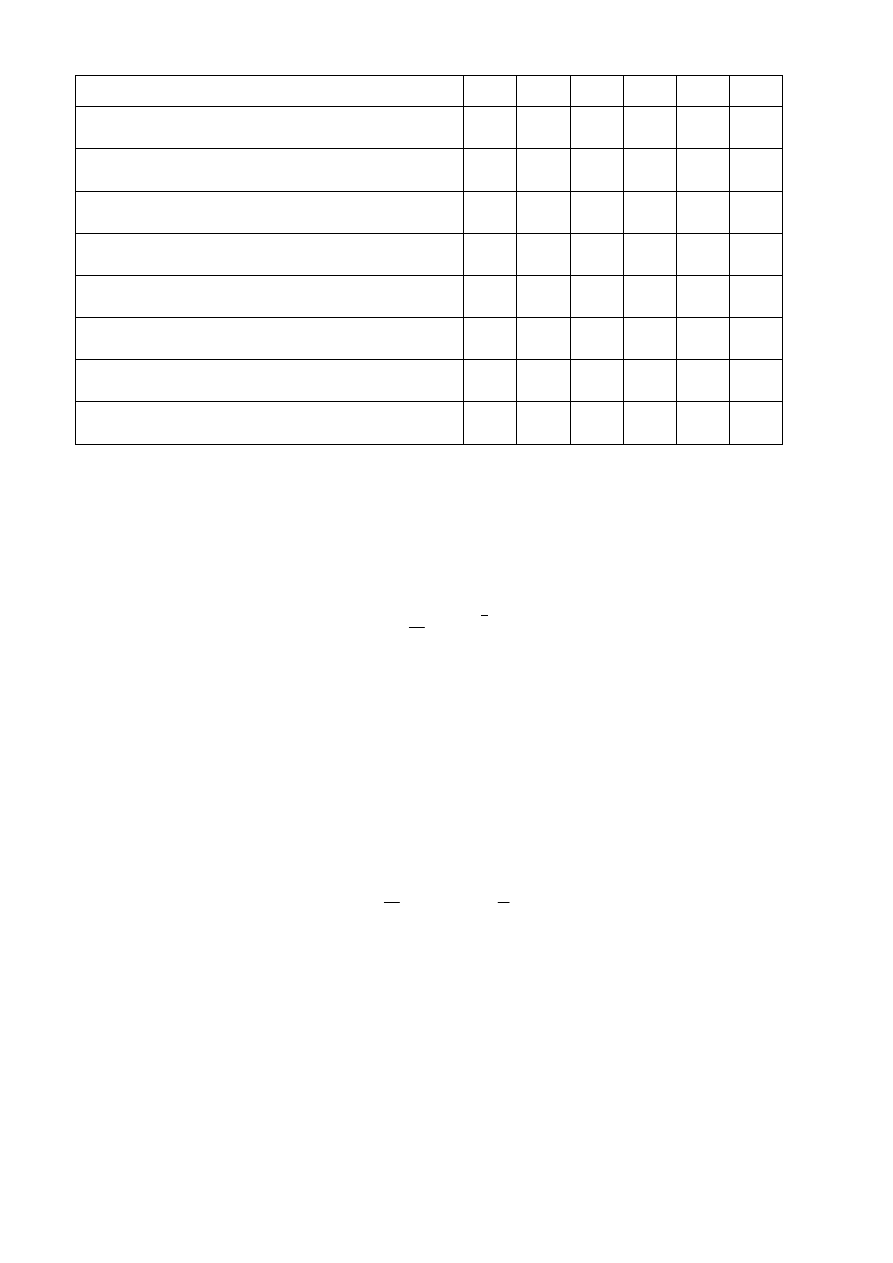
Nu mer kolbki
1
2
3
4
5
6
Il oś ć C H
3
COOH po b rana do po cz ątko wego
miareczko wani a, [cm
3
]
Il oś ć NaOH zuż yt a d o po cz ątko wego
miareczko wani a, [cm
3
]
Początko we st ężeni e CH
3
COOH
[mol dm
- 3
]
Il oś ć C H
3
COOH w 5 0 cm
3
roztwo ru
przed ads orpcją – a, [g]
Il oś ć NaOH zuż yt a d o mi areczko wani a
koń co wego, [cm
3
]
Koń co we st ężeni e C H
3
COOH,
[mol dm
- 3
]
Il oś ć C H
3
COOH w 5 0 cm
3
roztwo ru
po ads orpcj i – b, [ g]
Il oś ć C H
3
COOH zaadso rbo wan a z 5 0 cm
3
roztworu x = a – b, [g]
O PRACO WANIE W YNI KÓW :
1. Na p odst awie ró wn ani a Freu ndli ch a (1) w yk reślić izot ermę adso rp cji, cz yli
zależn oś ć x /m = f(c):
m
x
= k
n
c
1
,
gdzie: x – m as a s ubs tan cji z aads orbowan ej,
m – m as a ad so rb ent a,
c – st ężenie roztwo ru,
k, n – stałe dl a d anego u kł adu adso rb ent – adso rb at.
2. W yzn acz yć st ałe k i n metod ą grafi czn ą, korz ys t ając z e zlo gar yt mo wan ej p ost aci
ró wn ani a Freund lich a:
lo g
m
x
= lo g k +
n
1
lo g c
3. Omó wić ot rz ym an e z al eżnoś ci i wiel koś ci .
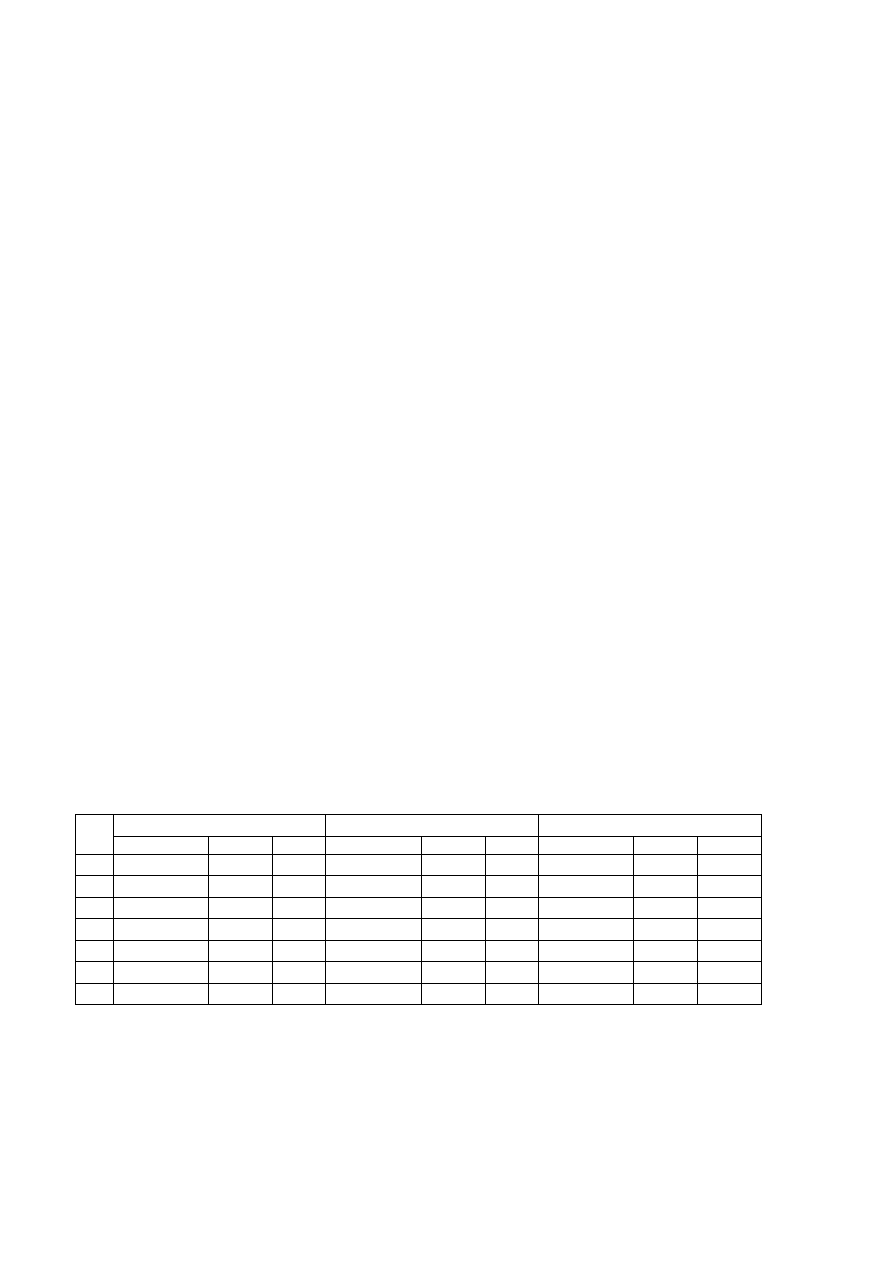
Ćw ic zeni e nr 4
BADANIE RÓWNOWAGI FAZOWEJ
W UKŁADZIE TRÓJSKŁADNIKOWYM -
- CIEKŁYM (trójkąt Gibbsa)
Cel em ćwi cz eni a j est zbad anie cz ęś cio wej rozp uszcz aln oś ci ci ecz y
o o grani czon ej rozp u szczal noś ci w ukł adz ie t rój skł adn iko w ym .
Apa ra tura i szkł o: Odczyn niki:
Miesz adł o m agn et yc zne C H
3
COOH – 10 0 %
Erl enm aj erki o p oj. 100 cm
3
– 7 szt. C HCl
3
Biu ret a o po j. 50 cm
3
H
2
O d est yl owana
Pipet y o poj . 2 5 cm
3
– 2 szt.
WYKO NANIE ĆWI CZENI A:
1. W such ych erl en m aj erkach prz ygot ować mieszanin y ch l oro fo rmu i k wasu
oct owego . W t ym celu odmi erz yć, o drębn ymi pip et ami (za pomo cą grusz ki lu b
pompk i wod nej ), ws kaz an e w t ab eli obj ętoś ci t ych ci ecz y i w ymi esz ać j e prz ez
wst rząs ani e.
2. Zawart ość k olb ek mi areczko wać wo d ą d est ylo wan ą, aż d o p oj awi en ia si ę t rwał ego
zmętni eni a.
W yn iki m iareczk owań not ować w t ab eli:
Obj ętoś ć, [cm
3
]
% wag. w rozt wo rze
% mo low y w roztworze
N r
C H
3
C O O H C H C l
3
H
2
O
C H
3
C O O H C H C l
3
H
2
O
C H
3
C O O H C H C l
3
H
2
O
1
21
2
2
19
4
3
15
6
4
11
9
5
8
11
6
5
13
7
2
15
O
H
d
2
= 1,0 0 g/ cm
3
3
CHCl
d
= 1, 50 g/ cm
3
OOH
CH
d
3
= 1 ,06 g/ cm
3

O PRACO WANIE W YNI KÓW :
Uzup ełni ć tabelę i, na po dst awi e ot rz yman ych w yn ikó w, s porz ądzi ć diagram
Gibb sa o raz w yk reś lić izot erm ę o grani czaj ącą zakres częś cio wej miesz aln oś ci w
bad an ym ukł adzi e.
Przep ro wadzi ć d ys ku sję di agram u faz owego.

Ćw ic zeni e nr 5
PRAWO PODZIAŁU NERNSTA
Cel em ćwi czenia j est w yzn aczen ie wsp ółcz yn nik a p odzi ału kwasu o ct owego
międz y dwa ni e mi es zające si ę rozp uszcz alni ki – wo dę i rozp uszczal- nik organi czn y
(chlo ro fo rm ).
Szkł o: Od czy nniki:
Biu ret a o po j. 50 cm
3
1 M CH
3
COOH
Kolb y mi aro we o poj . 50 cm
3
– 3 szt. 0,1 M NaOH l ub KOH
Rozdziel acze – 4 szt. CHC l
3
Erl enm aj erki o p oj. 100 cm
3
– 4 szt. feno loft al ein a
Pipet y
WYKO NANIE ĆWI CZENI A:
1. Rozci eń czaj ąc odp o wiedni o 1 M rozt wó r k wasu o cto wego, prz ygot ować, w
kolbk ach mi arow ych o p oj. 50 cm
3
, roztwor y o stęż eni ach: 1, 0 ; 0,7 5; 0,5; 0 ,25 M.
2. Do rozdzi el acz y, ust awi on ych w st at ywi e, od pip eto wać, z każ dej kol bki, p o 2 0 cm
3
roztworu, dod ać p o 20 cm
3
rozpusz czalnik a o rgani czn ego (chlo ro fo rmu ) i tak
prz ygo to wan e mi esz ani n y w yt rząs ać p rzez ok. 5 min ut n astęp ni e od st awi ć d o
rozdzi eleni a.
3. Z pozost ał ych (w ko lbk ach miaro w ych ) w yjś cio w ych rozt wo ró w kwas u o cto weg o
odpip et ować po 2 cm
3
i miareczko wać 0 ,1 M roztworem zas ad y (NaOH lub KOH)
wob ec fenol oft al ein y.
4. An alo giczn e mi areczkowani a w yk on ać dla warst w y wodn ej kwasu o cto wego z
rozdzi elacz y.
W yn iki z est awić w t ab eli 1:
Tab el a 1

Warst wa wod na
Prz ybliżo ne st ę-
żeni e C H
3
COOH,
[mol/dm
3
]
Pomiar
Obj ętoś ć zuż ytej
zasad y,
[cm
3
]
Obj ętoś ć zuż ytej zas ad y,
[cm
3
]
1
1
2
0,75
1
2
0,5
1
2
0,25
1
2
O PRACO WANIE W YNI KÓW :
12. Obli cz yć d okł ad ne st ężeni e k wasu oct owego [mol/ dm
3
] w w yj ś cio w yc h
roztworach i w warst wie wodn ej ukł ad u: CH
3
COOH – H
2
O – CHCl
3
.
13. Na po dst awi e ró wn ania:
K =
n
c
c
2
1
gdzie:
c
1
– st ężeni e subst an cji rozpusz czonej (CH
3
COOH) w wodzi e,
c
2
- st ężen ie su bst ancji rozpusz czon ej (CH
3
COOH) w chlo ro fo rmi e,
n - li czba ws kazująca ile raz y mas a cząst eczko wa M
1
subst ancji
rozpu szczon ej w pi erwsz ym rozp uszcz alni ku j est większa od mas y
cząs teczko wej M
2
tej sam ej sub st an cji, rozpu szczon ej w d ru gim
rozpu szcz alnik u: n = M
1
/M
2
,
obli cz yć współ cz yn n ik po dział u K.
Wartoś ć st ał ej d la tego ukł ad u nal eż y znal eź ć z wyk resu zlo gar yt mowanej
post aci równ ani a Nernsta:
lo g c
1
= lo g K + n lo g c
2
,
spo rządz aj ąc zal eżn ość lo g c
1
= f(l o g c
2
). W yni ki obli czeń przed stawi ć w
tab eli 2:
Tab el a 2.
c
1
c
2
lo g c
1
lo g c
2
K =
2
1
c
c
K
g r a f .
DYS KUSJ A WYNI KÓ W:
Przed ys k uto wać ot rzym an e w yn iki i prz epro wadzić an alizę bł ędó w.

Ćw ic zeni e nr 6
WYZNACZANIE STAŁEJ DYSOCJACJI WSKAZNIKA
KWASOWO - ZASADOWEGO
Cel em ćwi czeni a j est oznaczeni e st ał ej d ys o cj acji wsk aźnika – bł ęki tu
brom ot ym olo wego – na pod st awi e widm abso rp c yjn ych .
Apa ra tura i szkł o: Od czynniki :
Spek ol bł ękit b rom ot ym olo w y
Kolb y mi aro we o poj . 50 cm
3
– 10 szt . 0,1 M KH
2
PO
4
Pipet y 0,1 M Na
2
HP O
4
4 M NaOH
HC l – s tężo n y
WYKO NANIE ĆWI CZENI A:
1.
Do kol bki mi arowej o poj. 50 cm
3
wlać 2 cm
3
błękit u bromot ym o lo wego , kilk a
cm
3
wod y d est yl o wanej , 8 k ropl i st ężon ego roztwo ru HCl i dop eł nić wodą
dest yl o wan ą do k reski. T ak p rz ygo to wan y roztwór m a p H ró wn e 1 jedno st ce.
Zmierz yć wartoś ć ab sorpcj i roztwo ru dl a nast ępuj ąc ych dł u gości fal: 4 00 , 42 0, 4 40,
460 480 , 5 00, 55 0, 6 00, 700 nm. Spo rz ąd zić w yk res A = f(λ).
2.
Do k olbki miaro wej o poj. 50 cm
3
wl ać 2 cm
3
bł ękit u b rom ot ymol owego, 1 0
cm
3
0,1 M Na
2
HPO
4
, 10 cm
3
0,1 M KH
2
PO
4
i uzupeł ni ć wo d ą d est yl owan ą do kreski.
pH t ego roztworu w ynosi 6,9 .
W yko nać p omi ar abs orpcji (j ak w yżej) i n ani eś ć wi dmo na wcześni ej ot rz yman y
w yk res.
3.
Do kol bki mi arowej o poj. 5 0 cm
3
wl ać 2 cm
3
błęk itu b rom ot ym o lo wego , 1 cm
3
4 M NaOH, uzu peł nić wod ą d es t ylowan ą do kres ki i mi erz yć abso rpcj ę
prz ygo to wan ego rozt wo ru (o p H = 13 ), dl a w ymi en ion ych w yż ej dłu goś ci fal. Nani eś ć
widmo n a wcz eś niej otrz ym an y w yk res.
Na podstawie sporządzonych widm wybrać długość fali, dla której absorpcja ma jednostkową wartość dla różnych pH
(punkt izozbestyczny).
4. W sied miu kol bk ach o poj . 5 0 cm
3
s po rządzić rozt wo r y o n ast ępu jąc ych skł ad ach:

Nr
Wskaźni k
[cm
3
]
0,1 M KH
2
PO
4
[cm
3
]
0,1 M Na
2
HP O
4
[cm
3
]
pH
4
2,0
10,0
0
4,5
5
2,0
10,0
2,0
6,2
6
2,0
20,0
10,0
6,6
7
2,0
10,0
20,0
7,2
8
2,0
2,0
10,0
7,6
9
2,0
2,0
20,0
7,9
10
2,0
0
10,0
9,1
W yk on ać pomi ar abs orpcj i dla w yb ran ych dł u go ści fali: 4 60, 5 40 nm.
Przed stawi ć n a w yk resi e z ależn oś ć abs orpcji od pH roztwo ru [A = f(p H0 )] i o dcz ytać
warto ść pH, dla kt órej n ast ępu je prz ej ści e form y kwas owej w z as ado wą błękitu
brom ot ym olo wego (p unkt prz egi ęci a k rz ywej ).
O PRACO WANIE W YNI KÓW :
Błękit bromotymolowy jest wskaźnikiem jednozasadowym i dysocjuje zgodnie z równaniem:
HIn
←→
H
+
+ In
-
f o r m a k w a s o w a f o r m a z a s a d o w a
Stał a d ys o cj acji d an a jes t wz orem:
K =
k
s
H
c
c
c
+
, (1)
gdzie: c
s
– st ęż eni e fo rm y z as ad owej;
c
k
– stęż eni e fo rm y k wasowej .
p K = -lo g
k
s
c
c
(2 )
Po zlo gar ytmo waniu ró wn ani a (1 ) o trz ym uje si ę:
lo g K = l o g
+
H
c
+ l o g
k
s
c
c
lub - lo g K = -lo g
+
H
c
- lo g
k
s
c
c
.
Z ró wn ani a (2 ) w yni ka, że dl a c
s
=c
k
- p K = pH, a wi ęc n a po dst awi e wartości
pH, prz y k tó rej nast ępuj e prz ejś ci e form y kwaso wej w zasado wą (zn alezi on ej z
w yk resu A = f(p H), możem y o bli cz yć stał ą d ys o cj acji błękitu b romo t ymol owego:
K = 1 0
- p H
.
OBSŁUGA KOLO RYMETRU „S PE K OL”
W yk on ani e ćwicz eni a n a kol or ym etrz e:

1. Włącz yć ap arat d o gniazd ka p rądu zmi en nego.
2. Przeł ącznik (1 ) w z asil aczu ust awi ć w poz ycji I – po win na zap alić si ę żaró wk a
umieszczon a z t ył u aparatu, w op rawie (7 ). Ap arat nal eż y wł ącz yć 3 0 minut p rzed
rozpo cz ęci em pomi arów.
3. Ust awi ć odp owi ed ni ą d łu goś ć fali (w nm ) b ęb nem (4 ).
4. Umi eścić prz ed szczelin ą, w saneczk ach (8 ), roztwór b adan y z prawej st ro n y
i rozt wó r o dno śni ko w y (wod a d es t ylo wana) z l ewej st ron y.
5. Po wp ro wadz eniu , p rz y z amk niętej fotok o mórce [prz eł ącz nik (2) w p oz ycji 0], w
bieg wiązk i ś wi atł a (n a wp ro st sz czel i n y) ku wet y z roztworem odn ośni ko w ym ,
ustawi ć pok rętł em (3 ) wsk azówk ę w poz ycji 0 z l ewej st ron y d oln ej s kal i (6) .
6. Umi eścić p rzełączni k (2 ) w poz ycji I i pokrętł em wzm acn iacza (5) us tawi ć na
skal i (6) 10 0% prz epu szcz alno ści (sk al a d oln a) lub 0 ek st yn k cji (górn a sk al a
lo gar yt mi czna).
7. Zam kn ąć fotok omó rk ę, umi eszcz aj ąc p rzełącznik (2 ) w poz ycji 0.
8. W bieg wiązki ś wiatł a wp rowadzić ku wet ę z roztworem b ad an ym .
9. Odsł oni ć sz czel in ę, umieszczając prz eł ącznik (2) w poz ycji I.
10. Od cz yt ać w yn i k n a górnej sk ali lo gar yt miczn ej 0 – 2 (cz ytać o d st ro n y prawej).
11. Ust awić n ast ęp ną dł u goś ć fali bębn em (4 ).
12. Powt órz yć cz yn noś ci od 5 d o 1 0 pun ktu.

Ćw ic zeni e nr 7
LEPKOŚĆ
Cel em ćwi cz eni a j est w yzn aczenie zal eżn ości l epk oś ci ci ecz y od t emp eratur y.
Apa ra tura i szkł o: Od czyn niki:
Wiskoz ym etr Hep pl era 50 % roztwór gli cer yn y
Ultrat ermost at
Piknom et r
Stoper
WYKO NANIE ĆWI CZENI A:
1. Do rur y pomi arowej wis koz ym et ru (w yp oziomo wan ego i podł ączo nego d o
termost atu ), wl ać roztwó r gli cer yn y o raz umi eś ci ć w ni ej odp owi ed nią kul k ę.
Termom et r ko nt akto w y t erm ost atu ust awić n a żądaną t em peraturę (kol ejn o: 25 , 30 ,
35, 40 i 45
o
C).
2. Oznacz yć gęst oś ci gl icer yn y w po szczegó ln ych t emp erat urach. W t ym celu zważ yć
(n a wadze an alit yc znej ) pust y (do kład nie w ys uszo n y) oraz napeł nio n y wo dą
dest yl o wan ą pik nom etr, p o cz ym wl ać do pi knom et ru rozt wó r gli cer yn y (t en,
któr ym w yp eł nion a jest rura pomi arowa wiskoz ym et ru ). Tak p rz ygo to wan y
pikno met r umi esz czać w t ermost aci e i, po p od grz aniu gli cer yn y d o t em peratu r y
pomi aru (ob serwować wsk azani a t ermom etru z anu rzon ego w pikno met rz e), waż yć
pikno met r. Obli cz yć mas ę glicer yn y w d anej tem p eratu rze.
3. W yk on ać pomi ar cz asu op ad ani a k ulki m i ędz y zaz naczon ym i na ru rze p omi arowej
kresk ami . W t ym celu, po osi ągn ięci u p rzez roztwó r gli cer yn y w wi skoz ym et rze
zad an ej t emp erat ury p omi aru (25
o
C ), o dwró ci ć wisk o z ym et r o 180
o
, p o
przemieszcz eniu
si ę ku lki „n a
gó rę” wró ci ć do
pi erwotn ego po łożenia
wisk oz ym etru i mierz yć sto perem cz as o pad an ia k ulki . Każd y p omi ar p owt órz yć 3
– 4 raz y i obli cz yć średn i czas op ad an ia k ulki.
4. Po doko naniu w tem p. 25
o
C pomi arów czasu op adania k ul ki i mas y gli cer yn y,
nast awi ać t erm om etr kontakto w y term ost atu n a kol ejn ą tem p erat urę i powt órz yć
wsz yst kie do t ych czaso we cz ynn oś ci, cz yli m ierz yć czas op ad ani a kulk i i
w yzn acz yć m as ę gl i cer yn y w t ej t emp eratu rze. Pomi ar y w ykon ać we wsz ystki ch
wsk azan ych tem perat urach (30 , 3 5, 40, 45
o
C ).
O PRACO WANIE W YNI KÓW :
14. W yn iki bez poś redni ch od cz ytó w cz asu opadani a k ulki o raz mas y ciecz y w
pikno met rz e p rzedst awi ć w t abeli :
Czas o pad ani a k ulki ,
[s]
Tem p.
[
0
C]
1
2
3
4
Średni cz as
opadani a k ulki ,
[s]
Mas a
gl icer yn y,
[g]
15. Obli cz yć gęst oś ć roz two ru w posz czególn ych t emp erat urach wg wzo ru:
d =
0
1
0
2
g
g
g
g
−
−
d
0
gdzi e: g
o
– mas a pust ego pi knom et ru ,
g
1
– m as a pikn ometru z wod ą d est yl o wan ą,
g
2
– m as a pikn ometru z gli cer yn ą,
d
o
– gęst oś ć wod y w temp eraturz e pomi aru.
16. Obli cz yć l epk oś ć (m eto dą Sto ck es a) ze wzoru:
η
= t (d
1
– d
2
) K
gdzi e:
η
- l ep koś ć d yn ami czn a, [ cP],
t – czas o padani a k ul ki,
d
1
– gęst oś ć k ulki ,
d
2
– gęst oś ć roztworu b ad an ego (gli cer yn y),
K – st ał a, z ależ na od ro dzaj u k ulki.
Param et r y kulk i szkl an ej: m as a – 4, 457 5 g,
gęst oś ć k ulki – 2,2 2 8 g cm
- 3
,
stał a K – 0 ,07 456 8.
17. W yn iki pomi arów p rzedst awić w tabeli:
T
[K]
T
1
10
3
d
2
[g cm
- 3
]
d
1
– d
2
[g cm
- 3
]
η
[cP]
lo g
η
18. W yk reśli ć na p api erze mil imetro w ym zal eżność: lo g
η
= f(1/ T).
19. Meto dą n ajmn iej sz ych k wadrató w obli cz yć p aramet r y p rost ej l o g
η
= f(1/T ), a
stąd st ał e ró wn ani a Ah renius a-Guzman a:
η
= A e
T
B
20. Ok reślić „energi ę ak t ywacji” l epk oś ci m n ożąc st ał ą B prz ez R (st ał a gazo wa).
21. Przep ro wadzi ć d ys ku sję ot rz yman ych w yn ików.

Ćw ic zeni e nr 8
NAIPĘCIE POWIERZCHNIOWE
(M etod a st alagmom etr yczn a)
Cel em ćwicz eni a j est zbad ani e wpł ywu al koh oli o róż n ych dłu goś ci ach
łań cu ch a węglo wego i różn ych st ężen iach na n api ęci e p owi erzchn iowe wo d y.
Apa ra tura i szkł o: Odczynniki :
Stal agmo met r, 1 M CH
3
OH,
Kolb ki mi aro we o po j. 50 cm
3
– 2 szt. , 1 M C
2
H
5
OH,
Zlewki o poj. 50 cm
3
– 3 szt., 1 M C
3
H
7
OH,
Pipet a o p oj. 25 cm
3
, 1 M C
4
H
9
OH
WYKO NANIE ĆWI CZENI A:
1. Staran ni e um yt y st al agm omet r umo co wać w s tat ywi e w poz ycj i pio nowej .
2. Do st al agm om etru z ass ać wod ę d est yl o wana tak, ab y j ejpo ziom si ęgał p ow yż ej
górnej kres ki. Nast ępni e pozwoli ć wo dzie swobo dni e w yci ek ać z e stalagmom et ru .
Od mo mentu, w k tó rym menisk wo d y mi ja górna kres kę, li czyć k ro pl e do chwili ,
gd y m en isk wo d y mi ja d oln ą k resk ę. Po miar po wt órz yć 3 raz y (różni ca po międz y
pomi arami ni e p owi n na b yć wi ększ a niż 2 – 3 k ropl e).
3. W analo gi czn y spo sób p rzeprowadzi ć pomi ar il oś ci k rop el w ypł ywaj ąc ych ze
stal agm om etru dl a cz terech 1 M alko holi .
4. Z 1 M alko hol u but yl o wego p rz ygo tować roztwo r y o st ężeni ach: 0 ,5; 0 ,25; 0,1 2 5
M (p rzez kol ejn e ro zcieńcz eni a 1 M C
4
H
9
OH). Nas tępni e p rzep ro wadzi ć pomi ar
iloś ci k ro pel w yp ł yw aj ąc ych ze st al agm o met ru (j ak w yż ej ) dl a k ażd ego st ężeni a.
W yn iki z ami eś ci ć w tab eli, kt órej prz yk ł ad p rzed st awi ono po n iżej.
Stężenie,
[mol/dm
3
]
Li czb a
kro pel
Gęstoś ć w 20
o
C,
[g/ cm
3
]
Napięci e
powi erzch nio we,
[d yn a/ cm]
Woda
0,99 82
Met ano l
1
0,98 98

Etanol
1
0,98 60
Prop an ol
1
0,98 37
But anol
1
0,5
0,25
0,12 5
0,98 21
0,98 90
0,98 96
1,00 00
O PRACO WANIE W YNI KÓW :
22. Obli cz yć n api ęci e p o wierzchni owe rozt wo ró w alko holi ze wzo ru:
σ
=
n
d
n
d
0
0
0
σ
,
gdzie:
σ
,
σ
0
– napi ęcie powierzchnio we ci ecz y b ad an ej i wz orcowej,
n, n
0
– l iczb a krop el ci ecz y b ad an ej i wzorco wej ,
d, d
0
– gęstoś ć ci eczy b ad an ej i wzo rco wej.
23. Dla alko holi o różn ej dłu goś ci ł ań cu cha, ale o j edn ak ow ym st ężeniu , s porz ądzi ć
w yk res z ależ noś ci napięci a p owi erzchnio wego
σ
od l iczb y ato mów węgl a w
cząs teczce al koh olu. Na po dst awi e w yk res u p rzed ys k uto wać reguł ę T raub ego.
24. Dla alko holu bu t ylo wego obli cz yć n ad mi ar po wi erz ch nio w y
Γ
, z równani a Gibbs a:
Γ
= -
RT
c
(
c
σ
)
m etod ą grafi cznego różni czko wani a.

Ćw ic zeni e nr 10
KONDUKTOMETRIA
Cel em ćwi czenia jes t w yzn aczeni e s tał ej d yso cj acji k wasu o cto wego z
pomi arów prz ewodn i ctwa el ekt r yczn ego.
Apa ra tura i szkł o: Odczynniki:
Kon dukt om etr 0,1 M KCl
C yl ind er mi arow y d o pomi aró w 1/1 6 M CH
3
COOH
Kolb ki mi aro we o po j. 50 cm
3
– 2 szt. 1/3 2 M CH
3
COONa
Pipet y o poj . 2 5 cm
3
– 2 szt.
WYKO NANIE ĆWI CZENI A:
1. Ka librowanie kond ukto metru p rzed p o mia rem
Przyrząd włączyć do sieci. Przełącznik zakresów pomiaru „RANGE” ustawić w pozycji 500
µ
S i nacisnąć przycisk
„CAL”. Wskazówka aparatu powinna znaleźć się na podziałce oznaczonej kolorem czerwonym. Jeżeli wychyla się inaczej,
należy ustawić ją na tej podziałce przy pomocy potencjometru „CALIBRATION”.
2. Wykonani e p o mi a ru (zasada o góln a):
Ozn aczan y rozt wó r umieści ć w c ylind rze pomi aro w ym i zanurz yć w ni m
el ekt rod ę k ond ukto met ru. Nal eż y u ważać, ab y roztwó r cał kowi ci e po kr ył wsz ys tki e
trz y pi erś ci eni e pl at yn o we el ekt rod y. Przeł ącznik zak resó w pomi aru ust awi ć w
poz ycji um ożliwi aj ącej do kon ani e od cz ytu n a sk ali (w ych yl e nie wsk azó wki m ożli wie
naj dal ej w prawo ).
3. Po mia r s tał ej kond ukto metru
W sposób opisany w punkcie 2 wykonać pomiar przewodnictwa dla 0,1 M roztworu KCl. W tablicy umieszczono
wybrane wartości przewodnictwa właściwego dla 0,1 M roztworu KCl:
Tem peratu ra,
[
o
C]
Przewod nictwo wł aś ciwe,
[S cm
- 1
]
18
0,01 119
19
0,01 143
20
0,01 167
21
0,01 191
22
0,01 215
25
0,01 288
Wart oś ć st ał ej kon du ktom etru o bli cz yć ze wzo ru:

χ
=
R
1
K
gdzie:
χ
- prz ewodni ctwo właściwe 0,1 M KCl,
1/R – wartoś ć p rzewodni ct wa dl a 0 ,1 M KCl, zmi erzon a na
kond uk rom et rze,
K – st ał a k ond uktom etru.
4. Po mia r p rzewodni ctwa elek try cznego dla ro ztwo rów kwa su o ctoweg o i
octanu sodowego.
Pomiar przewodnictwa wykonać dla roztworów kwasu octowego i octanu sodowego o następujących stężeniach:
CH
3
COOH : 1/ 16 M ; 1/32 M; 1/6 4 M; 1/1 28 M; 1/ 256 M; 1/51 2 M; 1/1 024 M .
CH
3
COONa : 1/3 2 M ; 1/6 4 M; 1/1 28 M; 1 /256 M; 1/51 2 M; 1/ 1024 M.
W yn iki z est awić w t ab eli:
CH
3
COOH
CH
3
COONa
Stężenie,
[mol/dm
3
]
1/R
χ
λ
1/R
χ
λ
O PRACO WANIE W YNI KÓW :
1. Obli cz yć p rzewo dni ctwo wł aś ciwe
χ
i prz ewodni ct wo ró wn oważnik owe
λ
r
dla
roztworów kwas u o ct owego i o ct an u s odo wego, wedł u g wzo ró w:
χ
=
R
1
K ;
λ
=
c
χ
10 00 ,
gdzie: c – st ężeni e roztwo ru KCl.
2. W yk reśli ć z al eżnoś ć
λ
r
= f( c ) dl a roztworó w CH
3
C OOH i CH
3
C OONa. Dla
oct an u s odo wego z naleźć wartoś ć prz ewo dni ctwa grani czn ego, ek strap oluj ąc
otrz ym an y w yk res d o c = 0 (wt ed y
λ
r
=
λ
∞
).
3. Przewod nictwo grani czn e dl a kwas u o cto wego obli cz yć z ró wnan ia:
λ
∞
=
λ
k
+
λ
a
,
znaj ąc p rzewod ni ctwa grani czn e:
λ
∞
(H
3
O
+
) = 32 5,1 Ω
- 1
cm
2
λ
∞
(Na
+
) = 4 5,2 7 Ω
- 1
cm
2
oraz wartoś ć prz ewo dni ctwa grani czn ego dla CH
3
COONa (z wyk res u)
4. Obli cz yć st opi eń i stałą d ys o cjacji k wasu o cto wego .

Ćw ic zeni e nr 13
KATALITYCZNY ROZKŁAD H
2
O
2
Celem ćwicz eni a jest zb ad ani e k at ali t yczn ego wp ł ywu M nO
2
n a reak cję rozk ł adu
wod y utl enion ej .
Szkło labo ra to ry jn e: Odczynniki :
Kolb y mi aro we o poj .: 10 0, 200 , NaOH – stał y
250 – 2 szt., 50 0 cm
3
Na
2
B
4
O
7
– st ał y
Erl enm aj erki o p oj. 100 cm
3
– 4 szt. KMn O
4
- r-r 0,1 N
Biu ret a o po j. 25 cm
3
H
2
O
2
– r-r 3 3%
Zlewk a o p oj. 50 cm
3
H
2
SO
4
– r-r 1:1
WYKO NANIE ĆWI CZENI A
1. W kolbi e miaro wej o poj. 200 cm
3
p rz ygo to wać b ufor bo rano w y: w t ym cel u
odważ yć 1 g bo raksu , 2 g zasad y sod owej i uzu peł ni ć wod ą dest ylo wan ą d o k reski .
2. W kolbi e mi arowej o poj. 5 00 cm
3
prz ygo tować 0,0 2 N KM nO
4
przez pi ęcio kro tn e
rozcieńcz eni e 0,1 N KMn O
4
.
3. W kolbie mi aro wej o poj. 10 0 cm
3
p rzygo to wać 2 % roztwór H
2
O
2
: odmi erz yć
6,8 cm
3
33 % roztworu H
2
O
2
i uzu peł ni ć wodą d est yl o waną do kreski .
4. Do dwóch s uch ych kol b mi arow ych o poj . 2 50 cm
3
wl ać p o 100 cm
3
wo d y
dest yl o wan ej i po 5 0 cm
3
bu fo ru b oran owego . Nast ępni e, d o jedn ej (pi erwsz ej )
z nich dod ać 5 cm
3
0,02 N KM nO
4 ,
do dru gi ej 5 cm
3
wod y d est yl o wanej i do
każd ej po 5 cm
3
wod y utl enion ej 2 %. UWAGA: z chwil ą do dan ia wod y ut lenion ej
rozpo cz yn a si ę reak cj a rozkł adu (n al eż y wł ącz yć stop er). W ym i eszać roztwor y w
kolb ach, a p o upł yw ie 3 mi nut (od po cz ątk u reak cji, pob rać z każd ej (oddzi eln ą
pip etą p ró bk ę o ob jęto ści 5 cm
3
i u mieś ci ć je w erl enm aj erk ach
zawi eraj ąc ych już k i lka (2 -3 ) cm
3
k wasu siarko wego (1: 1). Miareczk ować 0,0 2 N
KMn O
4
do sł ab o ró żowego (t rwał ego) zab arwi eni a. Kol ej n e p ró bki po bi erać z

roztworu z kat aliz at orem co 5 min ut, p rzez okres 1 godz in y, a z rozt wo ru b ez
kat aliz ato ra do pi ero po u pł ywi e 1 go dzin y (od po cząt ku reakcji).
O PRACO WANIE WYNI KÓW :
Dl a obu reak cji w yk on ać w yk res y zal eżnoś ci lo gar yt mu ob jęt oś ci rozt woru
KMn O
4
, zuż yt ego do zmi areczko wani a próbki , o d czas u t rwani a rozkł adu wo d y
utlenion ej i n a ich p odst awi e w yzn acz yć grafi czni e st ałe sz yb koś ci reakcji .

Ćw ic zeni e nr 16
WYZNACZANIE CIEPEŁ ROZPUSZCZANIA TRUDNO
ROZPUSZCZALNYCH WODOROTLENKÓW
Cel em ćwicz eni a j es t w yzn aczenie ciepeł rozpu szcz ani a wod orotlenkó w wapni a,
magnezu i c yn ku .
Apa ra tura i szkł o: Od czy nniki:
kal or ym et r, t erm om etr Beckm ann a, M gO, ZnO, C aO – stałe,
stop er, c yli nd er mi arow y, szki eł ko z egark owe, 2 N HCl
ł yż eczka
WYKO NANIE ĆWI CZENI A:
1.
Do k alo r ym et ru wl ać, odmi erzo ne c ylin drem miaro w ym , 400 cm
3
roztwo ru HCl .
W roztwo rze t ym zanurz yć t ermom et r Beckm ann a i mi esz adł o. Włącz yć mi eszadł o i
tak prz ygoto wan y z estaw k alo r ym et r yczn y p ozost awi ć n a co najm niej 15 m inut , dla
w yrównani a t emp eratur. Wted y rozp ocz ąć p omi ar y (o kres I) , od cz yt ując ws kaz ania
termom et ru Beckm anna co 30 s eku nd, przez 5 minu t. Nast ępn ie,
ni e prz er ywa jąc
m ieszania i od cz ytó w tem peratu ry co 30 s, wp rowadzi ć do roztworu 2 g (wcześ niej
odważon ego) M gO i not ować zmi an y t empratu r y aż do mo ment u j ej ust al eni a się
(ok res głó wn y) i po t em j esz cze prz ez 3 – 4 mi nut y (co 30 s ).
2. W spos ób an alo gi czn y, d o o pis an ego w pk t. 1, w yk o nać pomi ary dl a 4 g Zn O.
3.
Do kalo r ym et ru wl ać, odmi erzon e c yl indrem mi arow ym , 400 cm
3
wod y
dest yl o wan ej, zanu rz yć mi eszadło i termom et r Beckmann a i, po u stal eniu się
temp eratur y, rozpo cząć p omi ar y, od cz yt ując wsk azan ia t ermomet ru co 3 0 s, p rzez
5 min (ok res I). Nast ępn ie,
nie prz er ywaj ąc m iesz ania i od cz ytów tem peratur y co 30
s, wp ro wadzić do wod y 0, 25 g C aO (od ważo nego wcz eśni ej na wadz e an ali t ycz nej ).
Po zako ń czeni u o kresu głó wn ego not o wać o dcz yt y t emp eratu r y j esz cze prz ez co
najm niej 3 – 4 mi nut y, po cz ym wp rowadzi ć do rozt wo ru dod at ko wo 5 g CaO
(od ważon ego na wad ze labo rat or yj n ej ) i w taki s am s pos ób w yzn acz yć efekt ciepln y
tej reakcji.
O PRACO WANIE W YNI KÓW :
25. Na
w yk res ach
przedst awić
prz ebi eg
zmian
t em peratu r y
w
czasi e
dla
poszcz egó ln ych pom iarów i okreś lić (graficz nie) prz yro st ∆T.
26. Ko rz yst aj ąc ze wzo ru (1), w yli cz yć ciepł a zmi erzo n e w k alo rym et rze:

Q
1
= (m c
w
+ K) ∆T, (1 )
gdzie: K – wart oś ć wodn a k al or ym etru – 30 cal/
o
C ,
∆T – p rz yrost t emp eratu r y,
m – m as a rozt wo ru,
c
w
– ci epł o właści we rozt wo ru.
27.
Wodorotlenki magnezu, cynku i wapnia należą do trudno rozpuszczalnych związków chemicznych. Dodatkową
trudność stanowi uzyskanie ich w postaci umożliwiającej dokładne odważenie (w czasie suszenia może nastąpić częściowy
rozkład). Trudności tych unikamy, wyznaczając ciepła rozpuszczania wodorotlenków na drodze pośredniej, w oparciu o
pomiar ciepła reakcji odpowiedniego tlenku z roztworem kwasu.
Przebieg reakcji tlenku z wodnym roztworem kwasu można przedstawić za pomocą dwóch schematów:
I MO + 2HCl
(r)
= MCl
2
+ H
2
O Q
1
II MO + H
2
O = M(OH)
2(st)
Q
2
III M(OH)
2(st)
= M(OH)
2(r)
Q
3
IV M(OH)
2(r)
+ 2HCl = MCl
2
+ 2H
2
O Q
4
Q
3
= Q
1
– ( Q
2
+ Q
4
) ,
gdzie: Q
1
– ciepło, które wyznaczono na drodze pomiarów kalorymetrycznych,
Q
2
– ciepło, które można wyliczyć, znając ciepła tworzenie substancji reagujących,
Q
3
– ciepło rozpuszczania wodorotlenków,
Q
4
– ciepło reakcji zobojętniania (-13,92 kcal/mol) .
W przypadku wodorotlenku wapnia, łatwiej rozpuszczalnego niż Mg(OH)
2
i Zn(OH)
2
, bezpośrednio wyznaczamy
ciepło rozpuszczania. Jeżeli efekt cieplny rozpuszczanie 0,25 g CaO oznaczymy jako Q
5
:
V CaO + nH
2
O = Ca(OH)
2(st)
+ (n-1)H
2
O Q
5
,
a efekt cieplny rozpuszczania 5 g CaO oznaczymy jako Q
6
:
VI CaO + Ca(OH)
2(st)
+ nH
2
O = 2Ca(OH)
2(r)
+ (n-1)H
2
O Q
6
,
to efekt cieplny reakcji rozpuszczania 1 mola Ca(OH)
2
– Q
7
– obliczamy:
Q
7 =
2
1
(Q
6
– Q
5
) .

Ćw ic zeni e nr 17
WYZNACZANIE RÓWNOWAśNIKA
ELEKTROCHEMICZNEGO MIEDZI
ORAZ STAŁEJ FARADAY’A
Cel em ćwi czeni a jes t prz ep rowadzeni e p ro cesu el ekt roliz y wodn ego rozt wo ru
siarcz an u mi edzi, w yznaczeni e ró wn oważ nik a elekt ro ch emi cznego i st ałej Farad a y’a.
Apa ra tura i szkł o: Od czynniki :
el ekt roliz er, k ompl et el ekt ro d pl at yn o w yc h, 1 N CuS O
4
stop er, mi esz ad ełk o, zlewk a o poj. 25 0 cm
3
WYKO NANIE ĆWI CZENI A:
1.
Elektrod y (k at od ę i ano dę) z anu rz yć n a ch wil ę w rozt wo rze kwasu azot owego
(1 +1 ), nast ępni e wyp łuk ać wod ą d est yl o wan ą i w ys u sz yć. T ak prz ygoto waną
el ekt rod ę siatko wą z waż yć na wadz e an al it yczn ej , z d okł adn o ści ą d o 0,1 m g .
Uwaga !
Nie do t yk ać p al cami !
2.
Przeł ączniki em
„M AINS”
u ru cho mić
el ekt rol izer,
wł ącz yć
oś wi etl eni e
(p rzeł ącznik „ LAMP ”)
3.
W uch w yt ach z zaciskami umi eś ci ć elektro d y: z ważo ną el ekt rod ę siat ko wą
i spiraln ą, p rzeł ączn ik biegun ów ust awić tak, ab y el ek tro d a siat kowa b ył a k ato d ą, a
spiral na – an od ą.
4.
Przeł ącznik op atrzo n y n api sem „ E LE KTROC HEM IC AL ANA LYS IS” ust awić
odpo wi edn io w poz ycji „ L” lub „R ”, w zal eżno ści od t ego, w kt órej gło wi c y
zamont owan e zo st ał y el ekt ro d y (l ewej cz y prawej ).
5.
Na pod st awi e u mieś ci ć umi eś ci ć zl ewk ę o poj . 2 50 cm
3
n ap ełni on ą roztworem
siarcz an u mi edzi, włoż yć mi esz alni k i prz eł ączn iki em „ START ING” u ru cho mić
miesz ani e.
6.
Po włączeniu grzan i a (p rzeł ącznik „HE AT ING” u stawi ć w poz ycji 2 – temp .
100
o
C ), opuś ci ć elekt ro d y, prz esu waj ąc p rzeł ącznik „E LE KTR ODE HEADS” tak ,
ab y z anurz on e b ył y w b ad an ym rozt worz e d o ¾ po wi erz ch ni.
7.
Pro ces rozpo cząć, ustawi aj ąc, za pom ocą p rzeł ącznik a „ E LE KTR OLYS IS ”,
nat ężeni e p rądu:
0, 6 A (ost rożni e!) i pro wadzi ć el ekt roliz ę p rz ez 15 min ut.

8.
Po zak oń czeni u el ekt roliz y, elekt rod ę opłu kać wod ą z akwaszon ą H
2
SO
4
,
przem yć wod ą dest yl owan ą i w ys usz yć.
9.
Tak p rz ygo to waną el ekt rod ę zważ yć i o bl icz yć m as ę w ydzi elo nej miedzi.
10.
Pomiar w yk on ać d wu krot ni e (pu nkt y od 1 do 9 ).
11.
Elektrod ę o cz yś ci ć z miedzi j ak w pun kci e
1 .
O PRACO WANIE W YNI KÓW :
28. Obli cz yć ró wno waż n ik elektro ch emi czn y miedzi.
29. Obli cz yć st ał ą Farad a y’a.
30. Podać bł ąd wz gl ędn y i b ezwz gl ęd n y.

Ćw ic zeni e nr 18
WYZNACZANIE STAŁEJ SZYBKOŚCI REAKCJI
I ENERGII AKTYWACJI
Celem ćwicz eni a jest w yzn acz eni e st ałej sz yb koś ci o raz en ergii akt ywacji reak cji
h yd roliz y o ct anu et ylu (met yl u ).
Apa ra tura i szkł o: Odczynniki:
Termos tat i czasza g rzej na 1 N HCl
Termom et r o ct an et ylu (m et yl u )
Stoper 0, 1 N NaOH lub KOH
Biu ret a fen ol oft al ein a
Erl enm aj erki o p oj. 250 cm
3
– 4 szt.
Zlewki: 40 0 cm
3
– 2 szt.; 1 50 cm
3
– 2 szt.
Kolb a miaro wa o poj . 20 0 cm
3
Pipet y: 5 cm
3
i 5 0 cm
3
WYKO NANIE ĆWI CZENI A:
1. Do każd ej erl enm aj erki wl ać p o 1 50 cm
3
wod y d est yl o wanej.
2. W kolbi e miaro wej o poj 2 00 cm
3
prz yg otować roztwó r zawi eraj ąc y
50 cm
3
1 N
HCl i 5 cm
3
estru. UWAGA: mom ent zmi eszani a j est po czątki em reakcj i h yd roliz y
– wł ącz yć st op er!
3. Z ot rz ym an ego rozt wo ru pob rać (możli wie sz yb ko ) próbk ę o objęto ści 5 cm
3
,
przeni eś ć j ą d o erl en maj erki z wod ą d es t yl o wan ą i mi areczko wać 0,1 N rozt wo rem
zasad y (NaOH lu b KOH) wob ec fenol oft alein y.
4. Kol ejn e próbk i o tej samej obj ętoś ci (5 cm
3
) po bi erać z mieszanin y reak c yjn ej p o
upł ywi e od powiedni o 5, 1 0, 2 0, 30 min u t od p ocz ątk u reak cj i i oznacz ać w ni ch
stęż eni e k wasu w sp osób opi san y w yż ej.
5. Zmierz yć t emp eratu rę mi esz ani n y reakc yj nej .
6. Pozostał y rozt wó r (w yjś cio w y) pod grz ać w zl ewce do wrzeni a, ab y reak cj a m o gł a
zajś ć d o k oń ca, nast ępn ie po brać próbk ę 5 cm
3
i m iareczk ować 0,1 N NaOH. Il oś ć
zasad y zuż yt ej d o zmiareczko wani a od powi ad a st ęż eniu k wasu p o całk owi tej
h yd rolizi e.
7. W an alo giczn y sp os ób (pun kt y 1 – 5) w yk on ać pomi ar y d la t emp erat ur y 4 0
o
C
(uż ywaj ąc t ermos tat u).
8. W yn iki umi eś cić w t ab el ach:

Tab . 1 Tab. 2
T
1
(zmi erzo n a)
T
2
(4 0
o
C )
Lp .
t [min]
V
N a O H
[ cm
]
Lp .
t [min]
V
N a O H
[ cm
]
Po po d grzan iu do wrzeni a: V
N a O H
=
O PRACO WANIE W YNI KÓW :
k =
t
303
,
2
lo g
c
a
W nasz ym prz yp adk u wiel koś ci a i c wyraż am y z a pomo cą stężen ia po całko witej
h yd rolizi e – a; p ocz ątkowego st ęż eni a – a
o
; o raz chwilo wego stęż eni a – a
t
.
Ost ateczni e mam y:
k =
t
303
,
2
lo g
t
o
a
a
a
a
−
−
Energię akt ywacji obli czam y z e znaj omoś ci st ał ych sz ybkoś ci reak cji w dwu
temp eraturach . W ykorz ys tuj ąc wzó r Arrh eni us a, d ro gą pro st ych p rz ekszt ał ceń,
dochodzim y d o w yrażeni a n a en ergi ę akt ywacji:
E =
1
2
1
2
2
1
log
303
,
2
k
k
T
T
T
RT
−
,
gdzi e: k
1
i k
2
oznacz ają st ał e sz yb koś ci reakcji w d wu temp eraturach .

Ćwicz eni e nr 20
J ONIT Y
Cel em ćwi czenia j est w yzn acz eni e zd olnoś ci w ymi en nej kati onu w sto sun ku do
jonó w s odu .
Apa ra tura i szkł o: Odczynniki :
PH-met r HC l 1 : 4
Kol umn a kat ionit owa HCl 1 : 9
Mieszad ło m agn et yc zne NaCl 1 M
Bi uret a poj . 100 cm
3
NaOH 2 M
Zl ewk a o poj. 40 0 cm
3
C ylin der m iaro w y – 100 cm
3
Kol ba stoż kowa - 1 szt.
WYKO NANIE ĆWI CZENI A:
1. Regen era cja ko lu mny:
Prz ed rozpo częciem ozn aczen ia zd olnoś ci w ymi en nej jonitu n al eż y k o lumn ę
jono w ymi en ną zregenero wać, tzn. ot rz ymać jonit w formie wodo ro wej. Regen eracj a
pol ega n a p owoln ym prz epu szcz aniu przez kolu mn ę k wasu so ln ego . W t ym celu
kolum nę p rzem yć
1 00 cm
3
ro ztwo ru H Cl roz ci eń czon ego w stos unk u 1:4 ; szyb ko ść
przepł ywu – 8 cm
3
/ min (1 60 – 17 0 k ro pli/min ). Następni e przepuś ci ć
15 0 cm
3
wod y
dest yl o wan ej i po no wni e
10 0 cm
3
kwasu solnego 1 : 9 (sz yb k ość prz epł ywu 8 cm
3
/min).
Kolum n ę prz em yć wodą dest yl owan ą aż do całk owi tego us un ięcia niez wi ązan ego kwasu .
Kwaso wo ść w yci ek u bad ać papierk iem ws kaźni kow ym .
2. Ozna czani e zdolno ś ci wymi ennej kati onitu:
Przez kolum n ę jo nit ową p rzepuś ci ć
150 cm
3
1 M NaCl t ak , b y sz yb ko ść p rzepł ywu
w yn osił a 2 ,5 cm
3
/m in (70 kropli/m in ). J on y Na
+
w yp ierają z gru p cz ynn ych jon y
wod orowe, kt óre p rzechodz ą do w ycieku . Poni eważ pierwsze partie w yci eku zawieraj ą
jesz cze cz yst ą, w yp art ą z kol umn y wo d ę, n al eż y b ad ać jeg o od cz yn. Wł aś ciw y etap
ćwi cz eni a rozpo czn ie si ę w chwi li, gd y z kol umn y z acznie w yciekać kwas. Po
przepusz czeniu p rzez kolumn ę 1 50 cm
3
NaCl p rzepusz czać prz ez kol umn ę wod ę
dest yl o wan ą, a el u at zbierać w zlewce o poj. 4 00 cm
3
do m o ment u, aż
wyci ek b ędzie
miał od czyn ob ojętny.
Nal eż y pamiętać, ż e jonit an i p rzez ch wilę n ie może b yć „s uch y”. Nad j ego
powi erzch ni ą st al e musi znajdo wać się 1-2 cm warstwa p ł yn u (tak w czasi e
w yk on ywani a ćwi cz enia, j ak i po j ego zak ończ eni u).
Do oznacz eni a stężeni a k wasu w el uaci e st osu jem y m eto dę mi areczko wania
pot en cjom et r ycz nego . W t ym celu zl ewk ę z bad an ym rozt wo rem umieści ć n a p odst awi e
miesz adł a magn et yczn ego , zanu rz yć w rozt wo rze el ek t rod ę kom bin owan ą oraz
miesz alni k. Mi arecz kować
2 M NaOH , wp ro wadzaj ąc d o eluat u po 1 cm
3
zasad y d o
ch wili, gd y p H ci eczy w zlewce prz ek ro cz y wart oś ć 1 0 j ed nos tek .

3. Opra cowani e wynik ów:
Sporz ądzi ć d wa w yk res y krz ywej mi arecz kowani a:
a) pH = f(V),
gdzie: V – obj ętoś ć d od an ej z as ad y,
b)
V
pH
∆
∆
)
(
= f(V),
gdzie: ∆(p H) – zmiana pH sp owo do wana dod ani em V obj ętoś ci zas ad y.
Z w yk resu b ) o kreśli ć pu nk k oń co w y mi areczko wani a. Znaj ąc st ężen ie z as ad y
w yzn acz yć cał ko wit ą ilość gramo równo ważnik ów k wasu w el uaci e. Zd olno ść w ymien ną
jonitu (kationi tu ) o bl icz yć ze wzo ru:
Z =
q
a
,
gdzie: a – il oś ć gramoró wn owaznik ów k wasu w w yci eku ,
q - m asa jo n itu w ko lumn ie (q = 50 g).
Ćw ic zeni e nr 22
WYZNACZANIE SZYBKOŚCI HYDRATACJI
BEZWODNIKA OCTOWEGO
Z POMIARÓW PRZEWODNICTWA
Apa ra tura i szkł o: Odczynniki:
Kon dukt om etr, t erm ostat, s top er, b ez wod nik kwas u o cto wego
Kolb ka mi arowa o p oj. 1 00 cm
3
,
Prob ówk a o poj. 10 0 cm
3
WYKO NANIE ĆWI CZENI A:
1. Ust awi ć termo stat n a tem peratu rę 2 0
o
C (± 0, 2
o
C).
2. Prz ygot ować z est aw do p omi aru p rzewo d nict wa.
3.
Do k olb y mi aro wej wlać 1 2 cm
3
b ez wod nik a o cto wego i uzup ełni ć wod ą
dest yl o wan ą do k res ki.
W m om encie d od awania wo dy włą cz yć stop er i ni e wył ączać
aż do k ońca pom ia rów (d o ust al eni a się warto ści prz ewodni ct wa). Rozp usz czać
bezwodni k o ct ow y w wo dzie, sil nie mi esz aj ąc.
4.
W yzn acz yć stop erem czas po cząt ku i k oń ca roz ci eń czania ( p odcz as d od awan ia
wod y poj awi a si ę grani ca rozdzi ału d wóch faz , a po wst rząśni ęciu , zmętn ienie –
- mom ent zni kni ęcia zmętni eni a uzn ać z a ko niec rozci eń cz an ia). Czas ś redn i prz yjąć
za mom en t p ocz ątk u reak cji .
5. Nacz yn i e (p rob ówk ę) z el ekt rod ą um ieś ci ć w t ermost acie, wl ać otrz ym an y
roztwór i mierz yć przewo dni ct wo, po cz ąt kowo częś ci ej (t rz y pomi ar y co 30 s, ok .
10 co 1 min ), n ast ępni e jeden pomi ar p o upł ywi e 5 min i j ed en p o 1 go dz. (od
pocz ątk u reak cji ). St ałoś ć ws kaz ań kon du ktom etru ozn acza ko niec reakcj i.
6. W yk on ać an alo giczn e p omi ar y (pu nkt y 2 – 5 ) w t emp erat urz e 40
o
C.
7. W yn iki z est awić w t ab eli:
Nr
T
[
o
C]
Czas
od p ocz ątk u
reak cji , τ
[s]
τ
R
1
τ
R
R
1
1
−
∞
lo g(
τ
R
R
1
1
−
∞
)
lo g
τ
R
R
R
R
1
1
1
1
0
−
−
∞
∞
K

O PRACO WANIE W YNI KÓW :
Reakcj a h yd rat acji b ezwo dnik a o cto wego j est reakcją pi erwszego rzędu, dl at ego
obli czen ia n ależ y p rzeprowadzi ć w op arciu o ró wn an ie:
k =
τ
1
ln
A
oA
c
c
=
τ
1
ln
x
o
o
c
c
c
−
(1 )
gdzi e: c
o
– po cz ątkowe st ężeni e b ezwodnik a o cto wego,
c
x
– st ężen ie powst ającego k wasu o cto wego ,
τ – cz as.
Wzrost p rzewod n ict wa w cz asi e j est p rop orcjo n aln y do st ężeni e p ows taj ącego
kwasu o cto wego. Il o ść po wst ającego k wasu o cto wego p rop orcjon aln a j est do iloś ci
uż yt ego bez wod nik a oct owego :
(CH
3
CO)
2
O + H
2
O = 2CH
3
C OOH,
dlat ego wzro st prz ewodni ct wa w czas ie t rwani a reak cji b ędzie p ro porcj on aln y
do po cz ątko wego stęż eni a k wasu o ctowego . Znaj ąc p rzewo dni ct wo roztworu
w mom enci e po cząt k ow ym κ
o
, w d an ym momenci e κ
τ
i po czasie κ
∞
m am y:
c
o
= co nst (κ
∞
- κ
o
) (2)
(c
o
– c
x
) = const (κ
∞
- κ
o
) – co nst (κ
τ
- κ
o
) = con st(κ
∞
- κ
o
- κ
∞
+ κ
o
) = cons t(κ
∞
- κ
τ
),
gdzi e: κ
o
– prz ewodni ct wo wł aś ciwe roztwo ru w m om en cie zaini cj owani a reakcji,
κ
o
– prz ewodni ct wo wł aś ciwe roztwo ru po upł ywi e czas u τ,
κ
∞
- p rzewodni ct wo wł aś ciwe p o zak oń czeniu reak cj i.
Z równań (1 ) i (2 ) wyn ik a, że:
k =
τ
1
ln
τ
ο
κ
κ
κ
κ
−
−
∞
∞
=
τ
1
ln
τ
R
R
R
R
1
1
1
1
0
−
−
∞
∞
(3 )
Prz ewodni ct wo roztwo ru 1/R, w mo men ci e rozpo częci a reakcj i, w yzn acz a się
z ekst rapol acji z ależności : ln (1/R
∞
- 1 /R
τ
) = f(τ). Dl a reak cji p ierwszego rzędu
w yk res t aki ej z al eżnoś ci j est lini ą p ro s tą. W yl icz yć st ałe s z yb koś ci dl a k ażd ego τ
oraz ob licz yć k
ś r .
i porównać j ej wartoś ć z wart oś cią ot rz yman ą z w yk res u (tan gens
kąt a nach yl eni a p ro s tej ).
Zn aj ąc warto ści s tał ej sz yb ko ści w d wóch t emp erat urach, z ró wn ani a:
l n
1
2
T
T
k
k
=
R
E
(
2
1
1
2
T
T
T
T
−
) (4 )
obli cz yć en ergię akt ywacj i
E t ej reak cji, a z ró wn ani a:
k = A e
- E / R T
(5 )
obli cz yć wartoś ć st ał ej
A.

Ćw ic zeni e nr 25
CIEPŁO ROZPUSZCZANIA SUBSTANCJI
ŁATWO ROZPUSZCZALNYCH W WODZIE
Cel em ćwicz eni a j est w yz naczeni e integraln ego i różn iczko wego ciepła
rozpu szcz ani a NaOH w wo dzie.
Apa ra tura i szkł o: Odczynniki :
Kal or ym etr, t ermom etr Beckmann a, NaOH – p ast yl ki
miesz adło , s top er, c ylind er mi arow y
WYKO NANIE ĆWI CZENI A:
1.
Do n acz yni a Dewara w k alo r ym et rze wlać, o dmi erzo ne c yl i ndrem mi aro w ym ,
400 cm
3
wod y d est ylo wan ej, zan urz yć mieszadł o oraz termom et r Beckm an na,
prz yk r yć p ok r ywk ą. Włącz yć mi esz adło i tak p rz ygo to wan y z est aw kalor ym etr ycz n y
pozost awić n a co n ajmniej 15 min ut, dl a w yró wn ani a t emp erat ur. Wted y rozpo cząć
pomi ar y (ok res I), o dcz yt ując wsk azan ia termom et ru Beck man na co 30 s ek und , prz ez
5 minut . Nas tępni e,
nie p rz er ywają c m iesz ania i od cz ytów tem per atur y co 3 0 s,
wp rowadzi ć do wod y 1 g NaOH i not o wać zmian y t emp eratur y aż do mom ent u jej
ustalenia si ę (o kres gł ówn y) i pot em jeszcze prz ez 3 – 4 mi nu t y (co 3 0 s ).
2. Cz yn noś ci opi sane w pun kcie 1 w yk on ać dla: 2, 3, 4, 5 g NaOH.
3. W yn iki prz edst awi ć w t ab eli:
Nr
pomi aru
Mas a wo d y,
[g]
Mas a NaOH,
[g]
Stężenie mol arn e roz two ru,
[mol/k g]
∆T
O PRACO WANIE W YNI KÓW :
1. In t egraln e ci epło rozpuszcz ani a NaOH o b licz yć z e wzo ru :
∆H
i n t .
=
NaOH
rozp
n
Q
.
(1 )
gdzi e: n – liczb a moli NaOH;
Q
r o z p .
– ci epło p ob ran e z k alo r ymet ru w t rak ci e rozp uszczani a NaOH.
Q
r o z p .
= - (m c
w
+ W
w
) ∆T (2 );
gdzie: m – m as a ro ztworu,
c
w
– ci ep ło właści we,
W
w
– warto ść wo dn a k alo r ym et ru równa 30 cal/ deg,
∆T – prz yro st t emp erat ur y o dcz ytan y z w yk resu T = f(t).
Uwaga ! c
w
możn a prz yj ąć za równe ci epłu wł aś ciwemu wod y.
2. Różniczk owe ci epł o rozpu szcz ani a ∆H
2
o blicz yć z e wzoru:
∆H
2
= ∆H
i n t .
+ m (
dm
H
d
.
int
∆
) (3 ),
gdzi e: m – s tęż eni e m olarn e rozt wo ru [ mol/k g]
Poch odn ą
dm
H
d
.
int
∆
o bli cz yć, różni czk ując grafi cznie w yk res ∆H
i n t .
= f(m), w
punkt ach mol arnoś ci prz ygot owan ych roz two ró w. Obli czon e wart oś ci p rzed stawi ć
w t ab eli:
m,
[mol/k g]
∆H
i n t .
,
[J /mol]
dm
H
d
.
int
∆
∆H
2
,
[J /mol]
3. Mak s ym aln y bł ąd w yznaczon ego ci epła ro zpuszcz ani a ∆Q
r o z p .
obli czam y
ze wzo ru:
∆Q
r o z p .
= ± (
m
T
c
w
∆
∆
+
)
( T
W
mc
w
w
∆
∆
+
)
4. Omó wieni e w yn i k ów

Ćw ic zeni e nr 27
POMIARY pH I MIARECZKOWANIE
POTENCJOMETRYCZNE
Cel em ćwicz eni a j est pozn anie m etod pomi aru p H i ob słu gi p H-met ru o raz
oznaczenie st ężen ia kwasu soln ego, oct o wego i fo sforowego meto dą miereczkowania
pot en cjom et r ycz nego .
Apa ra tura i szkł o: Odczynniki :
pH-met r z kom pl etem el ekt ro d, 0,1 N NaOH l ub KOH,
miesz adło m agn et ycz ne, 0 ,1 N HC l,
biuret a, 0,1 N C H
3
COOH,
zlewk i o poj . 1 50 i 2 50 cm
3
, 0,1 N H
3
PO
4
,
0,1 N KCl
WYKO NANIE ĆWI CZENI A:
1. Prz ygot owan ie pH-m etru d o pomi arów:
Prz yrz ąd wł ącz yć d o sieci . Po upł ywi e 30 minut podł ącz yć elektro dę k ombi nowaną
(al bo szkl an ą i k alo melo wą) i zanu rz yć w rozt wo rze b uforo w ym o pH = 7,1 .
Ust awi ć n a s kali warto ść pH odp owi ad aj ącą t emu bu fo rowi; n as tępni e zmi eni ć
roztwór b uforow y (n p. na rozt wó r o pH = 3,56 ) i sp rawdzi ć wych yl eni e ws kazó wk i, a
w razi e p ot rzeb y s ko r ygo wać j e.
2. Pomiar pH:
Do zlewki o p oj. 15 0 cm
3
wl ać, kol ejn o, 0,1 no rm aln e rozt wor y: HCl, NaOH, KC l
oraz wod ę d est yl o waną. Zmi erz yć p H k aż dego z t ych roztworó w.
3. Oznacz ani e st ęż eni a kwasu sol nego:
Do zlewki o p oj. 2 5 0 cm
3
odpi p eto wać 2 5 cm
3
0,1 N rozt wo ru HCl i roz ci eń cz yć
wod ą d est yl owan ą d o obj ętoś ci 10 0 cm
3
. Zlewk ę umi eś ci ć na po dst awie mi esz adł a
magnet yczn ego, z anurz yć el ekt ro dę kombi nowana, włącz yć mi eszani e i tak
prz ygo to wan y rozt wó r mi areczko wać 0,1 N NaOH (wpro wadzan ym z b i uret y),
odcz yt uj ąc wart oś ć pH po d od ani u k ażdego, k olej n ego cm
3
zasad y do uz ys k ania
pięciu zbliżon ych wart oś ci p H, świ ad cz ąc ych o zakoń czeniu reak cji . W yni ki zest awi ć
w t ab eli:
V NaOH
[cm
3
]
pH
V NaOH
[cm
3
]
pH
V NaOH
[cm
3
]
pH
Na p api erz e m ilim et ro w ym w yk reśli ć krz ywą mi areczko wani a i ok reśli ć graficz nie
punkt koń co w y m iareczko wani a. W t ym celu w yk reśli ć dwi e równol egł e p roste
st yczn e do k rz ywej miareczko wani a w p unkt ach najmni ejsz ego n ach yl eni a, prz ed i p o
punk ci e prz egi ęcia k rz ywej. W p oło wi e o dległoś ci międz y dwi em a p ro st ymi w yk reś lić
trzeci ą p rost a – punkt j ej prz ecięcia z krz ywą jest punkt em k oń co wym
miareczko wani a.
4. Oznacz ani e st ęż eni a kwasu o cto wego:
Do zlewki o p oj. 2 50 cm
3
odpi pet ować 25 cm
3
0,1 N rozt wo ru CH
3
COOH i
rozcieńcz yć wod ą d est yl owaną d o obj ęt ości 100 cm
3
. T ak prz ygo to wan y roztwó r
miareczko wać 0, 1 N roztworem NaOH, w spos ób opis an y w p u nkcie
3.
Ok reśli ć grafi czni e punkt koń co w y mi arecz kowan ia i o bli czyć cał ko wit e stęż eni e
kwasu o cto wego n a pocz ątk u miareczk o wania. Op ierając si ę na po cząt ko wej wartości
pH i obl iczo n ym st ężeniu C H
3
COOH, obli cz yć sto pi eń i stał ą d ys ocj acji kwasu .
Otrz ym aną wartoś ć p K
a
po ró wn ać z wart o ści ą o d cz ytan ą z k rz ywej mi areczk owani a.
W yn iki z est awić w t ab eli:
pK
a
Początko we
pH
Punkt
koń co w y
[cm
3
]
Całk owit e st ężeni e
CH
3
COOH
[mol/dm
3
]
Stopi eń
d yso cj acji Obliczone W yznaczone
grafi czni e
5. Oznacz ani e st ęż eni a kwasu fosforowego:
Do zlewki o poj . 250 cm
3
odpi petować 20 cm
3
0,1 N roztwo ru H
3
PO
4
i
rozcieńcz yć wo dą d est ylo wan ą do obj ęt o ści 100 cm
3
. Zl ewk ę umi eś cić n a p odst awie
miesz adł a m agn et ycz nego, z anu rz yć el ek t rod ę k ombi no wana, włącz yć mi esz ani e i tak
prz ygo to wan y rozt wó r mi areczko wać 0,1 N NaOH (wpro wadzan ym z b i uret y),
odcz yt uj ąc wart oś ć p H po d od aniu każd ego, kol ejn ego cm
3
zas ad y. Po do daniu 1 8 cm
3
roztworu NaOH zm niej sz yć do dawan e porcj e do 0,5 cm
3
(not ować p H), aż do
osiągni ęci a obj ętoś ci 21 – 22 cm
3
. Nast ępn ie roztwó r NaOH dozować p ono wni e po
1 cm
3
, do chwil i dod ani a 35 cm
3
, po cz ym znów dod awać po 0,5 cm
3
do o bjętoś ci 41
– 42 cm
3
. P ozost ał y w biu reci e rozt wór d od awać p o 1 cm
3
. W yn iki pomi arów
zest awi ć w t ab eli .
Sporz ądzi ć w yk res (na p api erz e milim et ro w ym ), od kładając na osi od ci ęt ych
obj ętoś ć (cm
3
) dod awanej zas ad y, a n a osi rzęd n ych wartoś ć p H. Napi sać ró wn ani e
reak cji zo boj ętn iani a H
3
PO
4
z as ad ą NaOH w pi erwsz ej i dru giej cz ęś ci k rz ywej
miareczko wani a.
Ok reślić, n a po dst awie otrz ym anego w yk resu , p K
a
d la k wasu H
3
PO
4
i H
2
PO
4
¯
.

Ćw ic zeni e nr 28
WYZNACZANIE PUNKTU
IZOELEKTRYCZNEGO AMFOLITU
Cel em ćwicz eni a jest w yz n acz eni e pun ktu izo el ekt r yczn ego amfolitu , cz yli
warto ści p H, prz y kt órej s tęż eni e post aci RH
2
+
i R
-
am fo litu są ró wn e.
Apa ra tura i szkł o: Odczynniki:
PH-m et r z el ekt rod ą kombi nowaną 0. 05 M NaOH
Miesz adł o m agn et yc zne 0, 05 M HCl
Biu ret a 0,0 05 M NH
2
CH
2
C OOH
Zlewki o poj. 15 0 cm
3
WYKO NANIE ĆWI CZENI A:
1. Zmont ować u kł ad do miareczk owan ia pH-met r ycz nego.
2. Do zlewki o po j. 150 cm
3
wlać 1 00 cm
3
k wasu ami noo cto wego. Zl ewk ę z
roztworem u mieścić na p odst awie mieszadł a m agn et yczn ego, zanu rz yć el ekt rodę
kombi nowaną i mi eszalni k i rozp ocz ąć miareczko wani e ro ztworu, sp uszcz aj ąc z
biuret y po 1 cm
3
0 ,0 5 M HCl (ł ączni e 1 0 cm
3
). P o do daniu k olej nej obj ęto ści titrant a
odcz yt ać wart oś ć p H.
3. Roztwór amfolit u (prz ygot owan y anal o gi cznie j ak w pk t. 2) mi areczko wać 0 ,0 5 M
NaOH, d od aj ąc po 1 cm
3
z biu ret y (ł ącz nie 10 cm
3
). P o d od ani u k olej n ej o bj ęto ści
titrant a od cz yt ać wartość p H.
W yni ki p omi arów i ob licz eń zest awić w t ab el ach:
V
N a O H
lu b V
H C l
[cm
3
]
pH
[H
+
] 10
3
lu b
[OH
¯
]
c
A
10
3
[mol dm
- 3
]
c
Z
1 0
3
lu b
c
K
10
3
[mol dm
- 3
]
pK
O PRACO WANIE W YNI KÓW :
1. Na pod st awi e p omi aró w p H k wasu amin ooctowego, m iarecz kowan ego roztworami
HCl i NaOH, obli cz yć warto ści p K
1
i pK
2
ze wzo ró w:
pK
1
= p H + l o g
]
[
]
[
−
+
+
−
−
OH
c
c
H
c
K
A
K
,

pK
2
= p H + l o g
]
[
]
[
−
−
−
+
−
OH
c
OH
c
c
Z
Z
A
,
gdzie: c
A
– całk owi te stęż eni e am foli tu,
c
K
– s tęż eni e kwasu (HCl ),
[ H
+
] – s tęż eni e j onó w wod orow ych ,
c
Z
– s tęż eni e zasad y (NaOH),
[ OH¯ ] – st ęż enie jon ów h yd roks yl ow ych .
W yni ki o bli czeń zest awi ć w t ab el ach (jak w yżej).
Obli cz yć p H p un ktu izo el ekt r yczn ego am foli tu wedłu g wz oru , p odst awiając
średni e wartoś ci pK
1
i p K
2
:
pH
i z o e l .
=
2
1
(pK
1
+ pK
2
)
Przep ro wadzi ć d ys ku sję ot rz yman ych w yn ików.

Ćw ic zeni e nr 29
WYZNACZANIE RZĘDU REAKCJI
METODĄ CAŁKOWĄ
Cel em ćwi czeni a j es t w yz nacz eni e rz ędu reak cji utl eni ania j onó w Fe
2 +
do Fe
3 +
jon ami Cl O
3
−
w ś rod owis ku kwaśn ym , zacho dzącej wedłu g su mar ycz nego ró wn ani a:
ClO
3
−
+ 6 H
+
+ 6 Fe
2 +
+ Cl
−
+ 3 H
2
O + 6 Fe
3 +
Apa ra tura i szkł o: Odczynniki:
spektrofotom et r „Sp eko l” Fe
2+
– 0,01 M i 0,004 M
szkło laboratoryjne
ClO
3
−
– 0,01 M i 0,004 M
HCl – 0,1 N
HCl – 2 N
NH
4
SCN – 25%
WYKO NANIE ĆWI CZENI A:
1. Zmieszać, w s tosu nk u 1 : 1 (np . p o 2 0 cm
3
), 0 ,00 4 mo lowe roztwo r y j onó w Fe
2+
i
ClO
3
−
,
włączając jednocześnie stoper.
2.
Z tak przygotowanej mieszaniny reakcyjnej pobrać, w możliwie najkrótszym czasie, próbkę o
objętości 2 cm
3
, rozcieńczyć 18 cm
3
0,1 N HCl i dodać 2 cm
3
rodanku.
Uwaga: w momencie
rozcieńczania zanotować czas! – następuje wtedy gwałtowne zahamowanie biegu reakcji.
Zmierzyć ekstynkcję tego roztworu dla
λ
max
= 500 nm.
3. Następni e po 10, 20 , 30, 40 , 5 0 mi nut ach w yk on ać pom iar y jak w pu nk cie 2.
4. An alo giczni e do p u nktó w 2 i 3 post ępować z mieszanin ą spo rządzon ą prz ez
zmieszani e 0 ,01 mol ow ych roztwo ró w j o nów Fe
2+
i ClO
3
−
.
5. W czasie trwania wyżej opisanych pomiarów przygotować się do sporządzenia krzywej cechowania
stężenia jonów Fe
2+
dla długości fali
λ
max
= 500 nm. W tym celu, do pięciu kolbek o poj. 25 cm
3
,
odmierzyć odpowiednio: 1; 2,5; 5; 7,5; 10 cm
3
roztworu wzorcowego Fe
3+
, dodać do każdej z
nich po 1 cm
3
2N HCl, po 2,5 cm
3
25% roztworu rodanku amonu, uzupełnić wodą destylowaną do
kreski i wymieszać. Zmierzyć ekstynkcję poszczególnych roztworów (jako odnośnik stosować
wodę destylowaną). Na papierze milimetrowym wykonać wykres zależności ekstynkcji od stężenia
jonów Fe
3+
.
O PRACO WANIE W YNI KÓW :

Odczytane wartości ekstynkcji dla próbek pobieranych mieszanin reakcyjnych w miarę postępu reakcji utleniania jonów
żelaza(II) oraz wyniki znalezione z krzywej cechowania jonów Fe
3+
przedstawić w tabeli wg wzoru:
t [s]
x – stężenie jonów Fe
3+
, odczytane z
wykresu
c – równe c
o
– x
1/c
x
′
= x/c
(x
′
– liczba postępu reakcji)
Na podstawie uzyskanych wyników sporządzić wykresy zależności 1/c od czasu, w myśl równania reakcji II rzędu (dla
równych ilości substratów):
t
k
c
c
2
0
1
1
+
=
i na ich podstawie (z nachylenia prostych) odczytać, dla obu stężeń, wartości stałych szybkości reakcji.
Aby określić rząd reakcji metodą całkową, należy wykonać wykres zależności liczby postępu reakcji od czasu: x
′
= f(t);
odczytać wartość t
1
i t
2
dla dowolnej wartości liczby postępu reakcji i wstawić do wzoru:
n = 1 +
1
2
2
1
log
log
a
a
t
t
,
gdzie: t
1
, t
2
– czas,
a – stężenie reagentów.
Przedstawić i przedyskutować otrzymane wyniki.

Ćw ic zeni e nr 30
ILOCZYN ROZPUSZCZALNOŚCI
Cel em ćwi czenia j est w yzn aczeni e il ocz yn u rozpusz czal noś ci z pomi aró w
przewo dni ct wa.
Apa ra tura i szkł o: Odczynniki:
Kon dukt om etr 0 ,1 M KCl
Wytrząsarka CaSO
4
, PbCO
3
, BaSO
4
,
Kolbki o poj. 100 cm
3
– 6 szt. BaCO
3
, PbSO
4
, SrSO
4
Cylinder do pomiaru przewodnictwa
WYKO NANIE ĆWI CZENI A:
1. Kal ib rowan ie ko n dukto met ru p rzed p o miarem :
Prz yrząd wł ącz yć do si eci. p rzełączni k zak resó w pom iaró w „Ran ge” ust awi ć w
poz ycji 500
µ
m i nacisnąć p rz ycisk „Cal ”. Wskazó wk a ap aratu powin na zn al eźć si ę
na p odziałce ozn aczonej czerwon ym tró jkąt em. W p rz yp ad k u inn ego w ych yl eni a
nal eż y ust awi ć ją n a tej podzi ał ce za pom ocą p ot en cjom et ru „ Calib ratio n”.
2. W yk on ani e pomi aru (zasada o góln a):
Ozn aczan y roztwó r umi eś cić w n acz yń k u pomi arow ym i zanurz yć w n im
el ekt rod ę k ond ukt om etru. Należ y uważać, ab y rozt wó r cał ko wi ci e po kr ył wsz ys tki e
trz y pierś ci eni e pl at yn o we elektrod y. P rzeł ącznik zak resó w pomi aru prz eł ącz yć
tak , ab y w ych yl eni e wsk azówki (n ajd al ej w p rawo ) umożli wi ał o od cz yt n a s kal i.
3. Pom iar s tał ej ko n dukto met ru :
W sp osó b o pis an y w pkt . 2 w yk o nać pomi ar p rzewod nict wa dl a 0 ,1 M r– ru KCl.
Wart oś ć st ał ej kon du ktom etru o bli cz yć ze wzo ru:
Κ
=
R
1
χ
,
gdzie:
χ
– p rzewo dni ctwo właściwe 0,1 M KCl,
1/R – wartoś ć prz ewodni ct wa dl a 0,1 M KCl, m ierzon a na ko ndu ktom et rze,
K – stał a ko n dukto met ru .
Niektó re warto ści p rzewo dni ct wa wł aś ci wego dla 0, 1 M KCl zest awi ono w tabel i 1:
Tab el a 1.
Tem pet at ura
T [
o
C]
Przewod nictwo
właści we
S [cm
– 1
]
18
0,01 119
19
0.01 143
20
0,01 167
21
0,02 291
22
0,01 215
25
0,01 288
4. W yk on ać p omi ar przewo dni ct wa dl a rozpuszcz alni k a.
5. Otrz ym anie roztworó w badan ych soli:
Kil k a gramó w b adan ej su bst an cji wp rowadzi ć d o k olbki o poj. 100 ml, uzup eł n ić
wod ą dest yl owan ą i w yt rząs ać n a w yt rz ąs arce p rz ez 10 min ut. Następni e rozt wó r
zdek ant ować, a pozo stał oś ć uzu peł ni ć wo dą dest yl owan a i po n owni e w yt rz ąsać.
Cz yn noś ci te po wt arzać aż do m om entu u z ys kani a st ał ej wart o ści prz ewodn ict wa.
Otrz ym an y wt ed y ro ztwór o grzewać w t ermost aci e d o t emp . 2 5
o
C . Po ust al eni u si ę
ró wno wagi t ermi czn ej pob rać p rób kę i z mierz yć wartoś ć prz ewod nictwa.
W yn iki z est awić w t ab eli:
Sól
1/R
[
Ω
– 1
]
χ
[
Ω
– 1
cm
– 1
]
c
[mol dm
– 3
]
L
L
lit.
Bł ąd
pomi aru
O PRACO WANIE W YNI KÓW :
W celu ok reśl en ia prz ewodn ict wa s ubst an cji rozpusz cz onej nal eż y od k aż dej
zmierzo nej
wartoś ci
przewo dni ct wa
roztworu
odj ąć
wart oś ć
p rzewod ni ct wa
rozpu szcz alnik a. Wt ed y wartoś ć prz ewod nict wa właści wego
χ
można obliczyć ze wzoru:
K
R
1
=
χ
Korzystając z literaturowych wartości przewodnictw równoważnikowych jonów oraz z wyznaczonej wartości
χ
, wyliczyć
wartości stężeń roztworów nasyconych ze wzoru:
χ
= F (
µ
+
+
µ
–
)
α
+
z
+
c = F (
µ
+
+
µ
–
)
α
–
z
–
c
lub
χ
= (
λ
+
+
λ
–
)
α
+
z
+
c = (
λ
+
+
λ
–
)
α
–
z
–
c ,
gdzie:
λ
+
,
λ
–
– grani czne p rz ewo dni ct wo równ oważnik owe kat i onu i anio nu,
µ
+
,
µ
–
– ru chli woś ć kat ion u i ani on u,
z
+
, z
–
– ł adu nek k atio nu i anio nu,
c – st ężeni e,
F – st ał a Farad a y’a,

α
+
,
α
–
– li czb a k ati onó w l ub an ion ow ot rz ym an ych w w yni ku rozp uszcz ani a
sol i w wodzi e.
Znając wart oś ć st ęż enia soli c w roztwo rz e n as yco n ym , m ożna obli cz yć il ocz yn
rozpu szcz alno ści L z ró wn ani a:
L =
)
(
−
+
−
+
+
−
+
=
α
α
α
α
λ
α
λ
α
c
otrz ym an e wart oś ci ilocz yn ó w rozpu szcz aln ości L b ad an ych soli n al eż y po ró wn ać z
ilocz yn ami lit eratu ro w ymi oraz obli cz yć błąd p omiaru .
PRZEPROW ADZ IĆ DYS KUSJ Ę WYN IKÓW.

Ćw ic zeni e nr 31
WYZNACZANIE CZĄSTKOWYCH OBJĘTOŚCI
MOLOWYCH
Cel em
ćwi czeni a
jest
w yz nacz eni e
cz ąstk ow ych
o bjęt oś ci
molo w ych
składni ków w mi eszanini e d wus kł adni ko wej o cał ko wit ej mi esz aln ości (n p.
wod a – m et anol ).
Apa ra tura i szkł o: Odczynniki:
Termos tat met an ol cz.d. a.
Piknometr o poj. 50 cm
3
, wykalibrowany co 0,1 cm
3
woda destylowana
Piknometr o poj. 25 cm
3
Biurety o poj. 50 cm
3
– 2 szt.
WYKO NANIE ĆWI CZENI A:
1. Kol ejn o spo rządzić miesz anin y wod y i met anol u p rzez zmi eszani e obj ęt ości V
1
jed nego skł adni k a i V
2
d ru gi ego, prz y cz ym V
1
i V
2
w yn oszą odpo wi edn io:
V
1
V
2
V
5
45
10
40
20
30
30
20
40
10
45
5
Obj ętoś ć
posz czególn ych
skł adn ikó w
spusz czać
z
bi uret
d o
k alib ro wanego
pikno met ru o poj. 50 cm
3
. Następni e pikn om etr p rzeni eść do t ermos tat u i, po
ustaleniu si ę t emp erat ur y, od cz yt ać obj ętoś ć całk owit ą mieszani n y V. (
Uwaga:
temp eratura w termo staci e m a b yć równ a temp eraturz e oto czenia).
2. Meto dą pi kno met r yc zną (pi knom et r o p oj. 25 cm
3
) w yz n acz yć, w tem p eratu rze
oto czeni a, gęst oś ci cz yst ych s kł adni kó w oraz i ch m iesz ani n.
3. Od cz yt an e w yn i ki z apisać w tabel i:

Nr
V
1
[cm
3
]
V
2
[cm
3
]
V
[cm
3
]
n
1
[mol]
n
2
[mol]
x
1
x
2
V
M
[cm
3
/mol
- 1
]
V
1
[cm
3
/mol
- 1
]
V
2
[cm
3
/mol
- 1
]
O PRACO WANIE W YNI KÓW :
1. Na pod stawi e obj ęt o ści p oszcz ególn ych składni ków i ich gęs tości obli cz yć li czb y
moli n
1
i n
2
, a n ast ępn ie uł amki mo lowe x
1
, x
2
o raz obj ęto ś ć m olo wą mi esz anin y
V
M
= V/n
1
+n
2
.
2. Sporz ądzi ć w yk res w ukł adzi e: obj ętoś ć molowa mieszanin y V
M
– j ej skł ad .
3. Z w yk resu , na pod stawie s t ycz n ych d o krz ywej zal eżnoś ci obj ęt oś ci molo wej
miesz anin y o d s kł ad u, o dcz yt ać mol owe obj ętoś ci cz ąstk owe składni ków V
1
i V
2
.
4. Sporz ądzi ć w yk res z al eżnoś ci cz ąstk ow ych obj ęto ści mol ow ych V
1
i V
2
o d s kładu.
5. Przep ro wadzi ć d ys ku sję w yn ikó w.

Wyszukiwarka
Podobne podstrony:
9.RÓWNOWAGI FAZOWE W UKŁADACH TRÓJSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywieni
11.RÓWNOWAGI CHEMICZNE, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV,
0.WSTĘP, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV, Chemia fizyczna
7.RÓWNOWAGI FAZOWE W UKŁACH JEDNOSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywienie
1.PODSTAWOWE INFORMACJE O GAZACH, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Se
10.WŁASNOŚCI ROZRWORÓW ROZCIEŃCZONYCH, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowiek
8.RÓWNOWAGI FAZOWE W UKŁADACH DWUSKŁADNIKOWYCH, Politechnika Łódzka, Technologia Żywności i Żywienie
4.TERMOCHEMIA, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV, Chemia fi
13.KONDUKTOMETRIA, Politechnika Łódzka, Technologia Żywności i Żywienie Czlowieka, Semestr IV, Chemi
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
więcej podobnych podstron