
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 1911/2005
z dnia 23 listopada 2005 r.
zmieniaj
ące załącznik I do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego wspólnotową
procedur
ę określania najwyższego dopuszczalnego poziomu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
octanu flugestonu
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2,
uwzgl
ędniając opinię Europejskiej Agencji ds. Produktów Lecz-
niczych wydan
ą przez Komitet ds. Weterynaryjnych Produktów
Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie, które s
ą
stosowane we Wspólnocie w produktach leczniczych
przeznaczonych do podawania zwierz
ętom hodowanym
w celu produkcji
żywności, powinny być oceniane
zgodnie z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
Octan flugestonu zosta
ł włączony do załącznika I do
rozporz
ądzenia (EWG) nr 2377/90 w odniesieniu do
owiec i kóz, mleka, do stosowania dopochwowego
oraz wy
łącznie w celach zootechnicznych. Substancja
zosta
ła również wprowadzona do załącznika III do
tego rozporz
ądzenia w odniesieniu do mięśni, tłuszczu,
w
ątroby i nerek, owiec i kóz, wyłącznie w celach leczni-
czych i zootechnicznych, w oczekiwaniu na zako
ńczenie
bada
ń naukowych. Badania te zostały już zakończone,
zatem octan flugestonu powinien zosta
ć włączony do
za
łącznika I do tego rozporządzenia do stosowania
w tych samych celach oraz dla tkanek docelowych, tak
jak w za
łączniku III.
(3)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(4)
Aby umo
żliwić zastosowanie niniejszego rozporządzenia,
nale
ży wyznaczyć odpowiedni okres na dostosowanie
przez Pa
ństwa Członkowskie, w świetle tego rozporzą-
dzenia, zezwolenia na wprowadzenie na rynek, wydawa-
nego zgodnie z dyrektyw
ą 2001/82/WE Parlamentu
Europejskiego i Rady z dnia 6 listopada 2001 r.
w sprawie wspólnotowego kodeksu odnosz
ącego się do
weterynaryjnych produktów leczniczych (
2
).
(5)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
W za
łączniku I do rozporządzenia (EWG) nr 2377/90 wpro-
wadza si
ę zmiany zgodnie z Załącznikiem do niniejszego
rozporz
ądzenia.
Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po
jego opublikowaniu w Dzienniku Urzędowym Unii Europejskiej.
Niniejsze rozporz
ądzenie stosuje się od dnia 23 stycznia 2006 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
Pa
ństwach Członkowskich.
Sporz
ądzono w Brukseli, dnia 23 listopada 2005 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
L 305/30
Dziennik Urz
ędowy Unii Europejskiej
24.11.2005
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 1518/2005 (Dz.U. L 244
z 20.9.2005, str. 11).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).
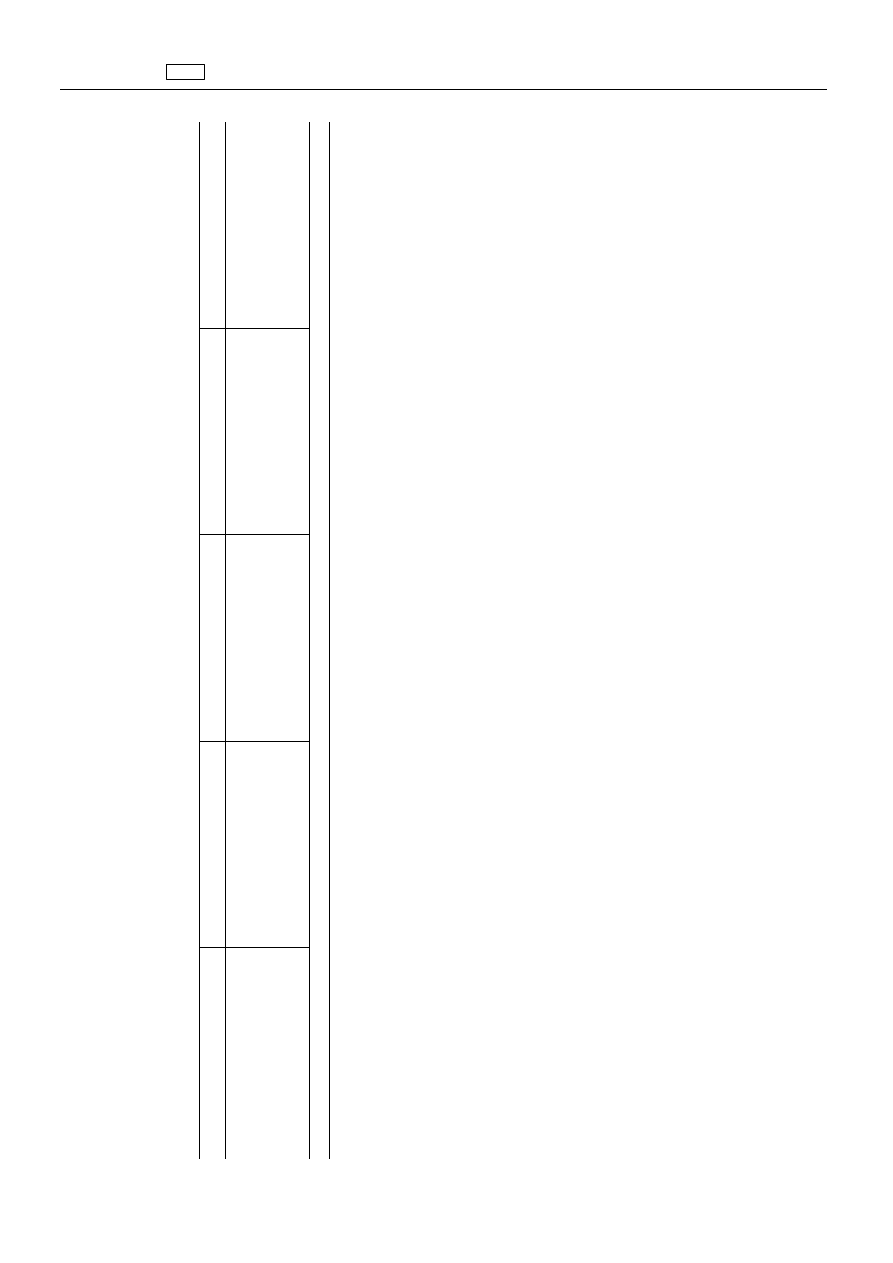
ZA
ŁĄ
CZNIK
A.
Do
za
łą
cznika
I
(Wykaz
subs
tancji
farmakologicznie
czynnych,
dla
których
ustalone
zosta
ły
maksymalne
limity
pozosta
ło
ści)
dodaje
się
nast
ępuj
ące
subs
tancje:
„6.
Środki
dz
ia
łaj
ące
na
system
reprodukcyjny
6.1.
Progestageny
Substancja(-e)
czynna(-e)
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunki
zwierz
ąt
Maksymalne
limity
pozosta
ło
ści
Tkanki
docelowe
octan
flugestonu
(
1
)
octan
flugestonu
owce,
kozy
0,5
μg/kg
Mi
ęś
nie
0,5
μg/kg
Tł
uszcz
0,5
μg/kg
W
ątroba
0,5
μg/kg
Nerka
(
1
)W
yłą
cznie
do
stosowania
w
celach
leczniczych
i
zootechnicznych.
”.
PL
24.11.2005
Dziennik Urz
ędowy Unii Europejskiej
L 305/31
Wyszukiwarka
Podobne podstrony:
2005 11 24 kol 1
2005 11 25 Wykład z biochemii
10 11 24 chkol2id 10740
2010.11.24, Studia, Rolnictwo, Semestr I, Ekonomia
2004 11 24 zdrowotne sympozjum
2005 09 24
ei 2005 11 s080
10 11 24 chkol2
2003 11 24
ei 2005 11 s055
2005 11 Szkoła konstruktorów klasa II
ei 2005 11 s006 id 154194 Nieznany
ei 2005 11 s091
pg 2005 05 24
Mikroekonomia 08 11 24, Ekonomia, Mikroekonomia
2001 11 24
scenariusz 21 2005 11 listopada, SCENARIUSZE I KONSPEKTY
więcej podobnych podstron