Czynniki warunkujące aktywność enzymów
Cel ćwiczenia:
Celem ćwiczenia jest poznanie wpływu takich podstawowych czynników jak temperatura, stężenie jonów wodorowych oraz stężenie enzymu na aktywność enzymów.
Odczynniki:
roztwór enzymu (wyciąg z kiełków pszenicy)
bufor o pH = 3,0
bufor o pH = 4,4
bufor o pH = 5,2
bufor o pH = 6,6
0,00075-molowy 4-nitrofenylofosforanu
roztwór NaCO3
Szkło i inne pomoce:
- 1 zlewka na 600 ml
- 1 pipeta serologiczna na 1 i 5 ml oraz
- 14 probówek chemicznych.
Wykonanie:
Próba zerowa:
Do probówki wlano 1,25 ml H2O, dodano to tego 0,5 bufora o pH= 5,2 i umieszczono na pięć minut w łaźni wodnej o temp. 38˚C. Następnie roztwór wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C . Po upływie wyznaczonego czasu dodano 2,5ml NaCO3.
Wpływ temperatur:
Przygotowanie:
Do trzech probówek odmierzono po 0,5 ml roztworu enzymu , następnie 0,5 ml wody i 0,75 ml buforu o pH = 5,2 . Pierwszą próbówkę umieszczono w temp. 0˚C (woda z lodem), drugą w łaźni wodnej o temp. 38˚C, a trzecią w łaźni wodnej temp. 100˚C na około 5 minut. Następnie probówki wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C . Po upływie wyznaczonego czasu dodano 2,5ml NaCO3.
Pomiar i wykres:
Po ustawieniu fotometru na próbę zerową i długość fali równą 420 nm uzyskano wyniki dla poszczególnych roztworów z probówek, następnie przedstawiono je w tabelce i sporządzono wykres zależności wpływu temperatury od absorpcji
Tabela wyników wpływu temperatury:
temperatura |
0˚C |
38˚C |
100˚C |
wynik |
0,012 |
0,233 |
0,023 |
Wpływ stężenia enzymu:
Przygotowanie:
o pięciu probówek odmierzono kolejno po 0,25; 0,5; 0,75; 1,0; 1,25 ml roztworu enzymu i odpowiednio po 1,0; 0,75; 0,5; 0,25 ml H2O (do probówki z 1,25 ml enzymu nie dodano wody). umieszczono na pięć minut w łaźni wodnej o temp. 38˚C do każdej probówki po 0,5 ml buforu o pH = 5,2. Tak przygotowane roztwory umieszczono na pięć minut w łaźni wodnej o temp. 38˚C. Po upływie wyznaczonego czasu dodano probówki wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C. Następnie dodano 2,5ml NaCO3 do każdej.
Pomiar i wykres:
Po ustawieniu fotometru na próbę zerową i długość fali równą 420 nm uzyskano wyniki dla poszczególnych roztworów z probówek, następnie przedstawiono je w tabelce i sporządzono wykres zależności wpływu stężenia enzymu od absorpcji
Tabela wyników wpływu stężenia enzymu
stężenia enzymu |
0,25 ml |
0,5 ml |
0,75 ml |
1,0 ml |
1,25 ml |
wynik |
0,187 |
0,315 |
0,316 |
0,571 |
0,765 |
Wpływ stężenia jonów wodorowych (pH):
Przygotowanie:
Do czterech probówek odmierzono po 0,5 ml roztworu enzymu, następnie 0,5 ml wody i odpowiednio po 0,75 ml buforu o pH = 3,0; 4,4; 5,2; 6,6. Tak przygotowane roztwory umieszczono na pięć minut w łaźni wodnej o temp. 38˚C. Po upływie wyznaczonego czasu dodano probówki wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C. Następnie dodano 2,5ml NaCO3 do każdej.
Pomiar i wykres:
Po ustawieniu fotometru na próbę zerową i długość fali równą 420 nm uzyskano wyniki dla poszczególnych roztworów z probówek, następnie przedstawiono je w tabelce i sporządzono wykres zależności wpływu stężenia pH od absorpcji
Tabela wyników wpływu pH
pH |
3,0 |
4,4 |
5,2 |
6,6 |
wynik |
0,053 |
0,189 |
0,288 |
0,167 |
Schemat rozcieńczeń

Obliczanie aktywności enzymu:
w temperaturze 38˚C
![]()
A- Absorpcja
0,002 - molowy współczynnik 4-nitrofenylofosforanu
139 - masa molowa produkt
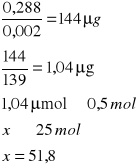
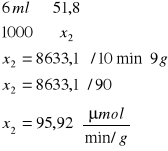
![]()
o stężeniu równym 0,5 mola
![]()
A- Absorpcja
0,002 - molowy współczynnik 4-nitrofenylofosforanu
139 - masa molowa produkt
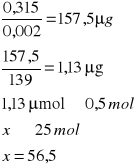

o pH = 5,2
![]()
A- Absorpcja
0,002 - molowy współczynnik 4-nitrofenylofosforanu
139 - masa molowa produkt
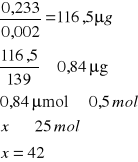

Wnioski:
W zależności od temperatury, stężenia enzymu czy też pH roztworu, absorpcja fali jest większa bądź mniejsza. Największą wartość osiąga w optymalnych warunkach, to jest w temperaturze 38˚C i w środowisku o pH = 5,2. Zwiększone stężenie roztworu nie powoduje spadku absorpcji, jak to jest w przypadku poprzednich czynników.

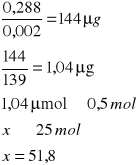
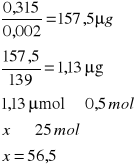
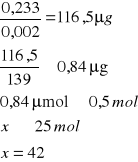

Wyszukiwarka
Podobne podstrony:
biochemia III;], Czynniki warunkujące aktywność enzymów
(), biochemia L, Wpływ temperatury na aktywność enzymów (ćw E)
Lab06 Aktywnosc enzymow I, Lekarski WLK SUM, lekarski, biochemia, enzymy
Ocena aktywności enzymów jako wskaźnik uszkodzenia narządów, MEDYCYNA, Biochemia
Czynniki wpływającego na aktywność enzymów
Czynniki wpływające na aktywność enzymów
Czynniki warunkujące zdrowie
Czynniki warunkuj ce wybor metod nauczenia odpowiednich dla
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
Czynniki warunkujące wystąpienie i czas trwania częściowej remisji u chorych na cukrzycę typu 1
Biochemia III, Notatki AWF, Biochemia, BIOCHEMIA - na koło
9) Oznaczanie aktywności enzymów amylolitycznych
Oznaczanie aktywności enzymów lipolitycznych
10 CZYNNIKI WARUNKUJĄCE AKCJĘ PORODOWĄ
więcej podobnych podstron