Temat: Czynniki warunkujące aktywność enzymów
Cel ćwiczenia:
Celem ćwiczenia jest poznanie wpływu takich podstawowych czynników jak temperatura, stężenie jonów wodorowych oraz stężenie enzymu na aktywność enzymów.
Odczynniki:
roztwór enzymu (wyciąg z kiełków pszenicy)
bufor o pH = 3,0
bufor o pH = 4,4
bufor o pH = 5,2
bufor o pH = 6,6
0,00075-molowy 4-nitrofenylofosforanu
10 % roztwór NaCO3
Szkło i inne pomoce:
- 1 zlewka na 600 ml
- 1 pipeta serologiczna na 1 i 5 ml oraz
- 14 probówek chemicznych.
Metoda i Wykonanie:
Próba zerowa:
Do probówki wlano 1,25 ml H2O, dodano to tego 0,5 bufora o pH= 5,2 i umieszczono na pięć minut w łaźni wodnej o temp. 38˚C. Następnie roztwór wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C . Po upływie wyznaczonego czasu dodano 2,5ml NaCO3.
Wpływ temperatur:
Do trzech probówek odmierzono po 0,5 ml roztworu enzymu , następnie 0,5 ml wody i 0,75 ml buforu o pH = 5,2 . Pierwszą próbówkę umieszczono w temp. 0˚C (woda z lodem), drugą w łaźni wodnej o temp. 38˚C, a trzecią w łaźni wodnej temp. 100˚C na około 5 minut. Następnie probówki wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C . Po upływie wyznaczonego czasu dodano 2,5ml NaCO3.
Wpływ stężenia enzymu:
Do pięciu probówek odmierzono kolejno po 0,25; 0,5; 0,75; 1,0; 1,25 ml roztworu enzymu i odpowiednio po 1,0; 0,75; 0,5; 0,25 ml H2O (do probówki z 1,25 ml enzymu nie dodano wody). umieszczono na pięć minut w łaźni wodnej o temp. 38˚C do każdej probówki po 0,5 ml buforu o pH = 5,2. Tak przygotowane roztwory umieszczono na pięć minut w łaźni wodnej o temp. 38˚C. Po upływie wyznaczonego czasu dodano probówki wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C. Następnie dodano 2,5ml NaCO3 do każdej.
Wpływ stężenia jonów wodorowych (pH):
Do czterech probówek odmierzono po 0,5 ml roztworu enzymu, następnie 0,5 ml wody i odpowiednio po 0,75 ml buforu o pH = 3,0; 4,4; 5,2; 6,6. Tak przygotowane roztwory umieszczono na pięć minut w łaźni wodnej o temp. 38˚C. Po upływie wyznaczonego czasu dodano probówki wyjęto i dodano 0,5 ml 4-nitrofenylofosforanu, wymieszano i inkubowano przez 10 min w temp. 38˚C. Następnie dodano 2,5ml NaCO3 do każdej.
Obserwacje:
Po dodaniu buforu i 4-nitrofenylofosforanu nie zaobserwowano żadnej zmiany barwy. Po inkubacji i dodaniu następnego odczynnika (roztwór NaCO3)można dostrzec jak roztwór zmienia barwę z bezbarwnej na odcień zieleni. W zależności od aktywności enzymu barwa jest intensywniejsza (przy większym), bądź mało intensywna (przy mniejszym).
Wyniki:
Po ustawieniu fotometru na próbę zerową uzyskano wyniki dla poszczególnych prób, następnie przedstawiono je w tabelkach i sporządzono wykresy zależności:
a) Temperatura
Tabela wyników wpływu temperatury:
temperatura |
0˚C |
38˚C |
100˚C |
wynik |
0,012 |
0,233 |
0,023 |
Stężenie enzymu
Tabela wyników wpływu stężenia enzymu
stężenia enzymu |
0,25 ml |
0,5 ml |
0,75 ml |
1,0 ml |
1,25 ml |
wynik |
0,187 |
0,315 |
0,316 |
0,571 |
0,765 |
Schemat rozcieńczeń
c) pH
Tabela wyników wpływu pH
pH |
3,0 |
4,4 |
5,2 |
6,6 |
wynik |
0,053 |
0,189 |
0,288 |
0,167 |
Schemat rozcieńczeń

Obliczanie aktywności enzymu:
w temperaturze 38˚C
![]()
A- Absorpcja
0,002 - molowy współczynnik 4-nitrofenylofosforanu
139 - masa molowa produkt
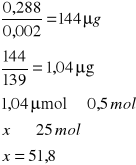
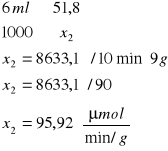
![]()
o stężeniu równym 0,5 mola
![]()
A- Absorpcja
0,002 - molowy współczynnik 4-nitrofenylofosforanu
139 - masa molowa produkt
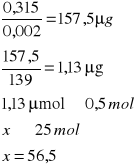

o pH = 5,2
![]()
A- Absorpcja
0,002 - molowy współczynnik 4-nitrofenylofosforanu
139 - masa molowa produkt
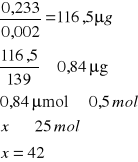

Wnioski:
W zależności od temperatury, stężenia enzymu czy też pH roztworu, absorpcja fali jest większa bądź mniejsza. Największą wartość osiąga w optymalnych warunkach, to jest w temperaturze 38˚C i w środowisku o pH = 5,2. Zwiększone stężenie roztworu nie powoduje spadku absorpcji, jak to jest w przypadku poprzednich czynników.
Aktywność enzymu w optymalnych warunkach i o odpowiednim stężeniu powinna być zbliżona. Aktywność enzymu mierzonego jest rozbieżna, co wskazuje na błąd podczas mierzenia bądź przygotowywania próbek.

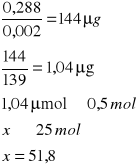
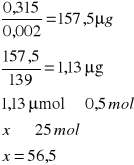
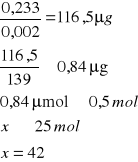

Wyszukiwarka