Podstawy biotechnologii żywności
Ćwiczenie 2
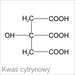
KWAS CYTRYNOWY
Kwas cytrynowy występuje w niewielkich ilościach w większości organizmów żywych, gdyż spełnia ważną rolę w ich metabolizmie- jest ważnym produktem przejściowym w cyklu Krebsa (zwanym stąd cyklem kwasu cytrynowego). W większych ilościach występuje w niektórych owocach, np. w cytrynach, w których stanowi nawet do 8% suchej masy (co odpowiada 0,65% masy świeżej cytryny).
Kwas cytrynowy jest używany jako regulator kwasowości i przeciwutleniacz w produktach spożywczych. Sole kwasu cytrynowego - cytryniany - są stosowane jako leki przy niedoborze określonego metalu w organizmie.
Fermentacja cytrynowa
Kwas cytrynowy występuje w przyrodzie w owocach cytrusowych i ananasach. Owoce te były do niedawna głównym źródłem kwasu cytrynowego, gdyż prawie 25% światowej produkcji pochodziło z tych owoców. W postaci krystalicznej kwas cytrynowy o wzorze sumarycznym (HOOC-CH2-C(OH)(COOH)-CH2-COOH) otrzymano po raz pierwszy w 1784 roku z cytryn i stąd pochodzi jego nazwa.
Ze względów praktycznych i czysto ekonomicznych dużo uwagi poświęcono produkcji kwasu cytrynowego przez grzyby. W 1893 roku. Wehmer po raz pierwszy wykrył kwas cytrynowy w kulturach pędzlaków i nazwał je Citromyces pfefferianus, a Currie w 1917 roku stworzył podstawy przemysłowej produkcji tego kwasu dzięki odkryciu, że Aspergillus niger rośnie dobrze i wydziela duże ilości kwasu cytrynowego w pożywkach płynnych o pH 2,5-3,5. Ze wzrostem pH pojawia się w pożywce kwas glukonowy, a w końcu kwas szczawiowy. Początkowa niska wartość pH chroni pożywkę przed zakażeniami, głównie bakteryjny. Dzięki temu w produkcji przemysłowej przy przeprowadzaniu hodowli powierzchniowej można pominąć warunki sterylności. W komorach fermentacyjnych aluminiowe tace (o powierzchni 2 X 2,5 x 0,15 m) wypełnia się do wysokości 8 cm. np. roztworem melasy, zaszczepia grzybem i przez 9-11 dni hoduje w temperaturze 30°C. Wydajność kwasu w tych warunkach jest znaczna. Po spuszczeniu melasy kożuch grzybniowy można ponownie podwarstwić świeżą pożywką. Ze spuszczonego roztworu pożywkowego cytrynian wapnia wytrąca się za pomocą kredy (CaCO3), krystalizuje i uwalnia przy użyciu kwasu siarkowego. W produkcji kwasu cytrynowego dokonano znacznego postępu i coraz częściej w wielu krajach wprowadza się metodę wgłębną w miejsce dotychczasowej powierzchniowej, ponieważ wydajność procesu liczona na kwas w stosunku do użytego cukru przekracza 90%, czyli ekonomicznie jest bardziej opłacalna i dlatego badania naukowe wielu ośrodków idą w tym kierunku. Naczynia do hodowli powierzchniowej i wgłębnej przedstawiono na rysunku 80.
Rysunek 80. Naczynia do hodowli powierzchniowej i wgłębnej drobnoustrojów tlenowych
Produkcja kwasu cytrynowego przez Aspergillus niger jest w bardzo dużym stopniu uzależniona od składu pożywki. Zależność ta ujawnia się wyraźnie, jeżeli przy zachowaniu innych stałych warunków będziemy stopniowo zmieniali skład pożywki. Jeżeli dodamy do prostej pożywki glukozę, oczyszczoną z elementów śladowych przez wytrącenie wodorotlenkiem glinu, a następnie dodawać będziemy pojedyncze składniki w znanych stężeniach i roztwór ten zaszczepimy, a po 9 dniach hodowli, np. na wytrząsarce, zważymy grzybnię oraz oznaczymy ilość pozostałego w roztworze cukru i wytworzonego kwasu cytrynowego - to stwierdzimy kilka zależności. Z przebiegu otrzymanych krzywych na diagramach można wnioskować, że:
NH4NO3 i MgSO4 nie wpływają specjalnie na wydajność kwasu cytrynowego, pomimo że rozwój grzybni jest kontrolowany i uzależniony od obecności tych soli w podłożu;
zależność pomiędzy wzrostem grzyba i produkcją kwasu a stężeniem cynku, żelaza, manganu i fosforu charakteryzują krzywe optymalne; jeśli koncentracja tych pierwiastków umożliwia tylko suboptymalny (poniżej optymalnego) rozwój grzyba, to wydajność kwasu zwiększa się; przy stężeniach poniżej suboptymalnych rozwój grzybni ogranicza produkcję kwasu;
szczególnie dużą wydajność kwasu cytrynowego można osiągnąć, jeśli żelazo i cynk znajdują się w ograniczonych ilościach.
Wyraźne działanie hamujące wywiera mangan; 3 mikrogramy Mn++ na 1 cm3 pożywki wystarcza, by zmniejszyć wydajność kwasu cytrynowego (dla przykładu podaje się, że w 140 g oczyszczonej glukozy handlowej znajduje się 10 mikrogramów Mn++, który wprowadza się do jednego litra pożywki).
Z punktu widzenia przemian biochemicznych oraz różnych procesów metabolicznych zachodzących w żywych komórkach grzybów, kwas cytrynowy wymaga oddzielnego omówienia jako jeden ze składników kwasów trikarboksylowych wchodzących w skład cyklu Krebsa (rys. 81), którego głównym zadaniem jest rozkład związków organicznych, a nie wydzielanie ich do podłoża. Otóż fermentacja cytrynowa, w odróżnieniu od procesów utleniania biologicznego zachodzącego w żywych organizmach, polega na gromadzeniu się znacznych ilości kwasu cytrynowego wskutek zablokowania w niektórych pleśniach enzymu biorącego udział w tlenowym rozkładzie cukrów. Jeśli uwzględnimy, że niektóre metale, takie jak: cynk, żelazo, mangan i inne pierwiastki śladowe, są aktywatorami pewnych enzymów, to brak ich powoduje blokowanie i powstają warunki, w których wytworzony kwas cytrynowy nie może być zmetabolizowany. Ta sztucznie wytworzona blokada przez odebranie z podłoża niektórych pierwiastków śladowych zmusza pleśnie do wytwarzania znacznych ilości kwasu cytrynowego gromadzącego się w podłożu, co z punktu widzenia mikrobiologii technicznej jest zjawiskiem pozytywnym i wykorzystywanym w celach praktycznych w przemyśle.
Do pleśni, które wytwarzają kwas cytrynowy należą: Aspergillus niger, Asp. clavatus, Penicillium citrinum, Mucor piriformis i inne (rys. 82). Najlepsze jednak okazały się odpowiednie rasy Aspergillus niger i tylko te są obecnie stosowane w produkcji kwasu cytrynowego na skalę przemysłową.
Rysunek 81. Cykl kwasów trikarboksylowych Krebsa; pierwszym związkiem symetrycznym jest dopiero bursztynian; cykl glioksalowy oznaczony został liniami przerywanymi; enzymy uczestniczące: 1 - syntetaza cytrynianowa, 2 i 3 - akonitaza, 4 i 5 — dehydrogenaza izocytrynianowa, 6 - dehydrogenaza alfa-ketoglutaranowa, 7 - tiokinaza bursztynianowa, 8 - dehydrogenaza bursztynianowa, 9 - fu- maraza, 10-dehydrogenaza jabłczanowa, 11 - liaza izocytrynianowa, 12-syntetaza jabłczanowa.
Rysunek 82. Produkcja kwasów organicznych przez grzyby.
Dobre szczepy powinny tworzyć duże ilości kwasu cytrynowego, mało produktów ubocznych w postaci kwasu szczawiowego i glukonowego oraz odznaczać się stałością cech biochemicznych, czyli nie ulegać degeneracji.
Fermentację cytrynową prowadzi się zwykle w środowisku zawierającym około 15% sacharozy, zakwaszonym kwasem solnym do pH 2,5-3,5 i uprzednio wyjałowionym. Można stosować też czysty cukier, a ostatnio coraz częściej stosuje się odpowiednio przygotowaną melasę.
Bilans fermentacji ma następującą postać:
C6Hł206 + 1,5 O2 > C6H807 + 2H20 + 804 kJ
Proces jest tlenowy, w związku z tym konieczne jest przewietrzanie pomieszczeń w przypadku prowadzenia go metodą powierzchniową, w której zachodzi fermentacja, lub napowietrzania tanków fermentacyjnych przy metodzie wgłębnej. Poza warunkami fizycznymi fermentacja cytrynowa wgłębna różni się znacznie od powierzchniowej także składem podłoży, rasami stosowanych pleśni, typem rozwoju samego organizmu pleśni oraz wydajnością. Jak z tego wynika, podczas fermentacji powinno się zaobserwować:
wzrost masy nastawu (przyłączenie tlenu) maskowany parowaniem i częściowo całkowitym spalaniem do CO2 i H2O,
nieznaczny spadek gęstości (c.wł. sacharozy 1,58, a c.wł. kwasu cytrynowego 1,54),
znaczny wzrost kwasowości spowodowany wytwarzaniem kwasu cytrynowego (80-90% ogólnej kwasowości) i kwasu szczawiowego (10-20% ogólnej kwasowości) oraz małych ilości kwasu glukonowego.
Jak już wspomniano, na powstanie kwasu cytrynowego ma wpływ wiele czynników. Zbyt bogata pożywka azotowa, na której następuje bujny wzrost grzybni, nie sprzyja tworzeniu kwasu cytrynowego. Podobnie nadmierne napowietrzanie zmniejsza wydajność, gdyż przesuwa proces tworzenia kwasu cytrynowego w kierunku oddychania.
Tworzenie kwasu cytrynowego związane jest głównie z okresem głodowania grzybni i dlatego większość tego kwasu tworzy się pod koniec okresu fermentacji, gdy substancje odżywcze zostaną już zużyte. Przetrzymywanie jednak grzybni na odfermentowanym podłożu powoduje straty przez spalanie kwasu cytrynowego do C02 i H20.
Optymalna temperatura fermentacji wynosi około 30°C w metodzie powierzchniowej przez 9-11 dni. Wydajność wówczas wynosi 50-70% w stosunku do zużytego cukru. W metodzie wgłębnej fermentacji cytrynowej optymalna temperatura waha się od 28 do 30°C i w czasie 5-7 dni otrzymuje się wydajność przy odpowiednio dobrze dobranych parametrach nawet do 90%.
Wiele kłopotów w produkcji kwasu cytrynowego metodami fermentacyjnymi, oprócz degeneracji stosowanych kultur pleśniowych i konieczności ich aktywacji, sprawiają zakażenia, szczególnie wtedy, kiedy podłoże hodowlane ma wartość pH powyżej 4,5 natomiast przy pH 2,5-3,0 rozwój mikroflory bakteryjnej jest zahamowany.
W związku z powyższym, jeśli pH jest powyżej 4,5, to spotyka się następujące grupy bakterii:
mlekowe - Streptococcus lactis, Leuconostoc mesenteroides, Thermobacterium cereale i inne,
masłowe i gnilne - Clostridium butyricum, Proteus vulgaris, Bacillus subtilis, Bac. megatherium, Bac. mesentericus i inne,
denitryfikacyjne - Pseudomonas fluorescens, które są szczególnie szkodliwe ze względu na tworzenie azotynów inhibitujących rozwój grzybni Aspergillus niger.
Z drożdży spotyka się, ale rzadko, Mycoderma i Thorulopsis, natomiast z pleśni najczęściej występuje Penicillium, która tworzy szybciej zarodniki niż Aspergillus i dlatego szybciej się rozrasta. Szczególnie szkodliwe są pleśnie pasożyty, jak Penicillium rugulosum, Penicillium rubrum i Penicillium purpurogenum.
Wyszukiwarka
Podobne podstrony:
1. METODYKA kwas cytrynowy, Biotechnologia UKW I ST, Biotechnologia żywności UKW
1 ćw kwas mlekowy - SPRAWOZDANIA, Biotechnologia UKW I ST, Biotechnologia żywności UKW
1 ĆW. kwas mlekowy - METODYKA, Biotechnologia UKW I ST, Biotechnologia żywności UKW
3 SPRAWOZDANIE ćw. 2 - karta pracy B-kw.cytrynowy (2), Biotechnologia UKW I ST, Biotechnologia żywno
ćw. 6-konserwanty NOWE- SPRAWOZDANIE, Biotechnologia UKW I ST, Biotechnologia żywności UKW
oznaczanie witaminy C, Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw. 5- barwniki-metodyka, Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw 10, Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw 10 - siła pędna drożdży , Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw 6 - metodyka konserwanty NOWA, Biotechnologia UKW I ST, Biotechnologia żywności UKW
7 ćw. - amylazy -sprawozdania, Biotechnologia UKW I ST, Biotechnologia żywności UKW
SPRAWOZDANIE-wit.C, Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw. 5 - KARTA PRACY -barwniki, Biotechnologia UKW I ST, Biotechnologia żywności UKW
7 ćw. - amylazy -sprawozdania (2), Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw 10, Biotechnologia UKW I ST, Biotechnologia żywności UKW
7 ćw. - amylazy -materiały dydaktyczne, Biotechnologia UKW I ST, Biotechnologia żywności UKW
ćw. 9 - biomasa- METODYKA NOWA, Biotechnologia UKW I ST, Biotechnologia żywności UKW
METODYKA -oznaczanie witaminy C, Biotechnologia UKW I ST, Biotechnologia żywności UKW
więcej podobnych podstron