Sprawozdanie poprawione.
LABOLATORIUM Z BIOCHEMII
ĆWICZENIE NR 1:
Aminokwasy
Data wykonania doświadczeń: 10.03.2011r.
Data oddania poprawionego sprawozdania: 31.03.2011r.
Grupa:
Dominika Kępska 157085
Katarzyna Kędzierska
Kierunek: Biotechnologia
Grupa dziekańska: III
Semestr IV
Wstęp teoretyczny
Celem ćwiczenia jest przeprowadzenie doswiadczeń pozwalających na wykazanie amfoterycznego charakteru aminokwasów oraz poznania ogólnych i wybiórczych metod analizy tych związków.
Aminokwasy- należą do związków azotowych. Są to aminowe pochodne niższych kwasów tłuszczowych, wchodzące w skład peptydów i białek. W swojej cząsteczce zawierają dwie grupy funkcyjne: aminową (-NH2) oraz kwasową-karboksylową (-COOH).
Możemy je podzielić na:
Proteinogenne (aminokwasy tworzące białka, o charakterystycznej konfiguracji L, posiadające dwie grupy funkcyjne przy tym samym atomie α węgla- wszystkie ( z wyjątkiem glicyny są chiralne- optycznie czynne) i nieproteinogenne.
Właściwości aminokwasów zależą od podstawnika łańcucha bocznego R.
Ogólny wzór aminokwasów proteinogennych to:
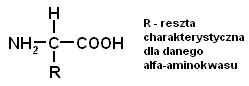
Aminokwasy proteinogenne,- oprócz proliny- będącej iminokwasem- są pierwszorzędowymi aminami, które dzielimy na endogenne (produkowane przez organizm człowieka) oraz egzogenne. Do tych drugich zaliczamy : Val, Ile, Leu (ze względu na rozgałęzioną budowę), Thr (posiadające gr hydroksylowa wewnatrz łańcucha), Met (z zablokowanasiarka), Phe i Trp (ze względu na występujący w ich budowie pierścień aromatyczny)oraz Lys (ze względu na występującą przy 6-tym atomie węgla gr-NH2).
His i Arg są względnie egzogenne (wytwarzane tylko przez dojrzały organizm).
Nastepnym podziałem, obejmującym aminokwasy ze względu na rolę, jaką pełnią w strukturze białek jest podział Karlsona:
I aminokwasy z apolarną reszta R (Gly, Ala, Val, Leu, Ile, Phe, Pro, Met)
II aminokwasy, które w reszcie R posiadają grupę polarna niejonizującą albo trudno jonizującą (Ser, Thr, Tyr, Trp, Cys, Gln, Asn, Cys-Se)
III aminokwasy monoaminodikarboksylowe (Asp, Glu)
IV aminokwasy diaminomonokarboksylowe wykazujące odczyn zasadowy (His, Lys, Arg)
Przy omawianiu aminokwasów (które są amfoterami i ulegają dysocjacji) ważnym pojęciem jest także punkt izoelektryczny- oznaczany jako pI. Jest to taka wartość pH, przy której jon jest w postaci amfijonu (wypadkowy ładunek na cząsteczce wynosi 0). W punkcie izoelektrycznym amionokwasy posiadają najmniejsze przewodnictwo elektryczne oraz najsłabszą rozpuszczalność. Każdy aminokwas posiada własny pI, co pozwala na identyfikowanie aminokwasów na podstawie ich własności fizycznych, np. w technice elektroforezy.
Część doświadczalna
Amfoteryczne właściwości aminokwasów.
Opis doświadczenia: L-tyrozynę rozpuszczamy na ciepło we wrzącej łaźni wodnej, w kilkunastu kroplach roztworu HCl. Następnie dodajemy kilka kropli 0,05M roztworu NaOH- do wytrącenia osadu. Na koniec alkalizujemy próbę przy użyciu 30% NaOH.
Obserwacje: Aminokwas rozpuścił się w kwasie (pod wpływem temperatury). Podczas dodawania do niego słabej zasady (0,05 M NaOH), zaczął wytrącać się biały, delikatny, igiełkowaty osad. Po dodaniu mocnej zasady (30% NaOH) osad rozpuścił się.
Wnioski: Początkowo aminokwas w środowisku silnie kwaśnym (pH poniżej pI) występował w postaci kationu-słabego kwasu. Po dodaniu 0,05M roztworu NaOH- L-tyrozyna osiągnęła punkt izoelektryczny, w którym to aminokwasy występują w postaci jonu obojnaczego-amfijonu i wykazują najsłabszą rozpuszczalność. Dzięki tej właściwości aminokwasów mogliśmy zaobserwować biały, delikatny, igiełkowaty osad w postaci którego wytrąciła się użyta w doświadczeniu L-tyrozyna. Natomiast po dodaniu mocnej zasady pH roztworu wzrosło i osad rozpuścił się ponownie (aminokwas w postaci anionu-słabej zasady). Zauważamy, że aminokwas ma charakter amfoteryczny- w zależności od pH środowiska, w którym się znajduje- może zachowywać się jak protonodawca lub protonobiorca.
Zasada: Właściwości amfoteryczne aminokwasu można zaobserwować poprzez zmianę pH roztworu w którym on występuje.
.1.Metody ogólne oznaczania aminokwasów.
2.2.1.1. Odczyn ninhydrynowy
Odczynnik: ninhydryna
Opis doświadczenia: Do 0,5 ml roztworu aminokwasu dodaję 0,5 ml odczynnika ninhydrynowego. Ogrzewam 3min w 100°C. Powtarzam doświadczenie zastępując aminokwas najpierw białkiem jaja kurzego, później wodą.
Obserwacje:
Tabela nr 1
Tytuł tabeli: Obserwacje w doświadczeniu z odczynnikiem ninhydrynowym
Badana substancja |
Barwa roztworu badanej substancji po ogrzaniu |
Glicyna |
Intensywnie granatowa |
Tryptofan |
Brązowo-zielona |
Histydyna |
Intensywnie fioletowo-granatowa |
Białko jaja kurzego |
Intensywnie fioletowa |
Woda |
Bezbarwny roztwór |
Wnioski: Zabarwieniu uległy wszystkie roztwory substancji badanych ( roztwory aminokwasów i roztwór białka jaja kurzego) z ninhydryną oprócz roztworu wody z ninhydryną. Występowanie wolnej grupy α aminowej w aminokwasie warunkuje powyższą reakcję. Oznacza to, że użyte w doświadczeniu substancje są aminokwasami z wolną grupą α aminową lub w przypadku białka jaja kurzego- składają się z takich aminokwasów.
Zasada: Reakcja powyższego odczynnika z aminokwasami przebiega w temperaturze 100°C. Jest dwuetapowa. W pierwszym: cząsteczka aminokwasu ulega utlenieniu (powstaje aldehyd o 1 atom węgla mniejszy). Wydziela się amoniak i CO2. Następnie, za pośrednictwem uwolnionej z aminokwasu cząsteczki amoniaku, zachodzi kondensacja cząsteczek: zredukowanej i utlenionej ninhydryny. W wyniku tej reakcji powstaje barwny kompleks, u którego intensywność zabarwienia odpowiada ilości uwolnionego amoniaku, co w konsekwencji świadczy o zawartości aminokwasu w badanej próbie.
Reakcji ulegają aminokwasy z wolną grupą α aminową (wśród proteinogennych reakcji tej nie ulega prolina).
Równanie reakcji:
2.2.1.2. Reakcja z kwasem azotowym (wg. Van Slyke'a)
Odczynnik: 5% roztwór azotynu sodowego oraz 2M roztwór kwasu octowego
Opis doświadczenia: Do 2ml roztworu NaNO2 dodajemy 2ml roztworu CH3COOH. Mieszamy. Wprowadzamy 2,5ml roztworu badanego aminokwasu. Równolegle wykonujemy próbę dla białka jaja kurzego oraz kontrolną- dla wody.
Obserwacje:
Tabela nr 2
Tytuł tabeli: Obserwacje w doświadczeniu z kwasem azotowym (wg. Van Slyke'a)
Badana substancja |
Zaobserwowany efekt reakcji |
Glicyna |
Bezbarwny roztwór, z którego wydziela się gaz |
Tryptofan |
Żółty roztwór, z którego wydziela się gaz |
Białko jaja kurzego |
Roztwór mętny, z którego wydziela się gaz |
Woda |
Roztwór bezbarwny |
Wnioski: Gazem wydzielającym się w powyższym doświadczeniu jest azot, którego to atom zostaje oderwany od grupy aminowej przez kwas azotowy. Oznacza to, że reakcja zachodzi jedynie dla związków zawierających wyżej wymienioną grupę funkcyjną. Kwas HNO2 syntetyzujemy w trakcie wykonywania ćwiczenia, gdyż w normalnych warunkach w niedługim czasie ulega on utlenieniu. Żółta barwa roztworu zawierające tryptofan świadczy o zajściu reakcji nitrowania jego pierścienia aromatycznego. Natomiast zmętnienie roztworu białka dowodzi jego denaturacji na drodze chemicznej (kwas denaturuje i koaguluje białko z roztworu).
Zasada: Kwas azotawy wywołuje deaminację aminokwasów. Prowadzi to do wydzielenia stechiometrycznej ilości gazowego azotu, co jest pomocne przy określaniu ilości aminokwasu zawartego w próbie.
Reakcja:
2.2.2.1. Reakcja ksantoproteinowa (dla aminokwasów aromatycznych)
Odczynnik: HNO3
Opis doświadczenia: Do 1ml roztworu aminokwasu dodajemy 0,5ml stężonego HNO3. Ogrzewamy 30s we wrzącej łaźni wodnej. Chłodzimy, całość alkalizujemy (2-3ml) roztworu NaOH.
Obserwacje:
Tabela nr 3
Tytuł tabeli: Obserwacje w doświadczeniu z reakcją ksantoproteinową.
Badana substancja |
Barwa roztworu badanej substancji przed ogrzaniem |
Barwa roztworu badanej substancji po ogrzaniu |
Zaobserwowany efekt reakcji po dodaniu NaOH do roztworu badanej substancji |
Glicyna |
Roztwór bezbarwny |
Roztwór bezbarwny |
Roztwór bezbarwny |
Tyrozyna |
Bezbarwny roztwór |
Jasnożółty roztwór |
Czerwony roztwór |
Tryptofan |
Żółty roztwór |
Pomarańczowy roztwór |
Krwistoczerwony roztwór |
Białko jaja kurzego |
Lekko żółty,mętny roztwór |
Lekko żółty, mętny roztwór |
Pomarańczowy, kłaczkowaty osad |
Woda |
Roztwór bezbarwny |
Roztwór bezbarwny |
Roztwór bezbarwny |
Wnioski: Zgodnie z przyjętą zasadą reakcji uległy aminokwasy zawierające w swej budowie pierścień aromatyczny: tyrozyna i tryptofan. Białko jaja kurzego jest pełnowartościowe- zawiera wszystkie aminokwasy proteinogenne- w tym także aromatyczne. A zatem znajdujące się w nim aminokwasy aromatyczne- również ulegają nitrowaniu. Ze względu na mniejszą zawartość aminokwasów aromatycznych (niż ta która jest obecna w czystej tyrozynie i tryptofanie)- jej zabarwienie jest mniej intensywne. Dodatkowo obserwujemy zmętnienie roztworu białka jaja kurzego co świadczy o jego denaturacji na drodze chemicznej (kwas denaturuje i koaguluje białko z roztworu).
Zasada: Reakcja ta polega na nitrowaniu pierścienia aromatycznego znajdującego się w łańcuchu bocznym aminokwasu. Zachodzi podczas ogrzewania aminokwasów aromatycznych ze stężonym kwasem azotowym.
W efekcie powstaje intensywne żółtopomarańczowe zabarwienie produktów.
Równanie reakcji:
2.2.2.2. Reakcja Millon'a (tylko dla tyrozyny)
Opis doświadczenia: Do 0,5 ml roztworu L-tyrozyny dodajemy 0,5 ml odczynnika Millon'a. Ogrzewamy we wrzącej łaźni wodnej do powstania barwnego roztworu. Reakcję powtarzamy dla białka jaja kurzego a następnie dla wody.
Obserwacje:
Tabela nr 4
Tytuł tabeli: Obserwacje w doświadczeniu z reakcją Millon'a.
Badana substancja |
Barwa roztworu badanej substancji przed ogrzaniem |
Zaobserwowany efekt reakcji po ogrzaniu |
Tyrozyna |
Bezbarwny roztwór |
Ceglastoczerwony roztwór |
Białko |
Biały, mętny roztwór |
Różowy, kłaczkowaty osad |
Woda |
Roztwór bezbarwny |
Roztwór bezbarwny |
Wnioski: Powyższa reakcja jest charakterystyczna dla tyrozyny- i to właśnie jej roztwór ulega zabarwieniu- powstaje sól rtęciowa nitrowej pochodnej L-tyrozyny. Roztwór białka jaja kurzego zawiera tyrozynę, a zatem również ulega tej reakcji. Zabarwienie jest mniej intensywne (ze względu na mniejsze stężenie aminokwasu zawartego w tym białku. Roztwór białka jest mętny ze względu na denaturację pod wpływem działania czynników chemicznych ( odczynnik Millona).
Zasada: Reakcja przebiega analogicznie do powyższego nitrowania, z tą różnicą, że podczas jej przebiegu obecne są jony rtęci. Produktem tej reakcji jest sól rtęciowa nitrowej pochodnej L-tyrozyny o ceglastoczerwonym zabarwieniu.
Równanie reakcji:
2.2.2.3. Reakcje charakterystyczne dla tryptofanu
2.2.2.3. A. Reakcja z aldehydem mrówkowym
Opis doświadczenia: Do 1ml roztworu L-tryptofanu dodajemy 3 krople aldehydu mrówkowego, 1ml stężonego kwasu siarkowego oraz 3 krople nasyconego roztworu siarczanu rtęci. Mieszamy roztwór L-tryptofanu z 3 kroplami aldehydu mrówkowego, 1ml stężonego kwasu siarkowego oraz 3 kroplami nasyconego roztworu siarczanu rtęci.
Obserwacje:
Tabela nr 5
Tytuł tabeli: Obserwacje w doświadczeniu z reakcją z aldehydem mrówkowym.
Badana substancja |
Zaobserwowany efekt reakcji po dodaniu HgSO4 do roztworu substancji badanej |
Glicyna |
Roztwór bezbarwny |
Tryptofan |
Czarny roztwór |
Białko |
Mleczny, różowawy, kłaczkowaty osad |
Woda |
Roztwór bezbarwny |
Wnioski: Reakcja ta jest charakterystyczna dla tryptofanu. Obserwujemy zabarwienie jego roztworu na skutek zadziałania na rozwór czynnikiem utleniającym ( stężonym kwasem H2SO4) i kondensację pierścienia indolowego z aldehydem mrówkowym. Dwie cząsteczki tryptofanu kondensują z 1 cząsteczka aldehydu mrówkowego. Tryptofan zawarty w białku wpływa na zmianę jego zabarwienia. Oznacza to, że pierścień indolowy tryptofanu znajdującego się w białku również ulega kondensacji- w taki sam sposób jak w przypadku roztworu czystego tryptofanu. Białko tak jak poprzednio zostaje zdenaturowane pod wpływem stężonego kwasu H2SO4
Równanie reakcji:
2.2.2.3.B. Reakcja z kwasem glikosalowym (Adamkiewicza-Hopkins'a)
Opis doświadczenia: Do 1ml roztworu L-tryptofanu dodajemy 1ml roztworu kwasu glioksalowego. Mieszamy. A następnie podwarstwiamy 1ml steż H2SO4.
Obserwacje:
Tabela nr 6
Tytuł tabeli: Obserwacje w doświadczeniu z reakcją z kwasem glioksalowym (Adamkiewicza-Hopkins'a)
Badana substancja |
Zaobserwowany efekt reakcji po dodaniu HgSO4 do roztworu substancji badanej |
Glicyna |
Roztwór bezbarwny |
Tryptofan |
Granatowa obrączka na granicy faz |
Białko |
Fioletowa obrączka na granicy faz |
Woda |
Roztwór bezbarwny |
Wnioski: Reakcja ta jest charakterystyczna dla tryptofanu. Obserwujemy zabarwienie jego roztworu na skutek zadziałania na rozwór czynnikiem utleniającym (stężony kwas H2SO4).i kondensację pierścienia indolowego z kwasem glioksalowym. Dwie cząsteczki tryptofanu kondensują z 1 cząsteczka kwasu glioksalowego. Tryptofan zawarty w białku wpływa na zmianę jego zabarwienia. Oznacza to, że pierścień indolowy tryptofanu znajdującego się w białku również ulega kondensacji- w taki sam sposób jak w przypadku roztworu czystego tryptofanu. Białko tak jak poprzednio zostaje zdenaturowane pod wpływem stężonego kwasu H2SO4
Równanie reakcji:
Zasada dla reakcji z aldehydem mrówkowym i kwasem glioksalowym: Tryptofan w swoim łańcuchu bocznym zawiera pierścień indolowy, który w obecności czynnika utleniającego (stężonego kwasu H2SO4)- tworzy barwne produkty kondensacji (aminokwasu z aldehydem mrówkowym lub aminokwasu z kwasem glioksalowym), powstające za pośrednictwem reszty aldehydu mrówkowego lub kwasu glioksalowego.
2.2.2.4. Odczyn Pauly'ego dla histydyny
Opis doświadczenia: .Do 1ml roztworu aminokwasu dodajemy 2ml roztworu kwasu sulfanilowego oraz 1ml roztworu azotynu sodu. Całość mieszamy, dodajemy 1ml NaOH.
Obserwacje:
Tabela nr 7
Tytuł tabeli: Obserwacje w doświadczeniu- odczyn Pauly'ego dla histydyny.
Badana substancja |
Zaobserwowany efekt reakcji roztworu substancji badanej z kwasem sulfanilowym i azotynem sodu |
Zaobserwowany efekt reakcji po dodaniu 30% NaOH do roztworu substancji badanej |
Glicyna |
Roztwór bezbarwny |
Jasnożółty roztwór |
Tyrozyna |
Roztwór bezbarwny |
Pomarańczowy roztwór |
Histydyna |
Roztwór bezbarwny |
Czerwony roztwór |
Białko jaja kurzego |
Roztwór się spienił |
Pomarańczowy spieniony roztwór |
Woda |
Roztwór bezbarwny |
Roztwór bezbarwny |
Wnioski: Jest to reakcja specyficzna dla histydyny- dlatego jej roztwór barwi się na czerwono. Podobnie dzieje się w przypadku tyrozyny- kolor pomarańczowy. Białko jaja kurzego zawiera powyższe aminokwasy, które analogicznie ulegają powyższej reakcji.
Zasada: Produktem reakcji kondensacji jest barwna pochodna diazowa powstała w wyniku sprzęgania wytworzonego z kwasu sulfanilowego diazwiązku ze składową azową, którą stanowi reszta histydyny zawierająca silnie zasadowy pierścień imidazolowy. Produkt wykazuje intensywnie czerwone zabarwienie.
Równanie reakcji:
2.2.2.5.Reakcja cystynowa
Opis doświadczenia: Szczyptę L-cysteiny rozpuszczamy w 0,5 ml wody, dodajemy kilka kropli octanu ołowiawego i 1ml NaOH. Próby ogrzewamy we wrzącej łaźni wodnej przez ok. 0,5 godziny..
Obserwacje:
Tabela nr 8
Tytuł tabeli: Obserwacje w doświadczeniu w reakcji cystynowej.
Badana substancja |
Zaobserwowany efekt reakcji po ogrzaniu roztworu substancji badanej |
Cysteina |
Szaroniebieski roztwór |
Białko |
Szaroczarny roztwór |
Woda |
Roztwór bezbarwny |
Wnioski: Reakcja jest charakterystyczna dla cysteiny, zawierającej siarkę w swoim łańcuchu bocznym- w grupie sulfhydrolowej. Atom siarki w cysteinie nie jest osłonięty żadną grupą i dlatego w warunkach oznaczenia może odłączyć się od cząsteczki. Białko zawiera cysteinę, w związku z czym reakcja dla niego również zachodzi.
Zasada: Reakcja przebiega w zasadowym środowisku, w temperaturze 100°C. W takich warunkach obecna w cząsteczkach cystyny i cysteiny siarka z grupy sulfhydrolowej zostaje uwolniona (jony siarczkowe w roztworze)i ulega reakcji charakterystycznej z jonami ołowiawymi. W efekcie powstaje czarny osad siarczku ołowiawego.
Równanie reakcji:
Ćwiczenie: Wykrycie otrzymanego aminokwasu
Probówka 15
Dominika Kępska 157085
Początkowo korzystam z metod ogólnych oznaczania aminokwasów. Jako pierwszą wykonuję reakcję z ninhydryną. W tym celu do 0,5 ml roztworu badanego aminokwasu dodaje 0,5ml odczynnika ninhydrynowego. Ogrzewam 3min. w temperaturze 100°C (we wrzącej łaźni wodnej). Obserwuję brak zmiany zabarwienia badanego roztworu, który pozostaje bezbarwny. Wnioskuję, iż badaną przez mnie substancją jest woda.
Aby potwierdzić swoje przypuszczenia wykonuję reakcję z kwasem HNO2 (reakcję Van Slyke'a). Do 2ml roztworu NaNO2 dodaję kolejno: 2ml roztworu CH3COOH (mieszam) oraz 2,5 ml badanego roztworu. Nie obserwuję wydzielania się gazu z probówki. Oznacza to, że powyższa reakcja nie zachodzi.
Na podstawie reakcji opisanych w punktach 1 i 2 stwierdzam, że badaną przez mnie substancją jest: woda.
Wyszukiwarka
Podobne podstrony:
Roczny plan poprawiony do druku (1), WYCHOWANIE FIZYCZNE, PIŁKA RĘCZNA
org. syst. prod. wykad poprawiony do druku, inż. BHP, V semestr
lalka poprawione do druku
Laborka?rro poprawiona do druku
poprawione do druku
Materialy do cw lab biochemia
wersja do druku, OCHRONA ŚRODOWISKA UJ, BIOCHEMIA, LABORKI
Biochemia poprawiona do tłuszczów
biochemia-Aci-ga(do druku), Zootechnika UP Lublin, biochemia
do druku moja poprawa
Aminokwasy, MEDYCYNA, Biochemia
aminokwasy i białka, Biochemia, aminokwasy białka
AMINOKWASY I BIAŁKA, biochemia, Biochemia
CW44, dc, GPF, Fizyka lab, do druku
projekt ogrzewnictwo do druku po poprawie
1koło-aminokwasy, 2 rok, Biochemia
aminokwasy, fizjoterapia, biochemia
więcej podobnych podstron