ENZYMY
1. Aktywatory i inhibitory reakcji enzymatycznych
Enzymy oprócz centrów katalitycznych posiadają również centra regulacyjne, czyli miejsca w których zachodzi wiązanie związków zwanych efektorami lub modulatorami. pod ich wpływem zachodzą zmiany konformacji cząsteczek enzymów doprowadzające do zmian aktywności ich centrów katalitycznych. Efektory zwiększające aktywność to aktywatory, hamujące to inhibitory.
Aktywatory dzielimy na autosteryczne, którymi są często same substraty enzymów oraz różne jony nieorganiczne(Ca2+; Mg2+; Mn2+; Co2+), mogą one wpływać na enzym w różny sposób: I-uczestniczą bezpośrednio w reakcji (Fe2+↔Fe3+ w cytochromach), II- przez przemianę właściwości substratu wskutek utworzenia kompleksu metal-substrat oraz allosteryczne, są nimi różne związki organiczne takie jak nukleotydy oraz metabolity różnych przemian, które wpływają na aktywność enzymu przez przyłączenie w miejsce allosteryczne.
Inhibitory- dzielimy na 2 podst. rodzaje: kompetycyjne (współzawodnicze) i niekompetycyjne (niewspółzawodnicze). Są to subst. naturalne wyst. w organiźmie bądź wprowadzane z zewnątrz. Inhibitory współzawodnicze wykazują podobieństwo strukturalne do substratu a ich działanie opiera się na konkurencyjnym hamowaniu aktywności wolnego enzymu przez inhibitor izosteryczny, czyli analog substratu lub koenzymu, tworząc układ enzym-inhibitor. Mogą nimi być produkty działania enzymów nagromadzone w znacznych ilościach, wiele środków leczniczych, niektóre pestycydy, antybiotyki, awitaminy. Natomiast inhibitory niewspółzawodnicze są reprezentowane przez subst. nie podobne do substratu, a ich działanie nie polega na konkurencyjnym współzawodnictwie substratu i inhibitora o centrum aktywne ale zależy wyłącznie od stężenia inhibitora, niezależnie od stężenia substratu w środowisku reakcji. Mogą nimi być jony metali ciężkich( rtęć, srebro, ołów), a także jony cyjankowe (CN-)
2. Katalityczne centra enzymów.
W cząsteczce białka enzymatycznego istnieje specjalne miejsce do którego przyłącza się niewielka na ogół cząsteczka substratu, tworząc zespół aktywny(ES). Takie miejsce nazywamy centrum katalitycznym bądź aktywnym enzymu. Centrum katalityczne jest umiejscowione w zagłębieniu powierzchni enzymu, gdzie występuje w postaci szczeliny lub bruzdy. Obszar centrum katalitycznego tworzą reszty aminokwasów łańcuchów bocznych, które są odpowiednio uporządkowane w przestrzeni. Reszty aminokwasowe wchodzące w skład centrum aktywnego należą zwykle do aminokwasów nie sąsiadujących ze sobą w łańcuchu polipeptydowym, lecz zbliżonych do siebie na skutek jego zwinięcia w formę globularną. We wszystkich enzymach poznanych pod względem struktury, miejsce wiązania substratów są właściwie niedostępne dla cząsteczek wody. Mimo to każde centrum katalityczne zawiera kilka polarnych reszt aminokwasowych odgrywających istotną rolę w wiązaniu substratu i procesie katalizy. Hudrofobowe właściwości centrów katalitycznych przyczyniają się do silniejszego wiązania substartu.
4. Klasyfikacja systematyczna enzymów
W kalsyfikacji systematycznej enzymy oznacza się wg. kodu liczbowego czterema cyframi arabskimi oddzielonymi kropkami. Pierwsza cyfra wskazuje na przynależności enzymu do jednej z 6 podst. grup: 1.oksydoreduktazy 2. transferazy 3. hydrolazy 4. liazy 5. izomerazy 6. ligazy czyli syntetazy. Kolejna, druga cyfra określa podklasę w obrębie danej grupy enzymatycznej. Liczba trzecia oznacza przynależność danego enzymu do podklasy. Czwarta oznacza numer enzymu.
1 oksydoredyktazy: II liczba: utleniana gr. w donorze(CHOH, CHNH2) III liczba: akceptor(NAD, NADP,cytochromy)
2 transferazy: II liczba: przenoszona grupa ( jedno węglowa, acyl, glikozyl , reszta kw.fosforowego) III liczba: akceptor(z gr. alkoholową ,COOH, zaw. azot-fosfotransferazy)
3 hydrolazy:II liczba: hydrolizowane wiązanie(estrowe, peptydowe) III liczba: hydrolizowane wiązanie-bliżej (estrowe w kw. karboksylowym, C-N w amidach)
4 liazy: II liczba: rozszczepiane wiązanie (C-C;C-O;C-N;C-S) III liczba: odszczepiana od substratu grupa lub zw.(CO2;H2O;H2S)
5 izomerazy: II liczba: typ izomeracji (izomeria miejsca, cis-trans, oksydoredukcja wewnatrzcząste.) III liczba: forma przekształcenia-bliżej; atakowany substrat lub grupa
6 ligazy: II liczba :powst. wiązanie (C-O;C-S,C-N) III liczba: substrat syntezy (kwas:tiol, kwas:aminokwas)
przykłady:
oksydoreduktazy: dehydrogenaza alkoholowa, mlecanowa, acylo-CoA; oksydaza glukozowa, ksantynowa.
transferazy: metylotransferaza guanido-octanowa; acylotransferaza cholinowa; transaminazy
hydrolazy: esterazy; lipazy; fosfatazy; nukleozydaza; karboksypeptydaza; pepsyna; trypzyna; chymotrypsyna
liazy: dekarboksylaza pirogronianowa; aldoza; hydrataza fumaranowa
izomerazy: epimeraza rybulozo-5-fodforanowa, mutaza metylomalonulo-CoA
ligaza: systataza: tyrozylo- tRNA, acetylo-CoA, glutaminowa, peptydowa, karboksylaza acetylo-CoA
4. Od czego zależy szybkość katalizowanej enzymatycznie reakcji?
Jeżeli enzymy są w stanie aktywnym wówczas szybkość katalizowanych przez nie reakcji zależy od: a)c. enzymu b)c. substratu c)c. produktów reakcji d) pH e) temp. f) obecność aktywatorów i inhibitorów. Ad.1. Szybkość reakcji wzrasta proporcjonalnie do stężenia enzymu; im więcej cząsteczek enzymu tym więcej cząsteczek substratu może ulec przemianie w jednostce czasu. Ad.2. Wzrost stężenia substratu tylko do pewnej wartości przyspiesza szybkość reakcji enzymatycznej, po osiągnięciu optimum szybkości maksymalnej dalszy wzrost stężenia nie powoduje wzrostu szybkości reakcji enzymatycznej. Ad.4. Szybkość reakcji zależy od stężenia jonów H+, dla każdego enzymu istnieje określone optimum pH, przy czcym dla większości enzymów znajduje się ono w środowisku obojętnym, zależność szybkości od pH można przedstawić w postaci krzywej na wykresie. Ad.5. Zależność szybkości reakcji od temp. jest podobna do zależności od pH i również można ją przedstawić w postaci krzywej, optimum temp. dla większości enzymów to 30-40° C.
5. Enzymy proteolityczne- omówić budowę i działanie
Enzymy proteolityczne - są to grupy enzymów trawiennych posiadające zdolność do rozpraszania białek. Do grupy enzymów proteolitycznych możemy zaliczyć m.in. proteazę. Dzielą się na endopeptydazy (działające wewnątrz łańcucha polipeptydowego) oraz egzopeptydazy (działające na jeden z końców białka). Z kolei enzymy egzopeptydazy można podzielić na: karboksypeptydazy działające na koniec białka z grupa -COOH, aminopeptydazy działające na koniec białka z grupą -NH2.
Biorąc pod uwagą specyficzność w stosunku do substratu, a ściślej do położenia rozkładanego wiązania w obrębie łańcucha peptydowego, dzielimy je na 4 klasy:
I. Hydrolazy peptydylo-peptydowe rozrywające wiązania peptydowe białek i peptydów znajdujące sie głownie wewnątrz łańcucha, dzieląc je na mniejsze fragmenty. Zaliczmy do nich proteinazy trawienne(pepsynę, trypsynę, chymotrypsynę oraz enzymy pochodzenia roślinnego( papainę, bromelainę, ficynę).
II. Hydrolazy peptydylo-aminokwasów- katalizują proces odszczepiania od łańcucha peptydowego skrajnych, pojedynczych aminokwasów z wolną grupą karboksylową, czyli działają na tzw. aminokwasy C-krańcowe.
III. Hydrolazy ά-aminoacylopeptydów- katalizują proces hydrolizy skrajnych wiązań peptydowych zlokalizowanych w łańcuchu peptydowym w sąsiedztwie wolnej grupy aminowej, czyli powoduja odszczepienie amninokwasu N-końcowego.
IV. Hydrolazy dipeptydów- katalizują proces hydrolizy tylko dipeptydów do amninokwasów.
Enzymy proteolityczne należą do białek prostych lub metaloprotein. Charakteryzują się stosunkowo szeroką specyficznością działania, czyli małą wybiórczością w stosunku do rozkładanego substratu. Oznacza to, że mogą katalizować hydrolizę różnych białek, lecz w obrębie danego białka rozkładają określone wiązania peptydowe. Prawie wszystkie enzymy proteolityczne są wytwarzane i wydzielane u zwierząt do przewodu pokarmowego jako nieaktywne prekursory :
pepsynogen→ pepsyna; trypsynogen → trypsyna
6. Enzymy przewodu pokarmowego
Enzymy trawienne przewodu pokarmowego - Enzymy, które są produkowane przez żołądek, trzustkę i komórki jelita cienkiego, a następnie wydzielane do światła przewodu pokarmowego. Ich obecność umożliwia rozłożenie skomplikowanych cząsteczek znajdujących się w pokarmie (np. białek i lipidów) do prostych cząsteczek (np. aminokwasów, kwasów tłuszczowych i glicerolu), które mogą zostać wchłonięte przez jelita i wykorzystane dla potrzeb organizmu.
Enzymy trawienne (gastralne) wystepują:
I. W jamie ustnej: ptialina (amylaza ślinowa) - trawi cukry (skrobię);
II. W żołądku: podpuszczka - ścina białko mleka, u człowieka występuje w okresie niemowlęcym, katalizuje rozkład rozpuszczalnego kazeinianu wapnia do nierozpuszczalnego parakazeinianu (twaróg); pepsyna - endopeptydaza rozkładająca białka na krótsze odcinki oligopeptydów, lipaza żołądkowa - przyczynia się do emulgacji tłuszczów i nieznacznie je hydrolizuje; enzymy żołądkowe wykazują optimum działania przy bardzo niskich pH (około 1), wchodzą w skład soku żołądkowego.
III. W dwunastnicy: trypsyna, chymotrypsyna, elastaza, karboksypeptydaza, amylaza trzustkowa, laktaza, sacharaza, maltaza, lipaza trzustkowa, deoksyrybonukleaza, rybonukleaza.
7. Enzymy grupy E.C.3
Enzymy należące do tej grupy to hydrolazy, które działają w obecności tlenu cząsteczkowego równocześnie na dwa odrębne substraty powodujące ich utlenienie, jeden z atomów tlenu jest włączony do jednego z substratów, a drugi z atomami wodoru drugiego substartu twosrzy cząsteczkę wody.
EC 3-HYDROLAZY
EC 3.1.-Esterazy - Działają na wiązania estrowe; EC 3.2. -Glukozylazy - Hydrolizują związki glikozydowe; EC 3.3. -Hydrolazy działające na wiązania eterowe; EC 3.4.-Peptydazy - działają na wiązania peptydowe; EC 3.5.-Hydrolazy działające na wiązanie C-N, ale różniące się od peptydowych; EC 3.6.-Enzymy działające na bezwodniki kwasowe; EC 3.7.-Hydrolazy działające na wiązanie C-C; EC 3.8.-Enzymy działające na wiązanie halogenkowe (halogenkowo-alkilowe); EC 3.9.-Hydrolazy działające na wiązanie P-N; EC 3.10.-Enzymy działające na wiązanie S-N; EC 3.11.-Hydrolazy działające na wiązanie C-P; EC 3.12.-Enzymy działające na wiązanie S-S; EC 3.13.-Hydrolazy działające na wiązanie C-S
8. Graficzny schemat budowy enzymu
Apo Enzym - część białkowa
Ko Enzym - część białkowa
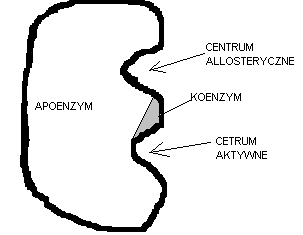
Apo E + Ko E = Holo Enzym
centrum aktywne- pofałdowanie łańcucha aktywnego ApoEnyzmu do którego przyłącza się substart
centrum allosteryczne- pofałdowanie łańcucha do którego przyłączają się zarówno ihibitory jak i aktywatory
WITAMINY
1. Omówić grupę witamin rozpuszczalnych w tłuszczach
Do witamin rozpuszczalnych w tłuszczach zaliczamy witaminy A, D, E, K. Stwierdzenie, że witaminy są rozpuszczalne w tłuszczach, oznacza, iż aby organizm mógł je wykorzystać, muszą być one dostarczone w obecności tłuszczu roślinnego lub zwierzęcego. Źródłem witamin rozpuszczalnych w tłuszczach, szczególnie witaminy E, są oleje roślinne, kiełki pszenicy i soi, orzechy oraz ryby morskie.
Witamina A - akseroftol
Odgrywa tak dużą rolę u młodych, rosnących organizmów, że jest nawet nazywana "witaminą wzrostową". Współdziała z hormonem wzrostu.
Jest niezbędna dla posiadania silnych kości, zdrowych zębów i skóry, do zachowania zdrowych włosów i paznokci, regeneracji naskórka. Ma kluczowy wpływ dla układu nerwowego i różnych funkcji z nim związanych, jak np. wzrok. Jest tak istotna dla siatkówki oka - retiny, że nazywana jest także retinolem. Pomocna w zwalczaniu infekcji. Jej stałe stężenie we krwi może zmniejszać ryzyko zachorowania na niektóre postacie nowotworów (rak piersi, szyjki macicy, żołądka, płuc).
Przyspiesza odnowę komórek skóry i sprawia, że rysy wygładzają się. Jest witaminą, która chroni skórę przed szkodliwym wpływem promieni UV.
Jej niedobór, a także nadmiar, powoduje utratę apetytu, suchość i świąd skóry, wypadanie włosów, gorsze gojenie się ran, "kurzą ślepotę", czyli złe widzenie o zmroku, zahamowuje wzrost.
Retinol, czyli biologicznie czynna witamina A, znajduje się w żywności pochodzenia zwierzęcego: w żółtkach jaj, pełnotłustym mleku i jego przetworach, wątrobie, tłustych morskich rybach, tranie.
ß-karoten - czyli prowitamina A to jej roślinna wersja, która w organizmie człowieka zamienia się w retinol. Występuje w warzywach i owocach o zielonym, żółtym, pomarańczowym i czerwonym kolorze - w marchwi, pomidorach, rzodkiewkach, brokułach, papryce, morelach, truskawkach, arbuzach.
Dobowe zapotrzebowanie wynosi średnio 4.000-5.000 j.
Witamina A może być magazynowana w organizmie, należy więc uważać przy suplementacji. Natomiast przy spożywaniu produktów roślinnych o dużej zawartości karotenu nie grozi nam przedawkowanie.
Witamina D - kalcyferol
Występuje w organizmach w postaci tzw. prowitamin (np. cholekalcyferolu, czyli witaminy D3), będących pochodnymi cholesterolu. Odgrywa podstawową rolę w procesie budowy kości i zębów poprzez wspomaganie wchłaniania wapnia i fosforu, wpływa na prawidłowe działanie systemu nerwowego. Nasza skóra, pod wpływem promieni słonecznych, sama produkuje tę witaminę. Dlatego zimą, gdy dni są krótkie i rzadko słoneczne, łatwo o jej niedobór, który u dorosłych objawia się nerwowością, bezsennością, powoduje osteomalację - rozmiękczanie kości i osteoporozę - zrzeszotowienie kości. U dzieci i młodzieży niedobór witaminy D prowadzi do choroby zwanej krzywicą, pogłębia próchnicę zębów, utrudnia zrastanie się złamanych kości. Witamina D jest odporna na działanie podwyższonej temperatury i długie przechowywanie produktów spożywczych. Jest stosunkowo trwała w środowisku zasadowym, natomiast wrażliwa jest na działanie kwasu. Dobrym źródłem są żółtka jaj, mleko, masło, śmietana, podroby, tłuste ryby i oczywiście tran. Wielkość zapotrzebowania na witaminę D zależy od wielu czynników, a przede wszystkim od wieku, ilości witaminy D powstałej w skórze pod wpływem naświetlania ultrafioletem, ilości i wzajemnej proporcji wapnia i fosforu w diecie. Przyjmuje się, że średnie zapotrzebowanie na witaminę D wynosi 500 j.m.
Witamina E - tokoferol
Odnawia lipidy międzykomórkowe, nazywane cementem skóry, poprawia kondycję naczyń krwionośnych. Jest odpowiedzialna za prawidłowe funkcjonowanie narządów rozrodczych, współdziała przy wytwarzaniu czerwonych ciałek krwi. Jako antyutleniacz wywiera korzystne działanie na komórki, wychwytując wolne rodniki i uniemożliwiając im niszczenie włókien kolagenowych, od których zależy jędrność skóry. Chroni przed wolnymi rodnikami na tyle skutecznie, że zyskała sobie miano "witaminy młodości".
Objawy niedoboru: trudności z koncentracją, nadpobudliwość, sucha skóra z tendencja do szybszego pojawiania się zmarszczek. Znajduje się w nieoczyszczanych olejach roślinnych, pełnym ziarnie zbóż, migdałach, pestkach słonecznika, orzechach włoskich i ziemnych, sałacie, kapuście. Dobowe zapotrzebowanie nie jest dokładnie określone, a zgodnie z aktualnymi danymi wynosi 6-10 mg.
Witamina K - filochinon
Jest niezbędna do syntezy czynników krzepnięcia w wątrobie, przede wszystkim protrombiny. Jej obecność jest istotna dla gospodarki wapniowej i mineralizacji tkanek. Zmniejsza kruchość naczyń krwionośnych, zapobiega tworzeniu się wybroczyn (tzw. pajączków), poprawia koloryt skóry.
Objawy niedoboru to obfite miesiączki, skłonność do wybroczyn, trudne gojenie się ran.
Przyczyną niedoboru witaminy K może być długotrwała kuracja antybiotykami, które niszczą florę bakteryjną przewodu pokarmowego.
Witamina K znajduje się w wieprzowinie, wątrobie, żółtkach jaj, zielonych warzywach, natce pietruszki. Jest wytwarzana także przez bakterie jelitowe bytujące w naszym przewodzie pokarmowym. Dobowe zapotrzebowanie wynosi w granicach 0,1-0,2 mg.
2. Witamina B1 i objawy awitaminozy
Witamina B1 (tiamina, aneuryna), heterocykliczny związek organiczny złożony z pierścienia tiazolowego i pierścienia pirymidynowego, które połączone są mostkiem metinowym.
wzór
Forma aktywna DPT - difosfotiamina - pirofosforan tiaminy - kokarboksylaza. Reszta pirofosforanowa jest wbudowywana do tiaminy przy udziale transferazy, dawcą pirofosforanu jest ATP. Funkcja biochemiczna: a) dekarboksylacja oksydacyjna α-ketokwasów tj.: kwas pirogronowy; kwas α-ketoglutarowy; α-ketokwasy powstałe w procesie transaminacji aminokwasów rozgałęzionych; b) udział w reakcji transketolacji odbywającej się w cyklu pentozowym; Rola w organizmie - rozpuszczalna w wodzie, odgrywa zasadniczą rolę w procesach oddychania tkankowego, głównie w przemianie węglowodanów, jest częścią składową koenzymu karboksylazy (pirofosforanu tiaminy). Wzmaga czynność acetylocholiny, hamuje esterazę cholinową, działa synergicznie z tyroksyną i insuliną, pobudza wydzielanie hormonów gonadotropowych. Tiamina przyspiesza gojenie się ran i wykazuje działanie uśmierzające ból.
Skutki niedoboru - zaburzenia czynności centralnego układu nerwowego: uczucie osłabienia i zmęczenie, oczopląs, zaburzenia pamięci, koncentracji, zaburzenia pamięci i depresja, niewydolność krążenia: przyspieszona akcja serca, powiększenie wymiarów serca, obrzęki kończyn górnych i dolnych, zaburzenia ze strony przewodu pokarmowego: utrata łaknienia, nudności, wymioty, biegunki, bóle brzucha, brak apetytu, spadek wagi.W przypadku silnej awitaminozy B1 może wystąpić choroba beri-beri, objawiająca się zaburzeniami pracy neuronów i włókien mięśniowych, co powoduje bóle kończyn, osłabienie mięśni, drżenie, niewydolność układu krążenia. Alkohol rozkłada witaminę B1 co powoduje że ludzie nadużywający alkoholu powinni szczególnie dbać o dostarczanie jej do organizmu. Normalnie odżywiając się, nie można doprowadzić do niedoboru witaminy B1. Problemem jest niedobór wit. B1 wywołany spożywaniem alkoholu. W tym przypadku można rozpoznać takie objawy jak: encefalopatia Wernickego; psychoza Korsakowa; Delirium tremens;
3. Budowa i działanie witaminy D
Do grupy witamin D (D2- D7) należą pochodne 7- dehydrocholesterolu i steroli roślinnych. Wspólną cechą budowy wit. z grupy D jest rozerwany pierścień B układy steranowego oraz utleniona grupa metylowa do grupy metylenowej w pozycji 19. Różnią się natomiast budową łańcucha bocznego, który w zasadzie nie ma istotnego znaczenia dla funkcji.
wzór
Do najlepiej poznanych należą wit. D2 i D3. Ergosterol jest prowitaminą D2 (ergokalcyferol), 7-dehydrocholesterol witaminy D3 (cholekalcyferolu). Powstają one pod wpływem promieni ultrafioletowych przy czym pęka wiązanie C-9 i C-10.
wzor: d2 i d3
Witaminy D, łącznie z hormonem przytarczyc regulują mechanizm wapnia i fosforu, maja wpływ na wchłanianie fosforu nieorganicznego w jelitach cienkich, umożliwiają jego włączenie w tkankę kostną i regulują wtórną resorpcje fosforu w kanalikach nerwowych. Przy niedoborze wit. D wu ludzi i zwierzą występują zmiany krzywiczne.
4. Witamina A i jej udział w procesie widzenia
Witamina A - akseroftol
Odgrywa tak dużą rolę u młodych, rosnących organizmów, że jest nawet nazywana "witaminą wzrostową". Współdziała z hormonem wzrostu.
Jest niezbędna dla posiadania silnych kości, zdrowych zębów i skóry, do zachowania zdrowych włosów i paznokci, regeneracji naskórka. Ma kluczowy wpływ dla układu nerwowego i różnych funkcji z nim związanych, jak np. wzrok. Jest tak istotna dla siatkówki oka - retiny, że nazywana jest także retinolem. Zapobiega wysychaniu i rogowaceniu nabłonka, jest niezbędna w procesie widzenia (jej brak prowadzi do tzw. „kurzej ślepoty”, czyli zaniku widzenia po zmierzchu ). Dłużej trwające niedobory retinolu prowadzą do trwałych zmian w oczach, co może doprowadzić nawet do utraty wzroku. Pomocna w zwalczaniu infekcji. Jej stałe stężenie we krwi może zmniejszać ryzyko zachorowania na niektóre postacie nowotworów (rak piersi, szyjki macicy, żołądka, płuc).
Przyspiesza odnowę komórek skóry i sprawia, że rysy wygładzają się. Jest witaminą, która chroni skórę przed szkodliwym wpływem promieni UV.
Jej niedobór, a także nadmiar, powoduje utratę apetytu, suchość i świąd skóry, wypadanie włosów, gorsze gojenie się ran, "kurzą ślepotę", czyli złe widzenie o zmroku, zahamowuje wzrost.
Retinol, czyli biologicznie czynna witamina A, znajduje się w żywności pochodzenia zwierzęcego: w żółtkach jaj, pełnotłustym mleku i jego przetworach, wątrobie, tłustych morskich rybach, tranie.
ß-karoten - czyli prowitamina A to jej roślinna wersja, która w organizmie człowieka zamienia się w retinol. Występuje w warzywach i owocach o zielonym, żółtym, pomarańczowym i czerwonym kolorze - w marchwi, pomidorach, rzodkiewkach, brokułach, papryce, morelach, truskawkach, arbuzach. Dobowe zapotrzebowanie wynosi średnio 4.000-5.000 j. Witamina A może być magazynowana w organizmie, należy więc uważać przy suplementacji. Natomiast przy spożywaniu produktów roślinnych o dużej zawartości karotenu nie grozi nam przedawkowanie. Występuje w maśle, wątrobach, mleku, jajkach, jerzynach.
wzór
5. Znaczenie witaminy B12
Podobnie jak inne witaminy z grupy B, witamina B12 bierze udział w przemianie węglowodanowej, białkowej, tłuszczowej i w innych procesach. Wpływa na energetyczną przemianę materii, dzięki czemu zapewnia aktywność, ma wpływ na wzrost, pracę mięśni, ułatwia przemianę żelaza, tłuszczu oraz pobudza apetyt. Przede wszystkim zaś uczestniczy w wytwarzaniu czerwonych ciałek krwi, a więc przeciwdziała niedokrwistości. Jest niezbędna do prawidłowej syntezy kwasów nukleinowych w komórkach, szczególnie szpiku kostnego, które wytwarzają komórki krwi. Witamina B12 wpływa także na prawidłowe funkcjonowanie układu nerwowego. Uczestniczy w tworzeniu otoczki mielinowej ochraniającej komórki nerwowe, a także neuroprzekaźników nerwowych, które ułatwiają przepływ informacji między komórkami. Poza tym B12 - razem z kwasem foliowym (czyli witaminą B9) - bierze udział w procesie wytwarzania metioniny zapewniającej dobry nastrój. Tak więc witamina B12 ułatwia osiągnięcie równowagi psychicznej, pomaga w uczeniu się i skupieniu uwagi. Oprócz tego odgrywa ona dużą rolę przy odtwarzaniu kodu genetycznego, aktywizuje budowę kwasów dezoksyrybonukleinowych oraz rybonukleinowych, czyli białek wchodzących w skład jąder komórek i zawierających cechy dziedziczne. Obecność witaminy B12 ma wpływ na funkcjonowanie karnityny, substancji "wyławiającej" z krwi cząsteczki tłuszczu i przenoszącej je do mitochondriów znajdujących się w komórkach, gdzie ulegają one utlenieniu, dzięki czemu komórka uzyskuje energię. Dlatego też dzięki witaminie B12 zmniejsza się ilość lipidów (tłuszczów) we krwi, gdyż przyczynia się ona do ich zużytkowania. B12 oddziałuje na układ kostny, co ma szczególne znaczenie dla rozwoju dzieci oraz dla kobiet w czasie menopauzy, które są w tym okresie zagrożone osteoporozą polegającą na utracie masy kostnej. O prawidłowym rozwoju kości świadczy obecność tej witaminy w tzw. osteoblastach, czyli komórkach produkujących substancję międzykomórkową tkanki kostnej.
6. Główne źródła witaminy A, C, B1, B2, PP, B12
B1 - (Thiamin) - Wieprzowina, warzywa strączkowe, całe ziarna, kiełki, orzechy; B2 - Riboflavin - Mleko, przetwory mleczne, całe ziarna, jaja, ryby, zielone liściaste warzywa; B12 - wątroba, nerki i serce, a także chude mięso, ryby, skorupiaki, sery i jaja; A - Żółtko jaj, mleko, masło, żółte i ciemnozielone warzywa, żółte i pomarańczowe owoce; C - Cytrusy, pomidory, brokuły, ziemniaki, zielona papryka, kapusta, truskawki; PP - wątrobie, mięsie, rybach, orzechach oraz ziarnach zbóż
7. Ryboflawiny - istota funkcji
Witamina B2 słabo rozpuszcza się w wodzie. Jest trwałą w kwaśnym środowisku. Rozkłada się dość szybko pod wpływem ultrfioletu. Bierze udział w procesach utleniania i redukcji; poprawia wzrok; współuczestniczy z witaminą A w prawidłowym funkcjonowaniu błon śluzowych; Niedobór powoduje osłabienie wzroku, wrażliwość gałek ocznych (łzawienie), popękane usta, zawroty głowy i brak koncentracji, zaburzenia oddychania, bezsenność; Nadmiar powoduje: nudności, wymioty; występuje w: serach, mleku, roślinach strączkowych, wątrobach.
INNE
1. Rola cyklu Krebsa w katabolizmie komórkowym
Cykl Krebsa stanowi ważne ogniwo w przemianie materii, łącząc różnorodne procesy kataboliczne i anaboliczne. Pełni on następujące funkcje:
1. Jest głównym producentem CO2 wykorzystywanego do syntezy zasad azotowych w nukleotydach, biosyntezy mocznika i do procesów karboksylacji.
2. Dostarcza komórce zredukowanych koenzymów (NADH, FADH2) pochodzących z utleniania ( odwodorowania) jego metabolitów. W tych koenzymach jest zawarta potencjalna energia chemiczna, która zostaje następnie stopniowo wyzwalana a postaci ATP a łańcuchu oddechowym, w samym cyklu wyzwala się niewielka ilość energii chem.
3. Dostarcza metabolitów do biosyntezy wielu związków niezbędnych dla komórki np: kwasy: 2-oksoglutarowy, szczawiooctanowy i fumaranowy są zużywane do biosyntezy aminokwasów.
4. Bierze udział w glukoneogenezie
5. Uczestniczy w biosyntezie kwasów tłuszczowych.
2. Związki wysokoenergetyczne
Podstawą wyróżnienia zw. wysokoenerg. jest ilość energii uwalnianej w czasie ich hydrolizy; rozkład wiązań chem. niskoenergetycznych dostarcza 2-5 kcal/mol, zaś wysokoenerg. od 7 do 14 kcal/mol. Ufosforylowe zw. wysokoenerg. dzielimy na 4 grupy: 1) difosforany i trifodforany nukleozydów( ADP, ATP, GDP, GTP, UDT, UTP, CDP, CTP); 2) acylofodforany ( acylofosforan i 1,3 - bisfosforan); 3) guanidynosforany (kreatynofosforan, argininofosforan); 4) endofosforany np. fosfoenolopirogronian. Do nieufosforylowanych wysokoenerg. zw. należą wszystkie acylowe pochodne CoA np. acetylo-CoA, sukcynylo-CoA, propionylo- CoA, pochodne imidazolu np. acetyloimidazol oraz S- adenozynometionina.
3. NAD- budowa, funkcje
NAD- dinukleotyd niotynoamidoadeninowy, wyst. w formie utlenionej lub zredukowanej
Funkcje: 1) Powoduje odłączenie dwóch atomów wodoru od zredukowanych substratów, przyjmując na siebie jon wodorowy, z równoczesnym uwolnieniem protonu. Przekształca się z formy utlenionej (NAD) a zredukowaną (NADH); 2) Uczestniczy w oksydacjyjnej deaminacji waliny i lecytyny; 3) Główny koenzym dehydrogenaz beztlenowych
[Cząsteczka NAD jest dinukleotydem składającym się z adenozyno-5'-monofosforanu i nukleotydu nikotynamidowego połączonych ze sobą wiązaniem bezwodnikowym. Cząsteczka NAD+ wiąże jeden proton i dwa elektrony. Miejscem ich działania jest amid kwasu nikotynowego. Drugi proton pozostaje w środowisku reakcji. Zredukowany NAD+ (NADH) przekazuje proton i elektrony na mitochondrialny łańcuch oddechowy, gdzie poprzez wiele ogniw pośrednich są one przekazywane na tlen, tworząc H2O. Procesowi temu towarzyszy powstawanie energii magazynowanej w postaci ATP.]
wzór
4. Składniki kwasów nukleinowych
Podstawową jednostką w budowie kwasów nukleinowych są nukleotydy. Składają się one z zasady azotowej, cukru i jednej lub więcej grup fosforanowych. Zasadą azotową jest pochodna puryny lub pirymidyny. W kwasach nukleinowych wyst. dwie główne puryny: adenina i guanina oraz trzy główne pirymidyny: cytozyna, tymina i uracyl. Nukleozyd skł. się z zasady purynowej lub pirymidynowej związanej z pentozą. Pentoza jest D- rybozą (RNA) lub deoksyrybozą (DNA). Najważniejszymi rybonukleozydami są: adenozyna, guanozyna, yrydyna, cytozyna,naatomiast najważniejsze doksyrybonukleozydy to: deoksyadenozyna, deoksyguanozyna, deoksytymidyna i deoksycytydyna.
5. Endogenne powstawanie wody
Woda wytwarza się w organizmie w wyniku katabolizmu składników energetycznych Na każde 100 kcal wytworzonej z tych składników energii powstaje około 14 cm1 wody. Najwięcej wody powstaje przy "spalaniu" tłuszczów (1,07 g H2O/g), a następnie węglowodanów (0,56 g H2O/g) W przemianach katabolicznych białek oprócz wody (0,39 g H2O/g) i dwutlenku węgla powstają związki azotowe, do których wydalenia przez nerki potrzeba ponad 2 razy więcej wody niż wyzwala się w wyniku przemian.
6. Mutacje genowe a mechanizmy naprawcze
Mutacje mogą powstawać samoistnie lub pod wpływem czynników mutagennych, czyli mogą być wywoływane przez człowieka - indukowane. Mogą przejawiać się efektami fenotypowymi dużymi lub nieznacznymi. Mutacje można podzielić ze względu na: 1) miejsce występowania: a) somatyczne (są niedziedziczne, dotyczą komórek ciała) b) generatywne( są dziedziczne, dotyczą gamet); 2) materiał genetyczny: a) mutacje genowe (obejmują krótki odcinek DNA i dotyczą zmian sekwencji nukleotydów o obrębie genu ) b) mutacje chromosomowe (dotyczą zmian w strukturze chromosomów) c) mutacje genomowe (dotyczą zmian liczby chromosomów)
Do mutacji genowych należy: a) tranzycja - zmiana zasady purynowej w purynową i pirymidynowej w pirymidynową b) transwersja - zmiana zasady purynowej w pirymidynową i odwrotnie c) delecja- wypadnięcie jednego nukleotydu d) insercja- wstawienie nowego nukleotydu w łańcuch DNA. W wyniku mutacji genowych powstaje nowy allel genu. U organizmów haploidalnych( np. Bakterii) będzie to zauważalne fenotypowo, natomiast u organizmów diploidalnych może się przejawiać w powstającej heterozygocie. Mutacje genowe wywołują następujące choroby: 1) albinizm ( bielactwo wrodzone, mutacja recesywna ); 2) fenyloketonuria ( mutacja recesywna objawiająca się zaburzeniami w rozwoju umysłowym, zaburzeniami ruchu ); 3) alkaptomuria ( mutacja recesywna, objawami są m.in. Czrne zabarwienie moczu i stany zapalne różnych narządów oraz ciemnienie skóry ); 4) anemia sierpowata ( hemoglobina ma słabe powinowactwo do tlenu a sierpowate krwinki łatwo ulegają zniszczeniu, mutacja recesywna ); 5) pląsawica Hunginktona ( mutacja dominująca, której objawem są m.in. Zaburzenia ruchowe i postępujące zmiany zwyrodnieniowe układu nerwowego w 25-45 roku życia, z upośledzeniem umysłowym )
Do mutacji chromosomowych należy: a) deficjencja- wypadnięcie większego odcinka z chromosomami; b) inwersja - odwrócenie fragmentu chromosomu obrót o 180 st. (duplikacja- podwojenie odcinka z genami, ale gdy został dołączony odcinek z chromosomami homologicznymi; Translokacja- do chromomosomu homologicznego zostaje przyłączony inny chromosom)
Naprawa DNA może odbywać się m.in. przez wycinanie np. uracyl wytworzony z cytozyny przez deaminację może być wycięty i zastąpiony przez cytozynę dzięki działaniu po sobie kilku enzymów( głónie polimerazy i ligazy)
7. Hormony steroidowe
Wśród hormonów seroidowych rozróżniamy: hormony nadnerczy, progestyny, androgeny, estrogeny. Prekursorem steroidów nadnerczowych i gonadalnych jest cholesterol. Hormony nadnerczy : a) glikokortykoidy- kortykosteron i kortyzol; b) mineralokortykoidy - aldosteron. Hormony męskie ( androgeny)- testosteron, androsteron. Hormony żeńskie- progesteron, estron, estriadol.
8. FAD
FAD, dinukleotyd flawinoadeninowy - koenzym pełniący funkcję przenośnika elektronów i protonów (wodoru). Złożony z mononukleotydu flawinowego (FMN) (pochodnej ryboflawiny) i kwasu adenozynomonofosforowego (AMP). Jest koenzymem oksydoreduktaz, przenosi dwa protony i dwa elektrony, w efekcie czego utleniona forma FAD przechodzi odwracalnie w formę zredukowaną FADH2. Katalizuje m. in przemiany oksydoredukcyjne: a) większości aminokwasów przez iminokwasy do ketokwasów; b) aktywnych nasyconych kwasów tłuszczowych w nienasycone.
wzór
9. Co to jest łańcuch spalań komórkowych i jaki jest jego sens biologiczny?
Łańcuch oddechowy inaczej łańcuch transportu elektronów - jeden z etapów oddychania komórkowego. Elektrony są transportowane z NADH do tlenu przez łańcuch transportu elektronów (określany również jako łańcuch oddechowy). NADH przenosi elektrony do dehydrogenazy NADH, dużego kompleksu białkowego zawierającego FMN i dwa typy centrów żelazowo-siarkowych (Fe-S) umieszczonych w białkach żelazowo-siarkowych. FMN przyjmuje elektrony przechodząc w FMNH2 i przekazuje je dalej do centrum Fe-S, gdzie atom żelaza odbiera i oddaje elektrony oscylując między stanem Fe³(+) a stanem Fe²(+). Z dehydrogenazy NADH elektrony są przenoszone do ubichinonu (koenzym Q, CoQ), przekształcają go w ubichinol (czyli CoQH2) i przechodzą dalej do kompleksu cytochromów bc1. Ten ostatni obejmuje cytochrom b i cytochrom c1, a także białko Fe-S. Każdy cytochrom zawiera grupę hemową z umieszczonym w centrum atomem żelaza, który w trakcie przyjmowania elektronu przechodzi ze stanu Fe³(+) do stanu Fe²(+). Po oddaniu elektronu do następnego przenośnika atom żelaza powraca do stanu Fe³(+). Kompleks cytochromów bc1 przenosi elektrony do cytochromu c, który z kolei przekazuje je do oksydazy cytochromowej, kompleksu zawierającego dwa cytochromy (cytochroma i cytochrom a3), związane z dwoma atomami miedzi (odpowiednio Cu A i Cu B). Podczas przenoszenia elektronów atomy miedzi oscylują między stanem Cu²(+) a stanem Cu(+). W końcu oksydaza cytochromowa przenosi cztery elektrony do tlenu cząsteczkowego, z utworzeniem dwóch cząsteczek wody.
BIAŁKA I AMINOKWASY
1. Aminokwasy egzogenne
Aminokwasy egzogenne nazywane też aminokwasami niezbędnymi - jest to grupa aminokwasów, które nie mogą być syntetyzowane w organizmie zwierzęcym i muszą być dostarczane w pożywieniu, w przeciwieństwie do aminokwasów endogennych. Żywienie pokarmami ubogimi w aminkowasy niezbędne może doprowadzić do zaburzeń chorobowych. Do aminkowasów niezbędnych dla człowieka zalicza się 8 aminokwasów z dwoma dodatkowymi (histydyna i arginina) u dzieci. fenyloalanina (Phe),izoleucyna (Ile),leucyna (Leu), lizyna (Lys), metionina (Met), treonina (Thr), tryptofan (Trp), walina (Val), histydyna (His), arginina (Arg)
2. Procesy deaminacji, transaminacji i dekarboksylacji
Dezaminacja - proces odrywania grup aminowych od cząsteczek związków organicznych (np aminokwasów). W wyniku reakcji powstaje ketokwas będący szkieletem węglowym oraz amoniak. Jest to pierwszy proces związany z degradacją aminokwasu umożliwijący późniejsze wykorzystanie aminokwasu jako substratu oddechowego
wzory z xero
Proces transaminacji jest katalizowany przez odpowiednie aminotransferazy, polega na enzymatycznej wymianie grupy aminowej pomiędzy 2-aminokwasem i 2- oksokwasem bez uwalniania do środowiska amoniaku. Koenzymem transaminaz jest fosforan pirydoksalu, który przechodzi odwracalnie w fosforan pirydoksaminy.
wzory
Dekaroksylacja ze względu na obecność grupy karboksylowej aminokwasy mogą ulegać dekarboksylacji tracąc CO2. Dekarboksylacja może być pierwotna lub wtórna. W wyniku dekarboksylacji powstają następujące związki: z aminokwasów obojętnych- monoaminy pierwszorzędowe; z aminokwasów zasadowych - oligoaminy; z aminokwasów kwaśnych - aminokwasy obojętne. Dekarboksylacja prowadzi do wytworzenia tzw. amin biogennych- związków o dużej aktywności biologicznej. Wiele z nich przejawia działanie silnie farmakologiczne inne odgrywają rolę jako prekursory hormonów i jako składniki koenzymów orza innych ważnych biologicznie substancji. Enzymy katalizujące ten proces to dehydrogenazy, a najważniejszą z nich jest dehydrogenaza glutaminianowa.
wzory
3. Struktury białkowe- I, II, III i IV rzędowe
Sekwencja aminokwasów - liniowy układ aminokwasów w łańcuchu białkowym zgodny z kodem genetycznym, stanowiący jego pierwszorzędową strukturę.
Struktura drugorzędowa białka - sposób przestrzennego ułożenia łańcuchów polipeptydowych białek na skutek powstawania spontanicznych układów wewnątrzcząsteczkowych wiązań wodorowych. Na ogół łańcuchy polipeptydowe białek układają się w kształt helisy (układ α) lub lameli (układ β).
Strukturę trzeciorzedową białka lub jego podjednostki określa układ w przestrzeni wszystkich jego atomów, bez uwzględniania zależności od sąsiednich cząsteczek. Warunkują ją różne wiązania chemiczne np.: a) Wiązania dwusiarczkowe (mostki disulfidowe) - należą one do najsilnieszych wiązań między resztami aminokwasów. Powstają w wyniku odwodornienia grup tiolowych -SH dwóch cystein znajdujących się w tym samym łańcuchu albo w dwóch łańcuchach polipeptydowych. Wiązania te nadają trwałość strukturze trzeciorzędowej; b) Odziaływania jonowe - mogą występować między grupami aminowymi lub guanidynowymi łańcuchów bocznych aminokwasów zasadowych, a grupami karboksylowymi aminokwasów kwaśnych (Asp, Glu).
Pojęcie Struktury czwartorzędowej cząsteczki białka dotyczy białek złożonych z kilku podjednostek (osobnych łańcuchów polipeptydowych), niepołączonych kowalencyjnie. Jest to sposób połączenia się tych podjednostek w jedną, większą całość, stanowiącą aktywne białko.
4. Trawienie białek
W trawieniu białek biorą udział proteazy żołądkowe, trzustkowe i jelitowe. Enzymy te powstające w trzustce i żołądku wydzielane są w nieaktywnej, prekursorowej postaci. W przeciwnym razie strawiłyby narząd, w którym powstały, składający się przecież z białka. Przypomnijmy, że w żołądku działa pepsyna, z kolei trzustka wydziela trypsynę, chymotrypsynę, elastazę i karboksypeptydazy (wszystkie w postaci nieaktywnej). Na koniec do "akcji" wkraczają enzymy jelitowe, zawarte w tzw. rąbku szczoteczkowym komórek błony śluzowej jelita. Ostatecznie "na placu boju" pozostają aminokwasy - "cegiełki", z których składają się białka. Aminokwasy są podobnie jak glukoza na tyle ważne dla organizmu, że "opłaca" się mu wydatkować na ich wchłanianie energię. Dzięki temu proces ten zachodzi bardzo szybko.
5. Biosynteza białka
Biosynteza białka to proces doprowadzający do wytworzenia w pełni funkcjonalnych cząsteczek białek. Proces ten ma miejsce stale w każdej żywej komórce, oprócz erytrocytów człowieka nie posiadających jąder (co uniemożliwia transkrypcję). Informacja o strukturze danego białka jest zapisana w genach. W trakcie procesów syntezy białka, informacja pochodząca z genów, zakodowana w nici DNA, musi zostać odczytana i na jej podstawie tworzy się łańcuch aminokwasów o określonej kolejności. Sekwencja aminokwasów decyduje w głównej mierze o właściwościach białka, czyli o tym czy będzie to np. składnik hemoglobiny, enzym trawienny, czy też białko budujące tkankę łączną, lub też immunoglobulina - białko odpornościowe. Synteza białka jest to procesem wieloetapowym, na który składają się: 1) transkrypcja - przepisanie informacji z DNA na RNA, proces ten odbywa się w jądrze komórkowym; 2) translacja - RNA przedostaje się z jądra komórkowego do cytoplazmy komórki i tam następuje odkodowanie informacji zawartej w RNA i na tej podstawie tworzony jest łańcuch polipeptydowy; 3) ukształtowanie struktury drugo- i trzeciorzędowej, czyli odpowiednie zwinięcie się łańcucha aminokwasów
potranslacyjna modyfikacja cząsteczki białkowej, ten etap nie zawsze występuje, polega najczęściej na doczepieniu do cząsteczki białka różnych cukrów złożonych (glikozylacja)
6. Translacja
Translacja to proces syntezy łańcucha polipeptydowego białek na matrycy mRNA. Proces ten katalizowany jest przez enzymy zawarte w dużej podjednostce rybosomu. Translacja polega na interpretacji informacji zawartej w kolejności ułożenia nukleotydów mRNA, zgodnie z zasadami kodu genetycznego, na kolejność ułożenia reszt aminokwasowych w białku. Translacja odbywa się w kierunku od 5' do 3' mRNA, a syntetyzowane białko powstaje od końca aminowego do karboksylowego. Proces składa się z trzech etapów: inicjacji, elongacji i terminacji. Zakończenie odbywa się gdy w mRNA zostanie napotkany nonsensowny (stop) kodon nie odpowiadający żadnemu tRNA.
7. Związki uczestniczące w procesie translacji
1) tRNA- transportujący, transferowy RNA, zadaniem tRNA jest dostarczenie odpowiednich aminokwasów do syntezy białka. Cząsteczki kwasu rybonukleinowego (RNA), których zadaniem jest przyłączanie wolnych aminokwasów w cytoplazmie i transportowanie ich do rybosomów, gdzie w trakcie procesu translacji zostają włączone do powstającego łańcucha polipeptydowego.
2) syntetaza aminoacylo-tRNA - aktywacja aminokwasu i utworzenie aminoacylo- tRNA odbywa się na drodze dwustopniowej reakcji, która jest katalizowana przez ten enzym, mając dwa centra aktywne w sposób bezbłędny rozpoznaje zarówno łańcuch boczny aminokwasu jak i strukturę odpowiedniego tRNA.
8. Cechy kody genetycznego
Kod genetyczny to odwzorowanie dzięki któremu informacja genetyczna, zawarta w sekwencji nukleotydów kwasu nukleinowego (DNA lub RNA), przetłumaczana jest na kolejność (sekwencję) aminokwasów w białkach. Kod ten ma następujące właściwości: 1) Jednemu aminokwasowi w białku odpowiada jedna trójka nukleotydów (triplet, inaczej kodon) w DNA lub RNA. Kod genetyczny jest więc kodem trójkowym; 2) Prawie wszystkie aminokwasy kodowane są przez kilka różnych kodonów, różniących się na ogół trzecim nukleotydem. Np. lizyna kodowana jest przez kodon AAA i AAG. Dzięki temu część zmian informacji genetycznej w wyniku mutacji nie znajduje swojego odbicia w sekwencji aminokwasów. Kod genetyczny jest więc zdegenerowany; 3) Każdy nukleotyd w obrębie sekwencji kodujących wchodzi w skład jakiegoś kodonu i tylko jednego kodonu - kod genetyczny jest bezprzecinkowy. Ponadto kodony nie zachodzą na siebie - np. biorąc pod uwagę powyższe dane, cząsteczka AAGAAA koduje sekwencję dwupeptydu lizylolizyny. Taki sam dwupeptyd może być zakodowany jako AAAAAA; 4) Trzem kodonom nie odpowiadają żadne aminokwasy. Kodony te, zwane nonsensownymi albo kodonami STOP, kodują polecenie przerwania biosyntezy peptydu (białka). Jeśli więc powyższa sekwencja miałaby oznaczać końcowy odcinek jakiegoś białka to mogłaby mieć postać AAAAAAUAA, gdzie UAA jest kodonem STOP (w mRNA, jego odpowiednikiem w DNA jest TAA. Jednak w pewnych białkach kodony te, w zależności od sekwencji sygnałowej w mRNA, kodują selenocysteinę i pirolizynę.
Powyższe zasady są przestrzegane dość dokładnie przez układy biosyntezy białek u wszystkich organizmów - kod genetyczny jest uniwersalny.
9. Replikacja DNA
Replikacja DNA to proces, w którym podwójna nić DNA ulega skopiowaniu. Replikacja jest semikonserwatywna (półzachowawcza) - w każdej z dwóch uzyskanych podwójnych nici DNA będzie jedna nić macierzysta i jedna nowa. Nie licząc niewielkiego prawdopodobieństwa (ok. 1 błąd na 109 nukleotydów, dla porównania błąd transkrypcji - 1 na 104) wystąpienia błędu obie cząsteczki DNA będą identyczne.Substratami tego procesu są: a) matryca DNA; b) trifosforany deoksyrybonukleotydów (dNTP); c) ATP - energia dla helikaz; W procesie tym stwierdzono wiele aktywności enzymatycznych (udział enzymów) tj.: 1) helikazy - rozrywają wiązania wodorowe między nićmi matrycowego DNA, rozkręcając helisę i umożliwiając rozpoczęcie procesu; 2) prymaza - syntetyzuje starter; 3) polimerazy DNA - polimeryzuje zgodnie z zasadą komplementarności fosforany deoksyrybonukleotydów; 4)egzonukleaza - usuwa startery RNA z nici; 5)ligaza DNA - uzupełnia brakujące wiązania fosfodiestrowe w szkielecie nowo-zsyntezowanej nici DNA; 6) rożne enzymy pomocnicze
10. tRNA- charakt. chemiczna i funkcja biol.
tRNA- transportujący, transferowy RNA, zadaniem tRNA jest dostarczenie odpowiednich aminokwasów do syntezy białka. Cząsteczki kwasu rybonukleinowego (RNA), których zadaniem jest przyłączanie wolnych aminokwasów w cytoplazmie i transportowanie ich do rybosomów, gdzie w trakcie procesu translacji zostają włączone do powstającego łańcucha polipeptydowego. Cząsteczki tRNA zbudowane są z ok. 74 do 95 nukleotydów. W skład cząsteczki wchodzą również zmodyfikowane zasady azotowe (pseudourydyna i dihydrourydyna). W każdej komórce organizmu znajduje się przynajmniej 20 rodzajów cząsteczek tRNA i przynajmniej jedna odpowiada swoistemu aminokwasowi. Wzór strukturalny tRNA ma budowę palczastą i przyjmuje kształt czterolistnej koniczyny w którym można wyróżnić 4 ramiona. Każde z tych ramion pełni inną funkcję. tRNA stanowi 10—12% ogólnej ilości kwasów rybonukleinowych w komórce i charakteryzuje się wśród innych rodzajów RNA najmniejszą masą cząsteczkową, zawartą w granicach od 25 do 30 kDa. tRNA cechuje wysoka specyficzność w stosunku do aminokwasów. Każdy z aminokwasów syntetyzowanego białka może być transportowany przez jeden, a niektóre przez kilka różnych tRNA. Cząsteczki tRNA występują w komórkach w stanie wolnym bądź też związane ze specyficznym aminokwasem
11. mRNA i rRNA
mRNA - matrycowy (lub informacyjny) RNA (z ang. messengerRNA). Cząsteczki kwasu rybonukleinowego zawierające przepisaną z genów, zakodowaną informację genetyczną o sekwencji poszczególnych polipeptydów. Cząsteczki te po przyłączeniu się do rybosomów stanowią matrycę - kolejne trójki nukleotydów mRNA (tzw. kodony) są rozpoznawane przez odpowiednie fragmenty (tzw. antykodony) cząsteczek transportujących aminokwasy (tRNA), dzięki czemu powstaje właściwa sekwencja peptydu. mRNA u procariota ma od końca 5' sekwencje liderowe, nie kodujące, kodon inicjujący syntezę białek AUG (metionina- aminokwas zapoczątkowujący każdą biosyntezę białka) a następnie rejon kodujący (kodony) Zakończony kodonem terminacyjnym UAA, UAG, UGA (nie koduje żadnego białka) mRNA u eucariota powstaje podczas transkrypcji jako heterogenne hnRNA, a następnie ulega obróbce posttranskrypcyjnej podczas której wycinane są introny przy pomocy endonukleaz i składane przy ligaz.
rRNA - rybosomalny, rybosomowy RNA (z ang. Ribosomal RNA). Cząsteczki kwasu rybonukleinowego wchodzące w skład rybosomów. Rybosomowy RNA (lub rybosomalny RNA) bierze udział w procesie biosyntezy polipeptydów. Powstaje w wyniku procesu transkrypcji DNA. rRNA występuje w jądrze (gł. jąderku) i rybosomach. Jego struktura przestrzenna jest bardzo rozbudowana, tworzy go 100-4500 nukleotydów. W jego budowie występują zarówno fragmenty dwuniciowej spirali jak i łańcuchów jednoniciowych. rRNA stanowi ok. 80% całkowitego RNA komórki. Rybosomalny RNA występuje w kilku rodzajach (najczęściej trzech u prokariontów i czterech u eukariontów). Rybosomalnym RNA towarzyszą w rybosomach liczne białka rybosomowe.
12. Budowa i działanie insuliny i glukagonu
Insulina to anaboliczny hormon peptydowy o działaniu ogólnoustrojowym, odgrywający zasadniczą rolę przede wszystkim w metabolizmie węglowodanów, lecz także białek i tłuszczów.
Nazwa insulina z łac. insula - wyspa, pochodzi od wysepek Langerhansa trzustki, gdzie insulina jest produkowana. Insulina produkowana jest przez komórki β (komórki B) wysp trzustki. Najważniejszym bodźcem do produkcji insuliny jest poposiłkowe zwiększenie stężenia glukozy we krwi. Dzięki zwiększeniu wytwarzania insuliny i jej wpływowi na komórki efektorowe (miocyty, adipocyty, hepatocyty) zwiększa transport glukozy do wnętrza komórek, co obniża poziom glukozy we krwi. Działanie insuliny podlega homeostatycznej kontroli licznych mechanizmów, głównie hormonalnych. Cząsteczka insuliny składa się z 2 łańcuchów polipeptydowych A i B połączonych ze sobą dwoma mostkami disiarczkowymi: łańcuch A zawiera 21, a łańcuch B - 30 aminokwasów.
Glukagon (ATC: H 04 AA 01) - jest polipeptydowym hormonem wytwarzanym przez komórki A (α) wysp trzustkowych. Hormon ten ma znaczenie w gospodarce węglowodanowej; wykazuje działanie antagonistycznie w stosunku do insuliny, które przede wszystkim objawia się zwiększeniem stężenia glukozy we krwi. Wzmaga on procesy glukoneogenezy i glikogenolizy oraz utleniania kwasów tłuszczowych. Struktura pierwszorzędowa cząsteczki glukagonu: NH2-His-Ser-Gln-Gly-Thr- Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu- Asp-Ser-Arg-Arg-Ala-Gln-Asp- Phe-Val-Gln-Trp-Leu-Met-Asn-Thr-COOH. Glukagon wydzielony przez wysepki trzustkowe dostaje się do wątroby przez żyłę wrotną i tam prawie całkowicie jest pochłaniany, a do krwi krążenia ogólnego przedostaje się tylko jego niewielka ilość. W stanie głodu zwiększa się wydzielanie glukagonu, co powoduje zachowanie prawidłowego stężenia glukozy we krwi, co jest niezwykle ważne dla zachowania właściwego funkcjonowania mózgu. Glukagon i insulina należą do podstawowych regulatorów przemian węglowodanowych w organizmie, wpływają na aktywny transport przez błonę komórkową i biosyntezę białek i tłuszczów w komórkach.
13. Glutation
Glutation (GSH, gamma-glutamylo-cysteinyloglicyna) - organiczny związek chemiczny, trójpeptyd zbudowany z reszt aminokwasowych kwasu glutaminowego, cysteiny i glicyny. Występuje we wszystkich organizmach roślinnych i zwierzęcych, jest najbardziej rozpowszechnionym i najobfitszym tiolem wewnątrzkomórkowym (składnikiem zawierającym siarkę) występującym w komórkach ssaków oraz drobnocząsteczkowym tripeptydem budującym żywe komórki. Właściwości: Ma właściwości przeciwutleniające, które przejawiają się w odtwarzaniu grup tiolowych -SH w białkach, w których uległy one utlenieniu do grup sulfonowych -SO3H lub wiązań disiarczkowych -S-S-. Dzięki odwracalnej reakcji odrywania lub przyłączania elektronów glutation działa w ustroju jako układ oksydo-redukcyjny chroniący grupy -SH białek przed utlenieniem. Bierze też udział w procesie oddychania i jest koenzymem niektórych enzymów oksydo-redukcyjnych. W formie zredukowanej, dzięki wolnej grupie tiolowej służy do redukcji nadtlenków (np. nadtlenku wodoru). Wyłapuje reaktywne czynniki elektrofilowe ochraniając komórki przed uszkodzeniem ze strony toksyn.
wzór
14. Cykl mocznikowy
Biosynteza mocznika, czyli proces ureogenezy jest podstawowym procesem usuwania z organizmu ssaków azotu pochodzącego z przemiany azotowej. Biosynteza mocznika zachodzi głównie w wątrobie gdyż tylko ten narząd zawiera wszystkie potrzebne do jej przebiegu enzymy. w nerkach występują tylko niektóre enzymy tego cyklu. Mocznik powstaje a argininy, która pod wpływem arginazy przechodzi w ornitynę, przy czym zostaje odłączony mocznik. Proces ten wymaga dopływu energii, której źródłem są 3 cząsteczki ATP. 2 są zużywane do syntezy karbamoilofosforanu, a 1 do syntezy sykcynyloargininy. Ilość wydalanego na dobę mocznika jest różna i zależy od wielkości organizmu. U człowieka mocz pierwotny- 120 litrów, mocz ostateczny1-1,5 litra na dobę.
15. Dekarboksylacja - przebieg enzymatyczny procesu
Dekarboksylację aminokwasów kwaśnych powodują dwie odrębne dekarboksylazy; jedna z nich działa na grupę karboksylową położoną w sąsiedztwie grupy aminowej, druga- na końcową grupę karboksylową. Enzymy katalizujące odłączenie grupy karboksylowej od aminokwasów, zwane dekarboksylazami aminokwasowymi, są na ogół swoiste w stosunku do określonych l- aminokwasów.
16. Losy grupy aminowej po deaminacji
a) jest włączana do cyklu ornitynowego ( człowiek,inne ssaki)
b) aminacja ά- ketokwasów, wytwarzanie aminokwasów endogennych
c) synteza asparaginy i glutaminy ( stanowią „magazyn” grup aminowych)
17. Biologicznie ważne oligopeptydy i ich działanie
Glutation- uczestniczy w regulowaniu właściwości oksydo - redukcyjnych cytoplazmy, koenzym niektórych izomeraz, koenzym w niektórych reakcjach detoksykacji zachodzących w wątrobie. Chroni erytrocyty przed uszkodzeniem przez nadtlenek wodoru. Uczestniczy w redukcji mostków disiarczkowych w białkach, wpływając w ten sposób na aktywność enzymów
Karnozyna i anseryna- występują w mięśniach, biorą udział w utrzymaniu pojemności buforowej, przyspieszają proces rozpadu węglowodanów w mięśniach, stabilizują aktywność enzymów
Oksytocyna- hormon tylnego płata przysadki mózgowej, stymuluje skurcze mięśni gładkich i włókien mięśniowych znajdujących się wokół gruczołu mlecznego.
Wazopresyna- hormon tylnego płata przysadki mózgowej, bierze udział a regulacji zawartości wody (przyczynia się do resorpcji wody w kanalikach nerwowych), działa na mięśnie gładkie naczyń krwionośnych.
Angiostatyna- powstaje we krwi przy udziale reniny, np. przy czasowym niedostatecznym zaopatrzeniu nerek w tlen, powoduje podwyższenie ciśnienia krwi.
ACTH- hormon przedniego płata przysadki mózgowej, stymuluje aktywność kory nadnerczy
Glukagon- hormon powstający w α-komórkach wysepek Langerhansa, powoduje podwyższenie zawartości glukozy we krwi na drodze mobilizacji glikogenu wątrobowego.
Insulina- hormon powstający w β-komórkach wysepek Langerhansa, powoduje obniżenie zawartości glukozy we krwi na drodze zwiększenia wykorzystania glukozy przez tkanki.
CUKRY
1. Synteza i rozkład glikogenu
Glikogen - biopolimer - polisacharyd (wielocukier) zbudowany z glukozy i gromadzony w wątrobie i (w mniejszym stopniu) w tkance mięśniowej. Jest głównym wielocukrowcem stanowiącym materiał zapasowy w komórkach zwierzęcych. Ma strukturę podobną do amylopektyny, tylko, że jego cząsteczki są bardziej rozgałęzione i jego łańcuchy są krótsze. Rozgałęzienie następuje co 8-12 reszt glukozy. W tych narządach glikogen w miarę potrzeby może być szybko rozkładany do glukozy. Do najbogatszych w ten materiał zapasowy tkanek należą granulocyty, mięśnie szkieletowe wątroby, mięśnie gładkie, mięsień sercowy i mózg. Rozkład glikogenu przebiega dwoma torami: fosforolitycznym i hydrolitycznym. Synteza glikogenu:Aktywną podjednostką do syntezy glikogenu jest UDP-glukoza, powstająca w reakcji katalizowanej przez pirofosforylazę UDP-glukozy. Zaktywowane podjednostki przenoszone są dzięki aktywności syntazy glikogenowej na grupę hydroksylową C-4 wydłużającego się łańcucha glikogenu. Dołączanie następuje do łańcuszków mających, co najmniej 4 reszty glukozy, dlatego ważną rolę pełni białko inicjator- glikogenina, zawierające reszty glukozy połączone wiązaniami alfa-1,4-glikozydowymi. Wzajemna interakcja tych dwóch białek ogranicza również rozmiar ziaren. Rozgałęzienia powstają z udziałem enzymu rozgałęziającego i powodują zwiększenie rozpuszczalności ziaren. Syntaza glikogenowa występuje w dwóch formach a i b. Forma a jest zdefosforylowana, i jest bardziej aktywna, to znaczy, że to ona w głównej mierze przeprowadza syntezę glikogenu. Natomiast forma b powstaje na skutek fosforylacji przez kinazę białkową A, syntazy glikogenowej a. Kinaza białkowa A ulega aktywacji w szlaku inicjowanym poprzez aktywacje cyklazy adenylowej przez glukagon ( lub epinefrynę) i jest zdecydowanie mniej aktywna. Rozkład glikogenu: W wyniku rozkładu glikogenu przez fosforylazę glikogenową, otrzymujemy łańcuch glikogenu skrócony o jedna resztę, oraz glukozo-1-fosforan. By wszedł on w przemiany metaboliczne przekształcany jest do glukozo-6-fosforanu przez fosfoglukomutazę. Ufosforylowana glukoza trudno wychodzi z komórki, co jest korzystne w mięśniach szkieletowych, które potrzebują jej na swoją działalność. Natomiast wątroba, która reguluje jej stężenie we krwi zawiera glukozo-6-fosfatazę, która przeprowadza usunięcie reszty fosforanowej, umożliwiając wejście glukozy do krwioobiegu, i regulacje jej stężenia. Fosforylaza glikogenu występuje także w dwóch formach a i b, które ulegają przemianie jedna w drugą na skutek fosforylacji i defosforylacji. Forma a jest ufosforylowana przez zaktywowaną kinazę fosforylazową (szlak aktywacji włączany przez glukagon, lub epinefrynę), i uczestniczy w rozkładzie glikogenu. Natomiast forma b nie jest ufosforylowana i jest mniej aktywna
2. Glikoneogenaza- co to jest?
glukoneogeneza, szlak syntezy glukozy z prekursorów niecukrowych, np. mleczanu, pirogronianu, aminokwasów, zachodzący głównie w wątrobie i w mniejszym stopniu w nerkach; g. jest zlokalizowana w cytozolu, matriks mitochondrialnej i gładkim retikulum endoplazmatycznym; funkcja g. polega na podtrzymywaniu poziomu glukozy we krwi podczas głodowania i intensywnego wysiłku fizycznego.
3. Kwas pirogronowy i jego dekarboksylacja
Kwas pirogronowy (nazwa systematyczna: kwas 2-oksopropanowy, wzór ogólny CH3COCOOH) to związek organiczny z grupy α-ketokwasów. Kwas pirogronowy powstaje jako produkt metabolizmu węglowodanów, w trakcie procesu nazywanego glikolizą. W środowisku komórki występuje w formie zdysocjowanej jako jon pirogronianowy (pirogronian). Cząsteczka glukozy pęka przechodząc w dwa jony pirogronianowe. Następnie pirogronian jest wykorzystywany przez organizm jako źródło energii na dwa sposoby: a) przy wystarczającej ilości tlenu zachodzi cykl Krebsa, w wyniku którego zostaje on rozłożony do wody i dwutlenku węgla; b) przy niewystarczającej ilości tlenu jest rozkładany do kwasu mlekowego w przypadku zwierząt i etanolu w przypadku roślin i bakterii. Pirogronian jest również wykorzystywany w organizmie do syntezy glukozy - jest podstawowym substratem w procesie glukoneogenezy.
Oksydacyjna dekarboksylacja kwasu pirogronowego - Przekształcenie cząsteczki kwasu pirogronowego do acetylokoenzymu A. Zachodzi tylko w warunkach tlenowych. Uwolniony wodór jest przenoszony na koenzym NAD i następnie wchodzi do łańcucha oddechowego. Jednocześnie wydziela się cząsteczka dwutlenku węgla (stąd nazwa 'dekarboksylacja')
4. Dwucukry biologicznie ważne
Disacharydy, dwucukry - węglowodany składające się z dwóch jednostek monosacharydowych. Hydroliza cząsteczki dwucukru prowadzi do utworzenia dwóch cząsteczek cukru prostego. Są aktywne osmotycznie i mają słodki smak. Do disacharydów należą: a) celobioza; b) maltoza; c) sacharoza; d) laktoza. Celobioza (C12H22O11) - dwucukier, zbudowany z dwóch cząsteczek D-glukozy, połączonych wiązaniem β-1,4-glikozydowym. Jest to jednostka strukturalna celulozy i produkt jej hydrolizy. Jest to dwucukier redukujący, nie występujący powszechnie w stanie wolnym w roślinach, lecz jest przejściowym produktem degradacji celulozy. Jest sacharydem nieprzyswajalnym przez człowieka. Maltoza zwana inaczej cukier słodowy. Jest to dwucukier zbudowany z dwóch cząsteczek glukozy, połączonych wiązaniem α-1,4 glikozydowym. Fermentuje. Otrzymywany przez hydrolizę skrobi, stosowany jako środek słodzący, do pożywek bakteriologicznych, stabilizator wielosiarczków. Występuje w słodzie i pośrednich produktach przemysłu fermentacyjnego. Sacharoza (inaczej cukroza, O-β-D-Fruf-(2→1)-α-D-Glcp) - węglowodan, disacharyd, złożony z fruktozy i glukozy, będący zasadniczym składnikiem cukru trzcinowego i cukru buraczanego. W temperaturze pokojowej sacharoza jest bezbarwnym, krystaliczny ciałem stałym. Jest nietoksyczna, ma słodki smak i bardzo dobrze rozpuszcza się w wodzie. Temperatura topnienia: 186 °C. Należy do cukrów nieredukujących, o czym świadczy negatywny wynik próby Trommera. Laktoza (4-O-β-D-galaktopiranozylo-D-glukopiranoza) zwana cukrem mlecznym (z łac. lac - mleko) jest dwucukrem, zbudowanym z D-galaktozy i D-glukozy, występującym w mleku ssaków. Zawartość laktozy: mleko krowie - 4,5%; mleko ludzkie - 5,5-7,5%Chemicznie jest to bezbarwna substancja stała o temperaturze topnienia 225°C, rozpuszczalna w wodzie, słabo rozpuszczalna w alkoholu i nierozpuszczalna w eterze. W jelicie cienkim ssaków enzym laktaza rozkłada laktozę na cukry proste, które ulegają wchłanianiu (absorpcji jelitowej).U niektórych osób dorosłych enzym ten zanika samoczynnie.
5. Resynteza glukozy z kwasu pirogronowego
Przemiana pirogronianu w fosfoenolopirogronian. Reakcja ta może przebiagać w warunkach in vitro przy znacznym stężeniu ATP, które w warunkach in vivo nie występują. Dlatego też przejście pirogronianu w fosfoenolopirogronian zachodzi drogą okrężną przy udziale mitochondriów. Pirogronian powstający w glikolizie w cytosolu zostaje przetransportowany do mitochondrium, gdzie pod wpływem karboksylazy pirogronianowej zostaje przekształcony w szczawiooctan. Ponieważ błona motochondrialna nie przepuszcza szczawiooctanu, zostaje on zredukowany przez dehydrogenazę jabłczanową do jabłczanu, który przedostaje się do cytoplazmy, gdzie cytoplazmatyczna dehydrogenaza jabłczanowa utlenia go do szczawiooctanu. Ten zaś pod wpływem karboksykinazy fosfoenolopirogronianowej i kosztem rozkładu GTP ulega dekarboksylacji i ufosforylowieniu do PEP.
6. Cukry redukujące
Cukry redukujące - są to wszystkie węglowodany, które reagują pozytywnie z odczynnikiem Fehlinga, Benedicta i Tollensa. Wszystkie monosacharydy i część polisacharydów jest cukrami redukującymi. Ich nazwa wynika z faktu, że reakcja z tymi odczynnikami polega na ich redukcji wolnymi grupami karbonylowymi (dokładnie aldehydowymi lub ketonowymi) występującymi w tych węglowodanach. Obecność tych grup możliwa jest tylko w środowisku zasadowym. Cukry posiadające grupę aldehydową nazywa się aldozami natomiast ketonową, ketozami. Grupa aldehydowa w reakcji z wcześniej wspomnianymi odczynnikami redukuje je, natomiast sama ulega utlenieniu do grupy kaboksylowej. Zaś grupa ketonowa ulega reakcji enolizacji tworząc epimery, dwie aldozy i jedną ketozę
7. Skrobia - struktura chemiczna
Skrobia - węglowodan, polisacharyd roślinny, składający się wyłącznie z merów glukozy, pełniący w roślinach rolę magazynu energii. (C6H10O5)n n=300-360; Czysta skrobia jest białą, bezpostaciową (nie jest krystaliczna), amorficzną substancją bez smaku i zapachu, nierozpuszczalną w zimnej wodzie. Skrobia hydrolizuje wyłącznie na alfa-D-glukozę, lecz nie jest jednorodnym chemicznie związkiem - składa się w rzeczywistoći z dwóch różnych polisacharydów: a) nierozgałęzionej amylozy łatwiej rozpuszczalnej w wodzie (70-80% składu skrobi)Jest ona wielocukrem - jej cząsteczki składają się z wielu reszt glukozowych połączonych ze sobą atomami tlenu; b) rozgałęzionej amylopektyny, z reguły w stosunku ilościowym (20-30% składu); rozgałęzienia powstają dzięki wiązaniom α-1,6-glikozydowym. Skrobia tworzy roztwory koloidowe. Jednoprocentowy roztwór wodny skrobi jest używany do wykrywania jodu cząsteczkowego, z którym tworzy zabarwienie niebieskie w wyniku wiązania jodu przez amylopektynę. W trakcie hydrolizy kwasowej skrobia rozpada się na coraz krótsze łańcuchy polisacharydowe tworząc kolejno: 1) amylodekstryny (barwiące się z I2 na niebiesko); 2) erytrodekstryny (barwiące się z I2 na czerwono); 3) achrodekstryny (niebarwiące się z I2); 4) maltozę i glukozę. Wykryć skrobię można za pomocą płynu Lugola, który selektywnie zabarwia ją na niebieski kolor. Alfa-amylazy (endoamylazy) rozkładają skrobię do dekstryny, a potem do maltozy i izomaltozy, występuje w ślinie. Beta-amylazy (egzoamylazy) trawią skrobię do maltozy (hydroliza co drugiego wiązania glikozydowego). W amylopektynie odcinają łańcuchy boczne (dając amylodekstrynę). Gamma-amylazy trawią skrobię do glukozy. Amylodekstryny zabarwiają się płynem Lugola na niebiesko. Erytrodekstryny pod wpływem odczynnika Lugola przybierają barwę czerwoną, natomiast achrodekstryny zabarwienia nie wykazują.
TŁUSZCZE
1. Ketogeneza
Ciała ketonowe ( acetooctan, 3- hydroksymaślan, aceton) powstają w wyniku ograniczenia utleniania acetyloCoA w cyklu Krebsa. Jak wiadomo warunkiem wejścia acetyloCoA do cyklu Krebsa jest jego połączenie się ze szczawiooctanem, który powstaje głównie w przemianie pirogronianu, a więc przemianie cukrowej. Jeżeli ta przemiana zostaje zakłócona lub gdy zapasy cukrowe ulegają wyczerpaniu np. w następstwie głodu to powstaje deficyt szczawiooctanu. Nasilony rozkład tłuszczów powoduje wzrost stężenia wolnego acetyloCoA, który nie zostaje całkowicie utleniony ponieważ jest za mało szczawiooctanu. AcetyloCoA musi być jednak usunięty gdyż na zasadzie równowagi reakcji gromadzenie go hamuje proces jego wytwarzania. Z acetyloCoA powstaje wówczas w mitochondriach wątroby przy udziale cyklu acetooctanowego, kwas octowy.
2 acetyloCoA → acetoacetyloCoA → 3- hydroksy - 3- metylo- glutaryloCoA →acetooctan→ aceton lub 3- hydroksymaślan
2. Bilans energetyczny β- oksydacji
1) W czasie każdego obrotu spirali Lynena powstają zredukowane koenzymy, które utleniają się w łańcuchu oddechowym: FAD → FADH2 - 2 ATP; NAD → NADH + H+ - 3 ATP. Zatem każdy obrót spirali to zysk energetyczny w postaci 5 ATP. 2) Na aktywację kwasu tłuszczowego zużywane jest 2 ATP. 3) Końcowe utlenianie acetyloCoA w cyklu Krebsa do CO2 i H2O - to zysk 12 ATP z każdej cząsteczki acetyloCoA. 4) Utlenianie kwasu tłuszczowego: a) parzystowęglowego np palmitynowy ( 16 atomów węgla- 7 obrotów spirali; 5 ATP x 7 obrotów = 35 ATP; 8 cząsteczek acetyloCoA x 12 ATP = 96 ATP; 131 ATP - 2 ATP [aktywacja] = 129 ATP [całkowity zysk utleniania kwasu palmitynowego]); b) nienasyconego - odejmujemy 2 ATP na każde podwójne wiązanie.
3. Spirala Lynena (β- oksydacja) - co to jest?
Jest to podstawowy proces rozkładu kwasów tłuszczowych w organizmach zwierzęcych, w czasie którego acylo-CoA (zaktywowany kwas tłuszczowy) rozpada się na odpowiednią liczbę cząsteczek acetylo-CoA (fragmenty dwuwęglowe). Chemat procesu został podany przez Lynena i dlatego znany jest pod nazwą spirali Lynena.
4.Powstawanie tłuszczów z cukrów
cukry przez glikolize do aldehydu 3P- glicerynowego: 1) przez izomeracje do fosfodyhydroksyacetonu przez redukcje do α- glicerynofosforanu i w tłuszcz; 2) do pirogronianu i dalej do acetylo-CoA z odłączeniem CO2 przez dekarboksylacje do malonylo-CoA przez kwasy tłuszczowe do tłuszczu.
5. Kwasy żółciowe- biosynteza i rola biol.
Kwasy żółciowe są syntezowane w wątrobie i są jednocześnie końcowymi produktami degradacji (rozkładu) endogennego (wewnątrzustrojowego) cholesterolu. W żółci głównie występują następujące pochodne kwasu cholanowego: a) kwas cholowy (3,7,12-trihydroksycholanowy); b) kwas deoksycholowy (3,7-di trihydroksycholanowy); c) kwas chenodeoksycholowy (3,7-dihydroksycholanowy); d) kwas litocholowy (3-hydroksycholanowy). Wśród związków steroidowych są one najlepiej rozpuszczalne w wodzie ze względu na obecność kilku hydrofilowych grup -OH oraz polarnej grupy karboksylowej. Ułatwiają rozpuszczanie się zawartego w żółci cholesterolu. Kwasy żółciowe są substancjami powierzchniowo czynnymi, mają zdolność zmniejszania napięcia powierzchniowego roztworów, a dzięki temu emulgowania tłuszczów i tworzenia szerokiej powierzchni dla rozwinięcia działalności lipazy trzustkowej - enzymu odpowiedzialnego za trawienie tłuszczów w jelicie (ponadto aktywują one ten enzym). Żółciany (czyli sole kwasów żółciowych) wywierają działanie hydrotropowe - pod ich wpływem ciała nierozpuszczalne w wodzie (np. kwasy tłuszczowe) łatwo rozpuszczają się w zawartości jelita. Kwasy żółciowe wytwarzają z kwasami tłuszczowymi połączenia kompleksowe zwane kwasami choleinowymi, które są rozpuszczalne i łatwo wchłaniają się w jelicie.
wzory
6. Kalcyferol - struktura, własności
Kalcyferole - grupa związków chemicznych, pochodnych cholesterolu, należąca do steroidów, wykazujących aktywność biologiczną specyficzną dla witaminy D. Do kalcyferoli zalicza się: a) ergokalcyferol i jego pochodne; b) cholekalcyferol i jego pochodne; kalcyferol, witamina D, ogólna nazwa grupy blisko ze sobą spokrewnionych związków steroidowych powstających z prowitamin pod wpływem promieniowania ultrafioletowego; do najważniejszych należą ergokalcyferol (witamina D2), powstająca z przekształcenia roślinnego sterolu (ergosterolu) oraz → cholekalcyferol (witamina D3), powstająca z prowitaminy (7-dehydrocholesterolu) pochodzenia zwierzęcego). [szerzej w witaminach]
7. Tokoferole
Witamina E ( C29H50O2, nazwa chemiczna: tokoferol, ATC: A 11 HA 03) - organiczny związek chemiczny, złożony fenol heterocykliczny. Związek ten zaliczany jest do witamin nierozpuszczalnych w wodzie, jest głównym przeciwutleniaczem występującym w komórkach. Rola w organizmie - tokoferol jest głównym antyoksydantem który chroni komórki przed utleniaczami. Bierze udział w dostarczaniu składników odżywczych do komórek. Wzmacnia ścianę naczyń krwionośnych oraz chroni czerwone krwinki przed przedwczesnym rozpadem. Wykorzystywana jest też do leczenia męskiej bezpłodności, zaburzeń mięśniowych, miażdżycy oraz chorób serca. Dym tytoniowy sprzyja degradacji witaminy E, która jest jednorazowa i nie może się w organizmie regenerować (wg nielicznych doniesień jednak może).
8. Lecytyny- wzór, funkcja
Lecytyny. Fosfolipidy (fosfatydylocholiny) zbudowane z glicerolu, kwasów tłuszczowych, kwasu fosforowego i 4-rzędowej zasady - choliny. Składnikami lecytyn są również fosfatydyloetanolamina, fosfatydyloseryna i fosfatydyloinozytol. Obecne między innymi w tkance nerwowej, w żółtku komórek jajowych i w soi. Lecytyny wchodzą w skład biomembran. Dostarczane wraz z pokarmem są źródłem choliny (składnik neurotransmitera acetylocholiny) i substratów do budowy struktur komórkowych. W farmacji stanowią ważny emulgator podczas produkcji leków. Preparaty lecytynowe działają ogólnie wzmacniająco (stymulujące psychofizycznie), lipotropowo (regulują stężenie i rozłożenie cholesterolu w tkankach), przeciwmiażdżycowo i regenerujące. Lecytyny są trawione przez fosfolipazy A, B, C i D. Fosfolipaza A katalizuje odłączenie nienasyconego kwasu tłuszczowego; powstaje wówczas izolecytyna. Fosfolipaza B zabiera II cząsteczkę kwasu tłuszczowego od izolecytyny, pozostawiając glicerofosforan choliny. Fosfolipaza C i D hydrolizują wiązania estrowe między alkoholem i kwasem fosforowym. Wspomniana wyżej cholina to pochodna trójmetylowa etanolaminy, to znaczy: wodorotlenek beta-hydroksyetylotrimetyloamoniowy. Biosynteza choliny w ustroju polega na dekarboksylacji seryny, a potem metylację etanolaminy.
wzory lecytyny i kefaliny
9. Sterydy
Sterydy, czyli steroidy są związkami zawierającymi rdzeń steranowy (gonanowy). Steran to cyklopentanoperhydrofenantren, zbudowany z 4 pierścieni (budowa tetracykliczna); tzw rdzeń steranowy jest więc 17-węglowy. Poszczególne związki sterydowe różnią się między sobą liczba i charakterem podstawników bocznych związanych z rdzeniem i tym samym stopniem nasycenia rdzenia. Do sterydów zalicza się hormony sterydowe, kwasy żółciowe, ekdysony, witanolidy, fitosterole, geniny glikozydów nasercowych, saponiny i alkaloidy sterydowe. Dawniej wydzielano z tej grupy sterole. Pod względem chemicznym są one sterydami, bowiem zawierają rdzeń steranowy z grupa wodorotlenową w pozycji 3 oraz łańcuch boczny w pozycji 17. Do steroli należy cholesterol. Cholesterol nie jest lipidem właściwym, ale zalicza się go do ogólnej grupy tłuszczowców.
10. Kwasy tłuszczowe 18 węglowe
Kwas stearynowy- C18H36O2 (nasycony)
Kwas olejowy - C17H33COOH (nienasycony)
Kwas linolowy- C17H31COOH (nienasycony)
Kwas linolenowy- C17H29COOH (nienasycony)
11. Katabolizm kwasów tłuszczowych w komórce
Katabolizm kwasów tłuszczowych (beta-oksydacja) prowadzi do utlenienia długołancuchowych kwasów tłuszczowych. Kwasy tłuszczowe przekształcane są w pochodne w formie acyloCoA. Wewnętrzna błona mitochondrium (dawna nazwa chondriozomów) nie przepuszcza długołańcuchowe pochodne w formie acylo-CoA. Transport taki jest możliwy dopiero po uprzednim związaniu z karnityną. Reakcja sprzegania jest katalizowana przez transferazę karnitynową I. Polega to na usunięciu CoA (koenzymu A) i wstawieniu w jego miejsce karnityny. Translokaza karnityna/acylokarnityna przenosi powstałą acylokarnityną przez błonę mitochondrium do matriks mitochondrium (macierzy mitochondrialnej). W matrix cząsteczki karnityny są uwalniane, grupa acylowa jest ponownie przenoszona na CoA. Tę część procesu katalizuje acetylotransferaza karnitynowa II. Sam proces beta-oksydacji ma na celu utlenienie kwasów tłuszczowych i wytworzenie energii w postaci ATP. Nadmiar acetyloCoA powstający podczas beta-oksydacji jest przekształcany w acetooctan i D-3-hydroksymaślan. Związki te mogą być zużyte do uzyskania energii dla mózgu w stanie cukrzycy i głodu.
2
Wyszukiwarka
Podobne podstrony:
tluszczowce zestawy, Zootechnika UP Lublin, biochemia
1 cykl krebsa, Zootechnika UP Lublin, biochemia
Biochemia 1 kolo cukry, Zootechnika UP Lublin, biochemia
biochemia kolos, Zootechnika UP Lublin, biochemia
odp na pyt bioch 4 kolumny 5ka, Zootechnika UP Lublin, biochemia
Sciągi bydło egzamin, Zootechnika UP Lublin, Hodowla bydła
pytania drob, Zootechnika UP Lublin, Chów i hodowla kur
Zjazd 4. cw, Zootechnika UP Lublin, Higiena i profilaktyka zootechniczna, profilaktyka
Owce-wyklady, Zootechnika UP Lublin, Chów i hodowla owiec i kóz
BYDŁO EGZAMIN(1), Zootechnika UP Lublin, Hodowla bydła
konie egzamin, Zootechnika UP Lublin, Hodowla Koni
Zywienie drobiu, Zootechnika UP Lublin, Chów i hodowla kur
Cw. 5 wentylacja pomieszczen, Zootechnika UP Lublin, Higiena i profilaktyka zootechniczna, higiena
Wykl. 1 Zatrucia pre.p.farmaceutycznymi, Zootechnika UP Lublin, Higiena i profilaktyka zootechniczna
Białaczka enzootyczna, Zootechnika UP Lublin, Hodowla bydła
niestrawnosci cw. 3, Zootechnika UP Lublin, Higiena i profilaktyka zootechniczna, profilaktyka
Cw. 5. chor.virusow, Zootechnika UP Lublin, Higiena i profilaktyka zootechniczna, profilaktyka
więcej podobnych podstron