Chemia, 2 rok studiów |
|
Kielce 26.01.2010 |
Nr 10 |
Sole podwójne i związki kompleksowe. Preparatyka i właściwości. |
Ocena:
|
Wstęp teoretyczny:
Kompleksowymi lub koordynacyjnymi nazywamy takie związki, których cząsteczki mają centralne atomy (lub jony) połączone z określoną liczbą jonów albo obojętnych cząsteczek zwanych ligandami. Liczba ligandów (liczba koordynacji jest większa od liczby wiązań, jakie może tworzyć atom centralny za pomocą swoich niesparowanych elektronów. Liczba koordynacji zależy jednak od struktury elektronowej centralnego atomu. Wiązanie koordynacyjne tworzy się w wyniku przeniesienia wolnych par elektronowych ligandów na akceptorowe orbitale atomu lub jonu centralnego. Wiązanie koordynacyjne nie różni się, ze względu na trwałość, charakterem od wiązania jonowego lub kowalencyjnego poza mechanizmem tworzenia. Związki kompleksowe są połączeniami nie tylko interesującymi z punktu widzenia teorii, ale też praktycznego zastosowania w wielu dziedzinach (np. katalizatory szeregu procesów technologicznych).
W wyniku łączenia się ze sobą (addycji) cząsteczek związków chemicznych powstają związki addycyjne. Są nimi zarówno sole podwójne takie, jak ałun żelazowo-amonowy (NH4)2SO4 × Fe2(SO4)3 × 24 H2O oraz związki kompleksowe (koordynacyjne) typu K4[Fe(CN)6]. Różnica pomiędzy tymi rodzajami związków chemicznych polega m.in. na tym, że sole podwójne ulegają dysocjacji elektrolitycznej rozpadając się na jony proste, a związki kompleksowe na jony proste i złożone
Według innej definicji, sole podwójne to sole, które mogą zawierać dwa rodzaje kationów metali połączonych z jednym rodzajem reszty kwasowej(anionu), np. MgAl2(SO4)4, lub dwa rodzaje anionów(reszt kwasowych), związanych z jednym rodzajem kationu metalu, np. Pb2Cl2CO3.
Cel ćwiczenia:
Celem ćwiczenia są syntezy:
1. ałunu glinowo-potasowego
2. ałunu chromowo-potasowego
3. siarczanu niklowo-amonowego
4. kompleksu niklu(II) z tiomocznikiem
5. kompleksu szczawianowego glinu
Wykonanie związków:
a) Synteza ałunu glinowo-potasowego:
Przygotowanie.
Do zlewki na 250 cm3 zawierającej 30 cm3 H2O dodać 1,45 g metalicznego glinu w postaci wiórków. Następnie dodać 60 cm3 H2SO4 (1: 2) Roztwór podgrzać na łaźni wodnej do całkowitego rozpuszczenia się glinu, a następnie przesączyć przez sączek karbowany.
Jednocześnie przygotować roztwór 4,5 g K2SO4 w 45 cm3 gorącej wody. Zlać oba ogrzane roztwory i odstawić do krystalizacji na kilka dni.
Zdekantować roztwór znad kryształów. Przesącz zagęścić przez odparowanie i pozostawić do krystalizacji.
Wydzielone kryształy przemyć niewielka ilością zimnej wody i wysuszyć na bibule.
Wnioski.
Zgodnie z równaniem reakcji: K2SO4 + Al2(SO4)3 → 2 [KAl(SO4)2•12 H2O]
Z 174 g K2SO4 → 948g KAl(SO4)2 x 12 H2O
Z 4,5 g K2SO4 → x
Powinno powstać 24,51g ałunu glinowo-potasowego.
W wyniku naszej reakcji powstało go 12,64g
![]()
b) Synteza siarczanu niklowo-amonowego
2,5 g siarczanu(VI) niklu(II) rozpuścić na gorąco w 14 cm3 3 M H2SO4. Do przesączonego, przez lejek ze spiekiem, roztworu dodać 5 g siarczanu(VI) amonu w 10 cm3 wody.
Po ochłodzeniu, w lodzie, wydzielają się ciemnozielone kryształy, które należy odsączyć na lejku ze spiekiem i przemyć niewielką (5 cm3) ilością zimnej wody.
Wysuszyć na bibule w temperaturze pokojowej.
Wnioski.
Podczas przebiegu reakcji: NiSO4 + (NH4)2SO4 + 6 H2O → Ni(NH4)2(SO4)2•6 H2O
155 g NiSO4 →395 g Ni(NH4)2(SO4)2 • 6 H2O
2,5 g → x
Przy 100% wydajności powinno powstać 6,4 g. Jednak powstało go 3,25g
![]()
c) Synteza ałunu chromowo-potasowego
Przygotowanie.
Odważyć 5 g drobnokrystalicznego K2Cr2O7, i rozpuścić go w zlewce (250 cm3) w 50 cm3 gorącej wody.
Obliczyć półtora krotną ilość potrzebnego kwasu siarkowego (VI) i posługując się tablicami przeliczyć na objętość stężonego kwasu o znanej gęstości (d =1,84 g/cm3 ma stężenie Cp=95%).
Kwas odmierzyć cylindrem miarowym i małymi porcjami (kroplami) wlewać do roztworu dichromianu(VI) ciągle mieszając (reakcję przeprowadzać pod dygestorium).
Następnie wkroplić pipetką Pasterowską alkohol etylowy. Należy wziąć półtorakrotnie większą ilość alkoholu od stechiometrycznej ilości wynikającej z równania reakcji (C2H5OH 96% ma gęstość d = 0,81 g/cm3). Alkohol dodawać stopniowo, tak by temperatura masy reagującej nie przekroczyła 40oC. (w czasie dodawania alkoholu roztwór silnie się nagrzewa). Zlewkę z mieszaninę reagująca trzymać w misce z lodem. Po dodaniu całej ilości alkoholu, roztwór przesączyć przez sączek karbowany do parownicy i pozostawić do powolnej krystalizacji.
Wydzielone kryształy przesączyć przez lejek Bőchnera, wysuszyć je pomiędzy kawałkami bibuły filtracyjnej. Preparat zważyć i obliczyć wydajność reakcji.
K2Cr2O7 + 3 C2H5OH + 4 H2SO4 → 2KCr(SO4)2 + 3CH3CHO + 7 H2O
Półtorakrotna ilość potrzebnego kwasu siarkowego (VI) :
![]()
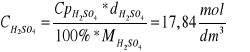
![]()
![]()
1mol K2Cr2O7 → 6mol H2SO4
![]()
0,017mol K2Cr2O7 → x mol H2SO4
![]()
x = 0,102 mol
![]()
![]()
Półtorakrotna ilość potrzebnego alkoholu etylowego:
![]()
1mol K2Cr2O7 → 4,5mol C2H5OH
![]()
0,017mol K2Cr2O7 → x mol C2H5OH
![]()
x = 0,0765 mol
![]()
W wyniku krystalizacji otrzymujemy zielone kryształy. O wadze 3,75 g
d) otrzymywanie kompleksu Ni (II) z tiomocznikiem
Przygotowanie.
Do (18 mmol) tiomocznika, rozpuszczonego w niewielkiej ilości alkoholu etylowego na gorąco, dodać po kropli stale mieszając stężony alkoholowy roztwór (3 mmole) sześciowodnego azotanu (V) niklu(II). Mieszaninę reakcyjną pozostawić do krystalizacji. Kompleks przesączyć, przemyć 5 cm3 alkoholu etylowego, wysuszyć na lejku pod pompką wodną.
Wnioski.
SC(NH2)2 + Ni(NO3)2•6 H2O → Ni[SC(NH2)2](NO3)2 + 6 H2O
291 g Ni(NO3)2 ∙ 6 H2O →259 g
0,87 g Ni(NO3)2 ∙ 6 H2O →x
Teoretyczna masa wynosi 0,77g.
Masa doświadczalna 0,72 g
W = (md/mt) 100%
W = 93,5 %
e) synteza kompleksu K3[Al(C2O4)3]
przygotowanie
Sporządzić roztwory:
- 3,3 g siarczanu (VI) glinu w 30 cm3 gorącej wody
- 5,4 g szczawianu potasu w 10 cm3 gorącej wody
- 5 cm3 1 M roztwór H2C2O4.
Do roztworu siarczanu glinu wkraplać powoli pipetką 5 cm3 roztworu kwasu szczawiowego, a następnie roztwór szczawianu potasu. Mieszaninę reakcyjną należy ciągle mieszać mieszadłem magnetycznym.
Po ostudzeniu do roztworu dodać 10 cm3 alkoholu etylowego. Roztwór pozostawić do krystalizacji. Po wykrystalizowaniu, kompleks przesączyć przez lejek ze spiekiem, przemyć 5 cm3 etanolu, suszyć na lejku pod pompką wodną.
Wnioski.
Dla zachodzącej reakcji: Al2(SO4)2 + 6 K2C2O4 → 2 K3[Al(C2O4)3] + 3 K2SO4
Obliczamy teoretyczną masę
342 g Al2(SO4)2 → 816 g K3[Al(C2O4)3]
3,3 g Al2(SO4)2 → x
mteoretyczna = 7,87 g
![]()
f) Właściwości soli podwójnych i związków kompleksowych:
W probówkach kolejno rozpuścić w 10 cm3 wody 0,1 g otrzymanych preparatów: ałunu glinowo-potasowego, kompleksu
szczawianowego glinu, siarczanu niklowo-amonowego oraz kompleksu niklu z tiomocznikiem. Do czterech probówek wlać po 1 cm3 otrzymanych roztworów, do każdej wkroplić po 8 kropli 1,5M NH3aq. Zaobserwować zmiany. Napisać równania reakcji (cząsteczkowo i jonowo) lub zaznaczyć, że reakcja nie zaszła.
ałun glinowo - potasowy + amoniak:
Obserwacje: wytrąca się biały kłaczkowaty osad.
Równania reakcji:
2KAl(SO4)2 + 6(NH3•H2O) → Al(OH)3↓ + 3(NH4)2SO4 +K2SO4
Al3+ + 3(NH3•H2O) → Al(OH)3↓ + 3NH4+
kompleks szczawianowy glinu + amoniak:
Obserwacje: brak widocznych zmian.
Równania reakcji: reakcja nie zachodzi.
siarczan niklowo - amonowy + amoniak:
Obserwacje: roztwór przybiera intensywniejszą barwę i wytrąca się zielony osad.
Równania reakcji:
2Ni(NH4)2(SO4)2 + 2NH3• H2O → Ni(OH)2↓ + [Ni(NH3)6]SO4
2Ni(NH4)2(SO4)2 + 2NH3•H2O → Ni(OH)2↓ + [Ni(NH3)6]2+
kompleks Ni(II)z tiomocznikiem + amoniak:
Obserwacje: brak widocznych zmian.
Równania reakcji: reakcja nie zachodzi.
Wnioski ogólne.
1. Sole podwójne są bardziej reaktywne od kompleksów (ałuny w przeciwieństwie do kompleksów reagują z 1,5 M NH3·H2O), ponieważ w roztworze dysocjują na jony proste (nie kompleksowe).
2. Ałuny należą do związków istniejących tylko w stanie krystalicznym, w roztworze natychmiast ulegają rozpuszczeniu (dysocjują na jony).
3. Na trwałość kompleksu wpływają właściwości atomu centralnego, jony metali przejściowych, ze względu na konfigurację elektronową, najłatwiej koordynują ligandy posiadające w swoim składzie więcej niż jeden atom będący donorem pary elektronowej. Takie połączenia są też trwalsze niż z ligandami posiadającymi tylko jeden taki atom donorowy (tzw. efekt chelatowy związany z efektem entropowym).
4. Otrzymane kompleksy należą do grupy kompleksów biernych (inertnych), gdyż stan równowagi pomiędzy składnikami kompleksu, a samym kompleksem ustala się bardzo powoli.
1
Wyszukiwarka
Podobne podstrony:
Związki kompleksowe, AGH różne, chemia wykłady
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
Związki nieorganiczne węgla i ich właściwości 1, Chemia(2)
synteza i właściwości związków kobaltu z amoniakiem, chemia nieorganiczna, laboratorium, Chemia nieo
sole podwójne, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, egzamin sole
Związki nieorganiczne węgla i ich właściwości, Chemia(2)
ZWIĄZKI KOMPLEKSOWE, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
otrzymywanie i właściwości związków kompleksowych
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE POIJODKÓW, chemia nieorganiczna
Właściwości chemiczne żelaza, chemia nieorganiczna
SYSTEMATYKA ZWIAZKOW NIEORGANICZNYCH 5.11 (8.11), Budownictwo PK, Chemia, Chemia nieorganiczna od Ma
reakcje kompleksowania, laborki chemia nieorganiczna
9. Przegląd podstawowych klas związków pierwiastków bloków d i f, pwr biotechnologia(I stopień), II
Sprawozdanie 3 Związki kompleksowe, Chemia Medyczna, Laboratorium
kompleksy, chemia nieorganiczna
6 Zależność właściwości substancji od rodzaju wiązania chemicznego, Budownictwo PK, Chemia, Chemia n
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
więcej podobnych podstron