SPRAWOZDANIE NR 3
data sporządzenia: 03.11.2015 |
wykonujący:
|
|
tytuł ćwiczenia: |
Związki kompleksowe |
|
opiekun grupy |
|
|
data przyjęcia
|
data oddania sprawozdania |
data przyjęcia sprawozdania poprawionego:
|
data ostatecznego zaliczenia sprawozdania:
|
ocena |
|
SPIS TREŚCI
Doświadczenie I |
|
Część teoretyczna |
Str. 2 |
Opracowanie wyników |
Str. 4 |
Doświadczenie I
CZĘŚĆ TEORETYCZNA
Temat: Badanie właściwości wybranych związków kompleksowych.
Cel: Zbadanie właściwości fizykochemicznych akwakompleksów, hydroksokompleksów
i aminakompleksów miedzi (II), cynku(II), niklu (II), chromu(II), chlorokompleksów miedzi(II)
i kobaltu(II). Porównanie stałych trwałości jonów tetrachlorożelazianowych(III), heksaflourożelazianowych(III) i heksa(N-cyjaniano)żelazianowych(III).Osiągnięty efekt kształcenia:
CH1_W05.1:
2. sprawne posługiwanie się terminologią i nomenklaturą dotyczącą prostych związków kompleksowych
CH1_U02:
Student:
2. posiada umiejętność samodzielnego przeprowadzania doświadczeń zgodnie z instrukcją, obserwacji
ich rezultatów, wyciągania wniosków i przedstawiania ich wyników w formie pisemnej
CH1_U07:
Student:
1. potrafi zastosować przepisy z zakresu BHP pozwalające na bezpieczną pracę w laboratorium
2. potrafi posługiwać się oznaczeniami substancji chemicznych
3. potrafi stosować środki ochrony osobistej
4. potrafi udzielić pierwszej pomocy w nagłych wypadkach
5. potrafi zastosować się do przepisów przeciwpożarowych obowiązujących na Wydziale Chemii
6. potrafi odpowiedzialnie używać związków chemicznych oraz potrafi je ich selekcjonować
odpowiednio do sposobów utylizacji
CH1_U03:
Student:
1. posiada umiejętność zastosowania edytora tekstu do napisania sprawozdania z przeprowadzonych
w laboratorium doświadczeń
CH1_W07:
Student:
1. dysponuje wiedzą z zakresu BHP pozwalająca na bezpieczną pracę w laboratorium chemicznym
2. potrafi omówić oznakowanie substancji chemicznych
3. potrafi wymienić środki ochrony osobistej
4. potrafi przedstawić sposoby udzielania pierwszej pomocy w nagłych wypadkach
5. potrafi omówić przepisy przeciwpożarowe obowiązujące na Wydziale Chemii oraz wskazać drogi ewakuacji
6. potrafi wyjaśnić, w jaki sposób powinno się odpowiedzialnie używać niebezpiecznych związków chemicznych oraz w szczególności potrafi przedstawić zasady ich utylizacji
CH1_U14:
Student posiada umiejętność rzeczowego przygotowania sprawozdania (w języku polskim) dotyczącego wykonywanych w laboratorium prac na podstawie notatek własnych z dziennika laboratoryjnego zawierającego wymaganą część teoretyczną przygotowaną z wykorzystaniem różnych źródeł Wydział Chemii Uniwersytetu Jagiellońskiego Podstawy Chemii - Laboratorium
CH1_K05:
Student dba o jakość i staranność zarówno podczas wykonywania zadań na zajęciach laboratoryjnych,
jak i podczas opisywania ich wyników w zeszycie laboratoryjnym oraz w sprawozdaniach
CH1_K06:
Student potrafi w sposób odpowiedzialny używać odczynników chemicznych i uwzględniając ich negatywny wpływ na ludzi i środowisko naturalne przez używanie minimalnych ilości szkodliwych odczynników oraz odpowiednią ich utylizację, jak również potrzebę ograniczania ilości generowanych odpadów
Wstęp teoretyczny:
Związek kompleksowy - to związek obojnaczy lub typu soli, w którym jeden z jonów jest kompleksem. Kompleksem nazywamy jon lub atom metalu stanowiący centrum kompleksu, połączony z ligandami za pomocą wiązań koordynacyjnych, w których ligandy są donorami,
a jon/atom centralny jest akceptorem elektronów.
Stała trwałości kompleksu - to wielkość charakteryzująca reakcje tworzenia kompleksu w stanie równowagi.
M + nL MLn
![]()
OPRACOWANIE WYNIKÓW:
Akwakompleksy
Siarczan(VI) miedzi(II) w postaci stałej i bezwodnej ma postać białego proszku. Jest on higroskopijny dlatego po dłuższym kontakcie z powietrzem ulega uwodnieniu i przyjmuje błękitne zabarwienie. Sole zawierające wodę krystalizacyjną, a więc także badany sześciowodny siarczan(VI) miedzi(II), mają ciemnoniebieską barwę. Wodny roztwór siarczanu(VI) miedzi(II) ma niebieskie zabarwienie bez względu na to, czy został sporządzony poprzez rozpuszczenie soli bezwodnej, czy uwodnionej.
pH roztworów [Zn(H2O)6](NO3)2 = 5 [Zn(H2O)6]2+ + H2O [Zn(OH)(H2O)5]+ + H3O+
[Ni(H2O)6](NO3)2 = 5 [Ni(H2O)6]2+ + H2O [Ni(OH)(H2O)5]+ + H3O+
[Al(H2O)6](NO3)3 = 3 [Al(H2O)6]3+ + H2O [Al(OH)(H2O)5]2+ + H3O+
[Cr(H2O)6](NO3)3 = 2 [Cr(H2O)6]3+ + H2O [Cr(OH)(H2O)5]2+ + H3O+
Odczyny pH badanych roztworów są kwaśne, ponieważ akwakompleksy ulegają deprotonacji skoordynowanych cząsteczek wody:
[Zn(H2O)6]2+ + H2O [Zn(H2O)5(OH)]+ + H3O+
[Ni(H2O)6]2+ + H2O [Ni(H2O)5(OH)]+ + H3O+
[Al(H2O)6]3+ + H2O [Al(H2O)5(OH)]2+ + H3O+
[Cr(H2O)6]3+ + H2O [Cr(H2O)5(OH)]2+ + H3O+
Hydroksokompleksy
|
|
NaOH, |
NaOH, 6 mol/dm3 |
HNO3, 2 mol/dm3 |
HNO3, 6 mol/dm3 |
wzór |
[Zn(H2O)6]2+ |
Zn(OH)2 |
[Zn(OH)4]2- |
Zn(OH)2 |
[Zn(H2O)6]2+ |
nazwa |
Jon heksaakwacynku(II) |
Wodorotlenek cynku(II) |
Anion tetrahydroksycynkowy(II) |
Wodorotlenek cynku(II) |
Jon heksaakwacynku(II) |
wzór |
[Ni(H2O)6]2+ |
Ni(OH)2 |
Ni(OH)2 |
Ni(OH)2 |
[Ni(H2O)6]2+ |
nazwa |
Jon heksaawkaniklu(II) |
Wodorotlenek niklu(II) |
Wodorotlenek niklu(II) |
Wodorotlenek niklu(II) |
Jon heksaawkaniklu(II) |
wzór |
[Al(H2O)6]3+ |
Al(OH)3 |
[ Al(OH)4]- |
Al(OH)3 |
[Al(H2O)6]3+ |
nazwa |
Jon heksaakwaglinu(III) |
Wodorotlenek glinu(III) |
Anion tetrahydroksoglinowy(III) |
Wodorotlenek glinu(III) |
Jon heksaakwaglinu(III) |
wzór |
[Cr(H2O)6]3+ |
Cr(OH)3 |
[Cr(OH)6]3- |
Cr(OH)3 |
[Cr(H2O)6]3+ |
nazwa |
Jon heksaakwachromu(III) |
Wodorotlenek chromu(III) |
Anion heksahydroksochromianowy(III) |
Wodorotlenek chromu(III) |
Jon heksaakwachromu(III) |
[Zn(H2O)6]2+ + 2OH- → Zn(OH)2 + 6H2O
Zn(OH)2 + 2OH- → [Zn(OH)4]2-
[Zn(OH)4]2- + 2H+ → Zn(OH)2 + 2H2O
Zn(OH)2 + 6H3O+ → [Zn(H2O)6]2+ + 2H2O + 4H+
[Ni(H2O)6]2+ + 2OH- → Ni(OH)2 + 6H2O
Ni(OH)2 + OH- → nie reaguje, jon Ni2+ nie tworzy związków kompleksowych z jonami OH-
Ni(OH)2+ H+ → nie reaguje, zgodnie z teorią osad Ni(OH)2 rozpuszcza się w rozcieńczonych kwasach organicznych, być może w tym przypadku stężenie kwasu HNO3 było zbyt niskie.
Ni(OH)2 + 6H3O+ → [Ni(H2O)6]2+ + 2H2O + 6H+
[Al(H2O)6]2+ + 3OH- → Al(OH)3 + 6H2O
Al(OH)3 + OH- → [ Al(OH)4]-
[Al(OH)4]- + H+ → Al(OH)3 + H2O
Al(OH)3 + 6H3O+ → [Al(H2O)6]3++ 3H2O + 3H+
[Cr(H2O)6]3+ + 3OH- → Cr(OH)3 + 6H2O
Cr(OH)3 + OH- →[Cr(OH)6]3-
[Cr(OH)6]3-+ 3H+ → Cr(OH)3 + 3H2O
Cr(OH)3 + 6H3O →[Cr(H2O)6]3+ + 3H2O + 3H+
Aminakompleksy
|
|
NH3aq 2 mol/dm3 |
NH3aq 6 mol/dm3 |
H2dmg |
HNO3 6 mol/dm3 |
wzór |
[Zn(H2O)6]2+ |
Zn(OH)2 |
[Zn(NH3)4]2+ |
[Zn(NH3)4]2+ |
[Zn(H2O)6]2+ |
nazwa |
Kation heksaakwacynku(II) |
Wodorotlenek cynku(II) |
Kation tetraaminacynku(II) |
Kation tetraaminacynku(II) |
Kation heksaakwacynku(II) |
wzór |
[Ni(H2O)6]2+ |
Ni(OH)2 |
[Ni(NH3)6]2+ |
[Ni(Hdmg)2] |
[Ni(H2O)6]2+ |
nazwa |
Kation heksaakwaniklu(II) |
Wodorotlenek niklu(II) |
Kation heksaaminaniklu(II) |
Dimetylogloksymian niklu(II) |
Kation heksaakwaniklu(II) |
wzór |
[Al(H2O)6]3+ |
Al(OH)3 |
Al(OH)3 |
- |
[Al(H2O)6]3+ |
nazwa |
Kation heksaakwaglinu(III) |
Wodorotlenek glinu(III) |
Wodorotlenek glinu(III) |
- |
Kation heksaakwaglinu(III) |
wzór |
[Cu(H2O)6]3+ |
Cu(OH)2 |
[Cu(NH3)4]2+ |
[Cu(Hdmg)2] |
[Cu(H2O)6]3+ |
nazwa |
Kation heksaakwamiedzi(II) |
Wodorotlenek miedzi(II) |
Kation tetraaminamiedzi(II) |
Dimetylogliksymianmiedzi(II) |
Kation heksaakwamiedzi(II) |
[Zn(H2O)6]2+ + 2(NH3∙H2O) → 2NH4+ + 6H2O+ Zn(OH)2
Zn(OH)2+ 4 (NH3∙H2O) → [Zn(NH3)4]2+ + 2OH- + 4 H2O
[Zn(NH3)4]2+ + H2dmg → reakcja nie rachodzi, jon Zn2+ nie ma zdolności tworzenia chelatów
z dimetyloglioksymem
[Zn(NH3)4]2+ + 6H3O+ → [Zn(H2O)6]2+ + 4NH4+ +2H+
[Ni(H2O)6]2+ + 2 (NH3∙H2O) → 2NH4+ + 6H2O+ Ni(OH)2
Ni(OH)2 + 4(NH3∙H2O) →[Ni(NH3)4]2+ + 2OH- + 4 H2O
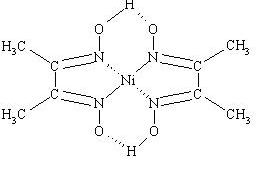
[Ni(NH3)4]2+ + H2dmg →
[Ni(NH3)4]2+ + 6H3O+ → [Ni(H2O)6]2+ + 4NH4+ +2H+
[Al(H2O)6]2+ + 3(NH3∙H2O) → 3NH4+ + 6H2O + Al(OH)3
Al(OH)3 + NH3∙H2O → reakcja nie zachodzi, jon Al3+ nie ma zdolności tworzenia związków kompleksowych z NH3
Al(OH)3 + H2dmg → nie przeprowadza się reakcji ze względu na brak klarownego roztworu
Al(OH)3 + 3H3O+ → [Al(H2O)6]3+
[Cu(H2O)6]2+ + 2(NH3∙H2O) → 2NH4+ + 6H2O+ Cu(OH)2
Cu(OH)2 + 4(NH3∙H2O) → [Cu(NH3)4]2+ + 2OH- + 4 H2O
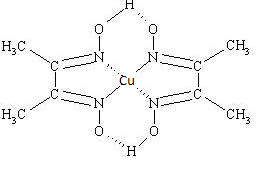
[Cu(NH3)4]2+ + H2dmg →
[Cu(NH3)4]2+ + 6H3O+ → [Cu(H2O)6]2+ + 4NH4+ +2H+
Chlorokompleksy
|
substrat |
reakcja |
produkt |
wzór |
[Co(H2O)6)]2+ |
[Co(H2O)6)]2+ +4Cl- → [CoCl4]2- + 6H2O |
[CoCl4]2- |
barwa |
różowy |
−−−−−−−− |
niebieski |
nazwa |
Kation heksaakwakobaltu(II) |
−−−−−−−− |
Anion tetrachlorokobaltanowy(II) |
wzór |
[Cu(H2O)6)]2+ |
[Cu(H2O)6)]2+ +4Cl- → [CuCl4]2- + 6H2O |
[CuCl4]2- |
barwa |
niebieski |
−−−−−−−− |
zielony |
nazwa |
Kation heksaakwamiedzi(II) |
−−−−−−−− |
Anion tetrachloromiedzianowy(II) |
Działanie atramentu sympatycznego
W wodnym roztworze chlorku kobaltu ustala się stan równowagi pomiędzy jonami kompleksowymi: tetrachlorokobaltanowymi(II) i heksaakwakobaltu(II).
[CoCl4]2- + 6 H2O [Co(H2O)6] + 4Cl- ΔH<0
Napis na bibule ma barwę lekko różową pochodzącą od jonów heksaakwakobaltu(II). Reakcja hydratacji jest procesem egzotermicznym, więc podwyższenie temperatury zgodnie z regułą Przekory powoduje przesuwanie stanu równowagi powyższej reakcji w lewo. Wówczas napis zmienia barwę na niebieską pochodzącą od jonów tetrachlorokobaltanowych(II).
Wymiana ligandów w jonie kompleksowym Fe(III)
|
[Fe(H2O)6]3+ |
+ stęż HCl |
+ 2M KSCN |
+ 2M KF |
barwa |
Jasnożółty roztwór |
Żółty roztwór |
Krwistoczerwony osad |
Bezbarwny roztwór |
wzór |
[Fe(H2O)6]3+ |
[FeCl4]- |
[Fe(NCS6]3- |
[FeF6]3- |
nazwa |
Kation heksaakważelaza(III) |
Anion tetrachlorożelazianowy(II) |
Anion heksa(tiocyjaniano-N)żelazianowy(III) |
Anion heksafluorożelazianowy(III) |
Uzgodnij reakcje chemiczne:
[Fe(H2O)6]3+ + 4Cl- → [FeCl4]- + 6H2O
[FeCl4]- + 6SCN- → [Fe(NCS6]3- + 4Cl-
[Fe(NCS6]3- + 6F- → [FeF6]3- + 6SCN-
Powyższe reakcje zachodzą spontanicznie, ponieważ dodawane odczynniki tworzą z jonem żalaza(II) kompleksy o coraz wyższej stałej trwałości. W reakcji pierwszej, jon żelaza(III) tworzy kompleks z jonami chlorkowymi [FeCl4]- o stałej trwałości 1,35·102. Dodawane następnie aniony tiocyjanianowe tworzą
z żelazem kompleksy [Fe(NCS6]3- o stałej trwałości 1,3·106.Wprowadzony na koniec aniony fluorkowe wypierają z kompleksu [Fe(NCS6]3- aniony SCN- tworząc kompleks [FeF6]3- o stałej trwałości 1,3·1016.
Sprawozdanie nr 3
Związki kompleksowe Strona 1
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 2 - rozdzielanie substancji, Chemia Medyczna, Laboratorium
Sprawozdanie 1 - Strącanie osadów, Chemia Medyczna, Laboratorium
sprawozdanie kompleksy, Chemia Medyczna, Chemia fizyczna
Sprawozdanie 6 związki kompleksowe
SPRAWOZDANIE 8.5, STUDIA, semestr 4, Chemia fizyczna, Laboratorium
Sprawozdanie 6 związki kompleksowe
Sprawozdanie z ChOiA zwiazki kompleksowe ćw 3
Sprawozdanie NR 5 związki kompleksowe
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
Związki kompleksowe, AGH różne, chemia wykłady
synteza i właściwości związków kobaltu z amoniakiem, chemia nieorganiczna, laboratorium, Chemia nieo
sprawozdanie analityczna, Technologia chemiczna, Chemia analityczna, Laboratorium
sprawozdanie spektro, Technologia chemiczna, Chemia analityczna, laboratorium
Wzór sprawozdania chemfiz lab, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratoriu
Sprawozdanie 10.1, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana
Sole podwójne i związki kompleksowe. Preparatyka i właściwości, chemia nieorganiczna
WZÓR SPRAWOZDANIA, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA FIZYCZNA laboratorium
Podać postać cis i trans podanego związku, UMED wojlek I rok, CHEMIA MEDYCZNA, Chemia medyczna
Wzór sprawozdania - chemog dzienne lab, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labor
więcej podobnych podstron