Chemia, 2 rok |
|
Kielce
|
Nr. Cwiczenia 25 |
Właściwości chemiczne żelaza, miedzi , srebra i ich wybranych soli. |
Ocena:
|
Wstęp teoretyczny:
Metaliczna miedź charakteryzuje się: gęstością wynoszącą 8,96 g/cm³, temperaturą topnienia 1083°C i czerwono-brązowym zabarwieniem. Zaliczamy ją do metali półszlachetnych więc jest dość odporna chemicznie. Nie ulega działaniu kwasów w warunkach nieutleniających. Na powietrzu ulega powolnej korozji powierzchniowej, pod wpływam wilgoci i dwutlenku węgla, pokrywając się charakterystyczną zieloną powłoką zwaną patyną. W naturze występuje w postaci rud oraz w postaci czystej jako minerał - miedź rodzima, który jest rzadko spotykany.
Żelazo jest metalem o kolorze srebrzystoszarym. Jego gęstość wynosi 7,87 g/cm³, temperatura topnienia: 1534,85°C. Jest ono kowalne i ciągliwe. Występuje w 3 odmianach alotropowych. W zetknięciu z elektrolitami i wilgotnym powietrzem ulega korozji i przemienia się w mieszaninę tlenków, węglanów i innych soli tworząc rdzę. W przyrodzie rzadko spotyka się żelazo rodzime, większość żelaza w skorupie ziemskiej występuje w połączeniu z tlenem, jak minerały tlenku żelaza, takie jak hematyt i magnetyt. Wraz z niklem jest ono głównym składnikiem metalicznego jądra ziemi.
Srebro jest srebrzystobiałym metalem, którego gęstość wynosi 10,49 g/cm³, temperatura wrzenia 961,78°C. Jest bardzo ciągliwym i kowalnym metalem. Ma najwyższą ze wszystkich metali przewodność elektryczną i cieplną. Srebro nie ulega działaniu tlenu atmosferycznego, utlenia je ozon. Jest metalem szlachetnym. Nie działają na nie kwasy nieutleniające.
Cel ćwiczenia:
Zapoznanie się z właściwościami chemicznymi związków żelaza, miedzi oraz srebra.
Wykonanie ćwiczeń:
Doświadczenie 1
Działanie kwasów na żelazo
Opis doświadczenia:
Do trzech probówek wrzucić trochę opiłków żelaza. Następnie dodać po kilka cm3 stężonego kwasu siarkowego(VI), azotowego(V) i solnego. Do kolejnych trzech probówek z opiłkami dodajemy rozcieńczone kwasy siarkowy(VI), azotowy(V) i solny.
Obserwacje:
Kwasy stężone:
H2SO4 - Na zimno reakcja nie zachodzi, dopiero po ogrzaniu roztworu w probówce wydziela się gaz i roztwór zmienia barwę na żółtą. Reakcja po ogrzaniu:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
HNO3 -Następuje pasywacja Fe, po czym reakcja dalej nie zachodzi:
HCl - Roztwór powoli zmienia barwę na żółtą oraz wydziela się gaz:
Fe + 2 HCI → FeCI2 + H2↑
Kwasy rozcieńczone:
H2SO4 - W czasie reakcji wydziela się gaz, ale roztwór nie zmienia barwy:
Fe + H2SO4 → FeSO4 + H2↑
HNO3 - Następuje delikatna zmiana barwy oraz wydziela się gaz:
Fe + 4 HNO3 → Fe(NO3)3 + NO↑ + 2 H2O
HCl - Gaz wydziela się mało intensywnie:
Fe + 2 HCI → FeCI2 + H2↑
Wnioski:
Potencjał normalny półogniwa Fe/Fe2+ wynosi - 0,44 V. Dlatego żelazo reaguje z kwasami nie utleniającymi wypierając wodór (stężony i rozcieńczony HCI, rozcieńczony kwas siarkowy(VI))
Doświadczenie 2
Właściwości wodorotlenku żelaza(II)
Opis doświadczenia:
Do dwóch probówek wprowadzić parę kropli soli żelaza(II) a następnie wkroplić zasady sodowej. Jedną pozostawiany na powietrzu, do drugiej dodajemy nieco 3% roztworu H2O2
Obserwacje:
W pierwszej i drugiej probówce wytrąca się biały osad.
FeSO4 + 2 NaOH → Fe(OH)2 + Na2SO4
Osad z pierwszej probówki pozostawiony na powietrzu zielenieje po czym staje się brunatny.
4 Fe(OH)2 + O2 + H2O → 4 Fe(OH)3
W drugiej probówce po dodaniu roztworu H2O2 osad również brunatnieje.
2 Fe(OH)2 + H2O2 → 2 Fe(OH)3
Doświadczenie 3
Właściwości redukujące soli żelaza(II)
Opis doświadczenia:
Do probówki wymytej mieszaniną chromową wlewamy roztworu soli żelaza(II) zakwaszonej H2SO4 i dodajemy do niej trochę roztworu AgNO3
Drugą probówkę z zakwaszonym roztworem FeSO4 ogrzewamy w płomieniu palnika i do gorącego roztworu dodajemy wodę bromową
Obserwacje:
W probówce pierwszej wydzielił się osad zredukowanego srebra. W drugiej probówce nastąpiło odbarwcie wody bromowej.
Wnioski:
Kationy Fe(II) wykazują wyraźne właściwości redukujące. Redukują w środowisku kwaśnym nie tylko dichromiany i manganiany(VII), lecz także sole srebra i bromu.
Doświadczenie 4
Reakcja miedzi z chlorkiem żelaza(III)
Opis doświadczenia:
Do probówki wprowadzić parę kropli FeCI3, zakwasić stęż. HCI w celu zahamowania hydrolizy. Do tego roztworu wrzucić pasek miedzi oczyszczonej uprzednio papierem ściernym.
Obserwacje:
Pasek miedzi całkowicie się rozpuszcza.
W roztworze zaszła reakcja utlenienia i redukcji:
2 FeCI3 + Cu → 2 FeCI2 + CuCI2
Wnioski:
Potencjał normalny półogniwa Fe2+/Fe3+ wynosi + 0,77 V, natomiast dla Cu/Cu2+ tylko + 0,34 V. Stąd jony żelaza(III) pełnią rolę utleniacza, a miedź jest reduktorem, ponieważ ma niższy potencjał normalny.
Doświadczenie 5
Redukcja soli żelaza(III)
Opis doświadczenia:
Przygotować trzy probówki. Do każdej wkroplić roztworu soli żelaza (III) i zakwasić kwasem siarkowym(VI). Następnie dodać: - do pierwszej - KI, - do drugiej - pył Zn - do trzeciej - roztworu SnCI2, którą należy podgrzać.
Obserwacje:
Powstaje brunatne zabarwienie i wydziela się wolny jod.
Fe2(SO4)3 + 2 KI → FeSO4 + I2 + K2SO4
Powstaje szary roztwór i pył ZnO przechodzi do roztworu.
2 FeCI3 + Zn → 2 FeCI2 + ZnCI2
Roztwór zmienia barwę z żółtej na pomarańczową.
2 FeCI3 + SnCI2 → 2 FeCI2 + SnCI4
Doświadczenie 6
Rozkład zasadowego węglanu miedzi(II)
Opis doświadczenia:
Dużą suchą probówkę z zasadowym węglanem miedzi(II), umieścić poziomo w łapie statywu i zamknąć korkiem zaopatrzonym w rurkę odprowadzającą zgiętą pod kątem prostym. Wylot rurki zanurzamy do probówki z wodą wapienną.
Obserwacje:
Pod wpływem wydzielającego się CO2 woda wapienna mętnieje, a w probówce pozostaje czarny CuO.
[Cu(OH)]2CO3 → 2 CuO + H2O + CO2↑
CO2 ↑+ Ca(OH)2 → H2O + CaCO3↓
Doświadczenie 7
Reakcja miedzi z tlenem i jonami węglanowymi
Opis doświadczenia:
Celem ćwiczenia jest otrzymanie patyny na przedmiotach miedzianych. W tym celu do kilku centymetrów wodnego roztworu NaHCO3 dodajemy 0,5 cm3 H2O2 30% i wrzucamy oczyszczone blaszki miedziane.
Obserwacje:
Przy blaskach miedzi roztwór zabarwia się na bardzo jasny kolor. Po upływie kilku minut powstaje zielona barwa na skutek przebiegających reakcji:
![]()
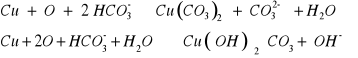
Doświadczenie 8
Działanie kwasu azotowego(V), siarkowego(VI), solnego i octowego na miedź.
Opis doświadczenia:
Do trzech probówek wrzucamy kawałek blaszki miedzianej, a następnie dodajemy niewielką ilość kwasu. Do pierwszej![]()
, drugiej HCl i ostatniej ![]()
.
Do czterech kolejnych probówek wrzucić kawałki blaszki, dodać po kilka centymetrów wody destylowanej i niewielka ilość kwasu(![]()
,![]()
,![]()
,HCl)
Obserwacje:
W pierwszej probówce w reakcji z HNO3 roztwór barwi się na niebiesko i wydziela się brunatny tlenek azotu.. Z pozostałymi kwasami reakcja nie zaszła.
W drugiej probówce zawierająca rozcieńczony kwas ![]()
zmieniła swoje zabarwienie po podgrzaniu na niebieski kolor i dało się zauważyć wydzielający się bezbarwny gaz.
Wnioski:
Reakcje zaszyły w probówkach zawierających kwas azotowy:
![]()
![]()
Z innymi kwasami reakcje nie zaszły jest to związane z potencjałem normalnym półogniwa Cu/Cu2+, które wynosi +0,34V. Dlatego miedź nie wypiera wodoru z kwasów. Reaguje tylko z kwasami utleniającymi, albo z innymi kwasami, ale w obecności środków utleniających.
Doświadczenie 9
Działanie kwasu azotowego(V), siarkowego(VI), solnego i octowego na tlenek miedzi(II).
Opis doświadczenia:
Do czterech probówek wlewamy niewielką ilość wody destylowanej i dodajemy po 1cm3 kwasu. Do pierwszej ![]()
,do drugiej![]()
,do trzeciej![]()
i do ostatniej HCl. Po czym w każdej umieszczamy szczyptę tlenku miedzi II.
Obserwacje:
Roztwór w pierwszej probówce zabarwił się na kolor jasno niebieski, w drugiej na niebieski w trzeciej na jasno niebieski a w ostatniej na niebiesko-zielony.
Wnioski:
![]()
![]()
![]()
![]()
Doświadczenie 10
Barwienie płomienia przez związki miedzi.
Opis doświadczenia:
W tygielku umieszczamy niewielką ilość CuCl2 w alkoholu etylowym. Tygielek umieszczamy nad palnikiem i zapalamy alkohol etylowy.
Obserwacje:
Płomień barwi się na zielono-niebieska barwę.
Wnioski:
Łatwo lotne sole miedzi II wykorzystuje się między innymi podczas wykrywania chlorowców w związkach organicznych ( na przykład do rozpoznania polichlorku winylu).
Doświadczenie 11
Działanie amoniaku na związki miedzi(II).
Opis doświadczenia:
W czterech probówkach umieszczamy kolejno w pierwszej CuO, w drugiej Cu(OH)2, w trzeciej ![]()
i w ostatniej CuSO4. Do każdej probówki dodajemy po 1![]()
wody amoniakalnej.
Obserwacje:
W pierwszej probówce roztwór zabarwił się na niebiesko, w drugiej osad się rozpuścił a roztwór zabarwił się na niebieski kolor, w trzeciej przybrał barwę niebieską a w ostatniej ciemnoniebieską.
Wnioski:
![]()
![]()
![]()
![]()
Amoniak reaguje ze związkami miedzi tworząc niebieskie rozpuszczalne w wodzie połączenia koordynacyjne, zawierające od jednej do czterech cząsteczek amoniaku. Przy nadmiarze czynnika kompleksującego powstają praktycznie kompleksy teraaminamiedzi (II).
Tworzenie się tych kompleksów można zobrazować jednym równaniem:
![]()
Doświadczenie 12
Reakcją jonów miedzi(II) z jodkami.
Opis doświadczenia:
Do probówki zawierającej niewielką ilość ![]()
dodajemy KI, wstrząsamy. Po czym dodajemy chloroformu i również wstrząsamy.
Obserwacje:
Po dodaniu KI roztwór barwi się na brunatno, strąca się osad. Po dodaniu chloroformu do probówki w warstwie chloroformowej jod barwi się na różowo-fioletowy kolor i wytraca się biały osad CuI na dnie probówki.
Wnioski: Cu2+ +2I- CuI2
2CuI2 2CuI+I2
Brunatne zabarwienie probówki spowodowane jest wydzielaniem wolnego jodu oraz wytrącaniem się osadu. Miedź II utlenia jony jodkowe do wolnego jodu i ustala się równowaga. Usuwanie jodu ze środowiska reakcji za pomocą chloroformu przesuwa równowagę w kierunku produktów.
Doświadczenie 13
Właściwości halogenków srebra.
Opis doświadczenia:
Do trzech probówek zawierających AgNO3 dodajemy do pierwszej roztworu chlorków, do drugiej roztworu bromków i do trzeciej roztworu jodków.
Osad chlorku srebra dzielimy na dwie probówki, jedną z nich pozostawiamy na świetle a druga przykrywamy ciemnym papierem.
Do probówki zawierającej bromek srebra wsypujemy szczawianu żelaza. Zawartość mieszamy.
Do wytrąconych halogenków srebra dodać w nadmiarze roztworu tiosiarczanu sodowego.
Obserwacje:
W pierwszej probówce wytrącił się biały serowaty osad, w drugiej probówce żółty serowaty osad w trzeciej również wytrącił się żółty serowaty osad.
Probówka z osadem chlorku srebra pozostająca na świetle zmienia barwę na ciemnofioletową
W probówce z bromkiem srebra po dodaniu szczawianu żelaza pojawia się osad zawierający metaliczne srebro.
Po dodaniu do probówek halogenków srebra tiosiarczanu sodowego w nadmiarze osady rozpuszczają się.
Wnioski:
Chlorek który pozostał na świetle zmieniła swoja barwę na skutek rozkładu fotochemicznego:
2AgCl→2 Ag + Cl2
Szczawian żelaza, redukuje bromek srebra do wolnego metalu:
3AgBr + 3 FeC2O4 → Fe2(C2O4)3 +FeBr3 + 3Ag
Chlorki, bromki i jodek srebra rozpuszczają się w tiosiarczanie tworząc związki kompleksowe.
![]()
![]()
![]()
Doświadczenie 14
Redukcja tlenku srebra (I) nadtlenkiem wodoru.
Opis doświadczenia:
Do probówki dodać ![]()
i NaOH. Następnie dodać 3% roztworu nadtlenku wodoru.
Obserwacje:
Po dodaniu NaOH wytrąca się osad tlenku srebra I. Gdy do mieszaniny dodaliśmy H2O2 wydzielił się gaz, który zidentyfikowałyśmy za pomocą tlącego się łuczywka, a na dnie probówki powstał czarny osad.
Wnioski:
W wyniku reakcji wymiany wytrąca się tlenek srebra I:
![]()
Nadtlenek wodoru zachowuje się jak reduktor, natomiast jon srebra I jest utleniaczem:
![]()
1
Wyszukiwarka
Podobne podstrony:
WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE POIJODKÓW, chemia nieorganiczna
6 Zależność właściwości substancji od rodzaju wiązania chemicznego, Budownictwo PK, Chemia, Chemia n
Węglowodory i ich właściwości chemiczne 2, Chemia(2)
Biłyk,chemia wody, Właściwości chemiczne wody
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
chemia, mydla, Grupa Funkcyjna - to atom, lub grupa atomów, decydująca o właściwościach chemicznych
chemia nieorganiczna egzamin, Technologia chemiczna pw, 1rok, chemia kolosy egz
Sprawozdanie 3 Właściwości chemiczne metali, Politechika Białostocka, budownictwo semestr I 2013-201
Węglowodory i ich właściwości chemiczne 1, Chemia(2)
właściwości chemiczne metali, Studia, Chemia, chemia7
Węglowodory i ich właściwości chemiczne, Chemia(2)
synteza i właściwości związków kobaltu z amoniakiem, chemia nieorganiczna, laboratorium, Chemia nieo
5 Wiazania chemiczne, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
KINETYKA CHEMICZNA, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
Mechanizmy reakcji chemicznych, Studia, Chemia organiczna i nieorganiczna
Sole podwójne i związki kompleksowe. Preparatyka i właściwości, chemia nieorganiczna
Typy reakcji związków chemicznych, Studia, Chemia organiczna i nieorganiczna
nomenklatura chemiczna, Farmacja, Chemia ogólna i nieorganiczna
Węglowodory i ich właściwości chemiczne 2, Chemia(2)
więcej podobnych podstron