Chemia, 2 rok studiów |
Julita Przeździecka Adrian Marzec |
Kielce 15.12.2009 |
Nr. 20 |
Otrzymywanie i badanie właściwości chemicznych prostych akwa, amina, chloro i hydrokso- kompleksów metali przejściowych |
Ocena:
|
Wstęp teoretyczny:
Kompleks składa się z atomu centralnego i ligandów. Atomem centralnym najczęściej są jony metali, a ligandy to cząsteczki obojętne lub jony elektroujemne. Atom centralny to akceptor ligandu, a kompleks jest jego donorem. Ligand jest jonem lub cząsteczką, które atom centralny przyłącza. Przebiega to zgodnie z ogólnym równaniem reakcji tworzenia się kompleksów:
atom centralny + ligand ↔kompleks
Reakcje kompleksowania możemy potraktować jako reakcje wymiany ligandu. Związki kompleksowe możemy podzielić na kompleksy bardzo trwałe, w niewielkim stopniu zdysocjowane, średnio trwałe, kompleksy nietrwałe. Powstawanie kompleksu polega na wypieraniu jednego ligandu przez drugi, o większej zdolności kompleksotwórczej w stosunku do danego atomu centralnego.
W roztworach wodnych metale znajdują się nie w postaci wolnych jonów (np. Cu2+, Ca2+), lecz w postaci akwakompleksów, czyli hydratów [odpowiednio Cu(H2O)4+, Ca(H2O)6+]. Ich reakcje z ligandami polegają na zastępowaniu cząsteczek wody w sferze koordynacyjnej metalu odpowiednimi ligandami. Dążność poszczególnych ligandów do zastępowania cząsteczek wody w akwakompleksach określa trwałość powstających kompleksów. Podczas tworzenia się kompleksów ligand zdolny do utworzenia kompleksu trwalszego wypiera ligand tworzący z danym metalem kompleks słabszy. Podobnie jeden jon metalu może wypierać z kompleksu inny jon metalu, słabiej związany z danym ligandem.
Cel ćwiczenia:
Zapoznanie się z chemią związków koordynacyjnych. Otrzymywanie kompleksów w roztworze wodnym i zbadanie ich właściwości.
Wykonanie ćwiczenia:
Doświadczenie numer 1
Związki o anionie kompleksowym
Otrzymywanie kompleksowego związku bizmutu (III)- tetrajodobizmutanu(III) potasu.
Opis doświadczenia:
W probówce umieszczamy kilka kropel ![]()
i dodajemy kroplami KJ aż do wytrącenia się jodku bizmutu (III). Osad rozpuszczamy w nadmiarze KJ i dodajemy jeszcze kilka kropli odczynnika.
Obserwacje:
Osad barwi się na czarny kolor, po dodaniu nadmiaru KJ osad rozpuszcza się i roztwór przybiera barwę pomarańczową.
Wnioski:
Zabarwienie otrzymanego roztworu jest czarne, spowodowane jest to obecnością
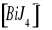
.Jonem kompleksotwórczym jest jon
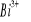
.Jon
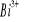
może utworzyć kompleks w danym roztworze z jonami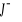
,ponieważ zawiera wolne pary elektronowe.Wzór koordynacyjny to:
![]()
Równania reakcji utworzenia
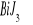
![]()
![]()
Równania reakcji działania nadmiarem KJ na otrzymany ![]()
:
![]()
![]()
Równanie dysocjacji elektrolitycznej związku kompleksowego:
![]()
b. Otrzymywanie kompleksu jodku rtęci(II)- tetrajodortęcianu(II) potasu
Opis doświadczenia:
Do dwóch probówek wprowadzić kilka kropel Hg(NO3)2. Jedna z probówek pozostawić jako wzorzec, natomiast do drugiej dodać roztworu KJ, do całkowitego rozpuszczenia osadu. Do obu probówek dodać po kilka kropli 2M roztworu NaOH.
Obserwacje:
W drugiej probówce początkowo pomarańczowo-czerwony osad który pod wpływem nadmiaru zmienia się na zielony, a zbyt dużym nadmiarze jasno zielony.
Po dodaniu do obu probówek NaOH , w pierwszej probówce roztwór zmienia barwę na musztardową, w drugiej natomiast nie ma żadnych zmian.
Wnioski:
Osad wydzielił się z pierwszej probówce zawierającej sam Hg(NO3)2.
Równania reakcji powstawania HgO:
![]()
![]()
3.
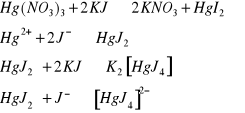
c) otrzymywanie kompleksowej soli tiosiarczanowej srebra(I)-ditiosiarczanosrebrzan(I) sodu
Opis doświadczenia:
Do probówki wprowadzamy kilka kropel ![]()
i dodajemy w nadmiarze roztworu ![]()
do momentu całkowitego rozpuszczanie wytrącającego się osadu tiosiarczanu srebra(I).
Obserwacje:
Na początku powstaje biały osad, który żółknie a pod wpływem nadmiaru tiosiarczanu rozpuszcza się.
![]()
Wnioski:
Równania reakcji tworzenia
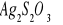
:
![]()
![]()
Tiosiarczan srebra (I) ma mniejszy iloczyn rozpuszczalności niż ditiosiarczanosrebrzan(I) sodu. Dodany tiosiarczan sodu powoduje że reakcja przebiega w kierunku tworzenia związku o większym iloczynie rozpuszczalności. Dzięki temu kompleks jest trwalszy we wskazanych warunkach.
Doświadczenie nr 2.
Związki o kationie kompleksowym
Otrzymywanie kompleksowej zasady niklu.
Opis doświadczenia:
W probówce wirówkowej wytrącić wodorotlenek niklu(II), wprowadzając do niej kilka kropli NiSO4 i taką samą ilość NaOH. Osad odwirować w wirówce i pomocą pipetki usunąć ciecz z nad osadu. Do osadu dodać 25% roztworu amoniaku aż do całkowitego rozpuszczenia osado wodorotlenku niklu(II).
Obserwacje:
Po dodaniu do osadu Ni(OH)2 25% roztworu amoniaku roztwór zmienił barwę na wrzosową.
Wnioski:
W roztworze NiSO4 jony Ni2+ miały barwę zieloną, natomiast otrzymany roztwór ma barwę wrzosową. Zmianę barwy otrzymanego roztworu powodują jony NH4+.
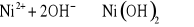

![]()
Mocniejszym elektrolitem jest Ni(NH3)6OH
Otrzymywanie kompleksowego związku miedzi(II) z amoniakiem - siarczan(VI) tetraaminamiedzi(II)
Opis doświadczenia:
Do probówki zawierającej kilka kropli roztworu siarczanu(VI) miedzi (II) dodać 25% roztworu amoniaku do całkowitego rozpuszczenia się zasadowej soli miedzi(II). Zwrócić uwagę na zabarwienie otrzymanego roztworu, jest ono spowodowane powstaniem kompleksowego jonu miedzi(II).
Obserwacje:
Po dodaniu 25% roztworu amoniaku roztwór zmienił barwę na granatową.
Wnioski:
CuSO4 + 4NH3 → [Cu(NH3)4]SO4![]()
Doświadczenie numer 3
Otrzymywanie związku zawierającego w cząsteczce kation i anion kompleksowy.
Opis doświadczenia:
Do probówki wprowadzamy kilka kropel ![]()
i ![]()
, do otrzymanego osadu dodać roztwór amoniaku do całkowitego rozpuszczania osadu.
Obserwacje:
Powstaje ciemnozielony osad po dodaniu w nadmiarze amoniaku zmienia się na fioletowy roztwór.
Wnioski:
Równania reakcji otrzymywania związków:
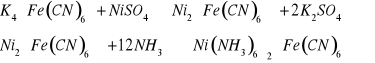
Równania dysocjacji elektrolitycznej związków:
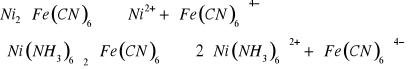
Doświadczenie nr 4.
Trwałość kompleksów
Opis doświadczenia:
Do każdej z trzech probówek dodać po 3 krople roztworu FeCI3. Do probówki pierwszej i drugiej dodać po 3 krople roztworu KCSN. Do probówki trzeciej dodać kroplami roztworu KF. Następnie do probówki drugiej dodać kroplami roztworu KF.
Obserwacje:
Probówka 1: po dodaniu KSCN roztwór zmienił barwę na krwistoczerwoną.
Probówka 2: po dodaniu KSCN roztwór zmienił barwę na krwistoczerwoną, po dodaniu KF roztwór nie zmienia zabarwienia.
Probówka 3: po dodaniu KF roztwór zmienia zabarwienie na jasnomleczne.
Wnioski:
Probówka 1: FeCl3 + 6KSCN → K3[Fe(SCN)6] + 3KCl
Probówka 2: FeCl3 + 6KSCN → K3[Fe(SCN)6] + 3KCl
K3[Fe(SCN)6] + KF →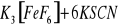
Probówka 3: FeCl3 + 6KF → K3[FeF6] + 3KClBardziej trwały jest kompleks K3[Fe(SCN)6].
Doświadczenie nr 5.
Trwałość kompleksów
Opis doświadczenia:
Do jednej probówki wprowadzić 6-7 kropli wody destylowanej, a do drugiej suchej probówki wprowadzić taką samą ilość alkoholu etylowego. Do obu probówek dodać parę kryształków CoCI2 · 6H2O . Roztwory wymieszać bagietką.
Obserwacje:
Probówka 1: roztwór zabarwił się na różowo.
Probówka 1: roztwór zabarwił się na granatowo.
Wnioski:
Jest to różowy roztwór związku o wzorze koordynacyjnym: [Co(H2O)6]Cl2
Sól dysocjuje zgodnie z równaniem: [Co(H2O)6]Cl2 ↔[Co(H2O)6]2++2Cl-
Jony Co2+ decydują o zabarwieniu wodnego roztworu soli Co(II)
Po dodaniu alkoholu: [Co(H2O)6]2+
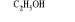
[Co(H2O)4]2++2H2O powstaje ciemno fioletowy roztwórPo dodaniu wody od roztworu alkoholowego ciemno fioletowy roztwór zmienia barwę na różową. Równowaga przesuwa się w stronę tworzenia [Co(H2O)6]2+
Doświadczenie nr 6.
Hydroliza akwakompleksów
Opis doświadczenia:
Do ośmiu oznakowanych probówek wlać po 2-3 krople 0,5M roztworów azotanów(V) odpowiednio; Cu(II), Ni(II), Co(II), Fe(III), Al(III), Zn(II), Cr(III) i Mg(II). Za pomocą papierka określiliśmy pH roztworów.
Obserwacje:
Cu(II) pH=1, Ni(II) pH=6, Co(II) pH=4,
Fe(III) pH=1, Al(III) pH=3, Zn(II) pH=5,
Cr(III) pH=2, Mg(II) pH=7
Wnioski:
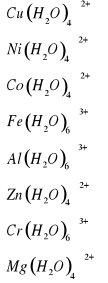
[Cu(H2O)4 ]2++2H2O↔[Cu(OH)2(H2O)2] ++2H3O+
[Ni(H2O)4 ]2++2H2O↔[Ni(OH)2(H2O)5]++2H3O+
[Co(H2O)4 ]2++2H2O↔[Co(OH)2(H2O)5]++2H3O+
[Fe(H2O)6]3++3H2O↔[Fe(OH)3(H2O)5]2++3H3O+
[Al(H2O)6 ]3++3H2O↔[Al(OH)3(H2O)3]2++3H3O+
[Zn(H2O)4 ]2++2H2O↔[Zn(OH)2(H2O)3]++2H3O+
[Cr(H2O)6 ]3++3H2O↔[Cr(OH)3(H2O)3]2++3H3O+
[Mg(H2O)4 ]2++2H2O↔[Mg(OH)2(H2O)3]++2H3O+
Doświadczenie numer 7:
Hydroksokompleksy.
Opis doświadczenia:
Do ośmiu probówek z poprzedniego doświadczenia dodawać po kropli 2M NaOH aż do uzyskania odczynu słabo alkalicznego. Następnie dodać 6M NaOH do momentu aż przestana zachodzić jakiekolwiek zmiany. Do otrzymanych hydroksokompleksów dodawać po kropki 2M ![]()
do momentu uzyskania pH obojętnego, po czym dodać kilka kropli 6M roztworu ![]()
.
1.Rozpuszczalne sole tworzą jony :
Cu(II), Co(II), Al(III), Zn(II), Cr(III)
2. Do probówek dodajemy 2M NaOH zaszły w nich następujące równania strącania osadów:
[Cu(H2O)4]2++2OH- ↔ [Cu(OH)2(H2O)2]↓ +2H2O błękitny osad
[Ni(H2O)6]2++ 4OH- ↔ [Ni(OH)2(H2O)2]↓ + 4H2O zielony osad
[Co (H2O)6]2++ 4OH- ↔ [Co(OH)2(H2O)2]↓ + 4H2O szafirowy osad
[Fe(H2O)6]3++ 3OH- ↔ [Fe(OH)3(H2O)3]↓ + 3H2O rdzawy osad
[Al(H2O)4]3++ 3OH- ↔ [Al(OH)3(H2O)]↓+ 3H2O biały osad
[Zn(H2O)4]2++ 2OH- ↔ [Zn(OH)2(H2O)2]↓ + 2H2O mleczny osad
[Cr(H2O)6]3++ 3OH- ↔ [Cr(OH)3(H2O)3]↓ + 3H2O ciemno zielony osad
[Mg(H2O)6]2++ 4OH- ↔ [Mg(OH)2(H2O)2]↓ + 4H2O biały osad
3. Następnie do probówek z osadami dodajemy 6M NaOH. Reakcje rozpuszczania osadów pojawiły się tylko w następujących probówkach:
[Cu(OH)2(H2O)2]↓+2OH-↔[Cu(OH)4]2- +2H2O ciemnoniebieski roztwór
[Co(OH)2(H2O)2]↓ + 4OH- ↔ [Co(OH)6]4-+4H2O wrzosowy roztwór
[Al(OH)3(H2O)]↓ + OH- ↔ [Al(OH)4]- +H2O bezbarwny roztwór
[Zn(OH)2(H2O)2]↓ + 2OH-↔[Zn(OH)4]2- + 2H2O bezbarwny roztwór
[Cr(OH)3(H2O)3]↓ + OH- ↔ [Cr(OH)4]- + H2O ciemnozielony roztwór
Do tych samych probówek dodajemy 2M HNO3, a następnie 6M HNO3.
1. Do probówek z roztworami dodajemy 2M HNO3 następuje w nich strącanie osadów, według następujących reakcji:
[Cu(OH)4]2- + 2H+↔ [Cu(OH)2(H2O)2]↓ niebieski osad
[Co(OH)6]4-+ 4H+↔ [Co(OH)2(H2O)2]↓ biały osad
[Al(OH)4]-+ H+ ↔ [Al(OH)3(H2O)3]↓ biały osad
[Zn(OH)4]2-+ 2H+↔ [Zn(OH)2(H2O)2]↓ biały osad
[Cr(OH)4]- + H+ ↔ [Cr(OH)3(H2O)3]↓ zielony osad
2. Do probówek z osadami dodajemy 6M HNO3 następuje w nich rozpuszczanie osadów, według następujących reakcji:
[Cu(OH)2(H2O)2]↓ + 2H+ ↔ [Cu(H2O)4]2+
[Co(OH)2(H2O)2]↓ + 4H+ ↔ [Co (H2O)6]2+
[Fe(OH)3(H2O)3]↓ + 3H+ ↔ [Fe(H2O)6]3+
[Al(OH)3(H2O)3]↓+ 3H+ ↔ [Al(H2O)6]3+
[Zn(OH)2(H2O)2]↓ + 2H+ ↔ [Zn(H2O)4]2+
[Cr(OH)3(H2O)3]↓ + 3H+ ↔ [Cr(H2O)6]3+
[Mg(OH)2(H2O)2]↓ + 4H+ ↔ [Mg(H2O)6]2+
Doświadczenie numer 8:
Aminakompleksy
Opis doświadczenia:
Do ośmiu probówek wlaliśmy kolejno roztwory azotanów(V): Cu(II), Ni(II), Co(II), Fe(III), Al.(III), Zn(II), Cr(III), Mg(II). Najpierw dodałyśmy 2M roztwór amoniaku do odczynu lekko zasadowego, a następnie 6M roztwór amoniaku do momentu aż przestaną zachodzić jakiekolwiek zmiany.
Obserwacje:
Cu(II) pH>8 granatowy roztwór mętny
Ni(II) pH>8 jasnobłękitny roztwór
Co(II) pH>8 ciemnozielony (szmaragdowy) osad
Fe(III) pH>9 rdzawy osad
Al(III) pH>9 biały osad
Zn(II) pH>8 biały osad
Cr(III) pH>8 zgniłozielony osad
Mg(II) pH>9 mętny mleczny osad
Po dodaniu 6M amoniaku następuje odbarwienie osadu.
Wnioski:
Co(OH)2[Co(NH3)6]2+
[Fe(H2O)6]3+ Fe(OH)3
Fe(OH)3![]()
[Fe(NH3)6]3+
[Al(H2O)4 ]3+ Al(OH)3
Al(OH)3[Al(NH3)4]3+
[Zn(H2O)4 ]2+ Zn(OH)2
Zn(OH)2[Zn(NH3)4]2+
[Cr(H2O)4 ]3+ Cr(OH)3
Cr(OH)3![]()
[Cr(NH3)4]3+
[Mg(H2O)4 ]2+ Mg(OH)2
Mg(OH)2[Mg(NH3)4]2+
Doświadczenie nr 9.
Chlorokompleksy
Opis doświadczenia:
Do dwóch oznakowanych probówek wprowadzić po 2-3 krople 0,5 M roztworów azotanu(V) miedzi(II) i 0,5 M roztworu azotanu(V) kobaltu(II) i do każdej z nich dodać po około 1 cm3 stężonego kwasu solnego.
Obserwacje:
W pierwszej probówce roztwór zmienił barwę na zieloną.
W drugiej probówce roztwór zmienił barwę na granatową.
![]()
![]()
1
8
Wyszukiwarka
Podobne podstrony:
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
Sole podwójne i związki kompleksowe. Preparatyka i właściwości, chemia nieorganiczna
reakcje kompleksowania, laborki chemia nieorganiczna
ZWIĄZKI KOMPLEKSOWE, Studja, Chemia Nieorganiczna, Wykłady, Wykłady pozostałe
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
Nierganiczna cw teoria, semestr 1, Chemia, Nieorganiczna teoria
odp test 1, 1 ROK Biologia i geologia, spec.Ochrona przyrody, Chemia nieorganiczna
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
więcej podobnych podstron