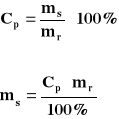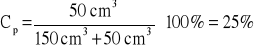ROZTWORY
Rodzaje stężeń roztworów. Sporządzanie roztworów procentowych
Roztwór - to mieszanina jednorodna, która składa się z substancji rozpuszczonej i rozpuszczalnika.
Stężenie - określa ile substancji rozpuszczonej znajduje się znajduje się w określonej ilości roztworu. Najczęściej wyraża się w procentach (%), molach, oraz g/100ml.
I. Stężenie procentowe:
A) Stężenie procentowe-wagowe - określa ile g substancji rozpuszczonej znajduje się w 100 g rozpuszczalnika.
Przykład
Ile gram substancji należy odważyć i ile użyć wody aby otrzymać 400g 8% roztworu?
Sposób I
8 g - 100 g x g - 400 g x = 32 [g]
400-32=368 g
Odpowiedź: 32 g substancji i 368 g wody. |
Sposób II
|
B) Stężenie procentowe wagowo-objętościowe
Określa ile gram substancji znajduje się w 100 cm³ roztworu.
Przykład I
Jakie jest stężenie procentowe wagowo-objętościowe roztworu, jeżeli w 800 cm³ tego roztworu znajduje się 40 g substancji?
Sposób I 40g - 800 cm³ x g - 100 cm³ x = 5g |
Sposób II
|
Odp. 5g/100cm³ , roztwór jest 5%
C) Stężenie procentowe objętościowe
Określa ile cm³ substancji znajduje się w 100 cm³ roztworu (cm³/cm³)
Przykład I
Jakie jest stężenie procentowe roztworu, jeżeli w 150 cm³ rozpuszczono 50 cm³ czystego 100% alkoholu?
Sposób I 50 cm³ - 200 cm³ (150 cm³ + 50 cm³) x cm³ - 100 cm³ x = 25 cm³ |
Sposób II
|
Odp. Roztwór jest 25 %
II. Stężenie molowe
Określa ile moli substancji znajduje się w 1 dm³ roztworu
![]()
![]()
- stężenie molowe [mol/dm³]
![]()
- masa substancji rozpuszczonej
M - masa molowa [g/mol]
V - objętość roztworu [dm³]
![]()
Przykład I
Ile gram ![]()
należy odważyć aby przygotować 500 cm³ 0,2 molowego roztworu?
![]()
= 65 + 35,5 + 35,5 = 131 g/mol
Sposób I 0,2 mola - 1000 cm³ (1 dm³) x mola - 500 cm³ x = 0,1 mola
1 mol - 131 g 0,1 mola - x g x = 13,1 g
|
Sposób II
|
Odp. 13,1 g
Roztwory molowe sporządza się w kolbach miarowych
Gęstość roztworu - stosunek masy do objętości
![]()
d - gęstość ![]()
m - masa [g]
V - objętość [cm³]
Gęstość roztworu mierzy się areometrem. Gęstość ważniejszych roztworów znajduje się w specjalnych tablicach ( kalendarzu chemicznym).
III. Reguła mieszania
Podczas mieszania roztworów tej samej substancji ale o różnych stężeniach , podczas rozcieńczania roztworu rozpuszczalnikiem lub też zatężania go otrzymuje się roztwór tej samej substancji ale o różnym stężeniu. Ilość roztworów wyraża się w jednostkach wagowych gdy ich stężenie wyrażone jest w procentach, natomiast w jednostkach objętości dla roztworów molowych. Jeżeli miesza się roztwory których stężenie podane jest w różnych jednostkach należy stężenie przeliczyć na tę samą jednostkę.
Stosując metodę krzyżową - po lewej stronie wpisuje się stężenie roztworów wyjściowych, w środku żądane stężenie, a pop prawej stronie różnice stężeń , przy czym należy zawsze odejmować od większej wartości wartość mniejszą. Otrzymane różnice przedstawiają ilość otrzymanych roztworów:
- w gramach gdy stężenie procentowe
- w cm³ gdy stężenie molowe
Przykład I
W jakim stosunku wagowym należy zmieszać 15 % roztwór z wodą aby otrzymać roztwór 7%?
Odp. 7:8 .
Przykład II
W jakim stosunku wagowym należy zmieszać 18% roztwór cukru z wodą aby otrzymać roztwór 3%?
Odp. 1:5
Przykład III
Ile gram stałej soli należy dodać do 300g 4 % roztworu aby uzyskać roztwór 9%?
5 g - 91 g (roztworu)
x g - 300 g
x = 16,48 g
Odp. 16,48 g NaCl.Ćwiczenie 1
Przygotować 100g 5% roztworu NaCl.
Składniki:
5g NaCl
95 ml wody
Ćwiczenie 2
Przygotować 250 g 15% roztworu NaCl
15 g - 100 g
x g - 250 g
x = 37,5 g
Składniki:
37,5 g NaCl
212,5 ml wody
5 % roztwór NaCl |
15 % roztwór NaCl |
gęstość z tablic - 1,034 g/cm³ gęstość przygotowana - 1,035 g/cm³ |
Gęstość z tablic - 1,109 g/cm³ Gęstość przygotowana - 1,111 g/cm³ |
4
Wyszukiwarka
Podobne podstrony:
ChO w Rodzaje izomerii, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
R.Mieszanie i rozcieńczanie roztworów procentowych, ~FARMACJA, I rok, chemia (ciul wie co), Semestr
R.Sporządzanie roztworów molowych, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Rodzaj wiązań, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Podstawowe czynności laboratoryjne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
AJ Identyfikacja kationów III grupy, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Podział stanowisk pracy – mycie i znakowanie szkła, ~FARMACJA, I rok, chemia (ciul wie co), Semestr
AJ Wykrywanie anionów I-VI grupy – analiza kontrolna, ~FARMACJA, I rok, chemia (ciul wie co), Semest
Podstawowe pojęcia i prawa chemiczne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Reakcje Redox cd, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
AJ Wykrywanie soli - analiza kontrolna, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Alkohole i fenole, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Węglowodory, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Metody rozdzielania i oczyszczania substancji chemicznych, ~FARMACJA, I rok, chemia (ciul wie co), S
Budowa oraz obsługa wag technicznych i analitycznych, ~FARMACJA, I rok, chemia (ciul wie co), Semest
Klasyfikacja związków nieorganicznych, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Reakcje Redox, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Podstawowy sprzęt laboratoryjny, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
AJ Podział anionów na grupy analityczne. Reakcje I i i II gr, ~FARMACJA, I rok, chemia (ciul wie co)
więcej podobnych podstron