GRUPA NR: ZESPÓŁ: |
ĆWICZENIE NR: 6
Równowagi w układzie trójskładnikowym, diagram Gibbsa.
|
DATA WYKONANIA ĆWICZENIA:
|
ZESPÓŁ:
|
|
OCENA:
|
1. WSTĘP TEORETYCZNY:
W układach trójskładnikowych, np.:
woda - ksylen - kwas octowy
woda - toluen - etanol
woda - toluen - metanol
woda - benzen - metanol
woda - chloroform - kwas octowy
woda - benzen - etanol itp.
Obserwuje się ograniczony zakres rozpuszczalności.
Wzajemna rozpuszczalność dwóch praktycznie nie mieszających się cieczy (np. woda - benzen, woda - chloroform itp.) ulega znacznemu zwiększeniu po dodaniu trzeciego składnika, takiego, jak np. metanol, kwas octowy itd. Przy dodaniu pewnej jego ilości mieszanina staje się roztworem jednorodnym.
Np. ilość kwasu octowego powodująca utworzenie układu jednorodnego (jednofazowego) trójskładnikowego woda - chloroform - kwas octowy zależy od temperatury oraz początkowych ilości wody i chloroformu.
Można też zaobserwować sytuację odwrotną. Załóżmy, że niewielką ilość cieczy A (powodującej późniejszą heterogenizację) dolewamy do roztworu BC, w temperaturze T. Po całkowitym rozpuszczeniu nowy układ trzech składników jest wciąż jednofazowy. Dodając dalej substancji A dojść można do stanu, w którym nawet najmniejsza ilość tej substancji nie może się już rozpuścić. W tym momencie następuje utworzenie dwóch faz (heterogenizacja). W jednej z tych faz ułamek masowy/molowy składnika A jest odmienny od tego samego ułamka w drugiej fazie, przy czym wartości ułamków są zdeterminowane w stanie równowagi.
2. CEL ĆWICZENIA:
Celem ćwiczenia jest określenie stężeń, w których występuje zjawisko heterogenizacji / homogenizacji mieszaniny przy założonej temperaturze i wykreślenie izotermy rozpuszczalności na diagramie Gibbsa.
3. ZADANE PARAMETRY:
Na podstawie miareczkowania etanolem układu benzen - woda destylowana aż do uzyskania klarownego roztworu należy wyznaczyć punkty na binodzie ograniczające zakres częściowej rozpuszczalności badanego układu trojskładnikowego. Punkty na binodzie wyznaczyć można przeprowadzając w tej samej temperaturze miareczkowanie roztworu benzen - etanol wodą destylowaną, aż do pojawienia się zmętnienia. Jeśli punkty uzyskane obydwoma sposobami będą leżały na tej samej binodzie (izotermie), uzyskamy potwierdzenie prawidłowości wykonania badania układu.
4. SPOSÓB WYKONANIA ĆWICZENIA:
Przygotowanie mieszaniny benzen - woda destylowana i ustabilizowanie jej temperatury w termostacie.
Przygotowanie etanolu w biurecie.
Miareczkowanie etanolem mieszaniny aż do utworzenia mieszaniny jednorodnej.
Zapis wyników miareczkowania i sprawdzenie temperatury.
Następnie - każdorazowo - dolewa się niewielkie ilości wody do mieszaniny w celu jej heterogenizacji i znowu odmiareczkowuje się odpowiednią ilością etanolu. Taki zestaw miareczkowań służy do określenia położenia binody na diagramie Gibbsa. Kolejnym etapem pomiarów jest „odwrócenie” metody, to znaczy miareczkowanie roztworu benzen - etanol wodą destylowaną, aż do jego zmętnienia. Oczywiście proporcje składników mieszaniny równowagowej w obydwu przypadkach muszą być zachowane, co jest weryfikacją poprawności przeprowadzonego doświadczenia. Wszystkie pomiary muszą się odbywać w tej samej temperaturze, gdyż binoda jest izotermą.
5. WYNIKI POMIARÓW:
ZESTAWIENIE DANYCH DOŚWIADCZALNYCH |
||||||
TEMPERATURA |
||||||
STĘŻENIE ALKOHOLU |
||||||
GĘSTOŚĆ ALKOHOLU |
||||||
GĘSTOŚĆ CZYST. BENZENU |
||||||
GĘSTOŚĆ CZYST. WODY |
||||||
GĘSTOŚĆ CZYST. ETANOLU |
||||||
L.P. |
OBJĘTOŚĆ V |
% WAGOWY |
||||
|
A |
B |
C |
A |
B |
C |
|
BENZEN |
WODA |
ETANOL |
BENZEN |
WODA |
ETANOL |
1 |
20.0 (20.0) |
2.8 (2.0) |
19.0 (19.8) |
0.50 |
0.08 |
0.42 |
2 |
20.0 (20.0) |
3.4 (2.5) |
20.7 (21.6) |
0.47 |
0.09 |
0.44 |
3 |
20.0 (20.0) |
3.7 (2.8) |
22.0 (22.9) |
0.45 |
0.10 |
0.45 |
4 |
20.0 (20.0) |
3.8 (2.9) |
22.4 (23.3) |
0.43 |
0.12 |
0.45 |
W nawiasach podane zostały objętości mieszanych ze sobą cieczy, natomiast pogrubione wartości określają rzeczywiste objętości cieczy pozostających w równowadze, gdyż uwzględniono, że stosowany alkohol nie jest czystym etanolem, lecz jego stężonym roztworem wodnym - w związku z tym ilość wody jest nieco większa, natomiast etanolu mniejsza.
Przeliczenie objętości:
Zakładając, że mieszanie etanolu i wody nie powoduje kontrakcji ani ekspansji objętości, można zapisać: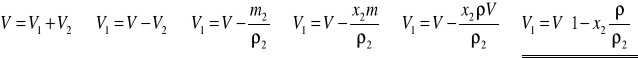
W związku z tym niedobór objętości etanolu, a tym samym naddatek objętości wody wyraża się wzorem:
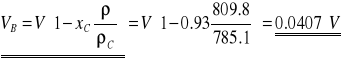
,
gdzie V jest objętością 93 %-go alkoholu użytego do miareczkowania.
Tą poprawkę każdorazowo uwzględniono w tabeli zbiorczej.
OPRACOWANIE DANYCH DOŚWIADCZALNYCH:
Obliczenie ułamków masowych:
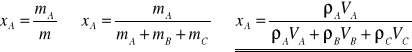
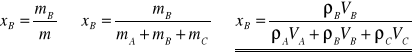
![]()
Operując każdorazowo objętościami i gęstościami czystych składników, można określić ułamki masowe składników w mieszaninie.
W drugim etapie doświadczenia, gdzie miareczkowanie odbywało się wodą, a roztworem był układ benzen - etanol, otrzymano niemalże identyczne proporcje składników, jak w przypadku pierwszym.
Zaznaczenie wyników na trójkątnym diagramie faz Gibbsa:
Na diagramie zaznaczono:
Punkty odpowiadające mieszaninom równowagowym otrzymanym w doświadczeniu, należące do binody.
Odcinki obrazujące mieszanie/miareczkowanie mieszaniny woda - benzen za pomocą etanolu.
Fragment binody, w oparciu o wyniki pomiarów.
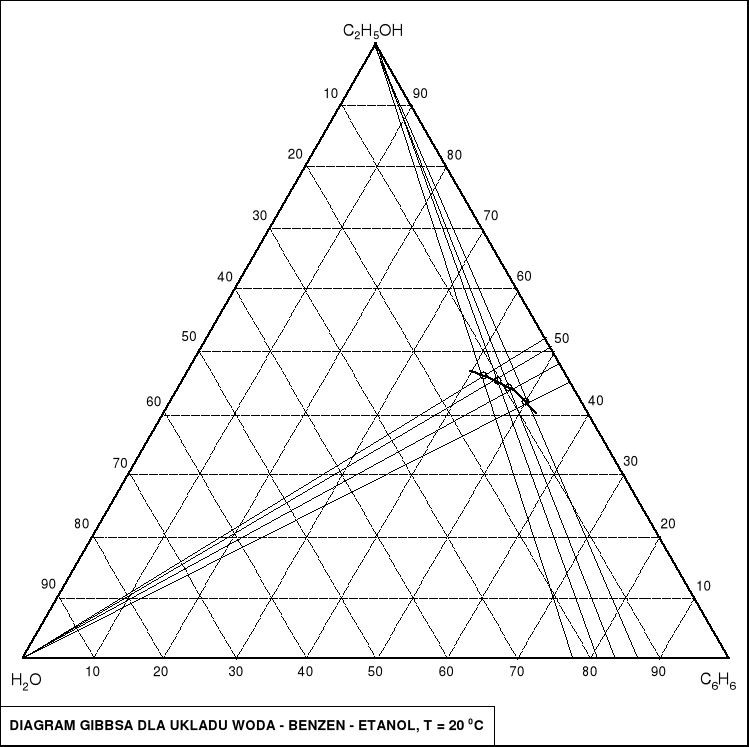
6. DYSKUSJA WYNIKÓW:
Zarówno skład mieszanin pozostających w równowadze, jak i skład wyjściowych roztworów został dość wiernie oddany na wykresie fazowym Gibbsa. Także charakter izotermy (binody) jest dosyć zbliżony do kształtu krzywej otrzymanej w wyniku dokładniejszych badań lub rozważań teoretycznych (którą znaleźć można w literaturze). Widać także, że - niezależnie od zastosowanej metody miareczkowania- skład mieszaniny określonej konkretnym punktem na binodzie pozostaje stały.
7. WNIOSKI KOŃCOWE:
Jeżeli dla danego układu przeprowadzono by więcej pomiarów z uwzględnieniem zróżnicowanego składu tego układu, to można by uzyskać pełny kształt binody, jeżeli badania byłyby przeprowadzone w jednakowej temperaturze. Taki wykres, z dodatkową informacją, jaką jest kształt linii zwanych konodami, jest powszechnie stosowany do bilansowania ekstrakcji - jednej z metod rozdziału.
Przyczyny trudności i ewentualnych błędów:
Temperatura w trakcie prowadzenia doświadczenia wykazywała pewne fluktuacje, więc mogło to mieć wpływ na stan równowagi w układzie.
Szkło laboratoryjne było w niewielkim stopniu zanieczyszczone, więc w układzie mogły znaleźć się także inne substancje, niż te badane.
Aby ustaliła się równowaga w układzie, potrzeba odpowiednio długiego czasu, więc mogły wystąpić także drobne błędy podczas samego miareczkowania.
1
Wyszukiwarka
Podobne podstrony:
Hoffmann, W3 - chemiczny
Wilk, W3 - chemiczny
7214, W3 - chemiczny
5133, W3 - chemiczny
W3 Chemiczne skladniki komorki
Ożyhar, W3 - chemiczny
Oleksyszyn, W3 - chemiczny
Szczygieł, W3 - chemiczny
hoffmann, W3 - chemiczny
5672, W3 - chemiczny
Ożyhar, W3 - chemiczny
Lejczak, W3 - chemiczny
7386, W3 - chemiczny
(), W3 - chemiczny
(), W3 - chemiczny
Oleksyszyn, W3 - chemiczny
9451, W3 - chemiczny
ożychar, Politechnika Wrocławska, W3 - chemiczny
więcej podobnych podstron