Grupa: Zespół: |
Ćwiczenie: 1 |
Data: |
|
Temat: Pomiar ciepła rozpuszczania NaOH metodą kalorymetryczną. |
Ocena: |
Część teoretyczna:
Ciepło rozpuszczania Qrozp jest to ciepło wydzielone w procesie rozpuszczenia 1 mola substancji w n-molach rozpuszczalnika. Jego wartość zależy od rodzaju substancji i rozpuszczalnika oraz jego ilości. Towarzyszące rozpuszczaniu ciepło jest sumą dwóch efektów:
-zniszczenia sieci krystalicznej substancji rozpuszczanej, kosztem pobrania z otoczenia (w postaci ciepła) energii równej tzw. energii sieciowej (wielkość ta zależy od elektroujemności jonów, ich wielkości, struktury krystalicznej)
-solwatacji jonów przez cząsteczki rozpuszczalnika (wielkość ta zależy od polarności rozpuszczalnika, przenikalności dielektrycznej i zdolności do tworzenia wiązań koordynacyjnych). Ciepło rozpuszczania może być zarówno dodatnie, jak i ujemne. Zależy to od wzajemnego stosunku wielkości energii sieciowej do energii solwatacji.
Stała kalorymetru K jest to wielkość charakteryzująca dany kalorymetr, wyznaczona doświadczalnie i równa:
gdzie: Q - znana ilość ciepła
Δt - przyrost temperatury wywołany znana ilością ciepła Q°
Do pomiaru ciepła rozpuszczania posługujemy się kalorymetrem. Przykładowy kalorymetr przedstawiony jest schematycznie na poniższym rysunku. W naszym ćwiczeniu stosujemy jednak nieco inny kalorymetr (prostszy). Zamiast naczynia Dewara stosujemy zwykłą zlewkę, która jest umieszczona w metalowym cylindrze wypełnionym wodą. Probówkę z zatyczką ze szlifem zamieniliśmy na szklaną bańkę, wypełnioną stałym NaOH, którą po wstępnym ustaleniu się temperatury rozbijamy bagietką, wtedy stały NaOH ulega rozpuszczeniu.
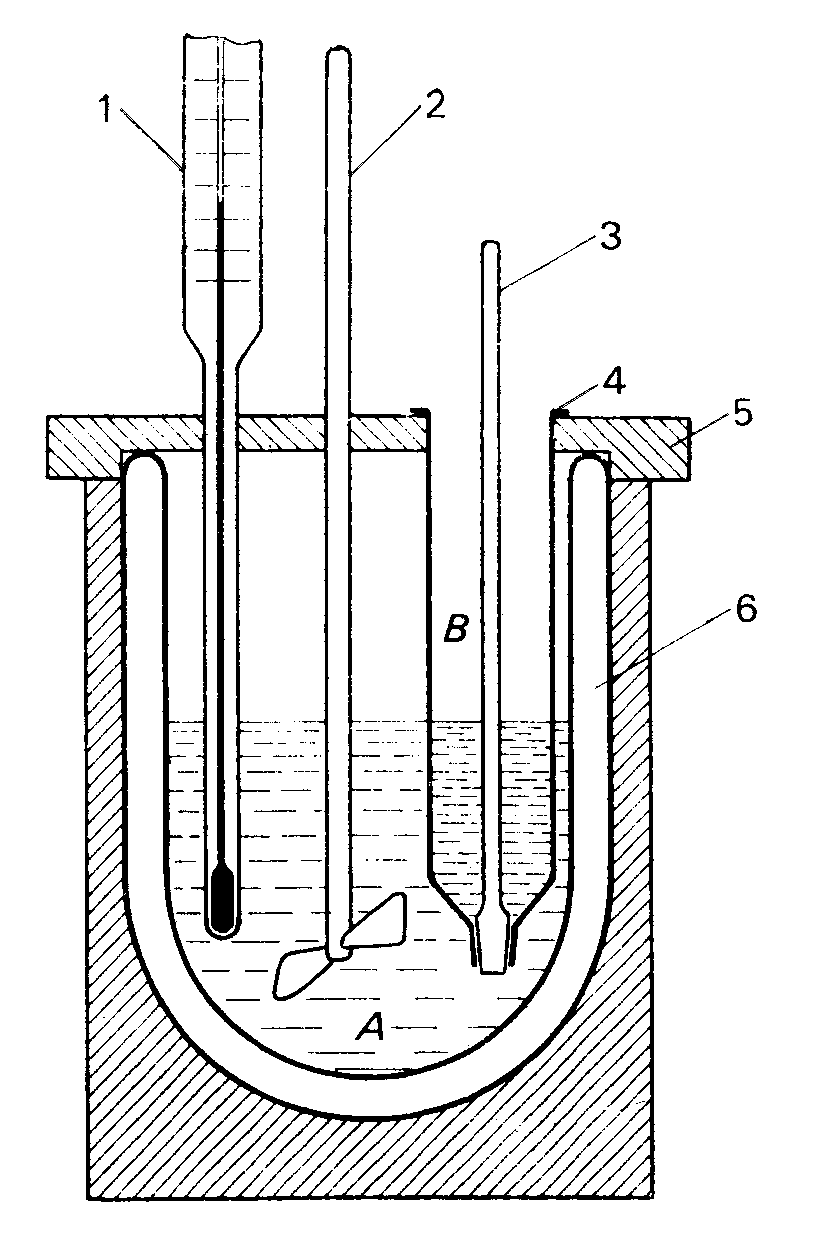
Rys. Schemat kalorymetru do pomiaru ciepła rozpuszczania:
A - woda, B - wodorotlenek sodu stały, 1 - termometr Beckmanna, 2 - mieszadło, 3 - zatyczka ze szlifem, 4 - probówka, 5 - pokrywa, 6 - naczynie Dewara
WYKONANIE ĆWICZENIA:
Do naczynia kalorymetrycznego wlewamy 1750 ml H![]()
O, wkładamy zlewkę napełnioną 500 ml H![]()
O i w niej umieszczamy bańkę z 30 g NaOH. Włączamy mieszadło i mierzymy temperaturę do ustalenia się jej na równym poziomie.
POMIARY:
T=82,034-56,062.logR
Przed rozbiciem:
Lp |
Czas [s] |
Temperatura [oC] |
1 |
60 |
17,85 |
2 |
120 |
17,86 |
3 |
180 |
17,86 |
4 |
240 |
17,83 |
5 |
300 |
17,81 |
6 |
360 |
17,60 |
Po rozbiciu:
Lp |
t [s] |
T [oC] |
Lp |
t [s] |
T [oC] |
Lp |
t [s] |
T [oC] |
1 |
15 |
18,00 |
9 |
135 |
18,66 |
17 |
255 |
18,97 |
2 |
30 |
18,06 |
10 |
150 |
18,66 |
18 |
270 |
18,99 |
3 |
45 |
18,27 |
11 |
165 |
18,79 |
19 |
285 |
18,99 |
4 |
60 |
18,31 |
12 |
180 |
18,77 |
20 |
300 |
19,01 |
5 |
75 |
17,84 |
13 |
195 |
18,77 |
21 |
315 |
19,02 |
6 |
90 |
18,45 |
14 |
210 |
18,85 |
22 |
330 |
19,02 |
7 |
105 |
18,56 |
15 |
225 |
18,85 |
23 |
345 |
19,04 |
8 |
120 |
18,68 |
16 |
250 |
18,70 |
24 |
360 |
19,04 |
OBLICZENIE WYNIKÓW:
Qrozp= QNaOH + Qkalor
ΔT=1,2 [K]
nNaOH= 30 [g]/40 [g/mol] =0,75 [mol]
Cp=59,45 [J/mol . K]
QNaOH= nNaOH⋅Cp ⋅ ΔT
QNaOH=53,505 [J]
Kkalor=25,19 [kJ/K]
ΔT=1,2 [K]
Qkalor= Kkalor.⋅ ΔT
Qkalor=30228,5 [J]
Qrozp=53,505 [J] + 30228,5 [J]
Qrozp=30281,505 [J] = 30,28 [kJ]
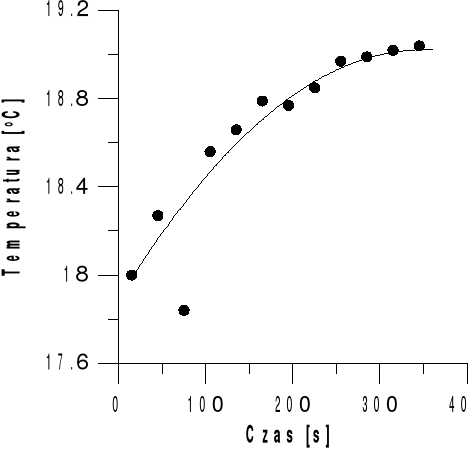
WNIOSKI
Ciepło rozpuszczania NaOH jest to ciepło rozpuszczania 1 mola substancji (NaOH) w n- molach.
Jak widać na wykresie w przedziale czasowym od 0 do 200 sekund. jest chwilowy etap szybkiego wzrostu temperatury, ale już od około 250 sekundy wzrost temperatury jest nagły, a po około 300 sekundach. nieco wolniejszy, ale stale utrzymuje się tendencja zwyżkowa , ze znacznymi etapami podwyższania temperatury (nawet do ok. 0.1°C).
Wyszukiwarka
Podobne podstrony:
Hoffmann, W3 - chemiczny
Wilk, W3 - chemiczny
5133, W3 - chemiczny
W3 Chemiczne skladniki komorki
Ożyhar, W3 - chemiczny
Oleksyszyn, W3 - chemiczny
Szczygieł, W3 - chemiczny
hoffmann, W3 - chemiczny
5672, W3 - chemiczny
Ożyhar, W3 - chemiczny
Lejczak, W3 - chemiczny
15, W3 - chemiczny
7386, W3 - chemiczny
(), W3 - chemiczny
(), W3 - chemiczny
Oleksyszyn, W3 - chemiczny
9451, W3 - chemiczny
ożychar, Politechnika Wrocławska, W3 - chemiczny
więcej podobnych podstron