Technologia chemiczna organiczna, laboratorium
PROCESY OKSYALKILENOWANIA:
REAKCJA EPICHLOROHYDRYNY Z ALKOHOLAMI
Ćwiczenie G
WPROWADZENIE
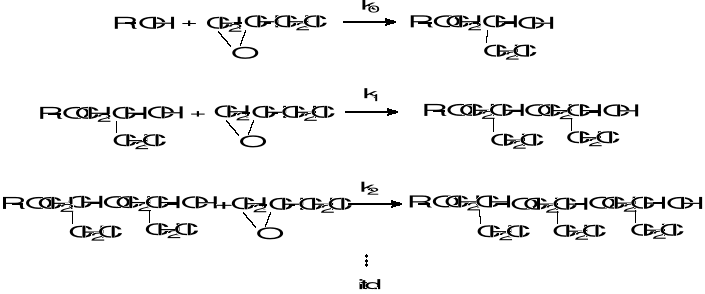
Podczas katalizowanej kwasami Lewisa reakcji epichlorohydryny (1-chloro-2,3-epoksypropanu) z alkoholami alifatycznymi addycja oksiranu przebiega według następującego schematu:
W pierwszym etapie reakcji powstają etery 3-chloro-2-hydroksypropylowo-alkilowe zawierające w swej cząsteczce nową drugorzędową grupę hydroksylowa, która reagując z następną cząsteczką epichlorohydryny tworzy produkty poliaddycji - etery alkilopoliepichlorohydryny.
W wyniku reakcji powstaje mieszanina związków o składzie zależnym zarówno od stosunku molowego wyjściowych reagentów, jak i stałych szybkości poszczególnych etapów przyłączania (k0, k1, k2, itd.). Podczas drugiego i następnych etapów addycji epichlorohydryna reaguje zawsze z drugorzędowa grupa hydroksylową znajdującą się w sąsiedztwie grupy chlorometylowej. Można więc założyć, że stałe szybkości tych reakcji są równe lub bardzo zbliżone do siebie: k1 ≅ k2 ≅ itd. Badania szybkości reakcji (kinetyki reakcji) sprowadzają się więc do wyznaczenia stałej szybkości k0 i k1.
Badania kinetyczne katalizowanej kwasami reakcji epichlorohydryny z alkoholami sugerują,że przebiega ona według mechanizmu substytucji nukleofilowej dwucząsteczkowej SN2 z utworzeniem kompleksu przejściowego przy węglu α epichlorohydryny:
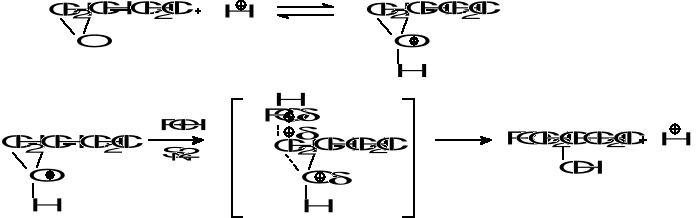
a jej szybkość można opisać równaniem:
![]()
w którym: kII - stała szybkości reakcjidrugiego rzędu;
[ckat.] i [EpCl] - stężenia katalizatora i epichlorohydryny.
Reakcja epichlorohydryny z alkoholami i fenolami stanowi pierwszy etap procesu technologicznego otrzymywania eterów glicydowych (1-alkoksy-2,3-epoksypropanów lub 1-fenoksy-2,3-epoksypropanów), które są substratem do otrzymywania szerokiej gamy produktów: środki powierzchniowo czynne, kationowe i niejonowe środki antystatyczne do tworzyw sztucznych i włókien syntetycznych, żywice epoksydowe alifatyczne i aromatyczne, reaktywne rozpuszczalniki do żywic epoksydowych, itp.
CEL ĆWICZENIA
Celem ćwiczenia jest prześledzenie przebiegu reakcji epichlorohydryny z alkoholami alifatycznymi wobec katalizatorów typu kwasu Lewisa, określenie jej rzędowości w stosunku do epichlorohydryny i wyznaczenie stałej szybkości.
WYKONANIE ĆWICZENIA
Aparatura i szkło
reaktor z płaszczem termostatującym,
ultratermostat,
termometr 0-500C z dokładnością do 0,10C,
mieszadło magnetyczne,
mikropipeta nastawna 200-1000 μl,
pipeta szklana z jedną kreską poj. 20 cm3,
biureta poj. 25 cm3,
kolbki stożkowe poj. 100 cm3 - 10 szt.,
chłodnica zwrotna z rurką zabezpieczającą przed dostępem wilgoci,
zlewki poj. 100-150 cm3 - 2 szt.,
pipeta z jedną kreską poj. 10 cm3 - 1 szt.
Surowce i odczynniki
epichlorohydryna (1-chloro-2,3-epoksypropan) dest., frakcja wrząca w temp. 115-116,50C,
alkohol n-butylowy, osuszony nad MgSO4 i przedestylowany,
eterat trójfluorku boru (BF3⋅Et2O),
roztwór kwasu solnego w dioksanie,
0,2 N r-r KOH w alkoholu metylowym,
czerwień krezolowa, wskaźnik, ok. 0,1 % r-r w alkoholu etylowym
Przebieg ćwiczenia
Przebieg reakcji epichlorohydryny z alkoholami (na przykładzie alkoholu n-butylowego) obserwuje się w warunkach pseudocząsteczkowych, przy zastosowaniu 7-krotnego nadmiaru alkoholu w stosunku do epichlorohydryny, przez oznaczenie zmiany jej stężenia w czasie w stałej temperaturze.
Do szklanego reaktora z płaszczem termostatującym, zaopatrzonego w termometr z podziałką co 0,10C, mieszadło magnetyczne, chłodnicę zwrotną z rurką zabezpieczającą przed dostępem wilgoci oraz zamknięcie do pobierania próbek, wprowadza się dokładnie odważone wyjściowe reagenty (epichlorohydrynę i alkohol n-butylowy w stosunku 1:7). Po uruchomieniu mieszadła magnetycznego, ustaleniu się żądanej temperatury procesu (ultratermostat) i uprzednim pobraniu próbki mieszaniny reakcyjnej, dodaje się mikropipetą ściśle odmierzoną ilość katalizatora (eterat trójfluorku boru). W wybranych odstępach czasu (0, 10, 20, 30, 50, 70, 90 i 120 min) pobiera się mikropipetą z tłokiem jednakowe objętości mieszaniny reakcyjnej i przenosi się do kolbki stożkowej zawierającej 10 cm3 roztworu HCl w dioksanie w celu oznaczenia liczby epoksydowej (patrz załącznik 1). Stężenie epichlorohydryny w mieszaninie reakcyjnej oznacza się na podstawie zawartości grup epoksydowych (liczby epoksydowej LE).
Wyniki oznaczeń zestawia się w następującej tabeli:
Nr próbki |
Czas pomiaru |
Czas reakcji [min] |
V1 |
V0 - V1 |
LE |
ln LE |
0 |
1050 |
0 |
|
|
|
|
1 |
1105 |
10 |
|
|
|
|
2 |
1115 |
20 |
|
|
|
|
itd. |
|
|
|
|
|
|
Opracowanie wyników
W oparciu o uzyskane wyniki zmiany stężenia epichlorohydryny (liczba epoksydowa LE) w czasie sporządzić wykres zależności ln LE = f (t) i wyznaczyć z wykresu stałą szybkości reakcji k0 oraz obliczyć stałą szybkości reakcji kII.
Załącznik 1.
Oznaczanie zawartości grup epoksydowych
(liczby epoksydowej LE)
Zasada oznaczania
Oznaczanie polega na ilościowym przyłączeniu chlorowodoru do grup epoksydowych w środowisku dioksanu, przez dodanie badanej próbki do nadmiaru odczynnika i na miareczkowaniu niezwiązanego chlorowodoru alkoholowym roztworem mianowanego wodorotlenku sodowego lub potasowego.
Odczynniki i roztwory
dioksan czda,
kwas solny stężony czda (d = 1,19 g/cm3),
0,2 N NaOH lub KOH w alkoholu etylowym lub metylowym,
czerwień krezolowa - wskaźnik: 0,1 g soli sodowej czerwieni krezolowej rozpuścić w 100 cm3 50 % alkoholu etylowego.
Przygotowanie roztworu kwasu solnego w dioksanie
Do rozdzielacza zawierającego określoną objętość dioksanu dodaje się kwas solny stężony w ilości 2 cm3 na każde 100 cm3 dioksanu. Zawartość rozdzielacza dokładnie wstrząsa i pozostawia na 2 h do rozdzielenia. Po odstaniu oddziela się dolną warstwę wodną, a pozostałość przelewa się do butelki z ciemnego szkła z dobrze dopasowanym korkiem.
Wykonanie oznaczenia
Do kolbki stożkowej z korkiem szklanym poj. 100 cm3 odmierza się pipetą z jedną kreską 10 cm3 roztworu kwasy solnego w dioksanie. (UWAGA: Roztwór HCl w dioksanie przed pobraniem próbki należy dokładnie wymieszać!), a następnie dodaje się ściśle określoną objętość badanej próbki. Kolbkę zamyka się doszlifowanym korkiem, zawartość miesza się do całkowitego rozpuszczenia próbki i pozostawia się na 0,5 h dla przereagowania składników (HCl z grupami epoksydowymi). Nadmiar nieprzereagowanego chlorowodoru odmiareczkowuje się 0,2 N roztworem wodorotlenku wobec 5-7 kropel czerwieni krezolowej, do uzyskania fioletowego zabarwienia. W taki sam sposób miareczkuje się „ślepą” próbkę (zawierającą tylko 10 cm3 dioksanu).
Liczbę epoksydową LE , wyrażoną ilością równoważników epoksydowych w 100 g badanej próbki oblicza się według wzoru:
![]()
w którym:
V0 - objętość roztworu wodorotlenku sodowego lub potasowego zużyta do miareczkowania „ślepej” próbki, cm3,
V1 - objętość roztworu wodorotlenku sodowego lub potasowego zużyta do miareczkowania badanej próbki, cm3,
N - normalność roztworu wodorotlenku,
m - masa badanej próbki, g (masę badanej próbki ustala się przez zważenie na wadze analitycznej próbki zerowej
KINETYKA REAKCJI EPICHLOROHYDRYNY Z ALKOHOLAMI
protokół z pomiarów
Data.........................
Grupa.......................
Surowce wyjściowe
Epichlorohydryna M.cz. = 92,53 ![]()
= 1,1801
Alkohol n-butylowy M.cz. = 74,12 ![]()
= 0,8104
Eterat trójfluorku boru (BF3⋅Et2O)
M.cz. = 141,94 ![]()
= 1,13
Warunki pomiarów
temperatura ...... ± 0,1 oC,
stosunek molowy reagentów epichlorohydryna:alkohol = 1:7,
stężenie katalizatora (BF3⋅Et2O) ........ mola/mol EpCl
Ilości reagentów
Alkohol n-butylowy : 0,70 mola = ......... g,
Epichlorohydryna : 0,10 mola = ......... g,
Katalizator : ........... mola = ......... g = ........... cm3
Stężenie katalizatora: ........... mol/dm3
Wyniki pomiarów
objętość próbki „zerowej” = 900 μl, masa próbki „zerowej” = ............... g,
objętość r-ru 0,2 N KOH zużyta na miareczkowanie „ślepej” próbki V0 = ............ cm,3
czas dodania katalizatora ..................
Wyniki oznaczeń LE:
Nr próbki |
Czas pomiaru |
Czas reakcji [min] |
V1 |
V0 - V1 |
LE |
ln (LE0/LE) |
0 |
|
0 |
|
|
|
|
1 |
|
10 |
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
7 |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
9 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
1
2

Wyszukiwarka
Podobne podstrony:
Cwiczenie - E, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Cwiczenie - B, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Polikondensacja cw 4, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Kopolimeryzacja cw 3, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
PolimeryzacjaSuspensyjna cw 2, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Zadania na rozgrzewke, Technologia chemiczna PWR, SEMESTR IV, Obliczenia w chemii technicznej
Procesy jednostkowe - egzamin 0, Technologia chemiczna PWR, SEMESTR V, Podstawowe procesy jednostkow
pytania koło koźlecki, Technologia chemiczna PWR, SEMESTR V, Inżynieria chemiczna - lab
Sprawozdanie nr 1 - Kopia, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Sprawozdanie nr 5, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Sprawozdanie nr 1, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
6 - utlenianie cykloheksanolu, Technologia chemiczna PWR, SEMESTR III, Chemia techniczna organiczna
10. Etery, Technologia chemiczna PWR, SEMESTR III, Podstawy chemii organicznej - lab
5 - sole diazoniowe, Technologia chemiczna PWR, SEMESTR III, Chemia techniczna organiczna
Sprawność półki sitowej w procesie desorpcji gazu, Technologia chemiczna PWR, SEMESTR V, Inżynieria
Współczynnik natężenia przepływu, Technologia chemiczna PWR, SEMESTR V, Inżynieria chemiczna - lab
więcej podobnych podstron