Technologia Chemiczna - surowce i procesy przemysłu organicznego
Ćwiczenie 4
Polikondensacja - otrzymywanie żywic fenylowo - formaldehydowej
wg. Y. Bedard, B. Ried, Journal of Chemical Education, 67, 1990, 977
Wprowadzenie:
W odróżnieniu od reakcji polimeryzacji styrenu i metakrylanu metylu, w wyniku których powstają polimery addycyjne, polimer fenolowo-formaldehydowy tworzy się w reakcji polikondensacji. W reakcji polikondensacji powstaje polimer i małocząsteczkowy związek, np. woda, chlorowodór lub inne związki jako produkty uboczne. Tym samym skład chemiczny polimeru różni się od składu chemicznego monomeru. W reakcji polikondensacji udział biorą najczęściej dwa monomery, których funkcyjność polega na obecności grup zdolnych do reakcji. Przedstawicielem polikondensatów są fenoplasty, czyli żywice syntetyczne otrzymywane w wyniku reakcji polikondensacji fenolu lub jego pochodnych (m-krezol, rezorcyna) z aldehydami, najczęściej formaldehydem.
W zależności od budowy i stosunku molowego substratów oraz od warunków prowadzenia procesu, w wyniku reakcji fenoli z aldehydami można otrzymać dwa rodzaje żywic fenolowych:
1. termoplastyczne żywice nowolakowe,
2. termoutwardzalne żywice rezolowe.
Ze względu na możliwość przeprowadzania polimerów ze stanu skupienia stałego do stanu ciekłego (stop polimerowy) pod wpływem temperatury dzielimy polimery na: termoplasty i duroplasty, Termoplasty można przeprowadzać w stan stopu wielokrotnie, a duroplasty tylko raz, ponieważ pod wpływem temperatury ulegają sieciowaniu (mostki poprzeczne między łańcuchami polimerowymi).
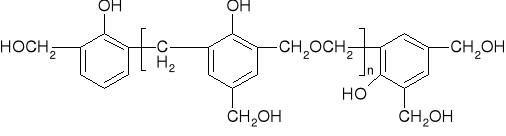
Nowolaki tworzą się podczas reakcji w środowisku kwasowym (nadmiar fenolu) i są to żywice termoplastyczne i rozpuszczalne w rozpuszczalnikach organicznych. Jednostkami łączącymi pierścienie fenolowe w nowolakach są mostki metylenowe. Sieciowanie (utwardzanie) nowolaków może przebiegać w wyniku ich ogrzewania, ale tylko w obecności aldehydów (żywice chemoutwardzalne).
Rezole powstają w środowisku zasadowym przy nadmiarze formaldehydu w stosunku do fenolu. W takiej żywicy pierścienie fenolowe połączone są wiązaniami metylenowymi i dimetylenoeterowymi, oprócz tego w żywicy obecne są też reaktywne grupy hydroksymetylowe (metylolowe), tj. -CH2OH, najczęściej w pozycji para do grupy fenolowej i w tym miejscu tworzy się wiązanie sieciujące. Pod wpływem temperatury rezole ulegają częściowemu usieciowaniu (rezitole), a następnie całkowitemu usieciowaniu (rezity). Rezity są już żywicami całkowicie nierozpuszczalnymi i niepłynącymi w podwyższonej temperaturze
Polikondensację można prowadzić w roztworze, w stopie lub na granicy faz. Zaletą polikondensacji prowadzonej w roztworze jest możliwość lepszego odprowadzania ciepła reakcji, a także możliwość uzyskiwania dużych mas cząsteczkowych. Rozróżniamy polikondensację, w której otrzymany związek wielkocząsteczkowy dobrze rozpuszcza się w rozpuszczalniku, oraz polikondensację, w której w roztworze znajdują się tylko substraty polireakcji, a powstały związek wielkocząsteczkowy nie rozpuszcza się. Rozpuszczalnik musi być tak dobrany, aby sprzyjał tworzeniu się wielkocząsteczkowego produktu. Powinien ułatwiać szybkie usuwanie z układu produktów ubocznych, jak np. H2O, NaCl itp., szybkie zmieszanie i homogenizację substratów oraz związaną z tym lepszą wymianę ciepła. Usunięcie małocząsteczkowych produktów ubocznych jest szczególnie ważne w reakcjach odwracalnych, ponieważ powoduje ono przesunięcie równowagi reakcji w stronę otrzymania związku wielkocząsteczkowego.
Wpływ na przebieg reakcji polikondensacji mają: stosunek molowy substratów polireakcji (stosunek między liczbą ich grup funkcyjnych), obecność domieszek związków jednofunkcyjnych, stężenie monomerów, temperatura reakcji, katalizator, rozpuszczalnik.
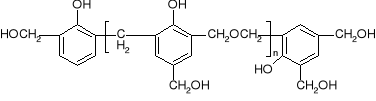
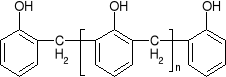
struktura o-nowolaku struktura rezolu
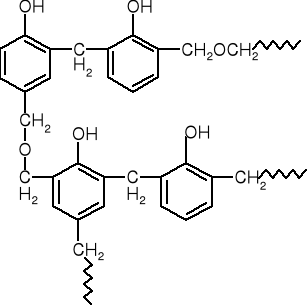
uproszczona struktura usieciowanej żywicy fenolowo-formaldehydowej
Odczynniki:
fenol 27g
paraformaldehyd 21g
woda destylowana 32 cm3
wodorotlenek sodu 50% r-r 2,4 cm3 + 2,75 cm3
wodorotlenek amonu 30%r-r 1,75 cm3
Wykonanie ćwiczenia:
Do kolby trójszyjnej o poj. 250 cm3 zaopatrzonej w mieszadło mechaniczne, chłodnicę zwrotną i wkraplacz wprowadza się 27g fenolu i część wody, miesza do momentu rozpuszczenia fenolu. Następnie dodaje się 21g paraformaldehydu i pozostałą część wody, miesza. Następnie do kolby wkrapla się 2,4 cm3 r-ru NaOH w ciągu kilku minut, wyjmuje wkraplacz, montuje termometr i ogrzewa mieszaninę reakcyjną w temperaturze 85°C przez 65 minut (nie wolno przekraczać podanej temperatury). Po tym czasie ochłodzi się mieszaninę reakcyjną do 30-40°C i dodaje 2,75 cm3 r-ru wodorotlenku sodu i 1,75 cm3 r-ru wodorotlenku amonu.
Następnie należy przeprowadzić wymienione oznaczenia:
pH żywicy;
zawartość części stałej - zważyć małą część roztworu przeniesioną na małą szalkę, odparować do sucha i ponownie zważyć;
czas sieciowania (utwardzania) żywicy w 110°C - wlać do wgłębień podgrzewanej płytki metalowej małe ilości żywicy i mieszając szpatułką mierzyć czas do chwili, w której żywica zacznie być krucha („nitki" żywicy zaczynają się urywać);
zdolność klejenia drewna - powlekać cienką warstwą roztworu żywicy dwa kawałki drewna, połączyć je ściskaczem i umieścić w suszarce w 100°C na jedną godzinę.
Literatura:
Z. Florjańczyk, S. T. Penczek - „Chemia Polimerów", Wyd. Pol. Warszawska, Wa-wa 1997
J. F. Rabek - „Współczesna Wiedza o Polimerach”, Wyd. Naukowe PWN, W-wa 2008
A. Puszyński, J. Pielichowski - „Chemia Polimerów" Wyd. AGH, Kraków 1998
Zagadnienia do przygotowania:
surowce polikondensacji i ich funkcyjność, różnica pomiędzy polimeryzacją, i polikondensacją, fenoplasty: właściwości, rodzaje i zastosowanie, polimery kondensacyjne, sieciowanie żywic fenylowych
Wyszukiwarka
Podobne podstrony:
Kopolimeryzacja cw 3, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
PolimeryzacjaSuspensyjna cw 2, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Cwiczenie - E, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Cwiczenie - B, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Cwiczenie - G, Technologia chemiczna pwr, 5 semestr, SIPPO, Laborka
Chemia techniczna organiczna ćw. 1 destylacja, Technologia chemiczna PWR, SEMESTR III, Chemia techni
Zadania na rozgrzewke, Technologia chemiczna PWR, SEMESTR IV, Obliczenia w chemii technicznej
Procesy jednostkowe - egzamin 0, Technologia chemiczna PWR, SEMESTR V, Podstawowe procesy jednostkow
pytania koło koźlecki, Technologia chemiczna PWR, SEMESTR V, Inżynieria chemiczna - lab
Sprawozdanie nr 1 - Kopia, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Sprawozdanie nr 5, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
Sprawozdanie nr 1, Technologia chemiczna PWR, SEMESTR III, Miernictwo i automatyka - lab
6 - utlenianie cykloheksanolu, Technologia chemiczna PWR, SEMESTR III, Chemia techniczna organiczna
10. Etery, Technologia chemiczna PWR, SEMESTR III, Podstawy chemii organicznej - lab
5 - sole diazoniowe, Technologia chemiczna PWR, SEMESTR III, Chemia techniczna organiczna
Sprawność półki sitowej w procesie desorpcji gazu, Technologia chemiczna PWR, SEMESTR V, Inżynieria
więcej podobnych podstron