Technologia chemiczna organiczna, laboratorium
Ćwiczenie B
PROCESY UTLENIANIA: UTLENIANIE KSYLENÓW
WPROWADZENIE
Utlenianie związków organicznych tlenem cząsteczkowym jest rodnikową reakcją łańcuchową o złożonym mechanizmie. Podobnie jak inne reakcje rodnikowe, utlenianie jest przyspieszane przez wysoką temperaturę, światło i substancje ułatwiające powstawanie wolnych rodników, np. jony metali ciężkich. Substancje takie nazywamy inicjatorami reakcji rodnikowych.
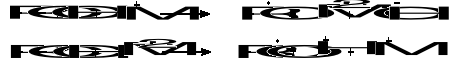
Pierwszymi uchwytnymi produktami utleniania są wodoronadtlenki, których powstawanie można przedstawić następującym równaniem:
![]()
węglowodór wodoronadtlenek
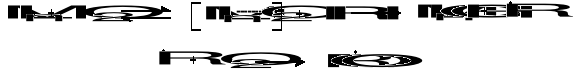
W rzeczywistości, gdy reakcja z tlenem odbywa się w obecności inicjatorów, można wyróżnić trzy elementarne stadia:
![]()
1) inicjacja - zapoczątkowanie przez rodnik inicjujący
rodnik inicjujący rodnik alkilowy
2) kontynuacja (propagacja)
![]()
- reakcja rodników alkilowych z tlenem
rodnik nadtlenkowy
- wytwarzanie wolnych rodników w reakcji rodników nadtlenkowych z węglowodorem
![]()
3) zakończenie reakcji w wyniku rekombinacji rodników

Łańcuchowy charakter utleniania polega na tym, że reakcje 2 powtarzają się aż do wyczerpania substratów lub do zużycia wolnego rodnika w innym procesie (proces rekombinacji), zanim zdąży on przereagować z tlenem. Powstawanie nadtlenków w czasie reakcji 2 sprawia, że przebiega ona autokatalitycznie.
Katalityczne działanie jonów metali ciężkich nie ogranicza się tylko do okresu inicjacji reakcji utleniania. Powodują one także rozkład wodoronadtlenków z wytworzeniem wolnych rodników:
jak też na aktywują tlen cząsteczkowy lub węglowodór wg reakcji:
![]()
Reakcje utleniania mogą zachodzić w podwyższonych temperaturach, jakie panują podczas spalania (reakcja jest inicjowania przez tlen), zachodzą one także w łagodnych warunkach, np. w temp. pokojowej; określa się je wtedy mianem autoutleniania (autooksydacji). Reakcja ta jest przyśpieszana przez światło. Autooksydacja jest uciążliwym zjawiskiem, bo jej konsekwencją jest „psucie się” wielu produktów organicznych. Guma i tworzywa sztuczne pękają i tracą swe właściwości, a żywność wymaga ochrony nie tylko przed bakteriami i pleśniami, ale także przed dostępem powietrza i światła.
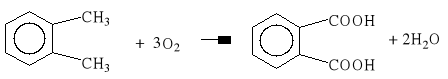
Procesy utleniania tlenem cząsteczkowym mają duże znaczenie przemysłowe: utlenianie wyższych parafin, kumenu, aldehydu octowego, kwasu octowego, czy ksylenów, stanowią przykłady tego typu procesów zrealizowane w skali przemysłowej.
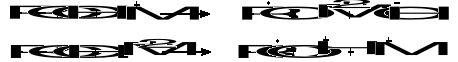
Tlen cząsteczkowy w obecności organicznych soli kobaltu (octan, stearynian) utlenia w ksylenach (w stosunkowo łagodnych warunkach: faza ciekła, temp. 120°C) tylko jedną grupę metylową. Dla utlenienia drugiej grupy metylowej w tych warunkach konieczne jest zneutralizowanie pasywującego działania grupy karboksylowej. Dla utlenienia drugiej grupy metylowej w tych warunkach konieczne jest zneutralizowanie pasywującego działania grupy karboksylowej. Osiąga się to prowadząc reakcję w wyższej temperaturze i pod zwiększonym ciśnieniem, estryfikując tą grupę lub stosując katalizator składający się z organicznej soli kobaltu i bromku (NaBr lub CoBr2) oraz prowadząc reakcję w roztworze organicznego kwasu. W każdym z tych przypadków zachowana zostaje kolejność utleniania grup metylowych - najpierw jedna z nich utlenia się do grupy karboksylowej, a dopiero następnie druga.
Pełne utlenienie grup metylowych w o-ksylenie daje kwas ftalowy, a w p-ksylenie - kwas tereftalowy:
kwas ftalowy
kwas tereftalowy
Jednoetapowe utlenianie p-ksylenu do kwasu tereftalowego prowadzi się w roztworze lodowatego kwasu octowego w obecności octanu kobaltu i bromku sodu. Stosunek ilościowy octanu kobaltu do bromku sodowego wpływa na szybkość utleniania. Maksymalną szybkość obserwuje się przy stosunku molowym tych soli bliskim jedności. Jedną z możliwych przyczyn zmniejszenia dezaktywującego działania grupy karboksylowej w tym wypadku może być przeniesienie elektronu przez jon bromkowy na grupę metylową p-ksylenu.
Kwas ftalowy nie posiada znaczenia technicznego, ponieważ do syntezy jego pochodnych używa się zawsze bezwodnika ftalowego, wytwarzanego albo przez utlenianie naftalenu, albo utlenianie o-ksylenu. Natomiast kwas tereftalowy i jego ester dimetylowy stanowią półprodukty w wytwarzaniu tworzyw poliestrowych (PET) i włókien poliestrowych, np. Terylen, Elana, Lawsan:

CEL ĆWICZENIA
Celem ćwiczenia jest prześledzenie przebiegu procesu utleniania p-ksylenu tlenem cząsteczkowym do kwasu tereftalowego.
WYKONANIE ĆWICZENIA
Utlenianie p-ksylenu
Śledzenie przebiegu utleniania p-ksylenu do kwasu tereftalowego polega na pomiarze szybkości pochłaniania tlenu. Aparatura do utleniania zaopatrzona jest w termostatowaną biuretę gazową, której dolny koniec połączony jest z rozdzielaczem, wypełnionym barwnym roztworem stanowiącym zamknięcie hydrauliczne. Przez podnoszenie i opuszczanie rozdzielacza napełnia się tlenem lub opróżnia biuretę oraz odczytuje się objętość tlenu w biurecie po zrównoważeniu ciśnienia w aparaturze z ciśnieniem atmosferycznym.
surowce i odczynniki
p-ksylen,
octan kobaltu,
tlen,
bromek sodowy,
kwas octowy lodowaty.
UWAGA!
Lodowaty kwas octowy jest substancją bardzo niebezpieczną, silnie trującą, parzącą i duszącą. Wszelkie operacje z nim należy wykonywać pod dobrze działającym wyciągiem w gumowych rękawiczkach i okularach ochronnych. W wypadku polania lub opryskania ciała kwasem octowym należy natychmiast zmyć miejsce kontaktu silnym strumieniem wody.
przebieg syntezy
W reaktorze umieszcza się 0,4-0,5g Co(CH3COO)2⋅ 4H2O (odważonego z dokładnością do 0,05g), 0,20-0,25g NaBr, 20-35 cm3 lodowatego kwasu octowego i 1,0-2,0 cm3 p-ksylenu oraz mieszadło magnetyczne. Następnie przedmuchuje się aparaturę czystym tlenem w celu usunięcia powietrza, uruchamia się mieszadło magnetyczne i rozpoczyna proces utleniania. Temperatura wody w płaszczu grzejnym reaktora powinna wynosić 80°C, a temperatura wody przepływającej przez chłodnicę zwrotną i płaszcz termostatujący biurety gazowej 20±0,1°C.
Odczytu objętości tlenu w biurecie dokonuje się w 5 min odstępach czasu aż do momentu, gdy zużycie tlenu pomiędzy kolejnymi pomiarami będzie mniejsze niż 5 cm3.
Pod koniec procesu roztwór staje się mętny od wypadającego, nierozpuszczalnego w kwasie octowym kwasu tereftalowego. Po zakończeniu utleniania i ochłodzeniu reaktora do temp. 400C, kwas ten odsącza się na lejku szklanym G-4 (nie myć lejka wodą !), przemywa się osad niewielką objętością etanolu i suszy. Otrzymany kwas waży się i oblicza się wydajność reakcji.
UWAGA:
Podczas dokonywania odczytów objętości tlenu w biurecie należy pamiętać o każdorazowym wyrównaniu poziomów cieczy w biurecie i rozdzielaczu.
zestawienie wyników
Sporządzić wykres V(O2)=f(t) i α (ksylenu) = f(t) (na jednym rysunku).
Załącznik:
Wybrane właściwości fizykochemiczne surowców i produktów
Substancja |
M |
|
Tw [oC] |
Tt [oC] |
|
Rozpuszczalność w H2O w 20oC, [g/100g] |
p-Ksylen |
106,2 |
0,861 |
138,4 |
13,2 |
1,5004 |
n.r. |
Kwas octowy |
60,0 |
1,059 |
118,1 |
16,6 |
1,3598 |
∞ |
Tlen |
32,0 |
1,429 kg/m3 |
-183 |
-218,4 |
- |
3,16 cm3/100g |
Bromek sodowy |
102,9 |
3,21 |
1392 |
755 |
- |
94,6 |
Octan kobaltu |
177 |
- |
- |
- |
- |
- |
Kwas p-toluilowy |
136,2 |
- |
275 |
182 |
- |
t.r. |
Kwas terftalowy |
166,1 |
- |
- |
300 r. |
- |
t.r. |
4
1
![]()
![]()
![]()
![]()

![]()

Wyszukiwarka