Wyznaczanie stałej inhibicji (Ki) dla dehydrogenazy bursztynianowej
WSTĘP
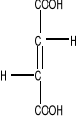
Dehydrogenaza bursztynianowa (EC 1.3.99.1 ) jest flawoproteiną integralnie związaną z wewnętrzną błoną mitochondrialną. Grupą prostetyczną enzymu jest kowalencyjnie związana cząsteczka FAD. Pierscień izoalloksazynowy FAD wiąże się z enzymem wiązaniem kowalencyjnym przez boczny łańcuch histydyny. Cząsteczka dehydrogenazy bursztynianowej oprócz FAD zawiera 4 atomy żelaza niehemowego. Enzym jest zatem białkiem żelazo-siarkowym. W warunkach fizjologicznych enzym utlenia bursztynian do fumaranu w myśl reakcji:
![]()
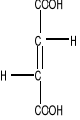

Bursztynian Fumaran
FADH2 utworzony w rezultacie utleniania bursztynianu nie oddysocjowuje od en-zymu, a dwa elektrony z FADH2 sa przenoszone bezpośrednio na ugrupowania Fe-S. Akceptorem wodorów dla zredukowanej dehydrogenazy bursztynianowej jest ko-enzym Q (ubichinon).
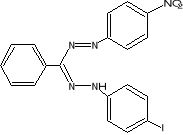
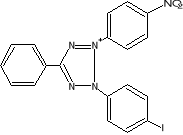
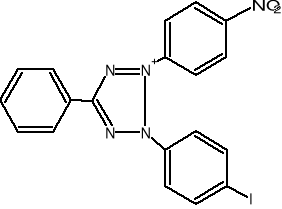
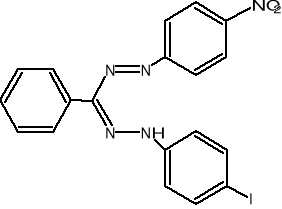
W oznaczeniach aktywności enzymatycznej używane są sztuczne akceptory wodoru jak, błękit metylenowy czy też barwniki tetrazoliowe (błękit nitrotetra-zoliowy,2-[p-jodofenylo-(3-p-nitrofenylo)-5-fenylotetrazoliowy chlorek]. W stoso-wanej metodzie oznaczania aktywności dehydrogenazy bursztynianowej akceptorem wodorów jest chlorek jodo-nitro-tetrazoliowy (INT), który ulega redukcji do barwne-go formazanu w myśl reakcji:
![]()
INT INT - formazan
Powstający w reakcji INT-formazan jest rozpuszczalny w mieszaninie octan etylu/etanol i wykazuje maksimum absorbcji przy λ=470nm.
HAMOWANIE AKTYWNOŚCI DEHYDROGENAZY BURSZTYNIANOWEJ PRZEZ MALONIAN.
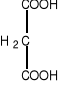
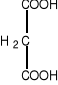
Niektóre związki, o strukturze zbliżonej do cząsteczki substratu mogą konkurować z nim o centrum katalityczne enzymu. W przypadku dehydrogenazy bursztynianowej może to być malonian lub szczawian.
![]()
![]()
bursztynian malonian szczawian
Centrum aktywne dehydrogenazy nie odróżnia tych związków od burszty-nianu w wyniku czego powstaje kompleks enzym-inhibitor, który nie ulegając rozpadowi na enzym i produkt blokuje centrum aktywne dehydrogenazy. Ten typ hamowania określany jest jako hamowanie kompetycyjne. Hamowanie to jest uzależnione od stosunku stężenia inhibitora do stężenia substratu. Typ hamowania (kompetycyjny lub niekompetycyjny) oraz wartość stałej inhibicji (Ki) można określić metodą Dixona. Metoda jest oparta na wyznaczaniu szybkości reakcji (v) przy kilku stałych stężeniach substratu [S] oraz kilku stężeniach inhibitora [I]. Na podstawie wyznaczonych szybkości reakcji wykreślamy krzywą zależności 1/v od [I] dla poszczególnych stężeń substratu.
Wykres pozwala ustalić typ hamowania oraz wartość Ki (patrz Rys. 1).
Metoda Dixona jest prostą metodą wyznaczania stałej inhibicji metodą graficzną bezpośrednio z rysunku bez dodatkowych obliczeń.
(A) (B)
Rys. 1. Krzywa Dixona: 1/v = f [I] dla inhibitora kompetycyjnego (A) i
niekompetycyjnego (B).
MATERIAŁY I METODY:
Odczynniki:
1. 0,5 M bufor fosforanowy (K), pH 7.4
2. 0,05 M bufor fosforanowy (K), pH 7.4 (homogenizacyjny)
3. 0,25 M bufor fosforanowy (K), pH 7.4
4. 0,4% roztwór INT w H2O
5. 0,065 M kwas malonowy w H2O
mieszanina octanu etylu i etanolu (1:1 v/v), zawierająca 5% kwas trójchlorooctowy (TCA)
0,025 M bursztynian sodowy w 0,25 M bufor fosforanowy (K), pH 7.4
0,0625 M bursztynian sodowy w 0,25 M bufor fosforanowy (K), pH 7.4
Przygotowanie homogenatu:
Odważoną (2 g) wątrobę wołową, rozdrobnić w homogenizatorze nożykowym lub mikserze z 18 ml 0,05 M buforu fosforanowego (K), pH 7.4 (10 % homogenat). Homogenat wirujemy przez 10 min. przy 3000 obr./min. Do oznaczeń 10% homogenat rozcieńczyć 10-krotnie buforem homogenizacyjnym (1 ml homogenatu + 9 ml buforu).
WYKONANIE OZNACZEŃ:
Przygotowanie roztworów inhibitora:
Z roztworu kwasu malonowego przygotowujemy 5 rozcieńczeń w następujący sposób: odmierzamy - 0.25, 0.50, 0.75, 1.0 i 1.5 ml 65 mM kwasu malonowego i uzupełniamy objętość wodą destylowaną do 5 ml. Otrzymujemy roztwory kwasu malonowego o następujących stężeniach: 3.25, 6.50, 9.75, 13.00 i 19.5 mM.
Przygotowanie roztworów substratu:
50 mM i 125 mM roztwory bursztynianu rozcieńczamy dwukrotnie 0,5 M buforem fosforanowym (5 ml substratu + 5 ml buforu). Otrzymujemy roztwory substratu o następujących stężeniach: 25 mM i 62.5 mM bursztynianu w 0,25 M buforze fosforanowym, pH 7.4.
Przygotowania mieszaniny reakcyjnej:
Do oznaczeń przygotowujemy 26 probówek. Do 12 probówek (1 ÷ 12) pipetujemy po 0.4 ml zbuforowanego 25 mM bursztynianu sodowego, a do kolejnych 12 probówek (1' ÷ 12') po 0.4 ml 62.5 mM bursztynianu. Do 2 pozostałych probówek (próby zerowe 13 i 13') dodajemy 0.4 ml 0,25 M buforu fosforanowego, pH 7,4.
Do wszystkich (26) probówek dodajemy po 0.2 ml 0.4 % INT. Z każdego zestawu 12 probówek zawierających dwa różne stężenia bursztynianu (25mM lub 62.5 mM) wydzielamy dwie próby (kontrolne - 11, 12 oraz 11', 12'), do których dodajemy 0.2 ml H2O; natomiast do pozostałych 10 prób pipetujemy po 0.2 ml kwasu malonowego o wzrastającym stężeniu od 3.25 do 19.5 mM (w dwóch powtórzeniach). Do prób zerowych, nie zawierających bursztynianu dodajemy po 0.2 ml wody. Wszystkie próby wstawiamy do termostatu (370C) i po 5 minutach preinkubacji rozpoczynamy reakcję dodając 0.2 ml 1% homogenatu. Reakcję przerywamy po 15 min, dodając do każdej próby 1.5 ml mieszaniny - octan etylu/etanol/TCA i natychmiast dokładnie mieszamy.
Natężenie barwy powstającego INT-formazanu mierzymy wobec prób zerowych przy λ = 470 nm.
Korzystając z podanego współczynnika (k = 1.95 wyrażone w μmolach INT-formazanu na próbę) obliczyć ilość powstającego w ciągu 1 minuty INT-formazanu. Wyliczyć wartość 1/v i sporządzić krzywą Dixona czyli wykres zależności 1/v od stężenia malonianu (I). Określić typ inhibicji i wyliczyć wartość Ki.
UWAGA !
Przed sporządzeniem wykresu należy obliczyć końcowe stężenie substratu i inhibitora w mieszaninach reakcyjnych.
5
![]()
![]()
![]()

FAD
FADH2
2

2
FAD
FADH2
1/v
1/v
[I]
[I]
0
0
- Ki
- Ki
Wyszukiwarka
Podobne podstrony:
Oznaczanie fosfatazy kwaśnej enzymol, [ ARCHIWA ], [ 2008-2009 ], Enzymologia, instrukcje
Raport selekcja szczepów K.K., [ ARCHIWA ], [ 2008-2009 ], Biotechnologia, Zakład BT-MB
raport - przechowywanie szczepów - A.G., [ ARCHIWA ], [ 2008-2009 ], Biotechnologia, Zakład BT-MB
Liga zadaniowa 16 II 2009, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Wykrywanie obecności enzymów - instrukcja, BIOCHEMIA
Liga zadaniowa - 24 XI 2008 - rozwiązania, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 6 XI 2008 - rozwiązania, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 6 XI 2008, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Liga zadaniowa - 24 XI 2008, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Instrumenty, UEK, Finanse 2008-2009
Liga zadaniowa - 15 XII 2008, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Enzymologia - instrukcje do cwiczeń, I
Liga zadaniowa 16 II 2009, Liga zadaniowa, Archiwalne + rozwiązania, 2008 - 2009
Wzorniki cz 3 typy serii 2008 2009
download Prawo PrawoAW Prawo A W sem I rok akadem 2008 2009 Prezentacja prawo europejskie, A W ppt
choroby trzustki i watroby 2008 2009 (01 12 2008)
Egzamin 2008 2009
geografia konkurs gim 2008 2009
więcej podobnych podstron