
Farmacja fizyczna, pod red. T. Hermanna, PZWL
Warszawa, 1999.
Podstawy chemii fizycznej, P. W. Atkins,
Wydawnictwo Naukowe PWN, Warszawa 1999.
Chemia fizyczna, A. Danek, PZWL, Warszawa, 1982.
Ćwiczenia z chemii fizycznej – skrypt dla studentów
Wydz. Farmaceutycznego i Oddziału Analityki
Medycznej – pod redakcją W. Gołkiewicza, Akademia
Medyczna w Lublinie, 2003.
Chemia analityczna, pod red. R. Kocjana, PZWL,
Warszawa 2000.
Krótkie wykłady: CHEMIA FIZYCZNA, A.G.
Whittaker, A.R. Mount i M.R. Heal, Wydawnictwo
Naukowe PWN, Warszawa 2003.
Chemia fizyczna, L. Sobczyk i A. Kisza, PWN,
Warszawa.
CHEMIA FIZYCZNA

CELE CHEMII
FIZYCZNEJ
Badanie zjawisk (procesów), którym
podlegają układy
Opisywanie tych procesów
Przewidywanie dróg przebiegu tych
procesów
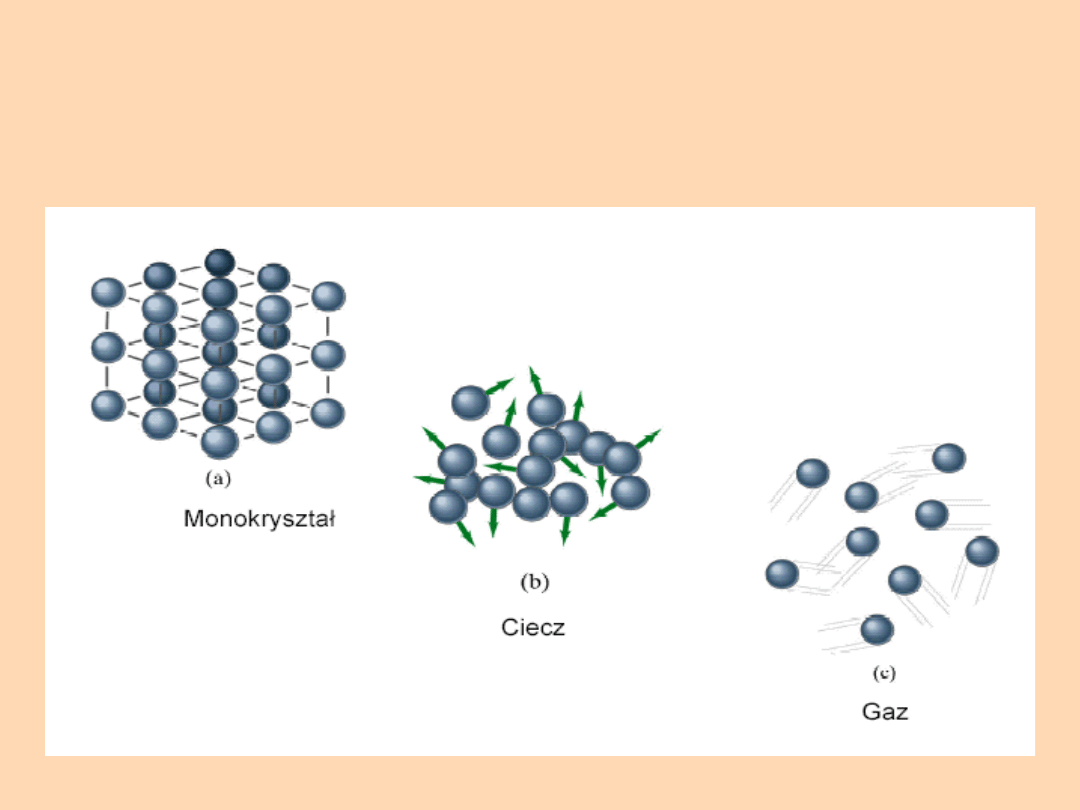
Stany
materii
PRAWA GAZOWE
P. Atkins, J. de Paula, Physical Chemistry, 8
th
ed.
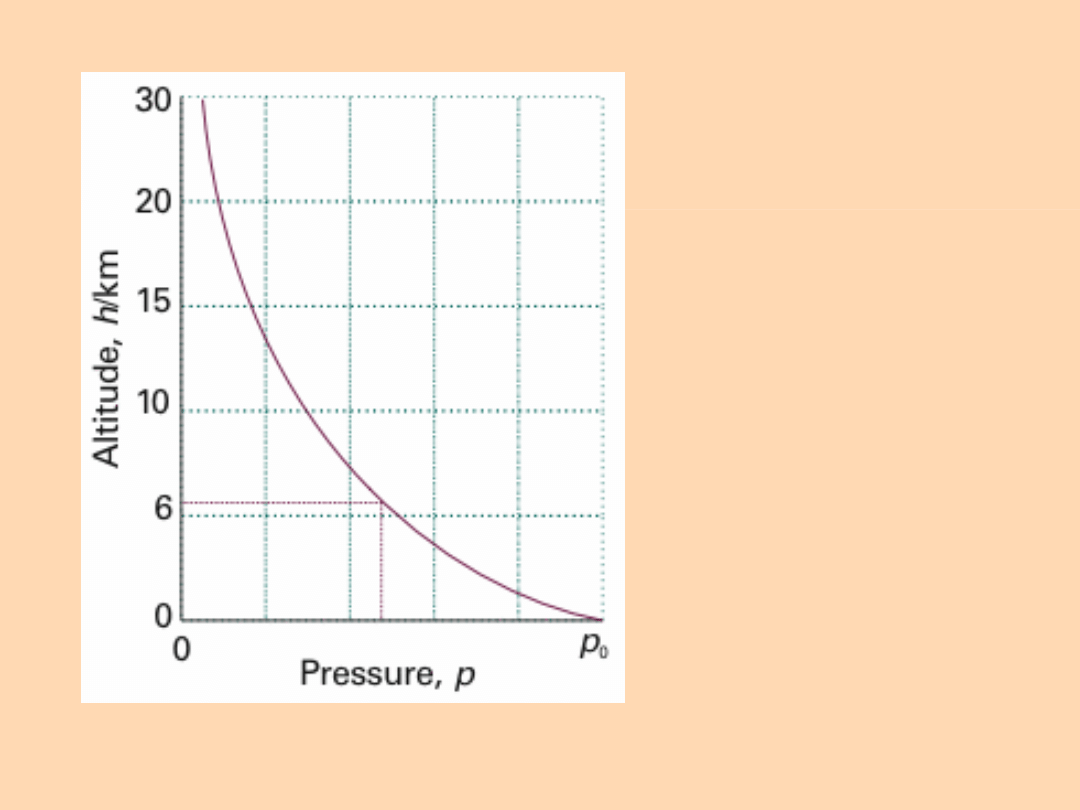
Zmiana ciśnienia
z wysokością
nad poziomem
morza
P. Atkins, J. de Paula, Physical Chemistry, 8
th
ed.

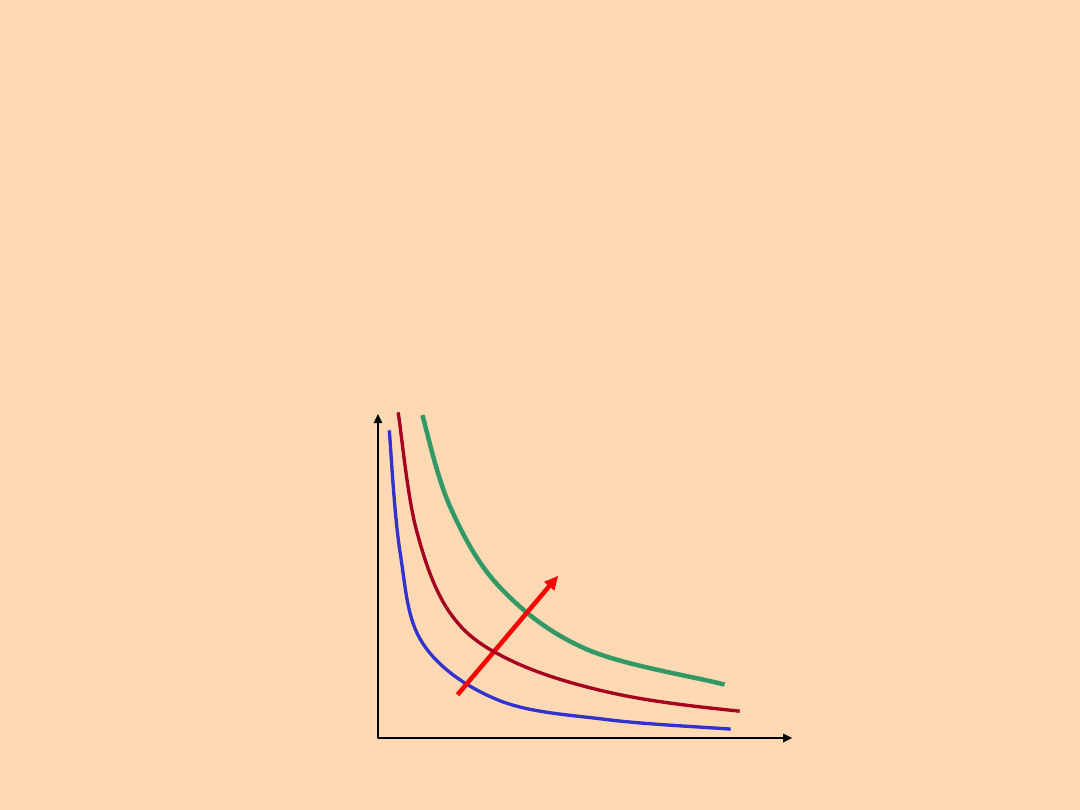
PRAWA GAZOWE
Prawo Boyle’a – Mariotte’a: w stałej
temperaturze iloczyn ciśnienia i
objętości danej masy gazu jest stały
p V = const.
[p] = 1 N/ m
2
=
1Pa
T
1
T
2
T
3
>T
2
>
T
1
p
V
T
3
p
V
T

Powierzchnia
możliwych
stanów
Prawo Boyle’a i Mariotte’a: w stałej
temperaturze objętość, V, danej masy gazu jest
odwrotnie proporcjonalna do jego ciśnienia, p
p V = const.
p = const. / V
T
= const
p
1 / V
Prawo Charle’a: przy stałej objętości gazu
stosunek ciśnienia do temperatury danej
masy gazu jest stały
P / T =
const.
p
T
0 K (-273,16
o
C
V
3
V
2
V
1
V
3
< V
2
<
V
1
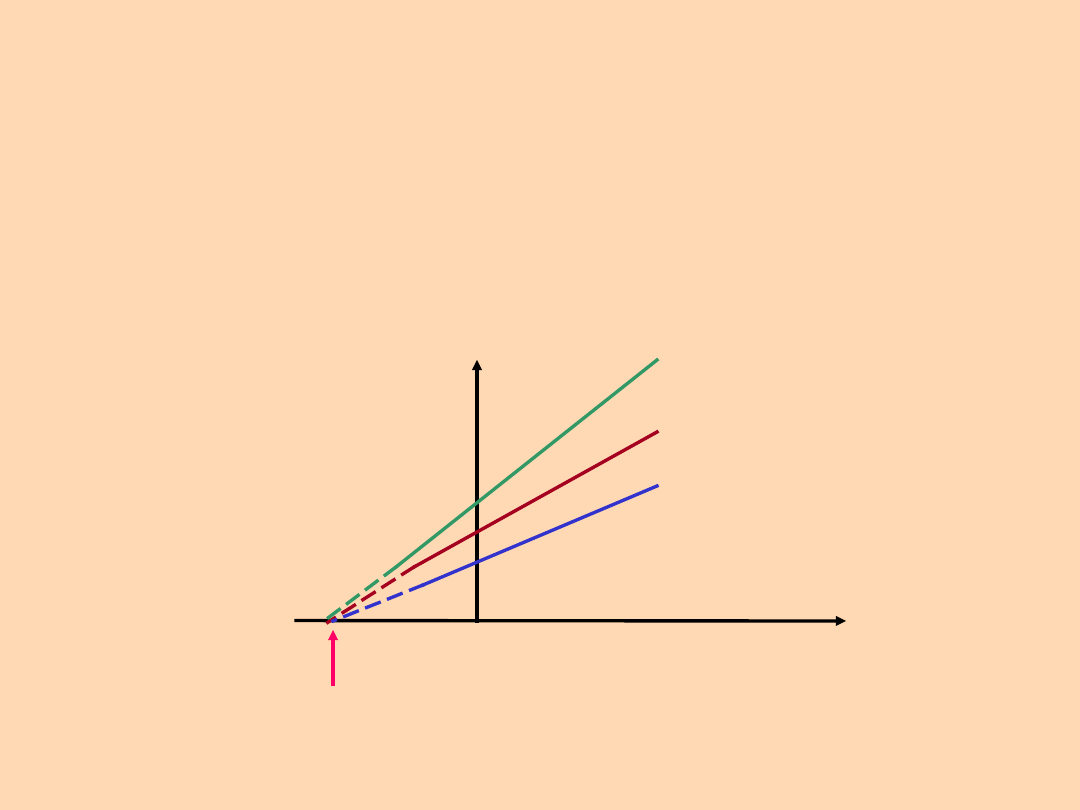
Prawo Gay-Lussaca: przy stałym ciśnieniu
stosunek objętości do temperatury danej
masy gazu jest stały
V / T =
const.
V
T
0 K (-273,16
o
C
p
3
p
2
p
1
p
3
< p
2
<
p
1
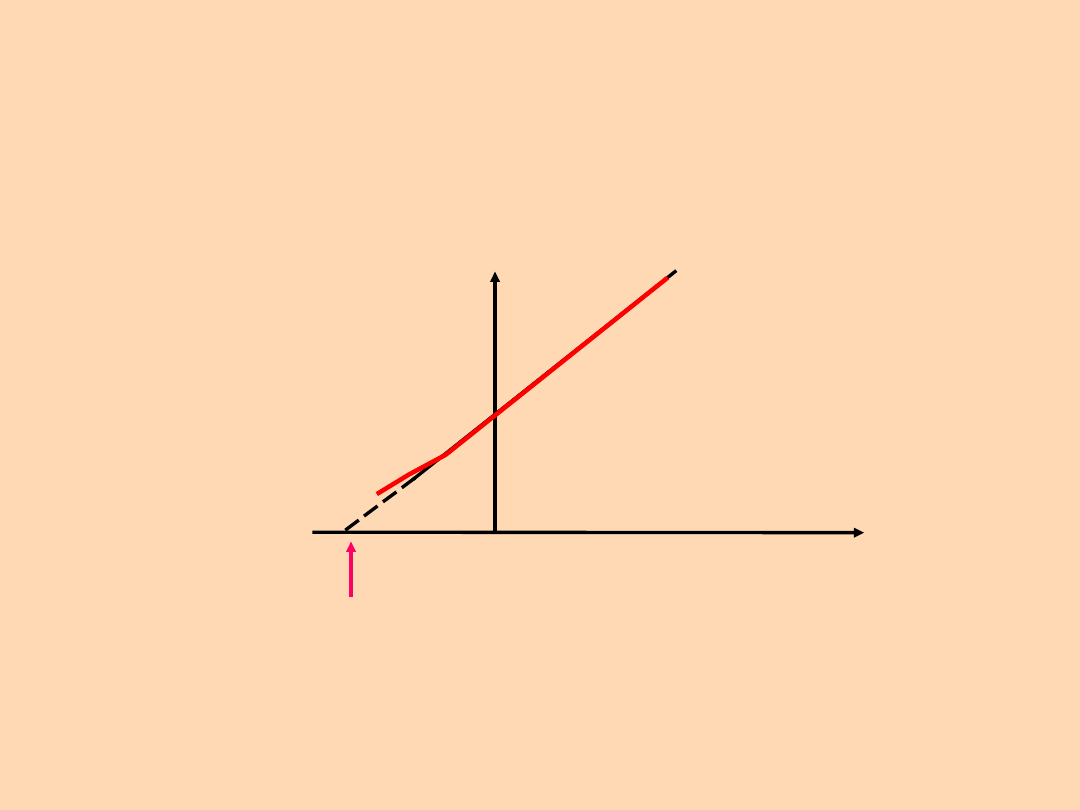
V / T = const. V =
const. * T
V
T
0 K (-273,16
o
C
P = const

Objętość molowa
p
RT
V
p
RT
n
V
nRT
pV
M

Objętości molowe gazów w
temp. 25
o
C
Gaz
V
M
(dm
3
* mol
-1
)
Amoniak
24,4
Argon
24,8
Dwutlenek
węgla
24,6
Wodór
24,8
Tlen
24,8

Mieszaniny gazów
Prawo Daltona
p = p
1
+ ..... + p
n
V
T
R
n
p
A
A
*
*
V
T
R
n
p
B
B
*
*
p = p
A
+ p
B

Ułamek molowy
B
A
A
A
n
n
n
x
B
A
B
B
n
n
n
x
1
A
A
x
x
p
x
p
A
A
*
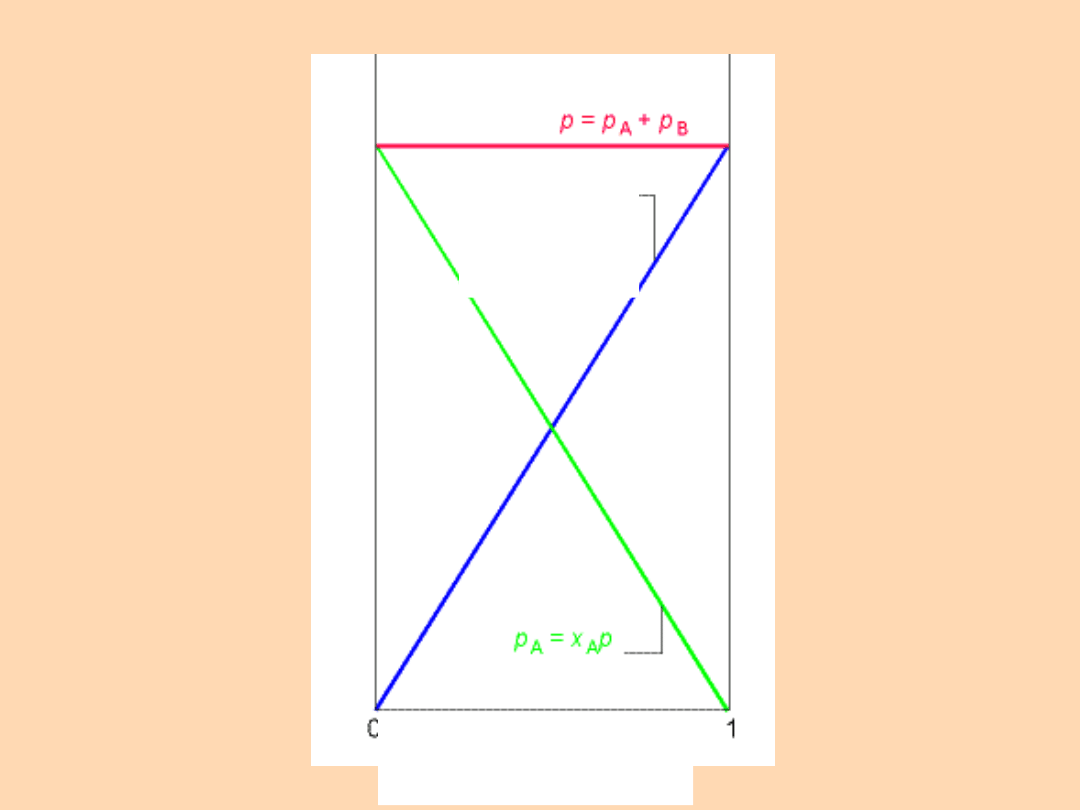
Ułamek molowy A,
x
A
p
Ciśnienie
cząstkowe
B
Ciśnienie gazu
V
nMc
p
3
2
N
s
s
s
c
N
....
2
2
2
1
c - średnia szybkość kwadratowa
3
2
nMc
pV
nRT
pV

3
2
nMc
nRT
R
Mc
T
3
2
Temperatura jest proporcjonalna do drugiej
potęgi średniej szybkości kwadratowej
cząsteczek
Związek szybkości cząsteczek gazu z
temperaturą:

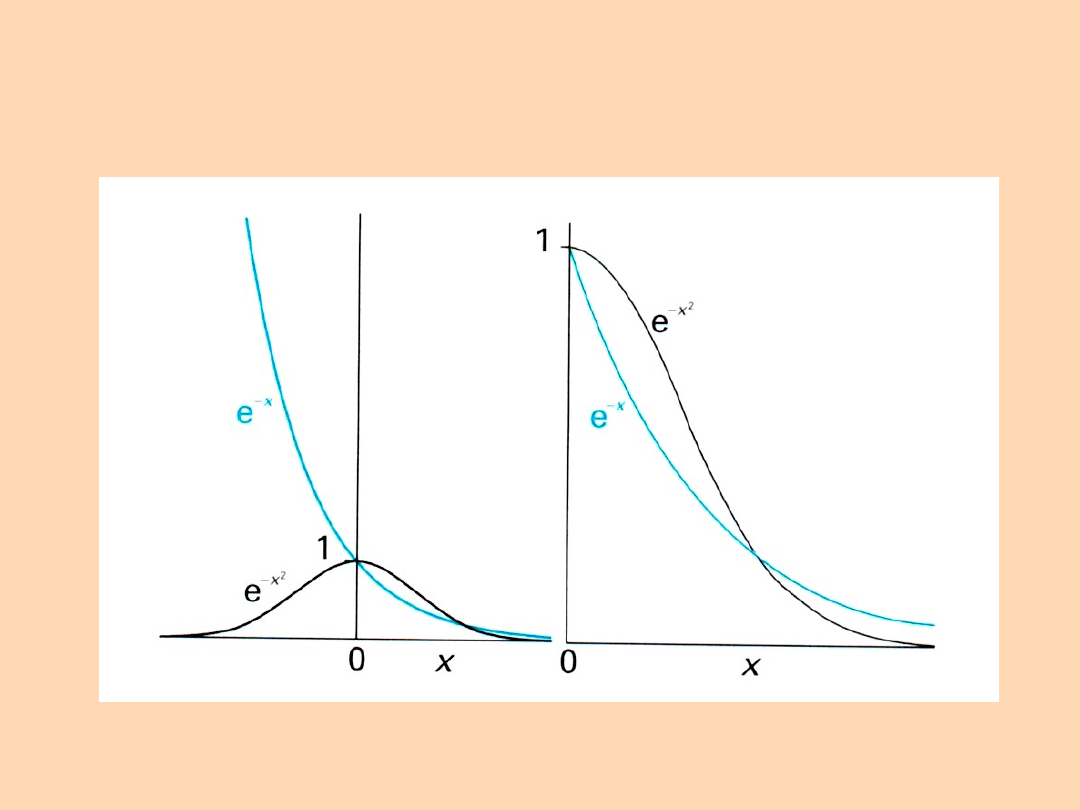
Rozkład szybkości cząsteczek Maxwella:
s
s
RT
M
f
RT
Ms
2
/
2
2
2
/
3
2
4
e
f - ułamek cząsteczek
posiadających prędkość w
przedziale od s do s+s
s - szybkość cząsteczki gazu,
M - masa molowa,
R – stała gazowa,
T - temperatura
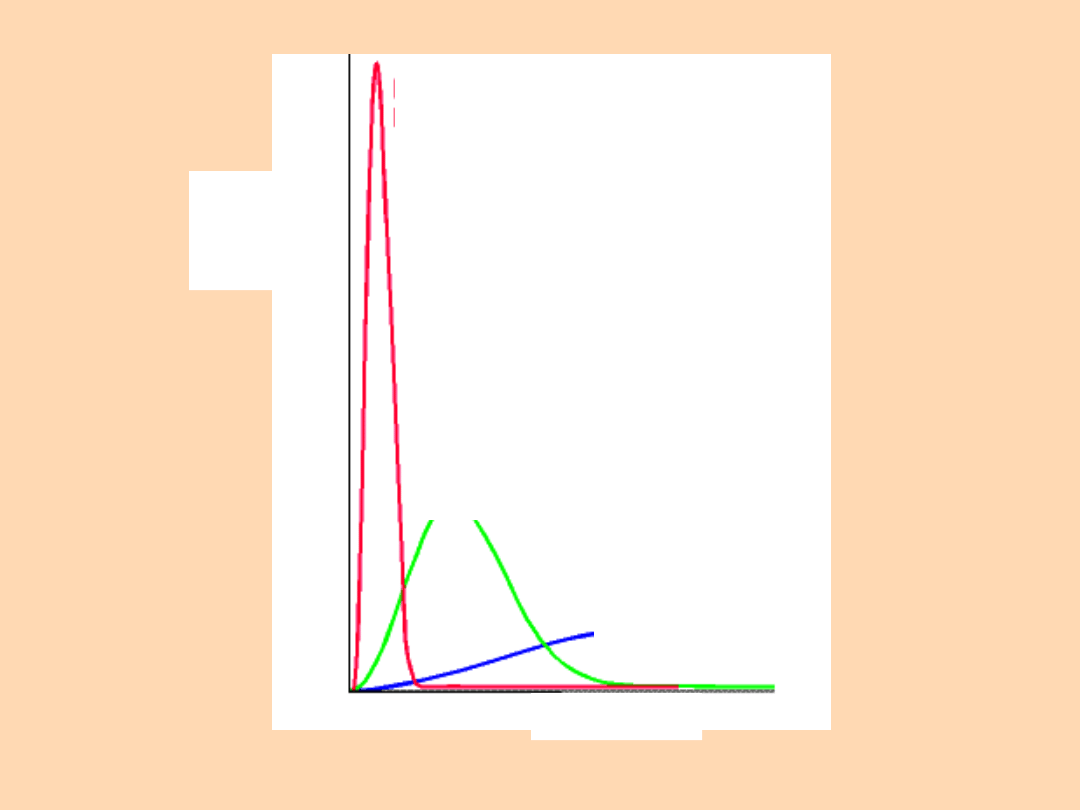
Duża masa
cząsteczkowa
Umiarkowa
na masa
cząsteczko
wa
Mała masa
cząsteczko
wa
Szybkość
Ułamek
cząstecz
ek
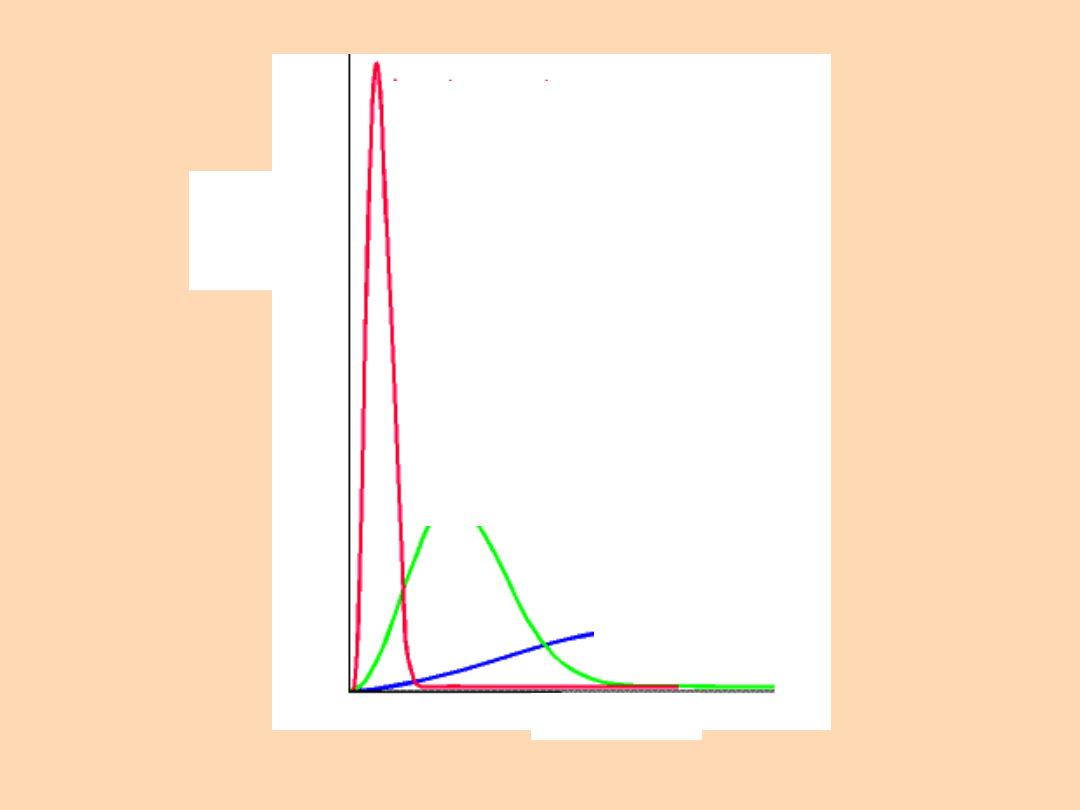
Niska
temperatura
Umiarko
wana
temperat
ura
Wysoka
temperat
ura
Szybkość
Ułamek
cząstecz
ek
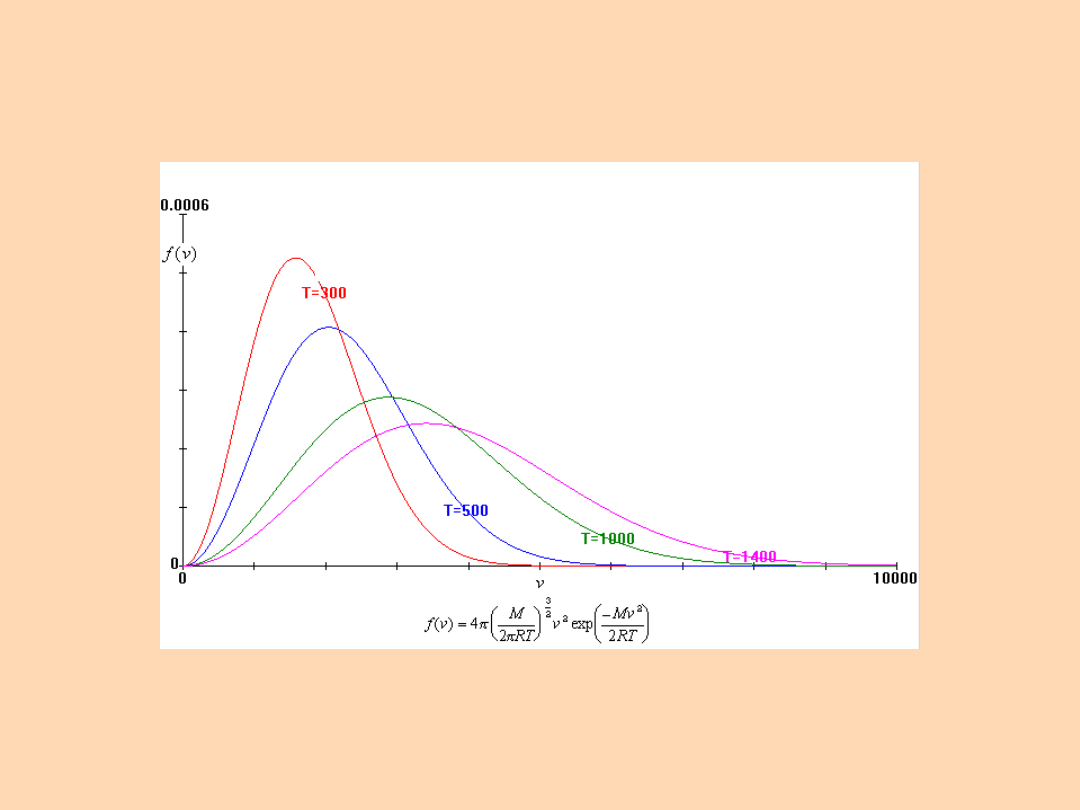
T = 300K
Rozkład szybkości
cząsteczkowej Maxwella
dla wodoru
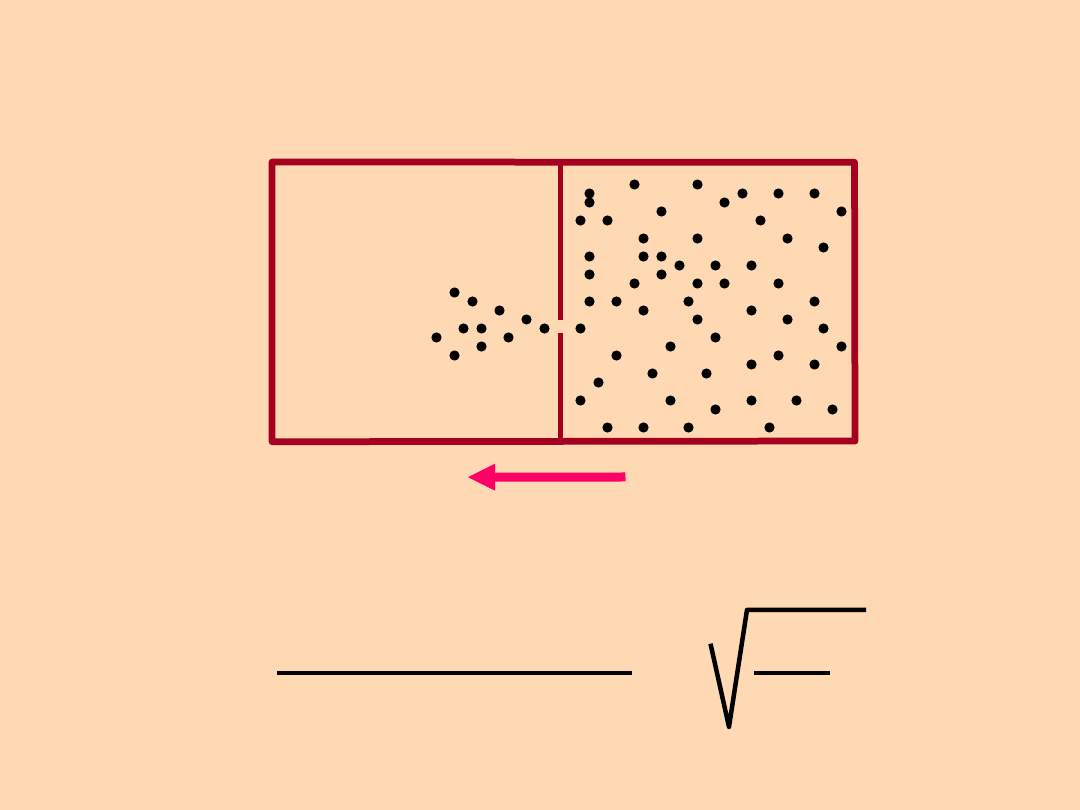
Dyfuzja i
efuzja
Szybkość efuzjii gazu B
Szbkość efuzjii gazu A
=
M
A
M
B
Prawo Grahama:
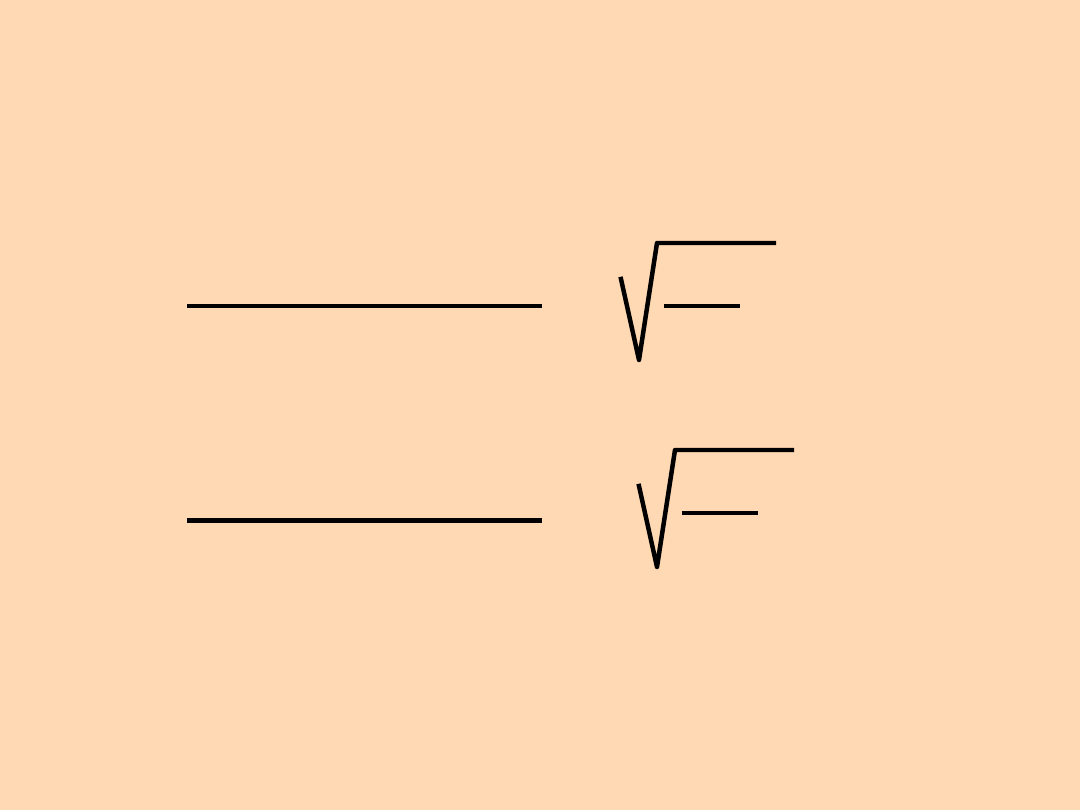
Dla gazowego tlenu i wodoru:
Szybkość efuzji gazu
B
Szybkość efuzji gazu
A
=
M
A
M
B
= =
4
32
2
Szybkość efuzji
wodoru
Szybkość efuzji tlenu
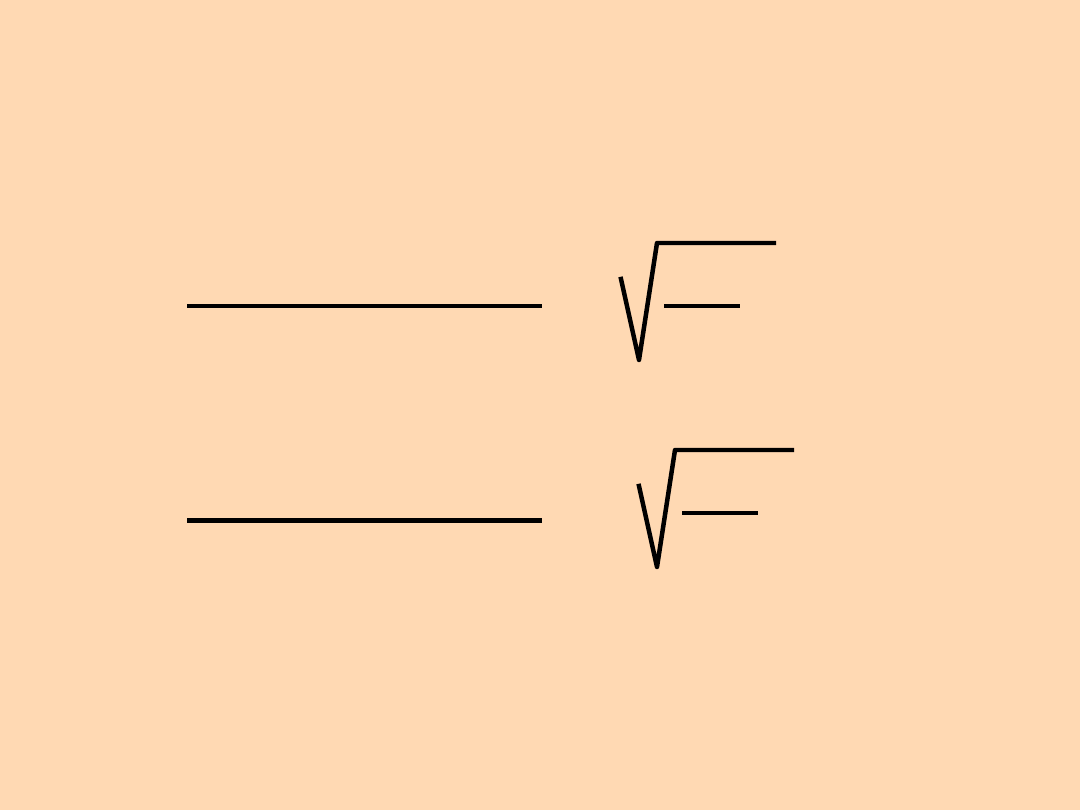
Dla gazowego
235
UF
6
i
238
UF
6
:
Szybkość efuzji gazu
B
Szybkość efuzji gazu
A
=
M
A
M
B
= =
1,004
352
349
Szybkość efuzji
238
UF
6
Szybkość efuzji
235
UF
6

Dla jednego mola gazu doskonałego:
Dla n moli gazu doskonałego:
nRT
pV
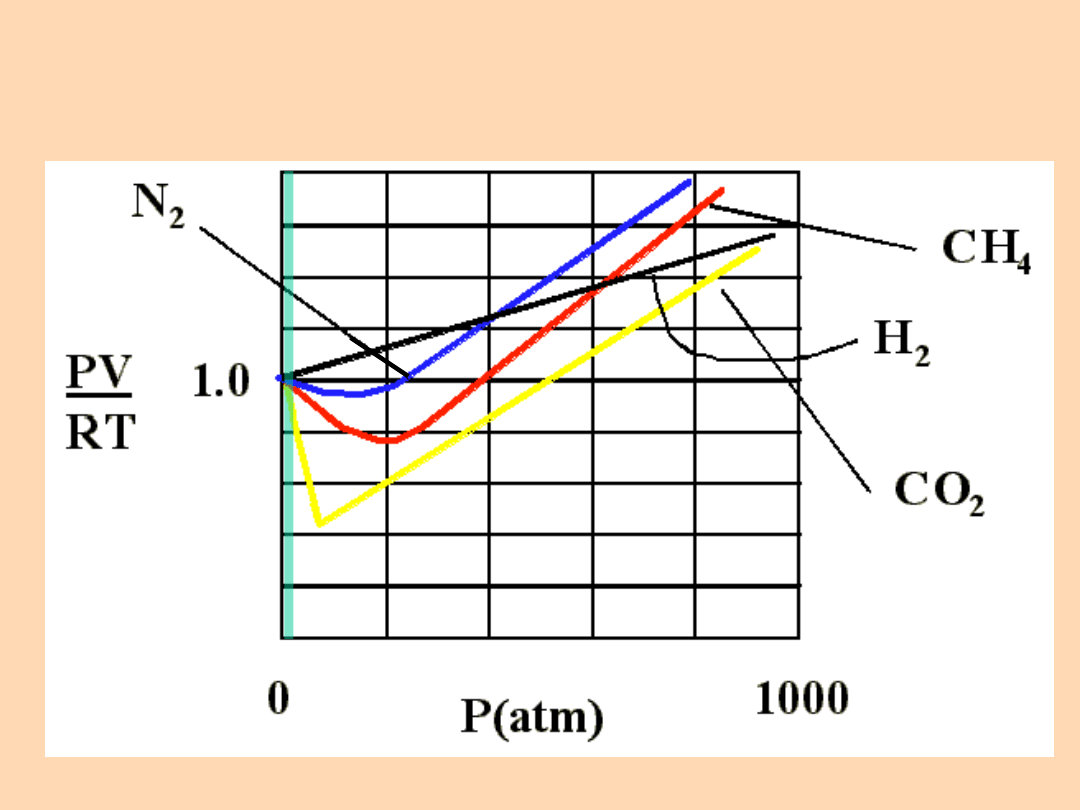
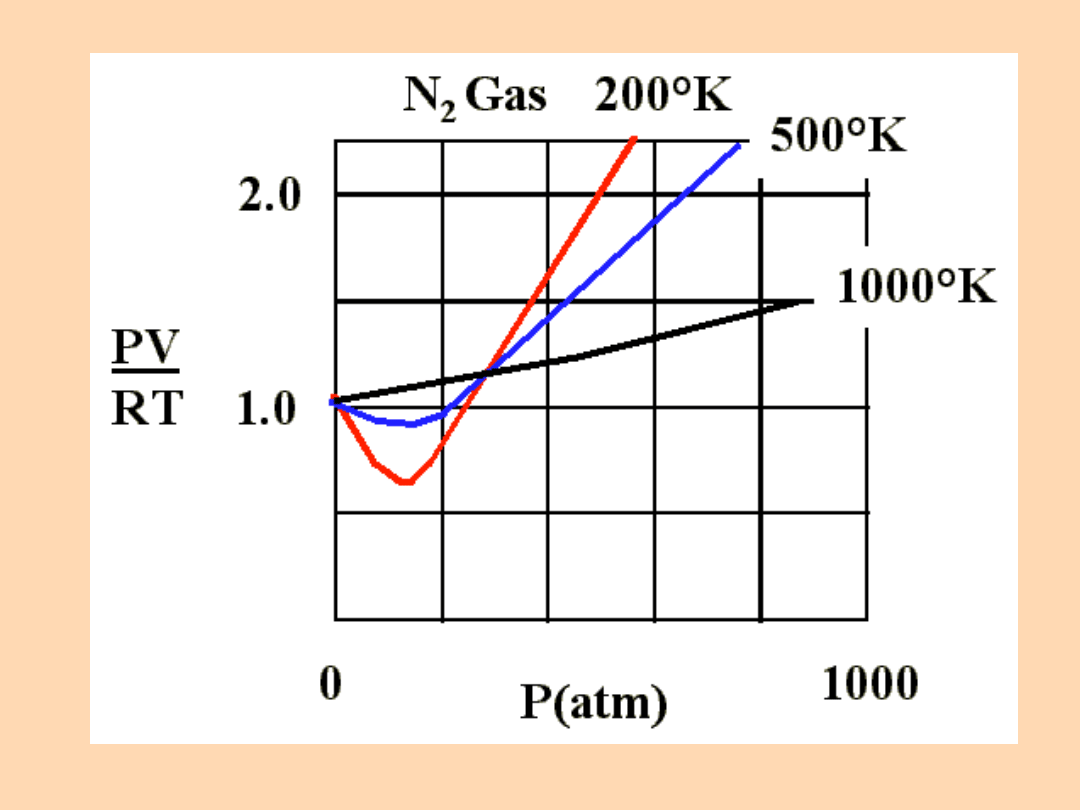
Gazy rzeczywiste wykazują odchylenia od praw
gazów doskonałych
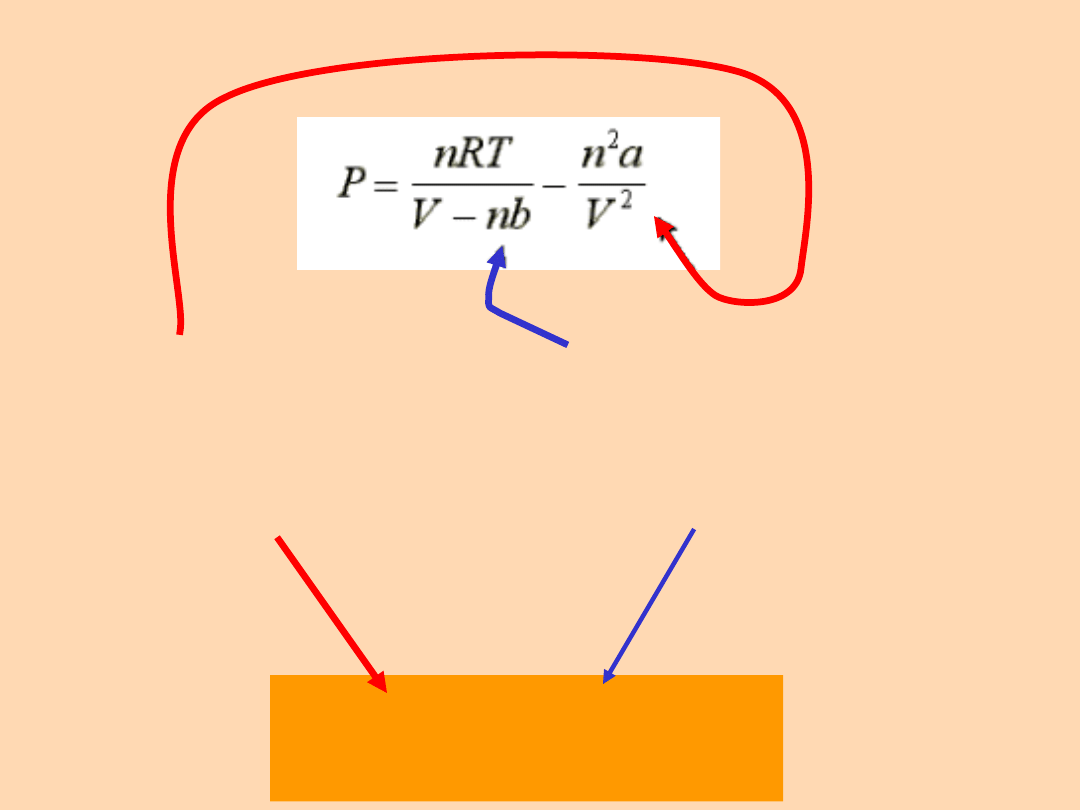
Poprawka na
objętość własną
cząsteczek,
związana z siłami
odpychającymi
Poprawka
związana z
oddziaływaniami
międzycząsteczko
wymi
przyciągającymi
(p + a /V
2
) (V - b) =
RT
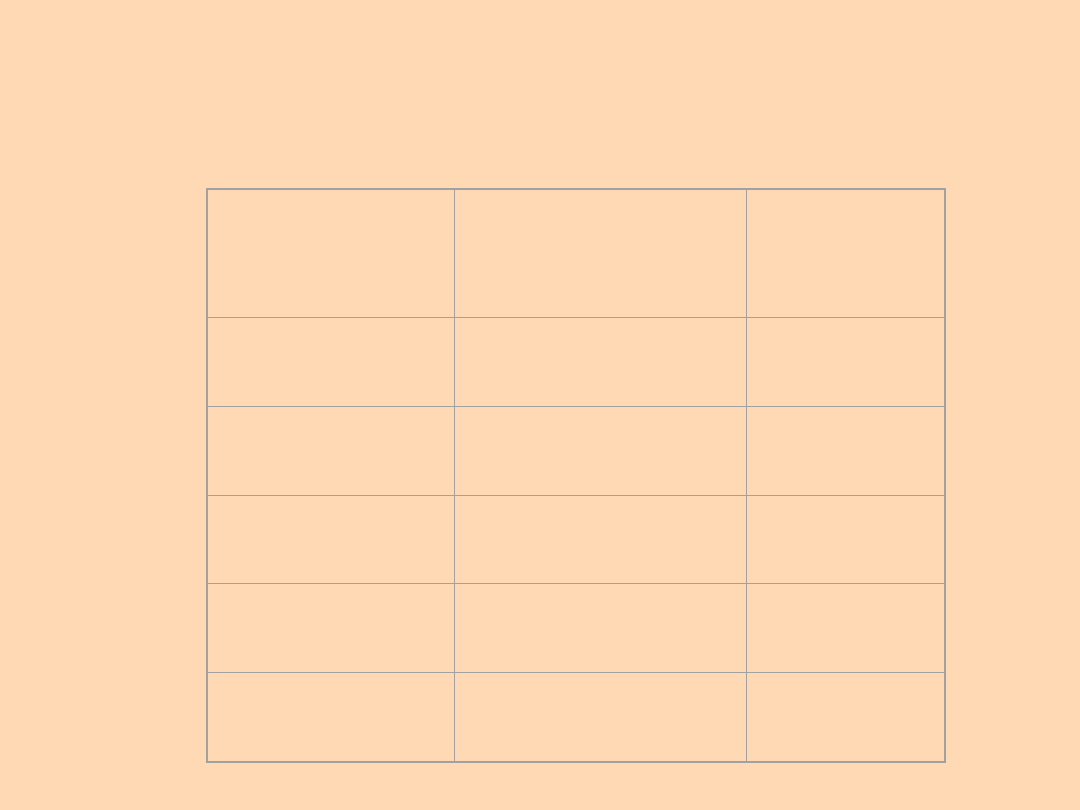
Substanc
e
a (L
2
atm/mol
2
)
b(L/mo
l)
He
0.0341
0.0237
H
2
0.244
0.0266
O
2
1.36
0.0318
H
2
O
5.46
0.0305
CCl
4
20.4
0.1383
Przykładowe wartości współczynników a i b w
równaniu van der Waalsa

Przykład:
Oblicz ciśnienie 100 moli gazowego tlenu o objętości
22.41 L w temperaturze 0
o
C.
V = 22.41 L
T = (0.0 + 273) = 273°K
a (O
2
) = 1.36 L
2
atm/mol
2
b (O
2
) = 0.0318 L /mol
P = 117atm - 27.1atm
P = 90 atm
P= 100 atm (gaz
doskonały)

Prawo Bernouliego:
Suma ciśnień: kinetycznego,
hydrostatycznego i statycznego w każdym
miejscu strumienia jest stała
0,5 m v
2
+ m g h + p V = const
0,5
v
2
+
g h + p = const
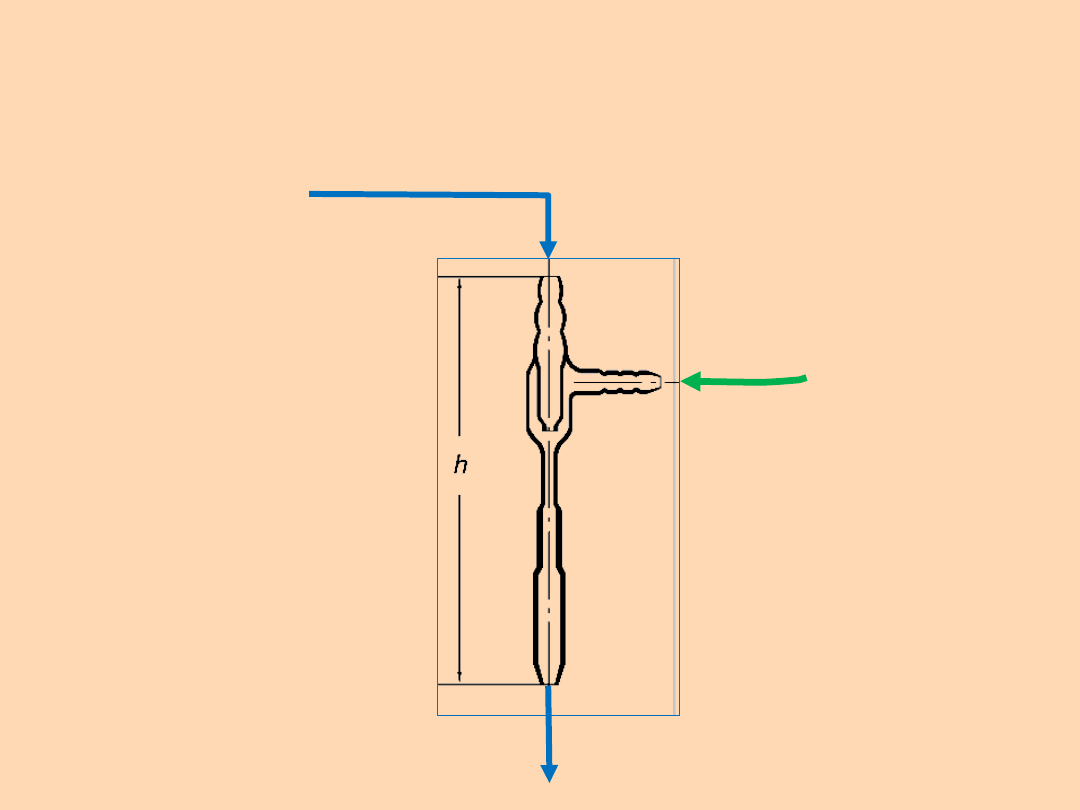
Woda z
kranu
Zasysane
powietrz
e
Pompka wodna
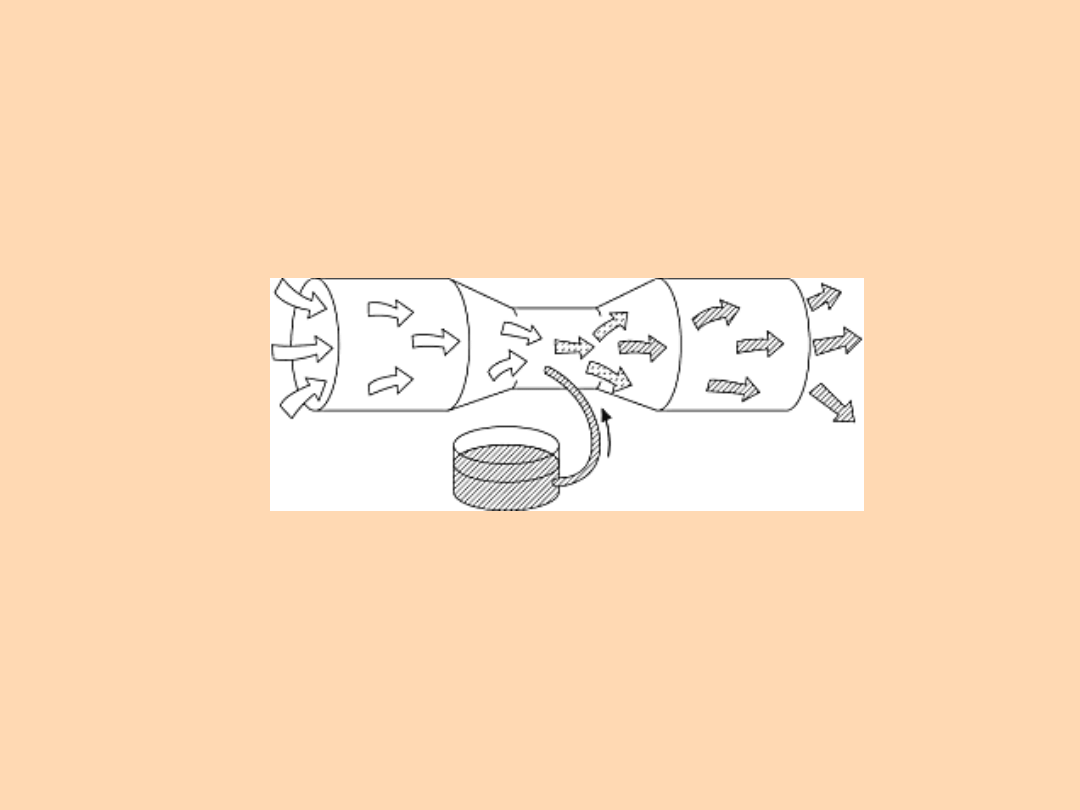
W gaźniku
samochodowym.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
08id 7215 ppt
05 Dokumenty w h z 12 05 08id 5675 ppt
01 08id 2508 ppt
06 Zagadnienia zrodla poznania I 08id 6450 ppt
13 Prezentacja 2007 2013id 14747 ppt
06 Zwyczaje i formuly 14 05 08id 6462 ppt
20051126 teoria wf wyk 08id 25411 ppt
10 Mięśnie klatki piersiowej 12 05 2007 komentarzid 10951 ppt
07 Targi 19 05 08id 6983 ppt
10 Polecenie wyplaty[1] Inkaso Akredytywa 26 05 08id 11008 ppt
1 Zdrowie Publiczne, 2007 (3)id 10158 ppt
16 Monizm i dualizm Problem psychofizyczny 08id 16780 ppt
08id 7215 ppt
05 Dokumenty w h z 12 05 08id 5675 ppt
01 08id 2508 ppt
06 Zagadnienia zrodla poznania I 08id 6450 ppt
rynek biur podróżyw Europie 2007 ppt
więcej podobnych podstron