1
Materia skondensowana
Ciała stałe: kryształy, polikryształy, ciała bezpostaciowe
Ciała niekrystaliczne
(np. szkło)
uporz
ą
dkowanie atomowe nie rozci
ą
ga si
ę
na
du
ż
e odległo
ś
ci.
Atomy w
krysztale
uło
ż
one s
ą
w
powtarzaj
ą
cy si
ę
regularny wzór zwany
sieci
ą
krystaliczn
ą
Polikryształy
ciała zbudowane z bardzo
wielu malutkich kryształków.
c
b
a
R
3
2
1
n
n
n
+
+
=
a, b, c –wektory translacji, n
1
, n
2
, n
3
- dowolne liczby całkowite
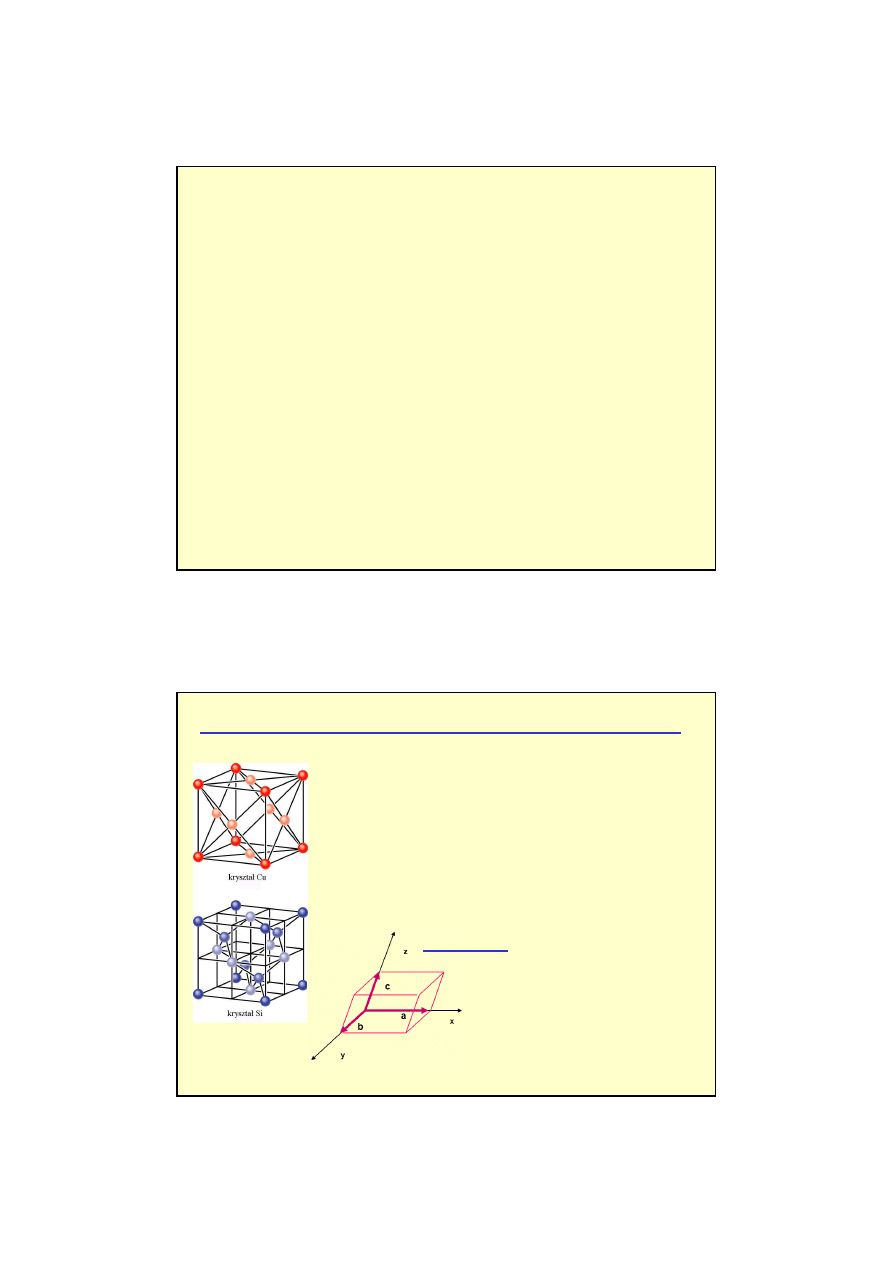
Kryształy:
Położenia cząstek (atomów) w sieci:
2
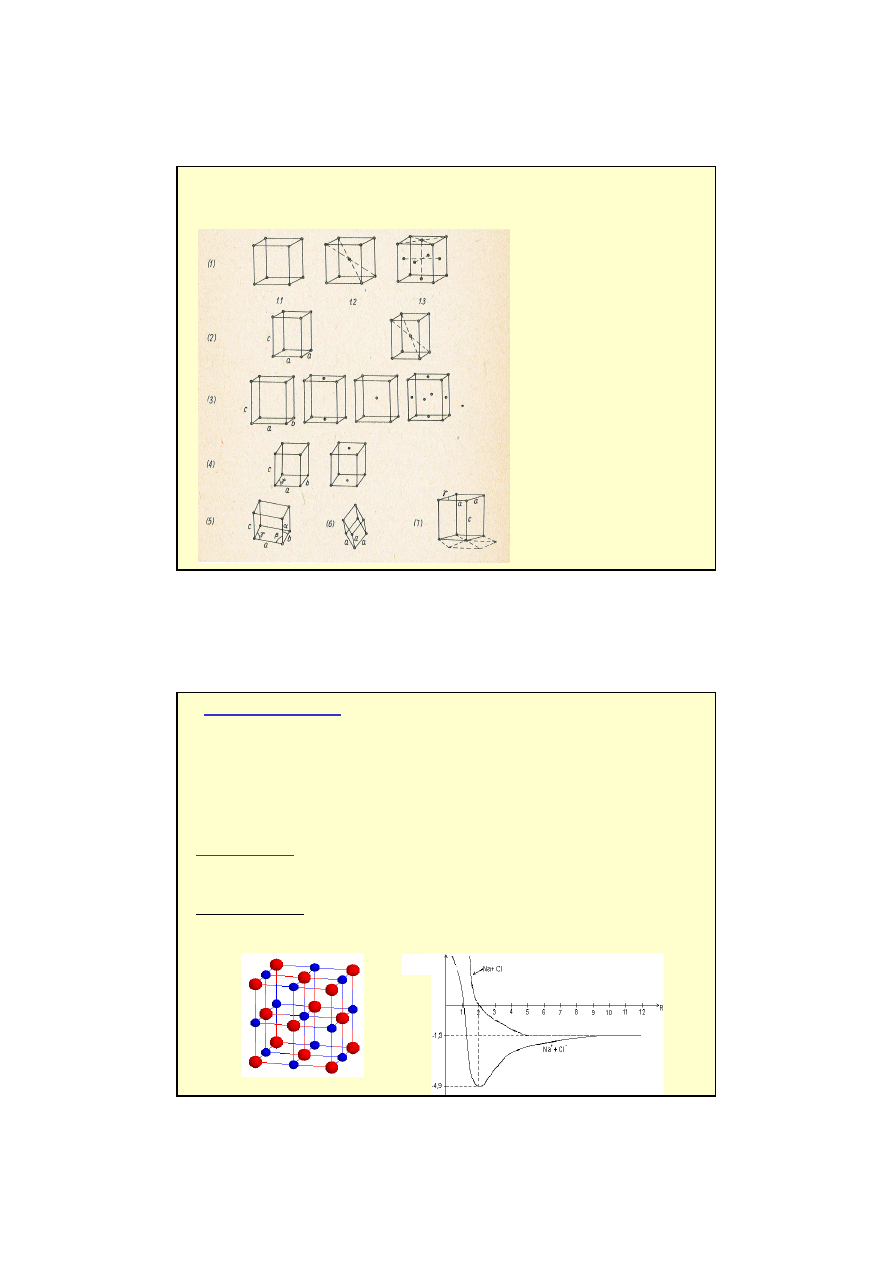
Komórki elementarne - sieci Bravais'go
1. Układ sze
ś
cienny
1.1 sie
ć
prosta
1.2 sie
ć
centrowana
obj
ę
to
ś
ciowo
1.3 sie
ć
centrowana
płasko
2. Układ tetragonalny
3. Układ rombowy
4. Układ jednosko
ś
ny
5. Układ trójsko
ś
ny
6. Układ
romboedryczny
7. Układ
heksagonalny
14 sposobów takiego wypełnienia przestrzeni
Rodzaje wi
ą
za
ń
Ze wzgl
ę
du na typy wi
ą
za
ń
kryształy dzielimy na:
•
Kryształy jonowe,
•
Kryształy atomowe (kowalentne),
•
Kryształy metaliczne,
•
Kryształy cz
ą
steczkowe (molekularne),
•
Kryształy o wi
ą
zaniach wodorowych,
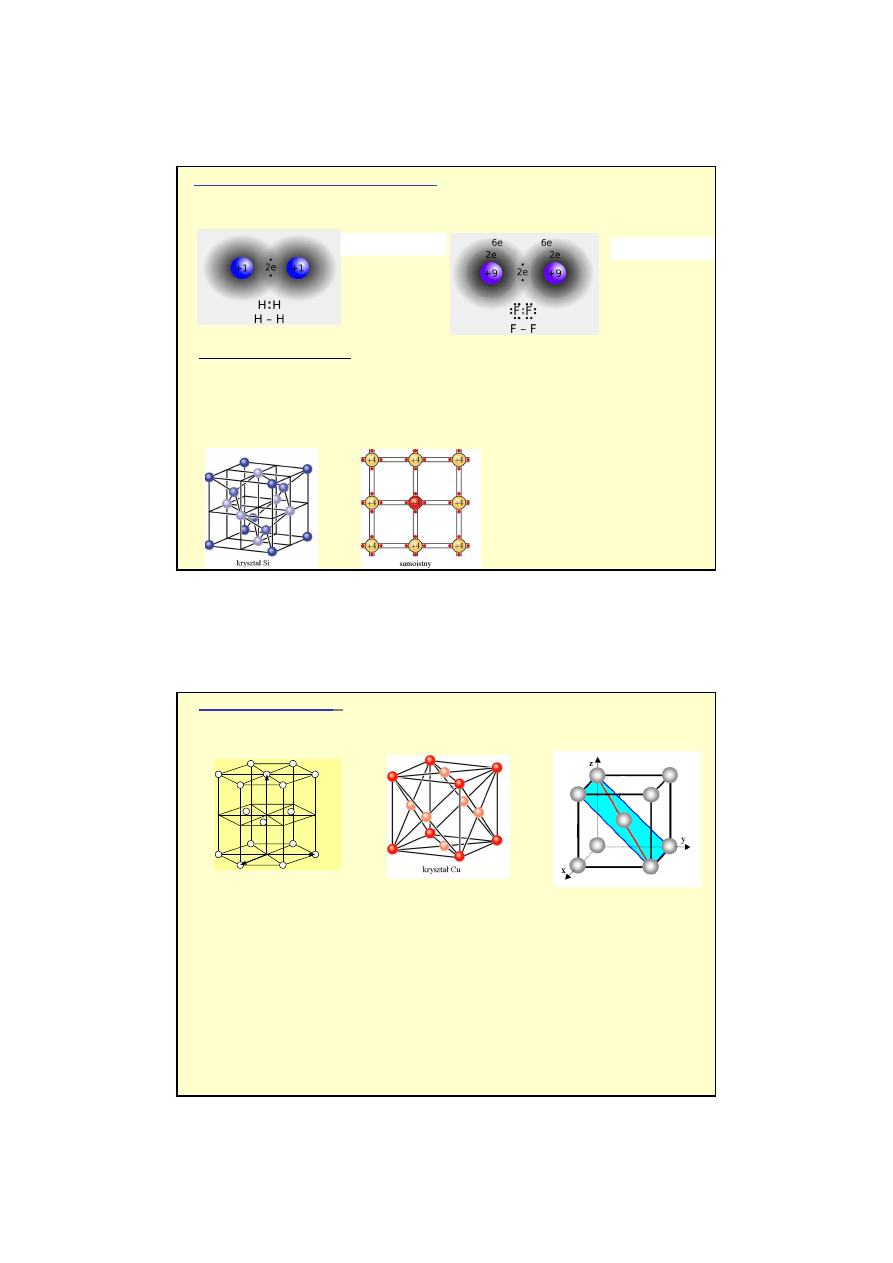
Wiazania jonowe
( np. NaCl, KCl, LiBr) - naprzemienne ułożenie dodatnich jonów (powstałych
z atomów elektrododatnich) i ujemnych jonów (powstałych z atomów elektroujemnych)
przyciąganie siłami kulombowskimi.
Kryształy jonowe (
np. NaCl, energia wiązania = 7.95 eV na parę)
brak swobodnych
elektronów
złe przewodniki elektryczności i ciepła
.
Siły kulombowskie wiążące kryształy
jonowe są duże
kryształy są
twarde
i mają
wysoką temperaturę topnienia.
Cl
-
Na
+
V [ev]
3
Wi
ą
zania atomowe, kowalencyjne
–
atomy elektroujemne połączone parami
wspólnych elektronów walencyjnych. Atomy osiągają konfigurację gazu
szlachetnego (wiązania w cząsteczkach H
2
, N
2
, F
2
, H
2
O, CO
2
, CH
4
...)
9
F : 1s
2
2s
2
2p
5
F
2
H
2
10
Ne :1s
2
2s
2
2p
6
1
H :
1s
1
2
He : 1s
2
gaz szlachetny:
gaz szlachetny:
Kryształy kowalencyjne - np. diament (en. wiąz. 3,6 eV/atom), german, krzem,
Chmura wspólnych elektronów skupiona jest pomiędzy parą atomów
wiązania mają
kierunek
i wyznaczają ułożenie atomów w strukturze krystalicznej
.
brak elektronów swobodnych
twarde
,
posiadają
wysoką temperaturę topnienia
,
nie są
dobrymi przewodnikami elektryczności i ciepła
.
14
Si : 1s
2
2s
2
2p
6
3s
2
3p
2
Wi
ą
zania metaliczne
-
między atomami elektrodatnimi, np. kryształy tworzone przez
metale alkaliczne (energia wiązania dla Li wynosi 1,6 eV/atom ). Wiązanie metaliczne to
graniczny przypadek wiązania kowalentnego - elektrony walencyjne są wspólne dla
wszystkich jonów w krysztale.
Kryształ metaliczny
elektrony na zewnętrznych powłokach są słabo związane
(mogą zostać
uwolnione kosztem bardzo małej energii).
Swobodne elektrony poruszają się w całym krysztale
są wspólne dla wszystkich jonów i tworzą
gaz elektronowy
wypełniający przestrzeń pomiędzy
dodatnimi jonami.
Gaz elektronowy działa na każdy jon siłą przyciągania większą od odpychania pozostałych jonów
tworzy
się wiązanie metaliczne.
Istnieje wiele nie obsadzonych stanów elektronowych (na zewnętrznych powłokach są wolne
miejsca)
elektrony mogą poruszać się swobodnie w krysztale od atomu do atomu.
Kryształy
metaliczne są doskonałymi przewodnikami elektryczności i ciepła
.
A
B
A
c
b
a
Ti
Fe
Cu
heksagonalny
sze
ś
cienny (
ś
ciennie centr.)
sze
ś
cienny (przestrz. centr.)
4
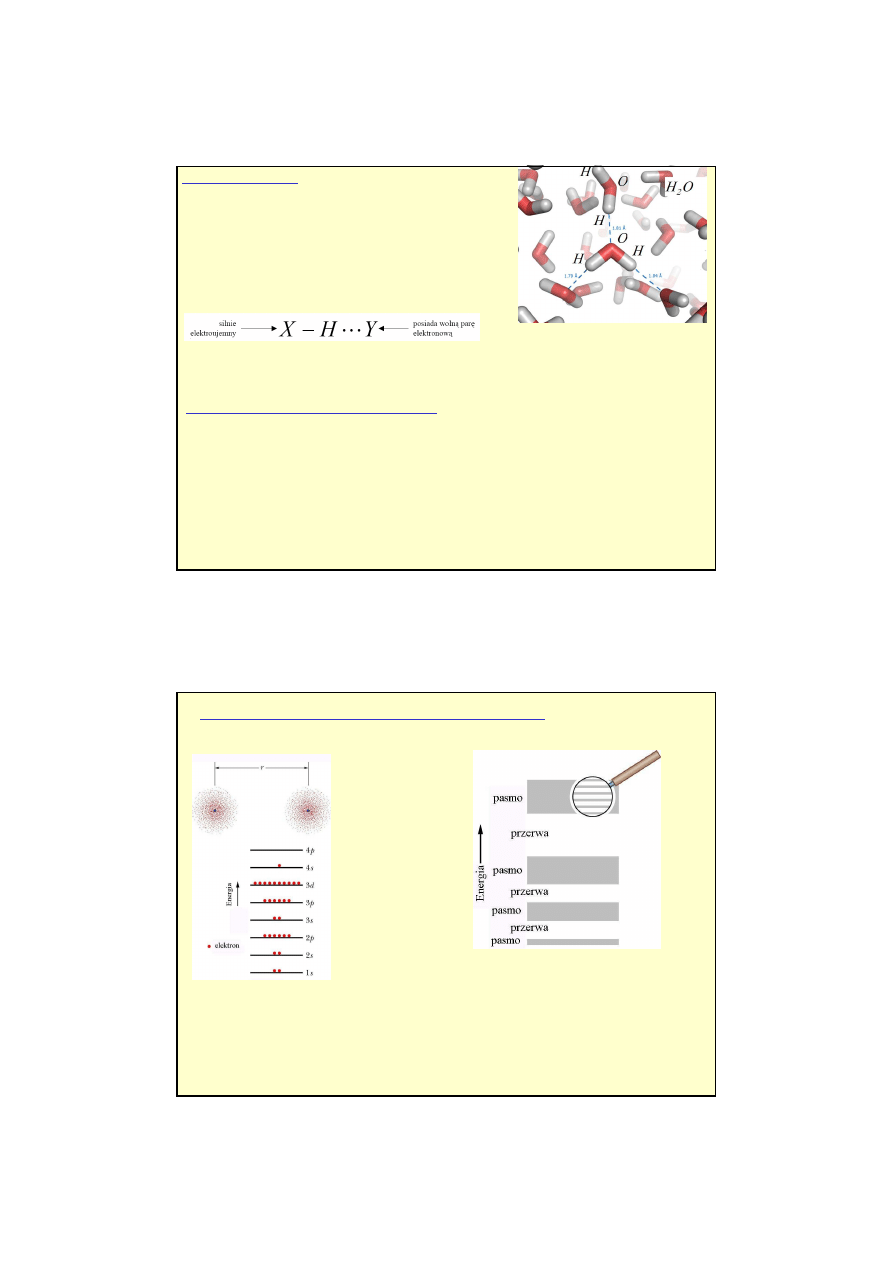
Wi
ą
zanie
wodorowe-
(energia wiązania ok. 0,1-0,2 eV)
powstaje, gdy atom wodoru jest połączony kowalencyjnym z
innym atomem o dużej elektroujemności (X, np. tlenem lub
azotem) i w ten sposób uzyskuje nadmiar ładunku
dodatniego. W wyniku tego oddziaływania pierwotne,
kowalencyjne wiązanie X-H ulega częściowemu osłabieniu,
powstaje zaś nowe, stosunkowo słabe wiązanie między
wodorem i innym atomem Y posiadającym wolną parę
elektronów.
Przykłady: oddziaływanie między cząsteczkami wody, w układach biologicznych wodorowe
pomiędzy pierwiastkami: P, O, N (białka, kwasy nukleinowe, DNA ).
Wiązania molekularne,
kryształy molekularne
(cząsteczkowe) tworzą między innymi w stanie
stałym gazy szlachetne (np. hel) i zwykłe gazy, takie jak dwutlenek węgla, tlen, azot, wodór
(wiązania między cząsteczkami He, CO
2
, O
2 ,
N
2
, H
2
)
Siły van der Waalsa (oddziaływanie pomiędzy dipolami stanowi siłę wiążącą kryształ).
Energia wiązania około 10
-2
eV (10
-21
J), dla porównania energia cieplna w temperaturze
pokojowej 3kT /2 = 6*10
-2
eV = 6*10
-21
J
zestalenie kryształów cząsteczkowych zachodzi
dopiero w bardzo niskich temperaturach. Np. dla wodoru 14 K (tj. −259 °C).
Kryształy cząsteczkowe
brak elektronów swobodnych
bardzo złe przewodniki ciepła i
elektryczności
.
Dwa atomy Cu w dużej odległości
Każdy atom ma taki sam rozkład 29
elektronów na powłokach
Atomy „nie widzą się”
chmury
elektronowe są odseparowane
Kwantowo
funkcje falowe elektronów
nie przekrywają się
Poziomy energetyczne w ciałach stałych
Zbliżamy atomy
tworzymy sieć krystaliczną
Zewnętrzne orbitale
nakładają się
(przekrywają się funkcje
falowe zewnętrznych elektronów)
Zamiast 2 niezależnych atomów mamy
układ 2-atomowy
zawierający 2*29 = 58 elektronów
Zakaz Pauliego
każdy elektron w innym stanie kwantowym
W sieci N atomowej każdy poziom energetyczny rozdziela się na
N poziomów
(N jest rzędu 10
24
)
!!!
Tworzą się
pasma
energetyczne
oddzielone
przerwami energetycznymi
.
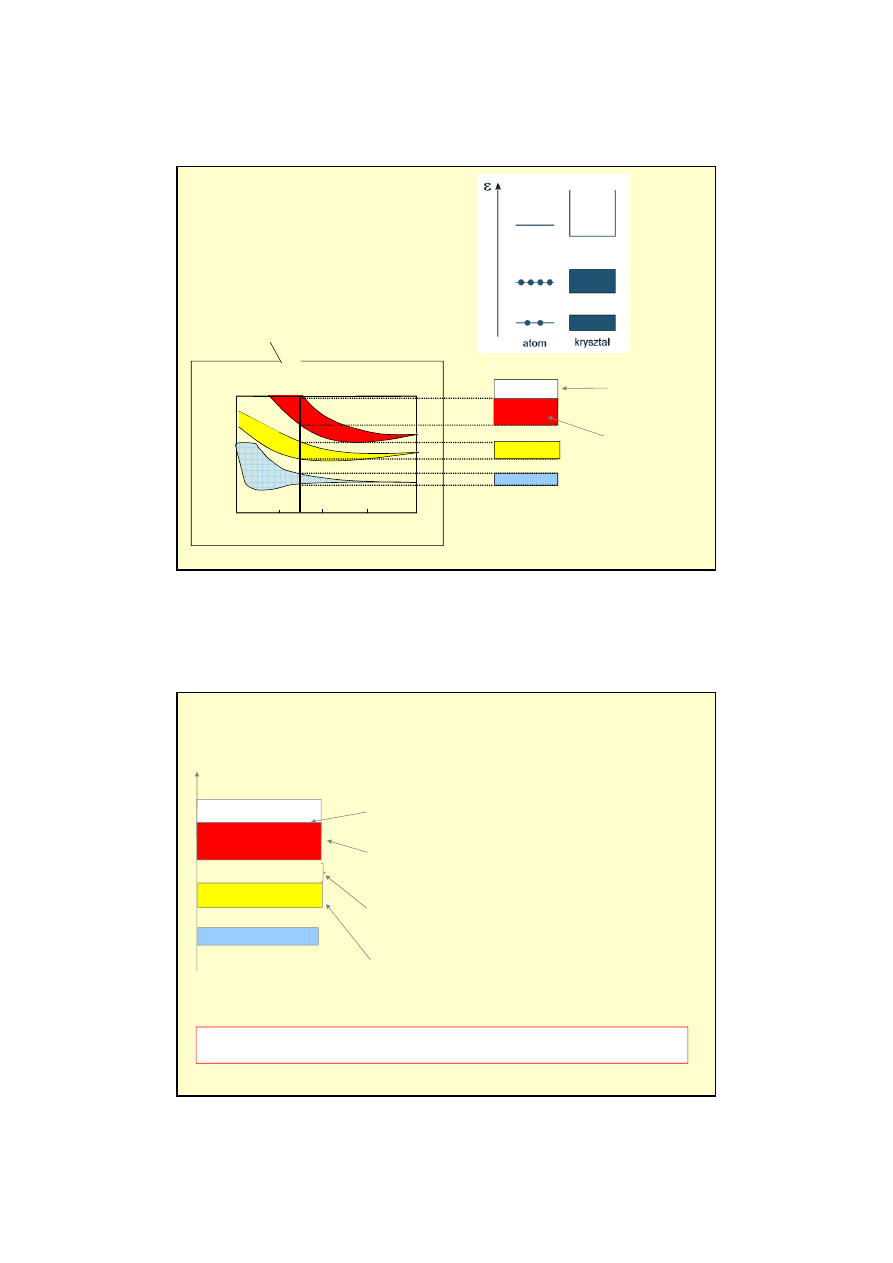
5
R(A)
E
0
5
10
15
20
Energia
stany
puste
stany
zapełnione
Przekrywanie chmur elektronowych
(funkcji falowych) zale
ż
y od odległo
ś
ci
mi
ę
dzy orbitalami.
Pasma o ni
ż
szej energii s
ą
w
ęż
sze
Widmo energetyczne
pojedynczego atomu i kryształu.
Pasmo energetyczne to zbiór bardzo blisko siebie poło
ż
onych stanów
elektronów.
Pasmo przewodnictwa;
istniej
ą
wolne
poziomy energetyczne: elektrony mog
ą
do
nich przej
ść
, co oznacza,
ż
e przewodz
ą
pr
ą
d
Pasmo walencyjne;
je
ś
li wszystkie dozwolone
poziomy energetyczne s
ą
zaj
ę
te, to elektrony,
mimo ich ruchu, nie przewodz
ą
pr
ą
du
Przerwa wzbroniona;
elektrony nie mog
ą
mie
ć
energii z tego zakresu
Poziom Fermiego;
najwy
ż
sza energia któr
ą
mog
ą
mie
ć
elektrony
Energia
stany puste
stany
zapełnione
Szeroko
ść
pasm energetycznych i poło
ż
enie poziomu Fermiego okre
ś
la
wi
ę
kszo
ść
własno
ś
ci elektronowych materiału
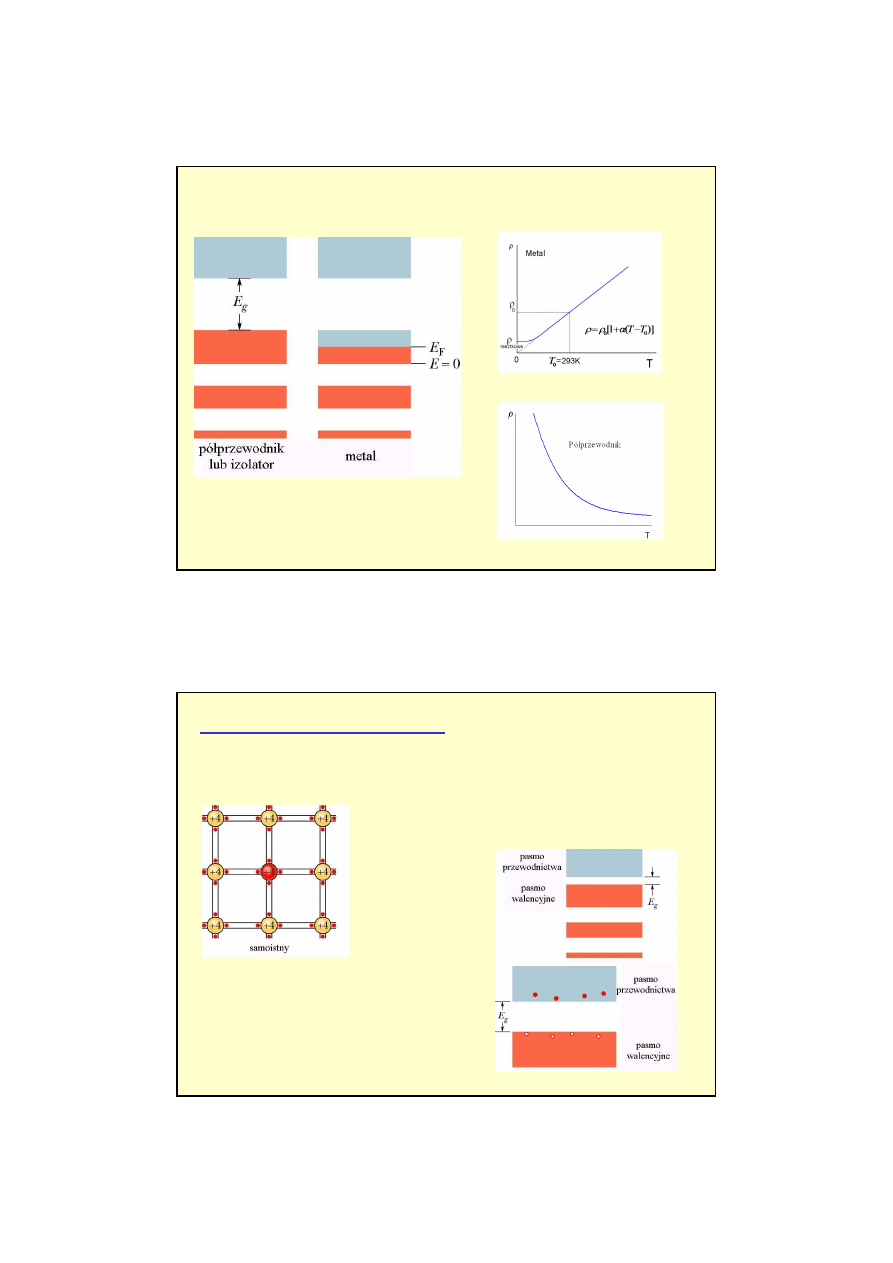
6
Pasma metali i półprzewodników (izolatorów)
pasmo przewodnictwa
cz
ęś
ciowo zapełnione
pasmo przewodnictwa
puste
Krzem E
g
= 1.2 eV
Diament E
g
= 5.5 eV
Np. german i krzem
IV grupa układu
okresowego (4 elektrony walencyjne).
Wszystkie elektrony walencyjne bior
ą
udział w
wi
ą
zaniach wi
ę
c brak jest elektronów swobodnych.
Wzbudzenia
(np. termicznie) elektronu
walencyjnego
staje si
ę
on swobodnym
elektronem
przewodnictwa
w powłoce
walencyjnej powstaje puste miejsce po
elektronie nazywane
dziur
ą
.
Półprzewodniki
samoistne
Własno
ś
ci półprzewodników
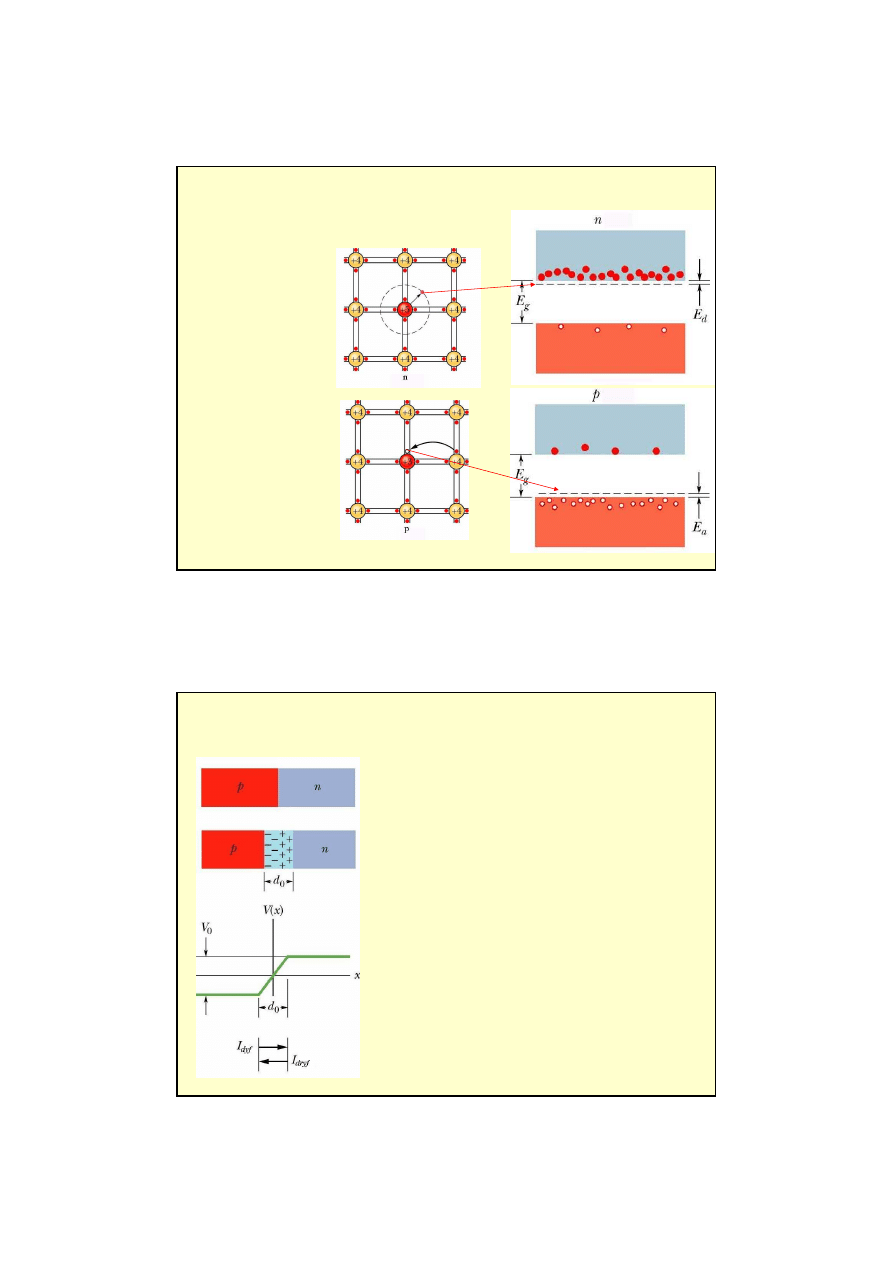
7
półprzewodnik typu n
(donorowe): domieszka
pierwiastka o wyższej
wartościowości
Si + P:
E
g
= 1.2 eV
E
d
= 0.045 eV
półprzewodnik typu p
(akceptorowe): domieszka
pierwiastka o niższej
wartościowości
Si + Al:
E
g
= 1.2 eV
E
a
= 0.067 eV
Domieszkowanie półprzewodników
1) Zł
ą
cze p - n
Ruch no
ś
ników
wi
ę
kszo
ś
ciowych
(elektronów i dziur)
przez zł
ą
cze tworzy
pr
ą
d dyfuzji
w zł
ą
czu tworzy si
ę
przestrzenny rozkład ładunku.
Z rozkładem przestrzennym ładunku zwi
ą
zana jest
ró
ż
nica potencjałów V
0
, która działa jako
bariera
dla
no
ś
ników wi
ę
kszo
ś
ciowych.
Ró
ż
nica potencjałów V
0
nie przeszkadza przepływowi
ładunków
mniejszo
ś
ciowych
pr
ą
d dryfu (unoszenia)
.
W stanie równowagi I
dyf
= I
dryf
I
wyp.
= 0
Zastosowania półprzewodników:
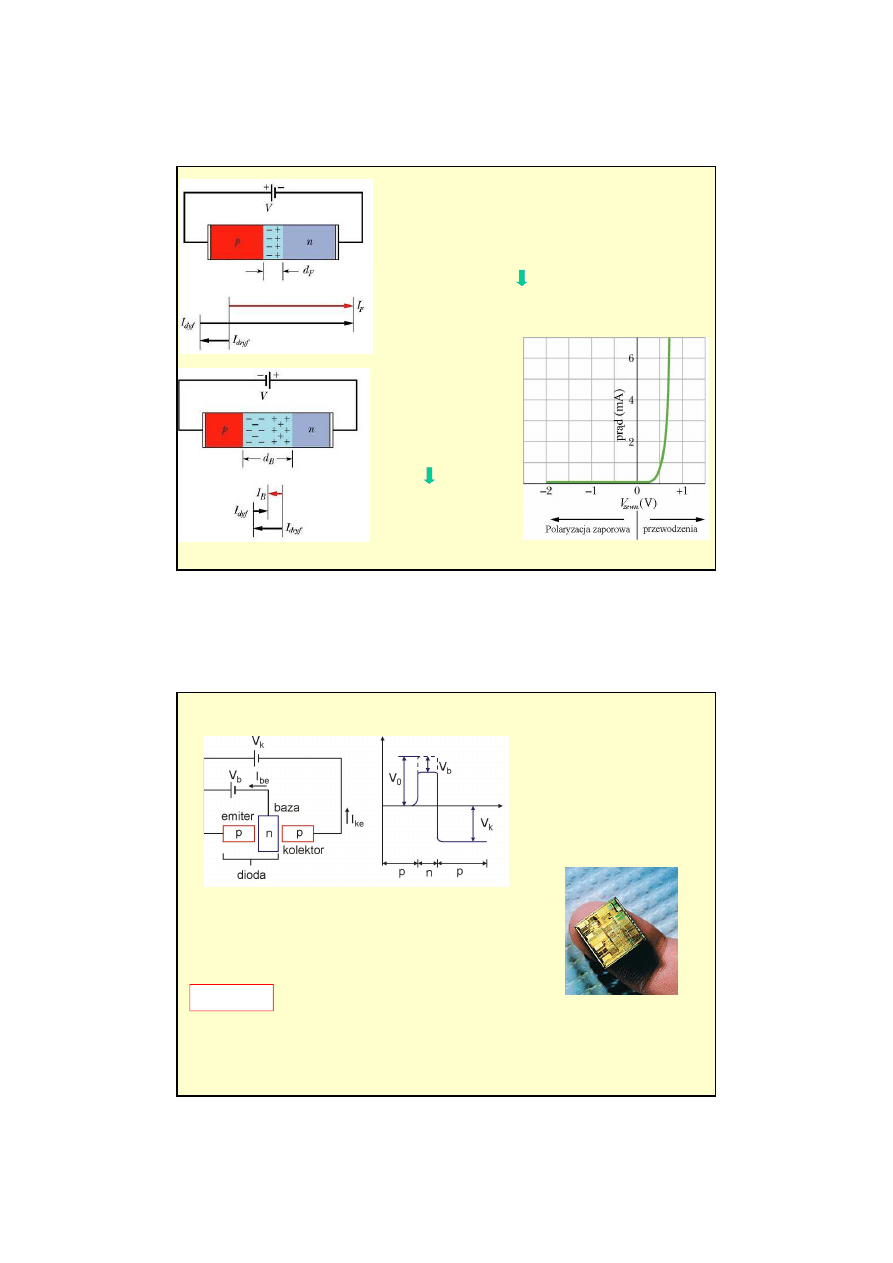
8
Zmniejszona
wysoko
ść
bariery potencjału V
0
pr
ą
d no
ś
ników wi
ę
kszo
ś
ciowych ro
ś
nie
.
Ró
ż
nica potencjałów V
0
nie wpływa na przepływowi
ładunków
mniejszo
ś
ciowych
pr
ą
d dryfu nie zmienia
.
Du
ż
y, wypadkowy pr
ą
d I
F
płynie przez zł
ą
cze
Zwi
ę
kszona
wysoko
ść
bariery potencjału V
0
pr
ą
d no
ś
ników
wi
ę
kszo
ś
ciowych
maleje
.
Mały, wypadkowy pr
ą
d
wsteczny I
B
płynie przez
zł
ą
cze
tranzystor
dioda do
której doł
ą
czono obszar p
(kolektor)
V
b
w kierunku przewodzeni
du
ż
y pr
ą
d (dziurowy)
z emitera do bazy
Baza jest bardzo cienka
99% dziur przechodzi do
kolektora, 1% wypływa z bazy (I
be
).
be
ke
/ I
I
=
β
współczynnik wzmocnienia pr
ą
du
W typowych tranzystorach
β
= 100.
Na
wej
ś
ciu
tranzystora pr
ą
d I
be
(sygnał zmienny o danej charakterystyce)
na
wyj
ś
ciu
tranzystora pr
ą
d I
ke
o takiej samej charakterystyce ale 100 razy
silniejszy.
2) Tranzystor
Wyszukiwarka
Podobne podstrony:
22 materia skondensowana [tryb zgodności]
22 materia skondensowana [tryb zgodności]
Bankowosc materialy 14 [tryb zgodnosci]
21 materia skondensowana new
Bankowosc materialy 2014 [tryb zgodnosci]
21 Schrodinger atom [tryb zgodności]
Bankowosc materialy 14 [tryb zgodnosci]
Microsoft PowerPoint Alergia na materiały protetyczne [tryb zgodności]
Bankowosc materialy 2014 [tryb zgodnosci]
3 Materiały półprzewodnikowe, własności, wytwarzanie i ich obróbka mechaniczna [tryb zgodności]
4 halogenki alkilowe SN materiały [tryb zgodności]
Sprawozdanie 3 (tryb zgodności), Prywatne, Budownictwo, Materiały, IV semestr, od Beaty, Semestr 4,
3 Materiały półprzewodnikowe, własności, wytwarzanie i ich obróbka mechaniczna [tryb zgodności]
2012 KU W5 tryb dzienny moodle tryb zgodnosci
(W7a Stale do kszta t na zimno cz I [tryb zgodno ci])
więcej podobnych podstron