Wykłady z Biofizyki dla studentów kierunku analityka medyczna
Biofizyka molekularna
– oddziaływania wewnątrz- i
międzycząsteczkowe
Hanna Trębacz
Katedra i Zakład Biofizyki
Uniwersytet Medyczny w Lublinie
2012/2013
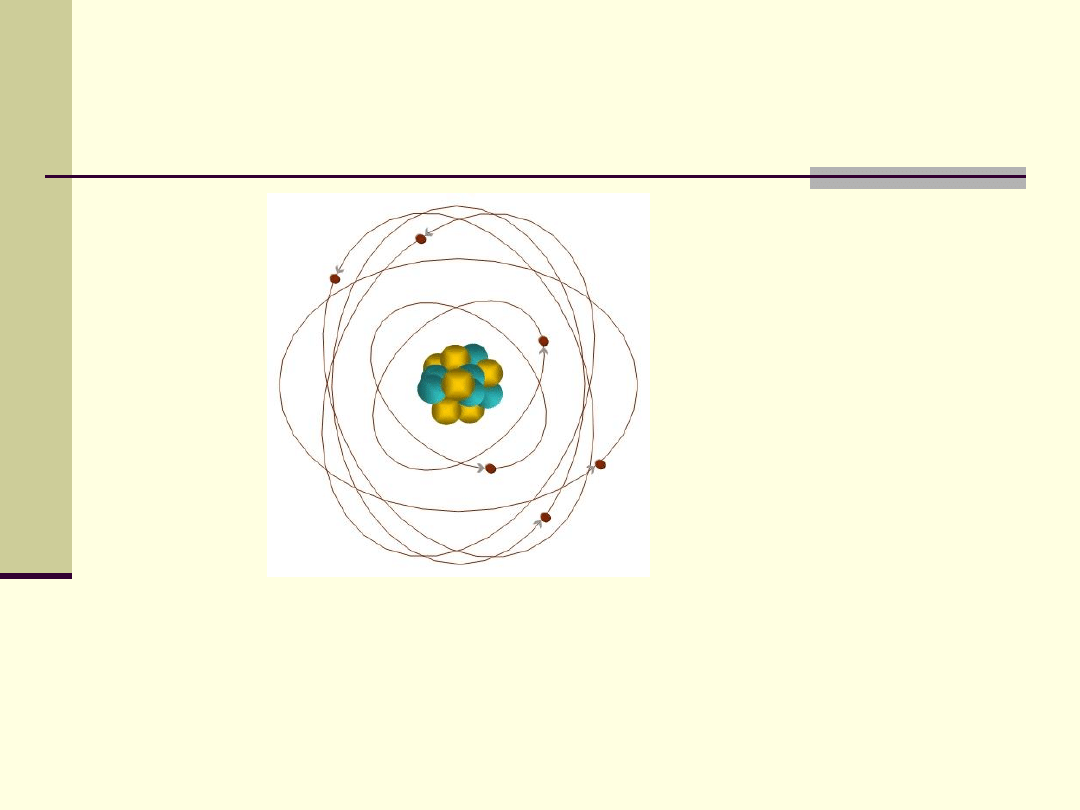
Atom
Elektrony w atomie są przyciągane siłami
elektrycznymi przez protony w jądrze.
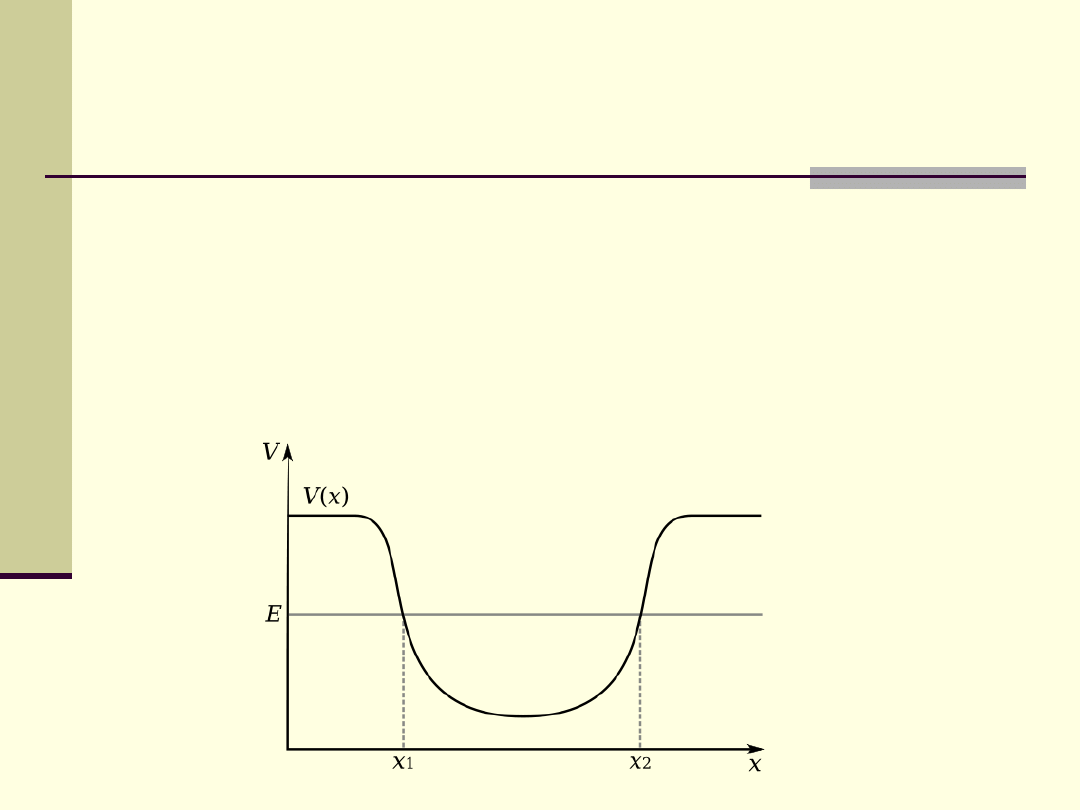
Studnia potencjału wokół jądra – uwolnienie z niej wymaga
dostarczenia elektronom energii z zewnątrz.
Im bliżej jądra znajduje się elektron, tym silniej jest przyciągany i
wzrasta energia konieczna do jego oderwania od atomu (
głębsza
studnia potencjału)
Atom
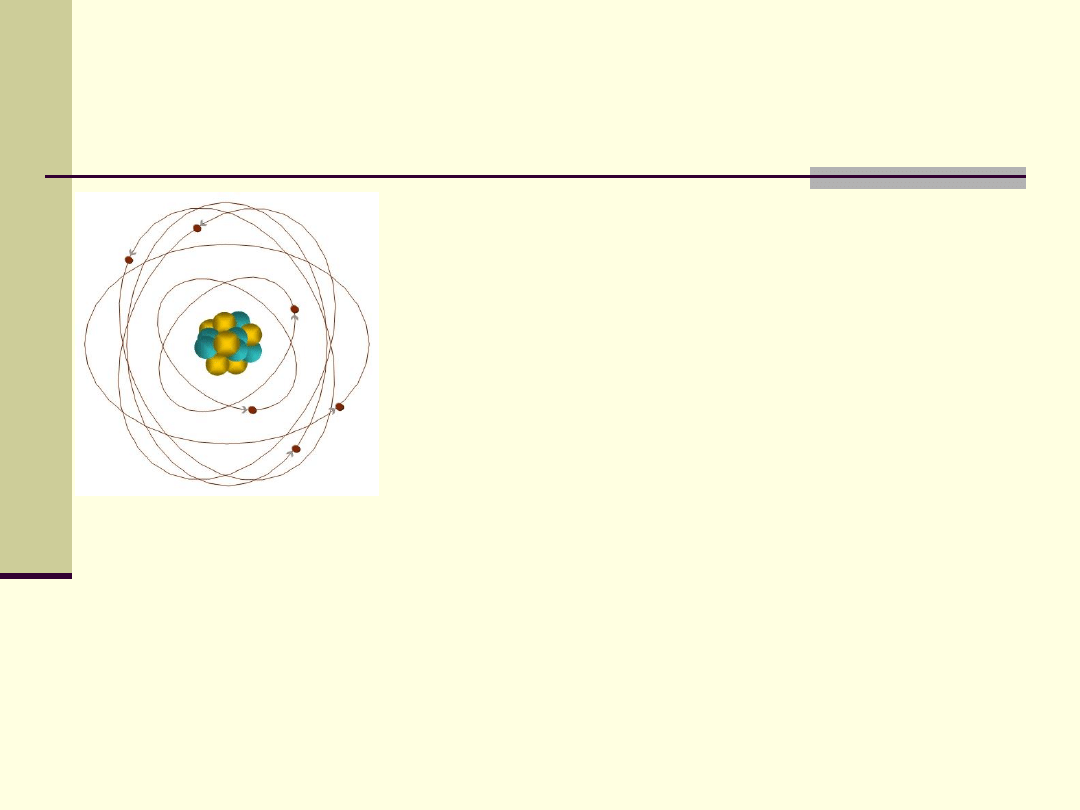
Atom
Zgodnie z mechaniką kwantową,
elektrony są jednocześnie cząstkami i
falami.
Każdy elektron można opisać funkcją
określającą prawdopodobieństwo
znalezienia elektronu w określonym
obszarze. Dla elektronu w studni potencjału
funkcja ta jest nazywana orbitalem.
Zbiór orbitali posiadających podobny
poziom energetyczny to powłoka
elektronowa, a wszystkie powłoki − chmura
elektronowa.

Atom helu w stanie podstawowym.
Jądro ma rozmiary
rzędu 1 fm – ok. 100 000
razy mniej od rozmiarów
chmury elektronowej.
Chmura elektronowa
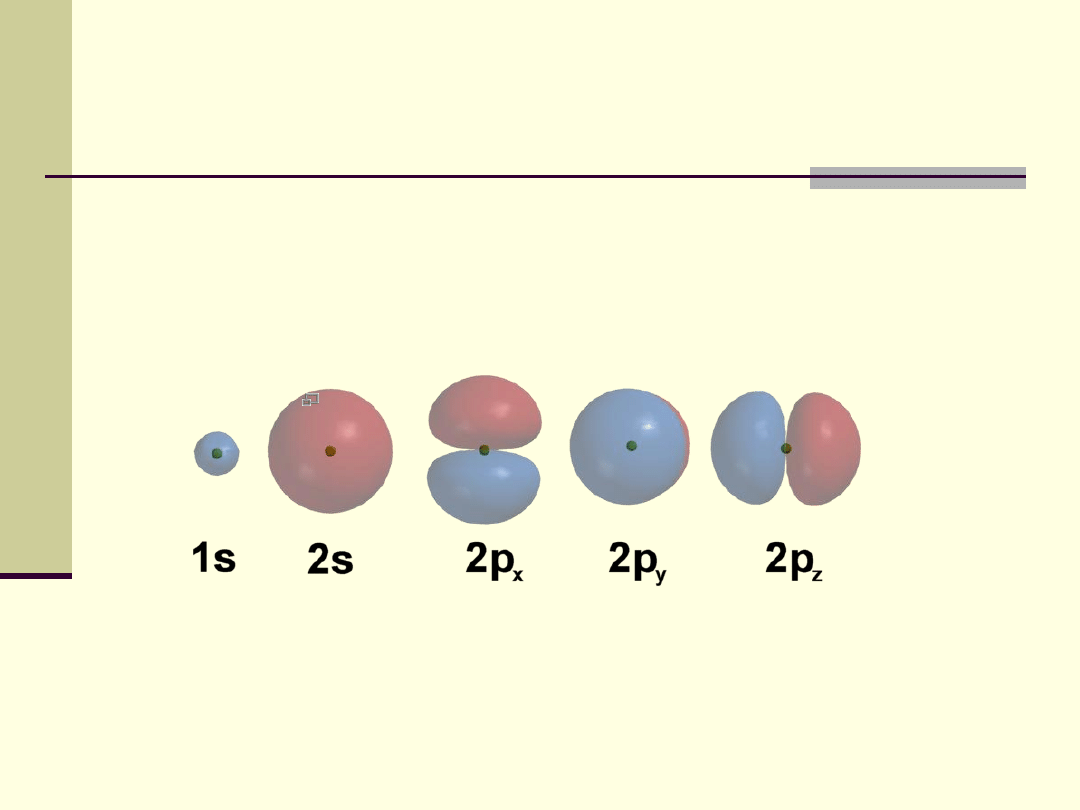
Atom
Kształty pięciu najprostszych orbitali. Trzy orbitale 2p mają
identyczny kształt, różnią się jedynie orientacją w przestrzeni
Istnieje określony, niewielki zbiór stabilnych orbitali
wokół jądra a wszystkie pozostałe, które są
teoretycznie możliwe, szybko rozpadałyby się.

Stan podstawowy
Elektrony na orbitalach oddziałują ze sobą zmieniając
kształt orbitali.
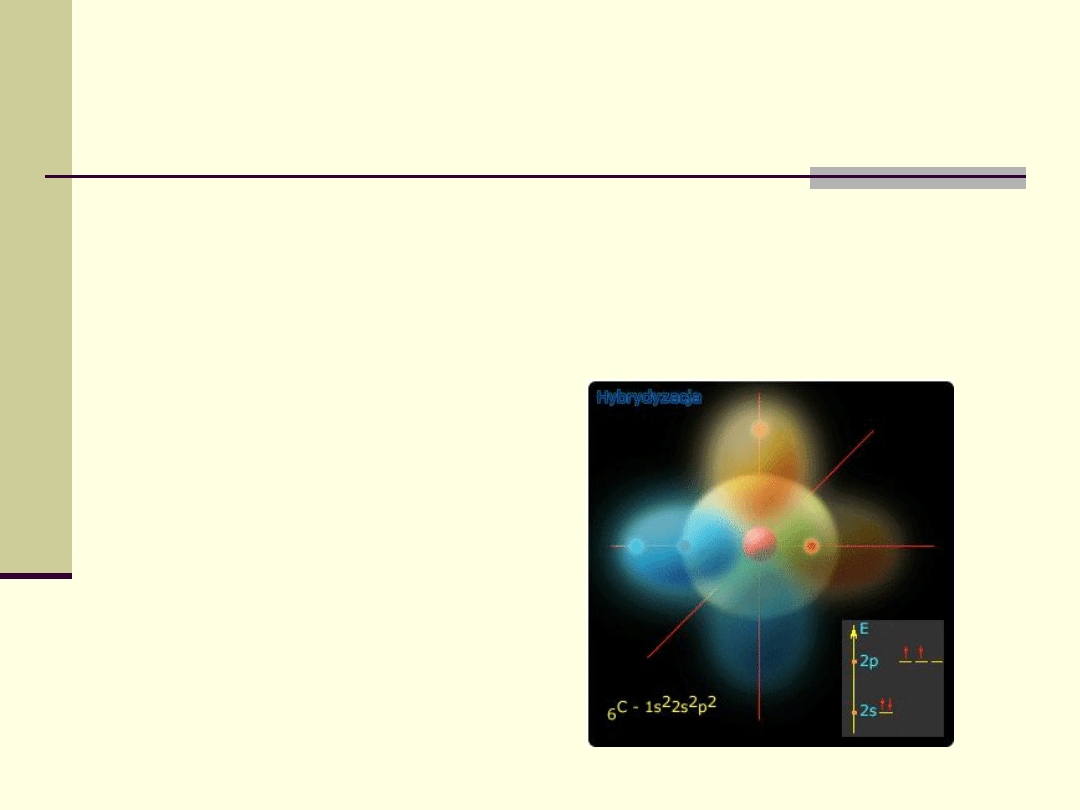
W stanie wzbudzonym zaburzenia ruchu elektronów są
jeszcze bardziej zakłócone a wszystkie orbitale
zaczynają mieszać się.
Proces mieszania się orbitali w danym atomie nazywa
się procesem hybrydyzacji.
Stan wzbudzony

Powstawanie wiązań
W wyniku zmieszania orbitali powstają warunki do tworzenia
wiązań chemicznych.
W przypadku atomu węgla powstają cztery hydrydy skierowane do
naroży tetraedru i każda będzie dążyła do sparowania elektronów.
To sparowanie może uzyskać w wyniku utworzenia wiązania
chemicznego z innym atomem.
Wiązanie chemiczne wg
mechaniki kwantowej
Wytworzenie wiązania chemicznego polega
na deformacji powłoki elektronowej atomów,
zmianie gęstości elektronowej w otoczeniu
jąder atomów, a przez to wyróżnieniu
uprzywilejowanych kierunków w przestrzeni.
Zakłada się, że orbital cząsteczkowy
powstaje w wyniku nakładania się orbitali
atomowych atomów tworzących wiązanie.
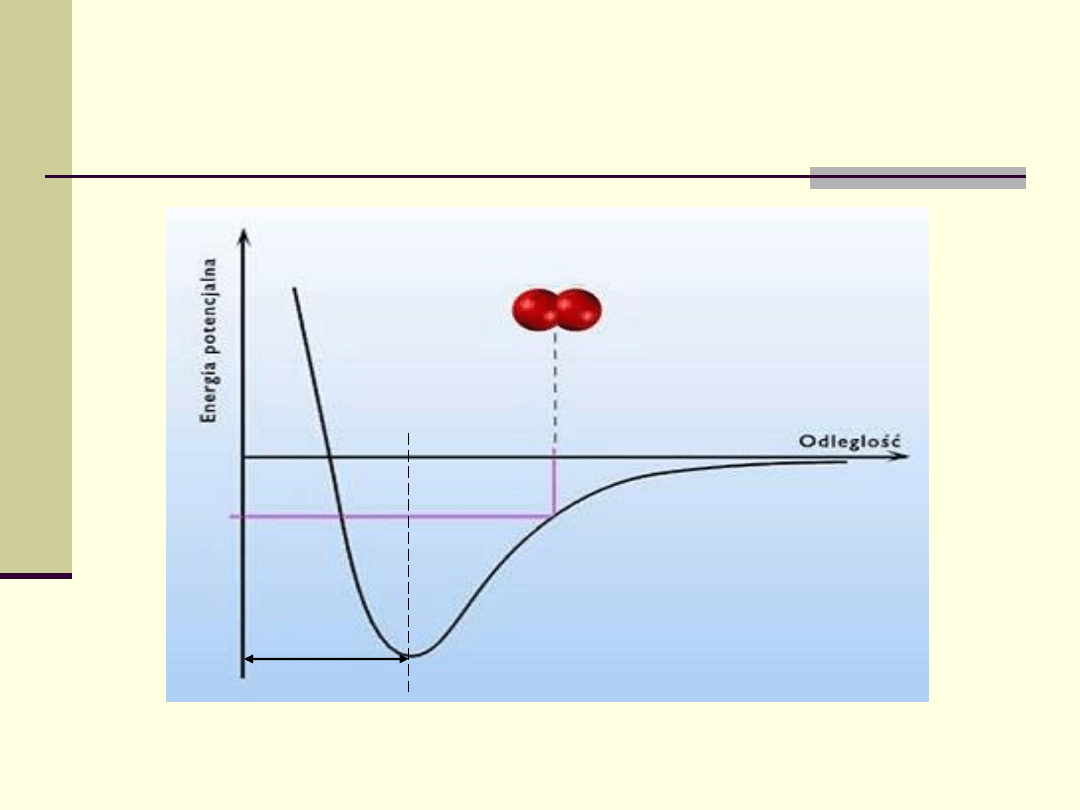
Energia potencjalna
układu atomów
w cząsteczce
r
o
E
w
E
w
– energia wiązania (minimalna
energia dla rozerwania wiązania)
Siły wiążące atomy w cząsteczce
Wiązania jonowe
Wiązania kowalencyjne
koordynacyjne
Oddziaływania wewnątrzcząsteczkowe
Wiązanie jonowe
Wiązanie jonowe (elektrowalencyjne,
heteropolarne lub biegunowe) - utworzone
przez elektrostatyczne oddziaływanie między
jonami o różnoimiennych ładunkach.
Wiązanie to powstaje najczęściej między
metalem a niemetalem.
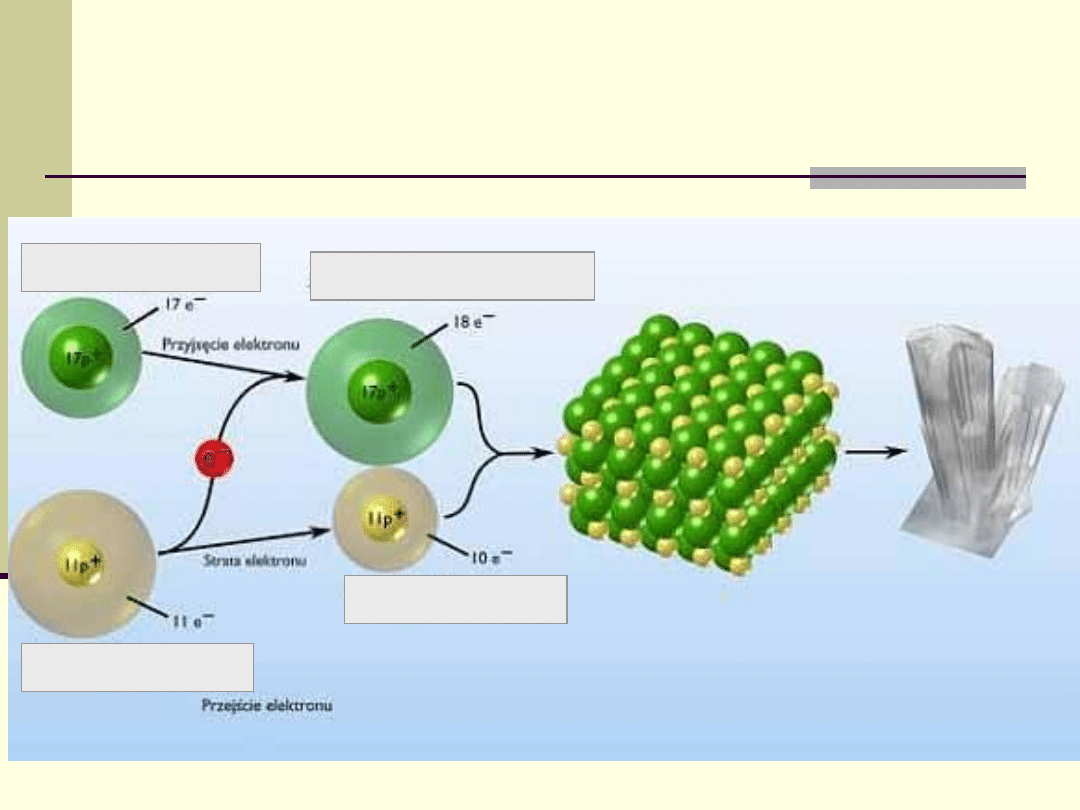
Atom chloru (Cl)
Atom sodu (Na)
Jon sodu (Na
+
)
Jon chlorkowy (Cl
-
)
Schemat powstawania
wiązania jonowego
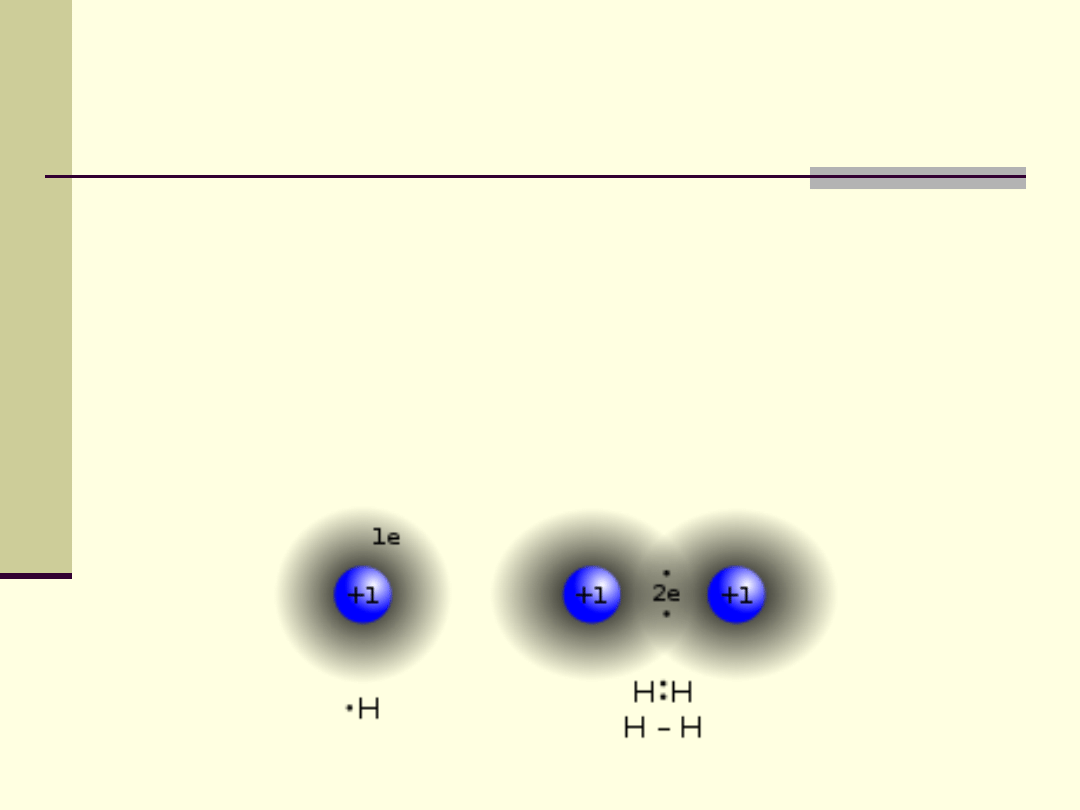
Wiązanie kowalencyjne
Połączenie atomów w cząsteczkę poprzez parę elektronów,
które są współdzielone przez oba atomy tworzące to wiązanie.
Wspólne elektrony znajdują się na wspólnych orbitalach
molekularnych, które powstają w wyniku nakładania się
odpowiednich orbitali atomowych.
Wszystkie elektrony na wszystkich orbitalach molekularnych
tworzą chmurę elektronową, otaczającą oba połączone atomy.
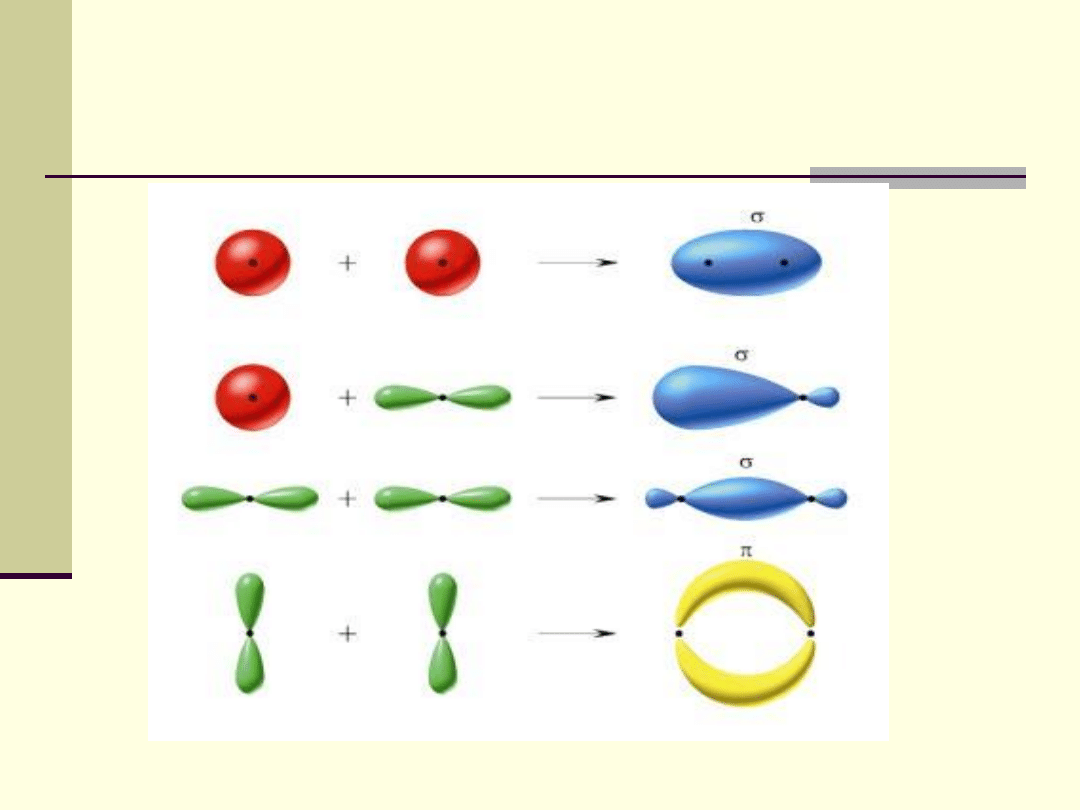
Ze względu na sposób nakładania się orbitali
atomowych tworzących orbitale molekularne
rozróżnia się wiązania σ (sigma) i π (pi).
Wiązania
σ
powstają w wyniku czołowego
nakładania się orbitali atomowych (orbitale
ustawione wzdłuż osi podłużnych).
Wiązania
π
powstają w wyniku nakładania
się bocznego orbitali (orbitale ustawione
równolegle).
Klasyfikacja wiązań kowalencyjnych
Klasyfikacja wiązań kowalencyjnych
s
– s
p
– p
s
– p
p
– p
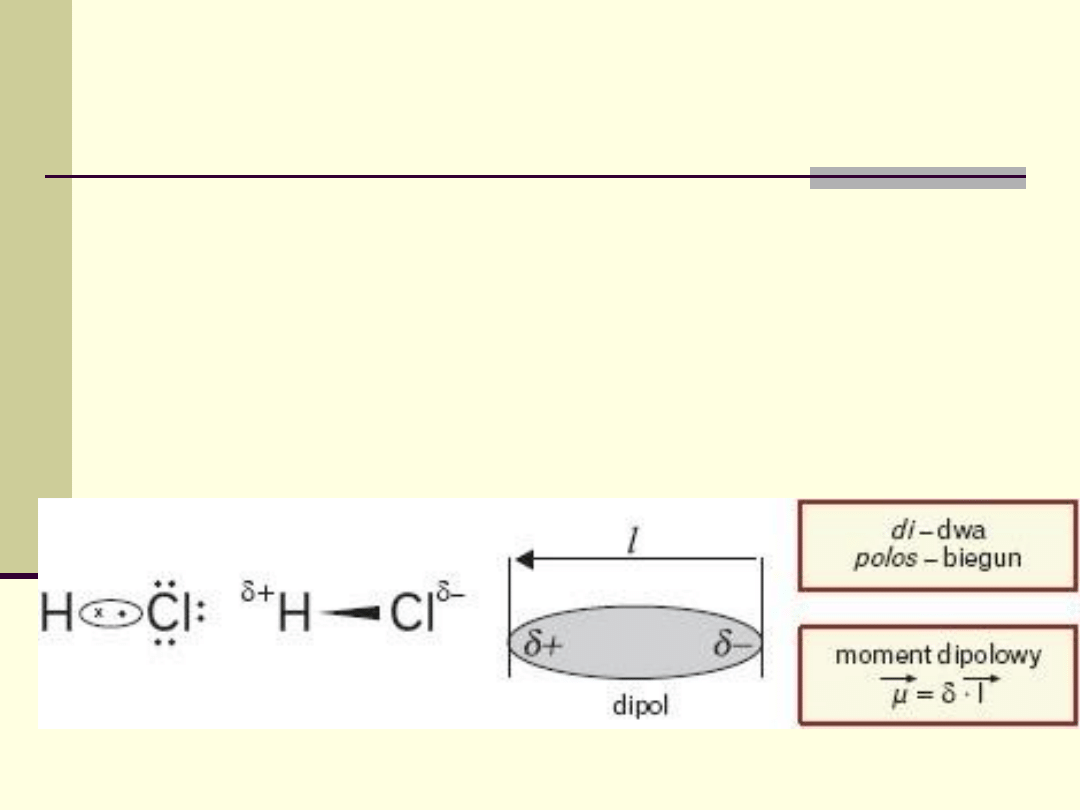
Wiązania spolaryzowane
Wiązania kowalencyjne, w których biorą udział atomy
różniące się elektroujemnością, nazywa się wiązaniami
spolaryzowanymi.
Wspólna para elektronowa jest przesunięta w kierunku
atomu o większej elektroujemności.
Polaryzację wiązania można określić, podając moment
dipolowy wiązania.
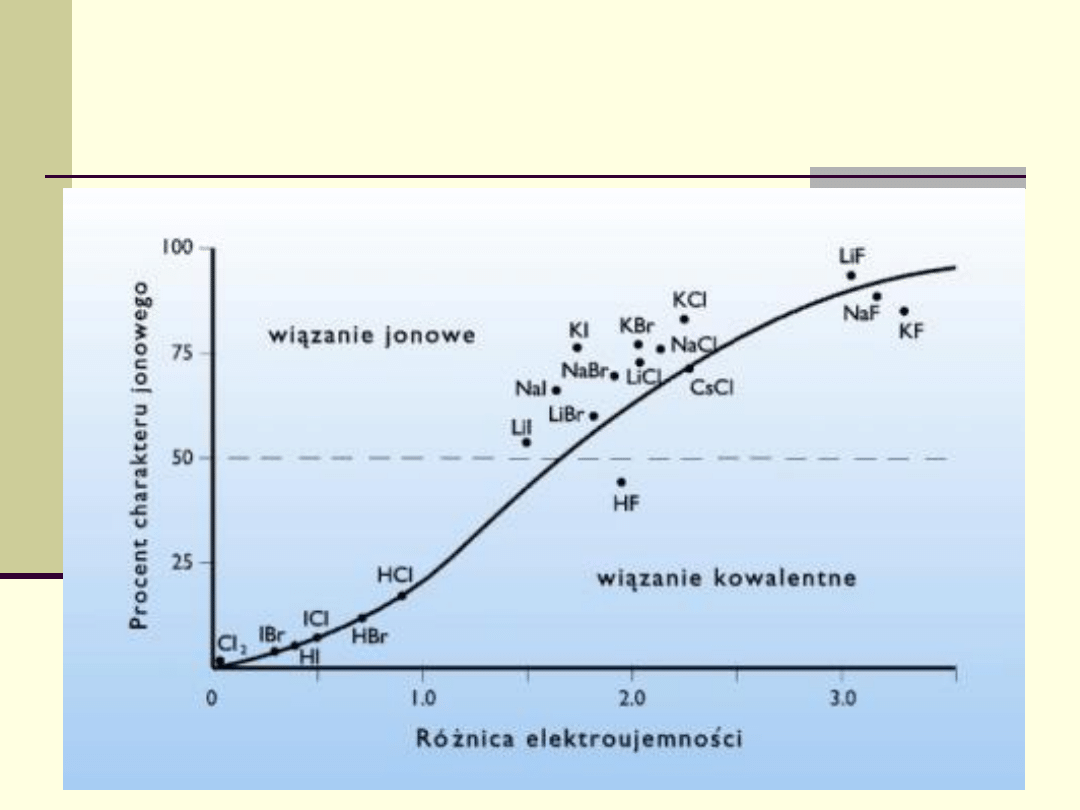
Różnica miedzy wiązaniem jonowym a
kowalencyjnym ma charakter dość umowny
Oddziaływania międzycząsteczkowe
Są odpowiedzialne za tworzenie struktur
nadmolekularnych (
wielocząsteczkowych)
Energia wiązań międzycząsteczkowych jest
ok. stukrotnie mniejsza niż wiązań
wewnątrzcząsteczkowych
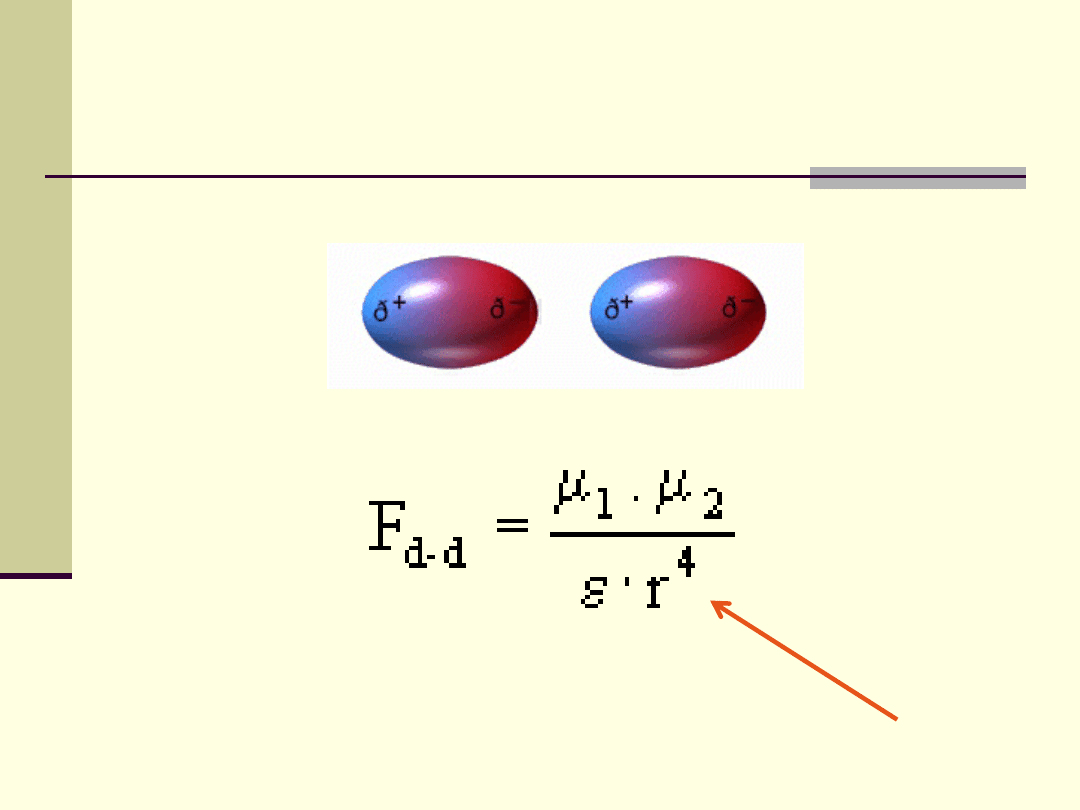
Oddziaływania międzycząsteczkowe
Oddziaływania van der Waalsa (uniwersalne)
Odziaływania wodorowe (specyficzne)
Oddziaływania
van der Waalsa
oddziaływania trwałych dipoli
oddziaływania trwały dipol – dipol
indukowany
siły dyspersyjne.
Oddziaływania trwałych dipoli
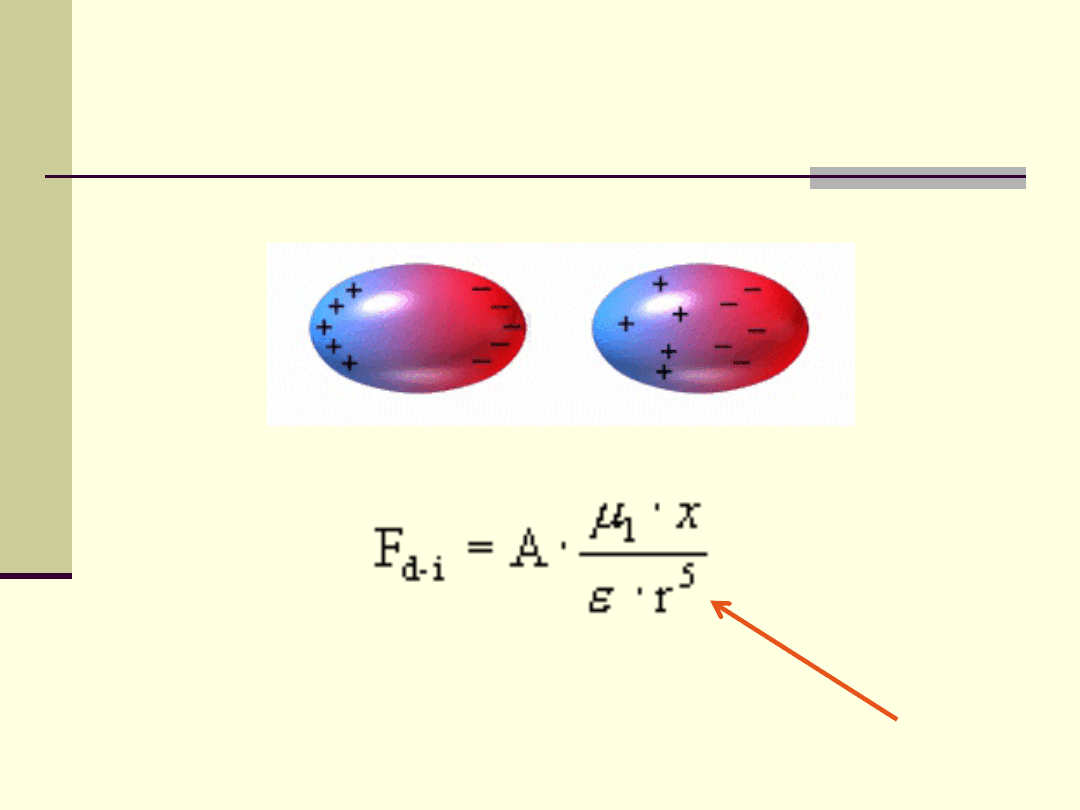
Oddziaływania trwały dipol
– dipol indukowany
Siły dyspersyjne
Siły dyspersyjne powstają wskutek chwilowych
zmian gęstości elektronów w cząsteczkach.
Cząsteczka posiadająca chwilowy moment
dipolowy może go wzbudzić w cząsteczce
sąsiadującej, wskutek czego obie cząsteczki mogą
się nawzajem chwilowo przyciągać lub odpychać.
Uśrednienie sił odpychających i przyciągających
daje oddziaływanie przyciągające proporcjonalne
do 1/r
6
.
Oddziaływania van der Waalsa
Przyczyną wystąpienia oddziaływania van der Waals
są trwałe oraz wyindukowane momenty dipolowe w
cząsteczkach lub - w przypadku oddziaływań
dyspersyjnych -
chwilowe asymetrie rozkładu ładunku
w cząsteczce lub atomie.
Oddziaływania van der Waalsa są oddziaływaniami
bliskiego zasięgu (do 0,5 nm).
Występują w kryształach wszelkiego typu (dominują w
kryształach molekularnych), ponadto mają duże
znaczenie w zjawiskach takich jak np. adsorpcjia czy
skraplanie gazów.
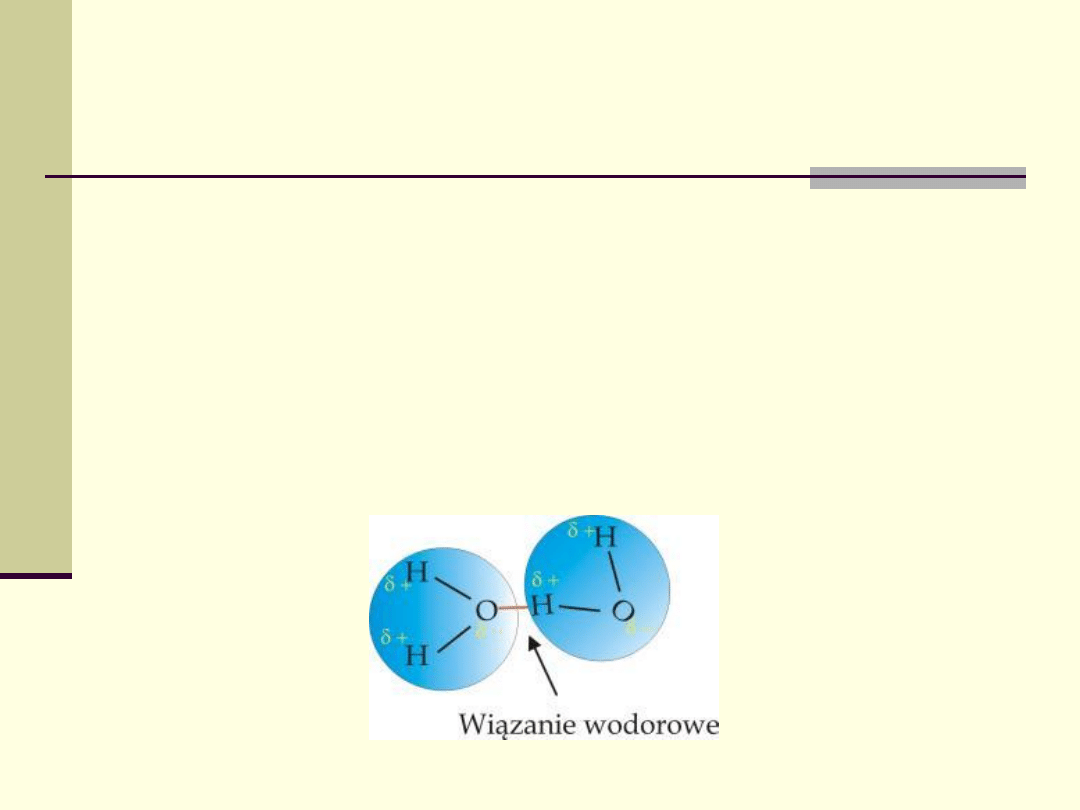
Wiązanie wodorowe
(mostki wodorowe)
Występuje ono pomiędzy kowalentnie związanym
atomem wodoru (donor), a elektroujemnymi atomami
sąsiedniej cząsteczki (akceptor)- najczęściej O, N, S,
czasami C.
silniejsze od van der Waalsa, ale słabsze od
kowalentnych.
Wiązanie wodorowe
Wiązania wodorowe, jeśli występują w
obrębie jednej cząsteczki, są często
traktowane jak słabe wiązanie chemiczne
jeśli jednak wiąże ono dwie lub więcej
cząsteczek, można je traktować jako
oddziaływanie międzycząsteczkowe.
Wiązanie wodorowe
Wszystkie wiązania wodorowe są znacznie słabsze od
wiązań kowalencyjnych.
Słabe wiązanie wodorowe – energia poniżej 4 kcal/mol.
Silne wiązanie wodorowe to takie- energia powyżej 4
kcal/mol,
Bardzo silne wiązania wodorowe tworzą się między
atomami w cząsteczkach (wewnątrzmolekularne wiązania
wodorowe
). Najsilniejsze znane wiązania wodorowe
posiadają energię zbliżoną do słabszych wiązań
kowalencyjnych
– rzędu 40 kcal/mol.
Wiązanie wodorowe
Wiązania wodorowe występują w cząsteczce i
międzycząsteczkami wody oraz we wszystkich
biomolekułach
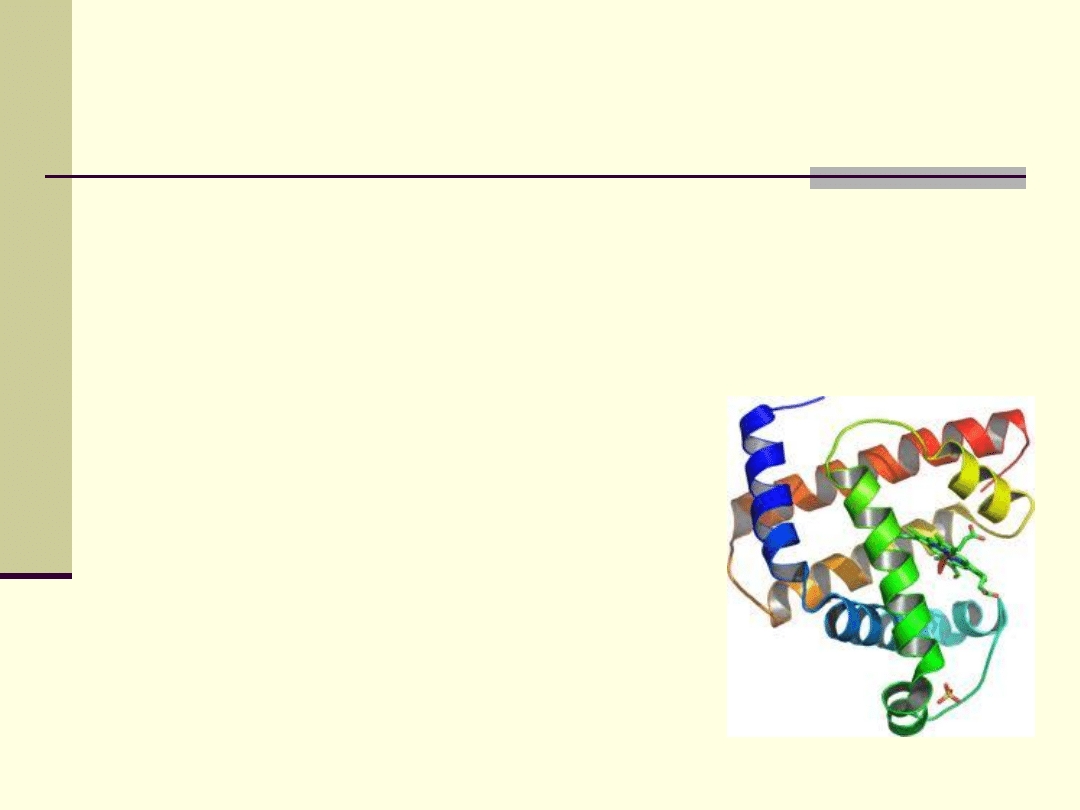
Struktura III i IV-
rzędowa białek ( a więc i ich
właściwości) wynika z tego , że wiązania
wodorowe są kierunkowe; dotyczy to też
lipidów oraz węglowodanów.
Biologiczne znaczenie wiązań wodorowych
W
białkach konformacja głównego łańcucha peptydowego
odpowiedzialnego za tworzenie helikalnej, bądź płaskiej struktury
zdeterminowana jest przez wiązanie wodorowe N-H...O=C pomiędzy
grupami aminową i karbonylową.
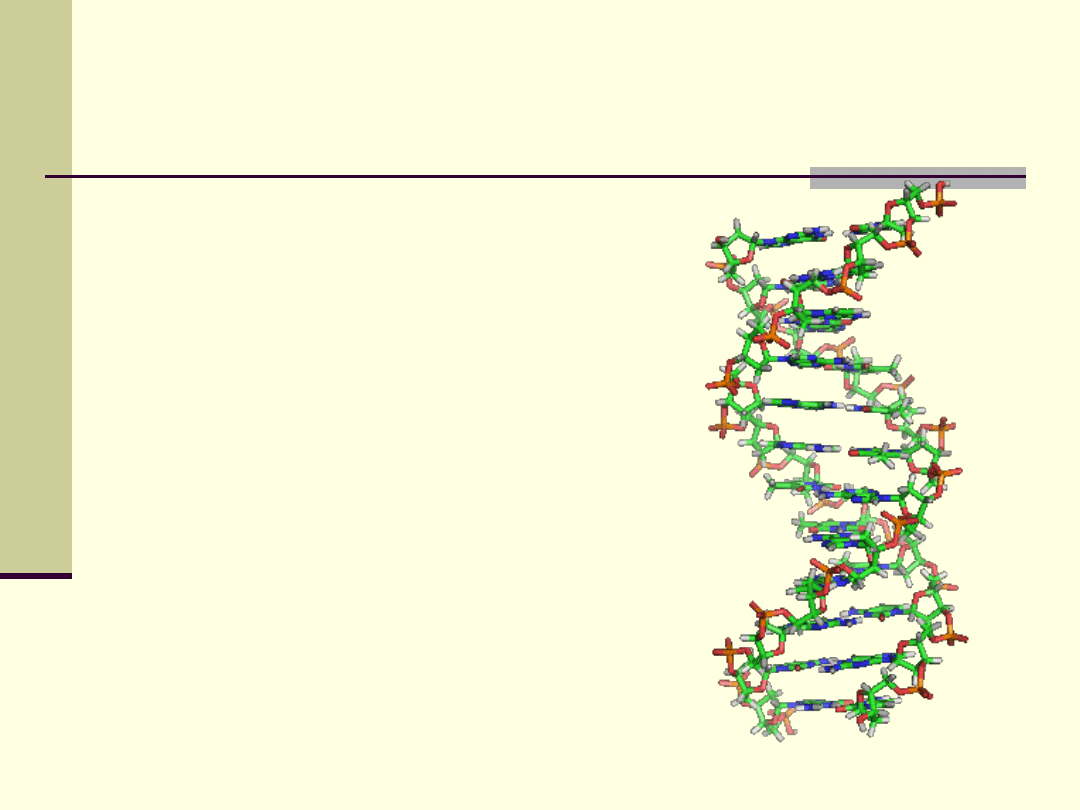
Biologiczne znaczenie wiązań wodorowych
Oba łańcuchy helisy DNA są
utrzymywane razem przez wiązania
wodorowe pomiędzy
komplementarnymi parami zasad
azotowych.
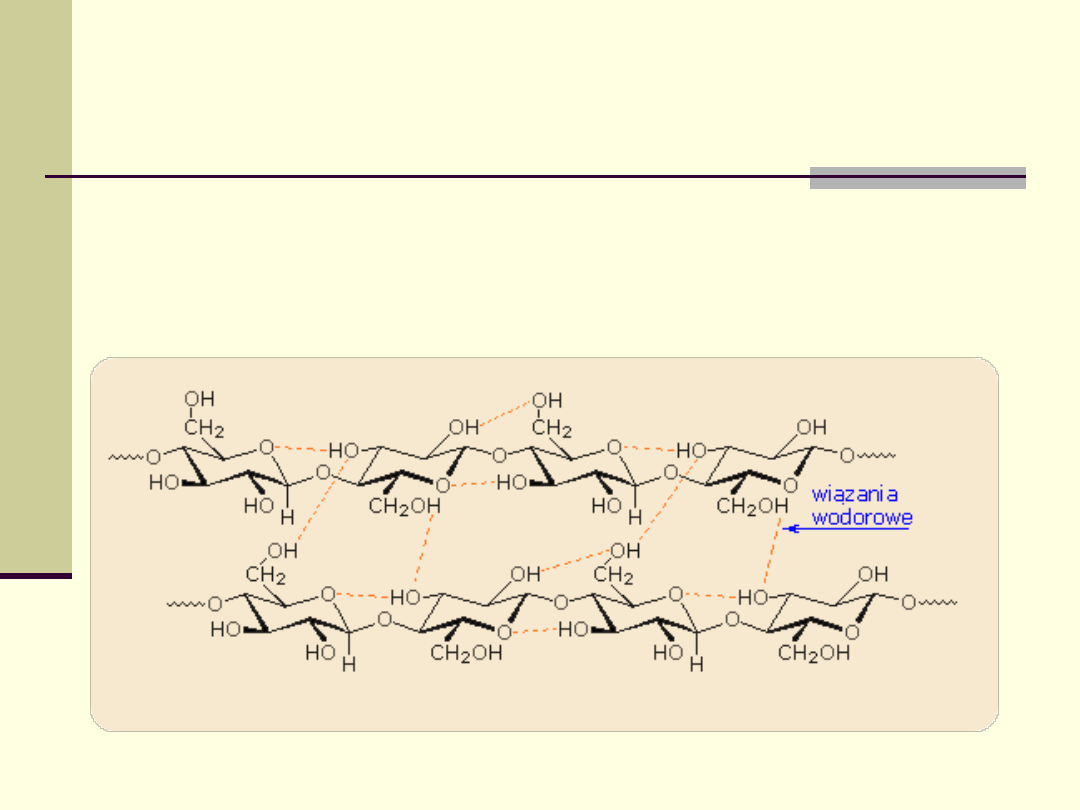
Biologiczne znaczenie wiązań
wodorowych
W przypadku
polisacharydów wiązania wodorowe
pomiędzy grupami hydroksylowymi stabilizują ich
strukturę, znacząco wpływając na ich właściwości.
Biologiczne znaczenie wiązań wodorowych
Wiązania wodorowe mogą stosunkowo szybko
powstawać i zanikać, co ma szczególne znaczenie
w reakcjach biochemicznych.
Struktura i właściwości fizyczne wody
Rola wody:
ok. 60%składu protoplazmy,
rozpuszczalnik organiczny,
uczestnik reakcji biochemicznych,
jako nośnik w transporcie substancji i ciepła;
Właściwości fizyczne wody:
wysoka temperatura topnienia i wrzenia,
duże ciepło topnienia i parowania ,
duże napięcie powierzchniowe,
anomalna rozszerzalność termiczna
duża wartość przenikalności elektrycznej (sprzyja dysocjacji)
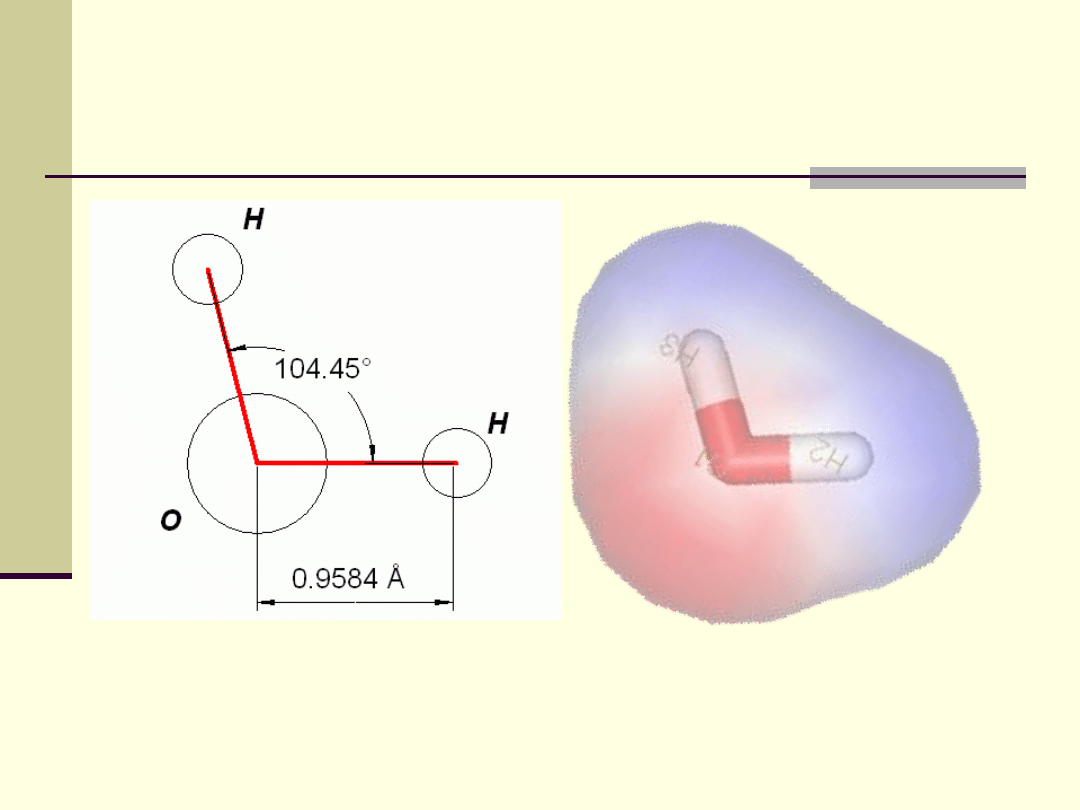
Struktura i właściwości fizyczne wody
+
+
-
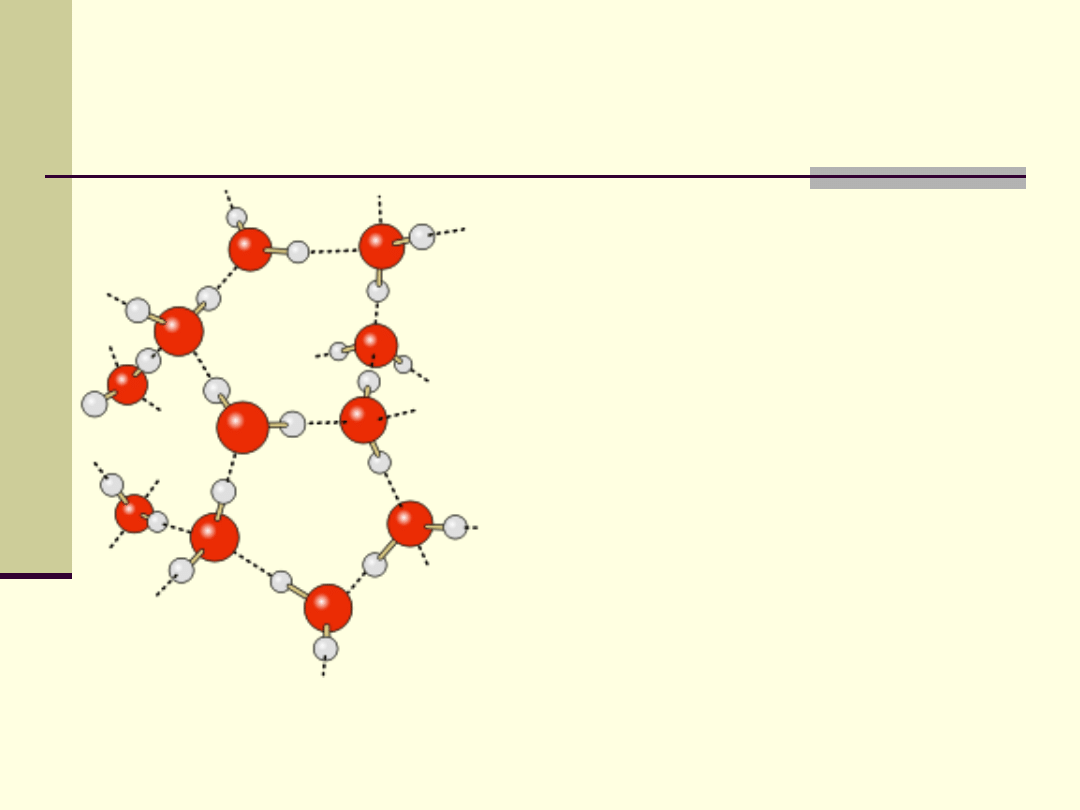
Struktura i właściwości fizyczne wody
Rozkład przestrzenny ładunku
elektrycznego w cząsteczce wody
sprawia, że jedna cząsteczka
może za pośrednictwem wiązań
wodorowych przyłączyć dalsze
cztery.
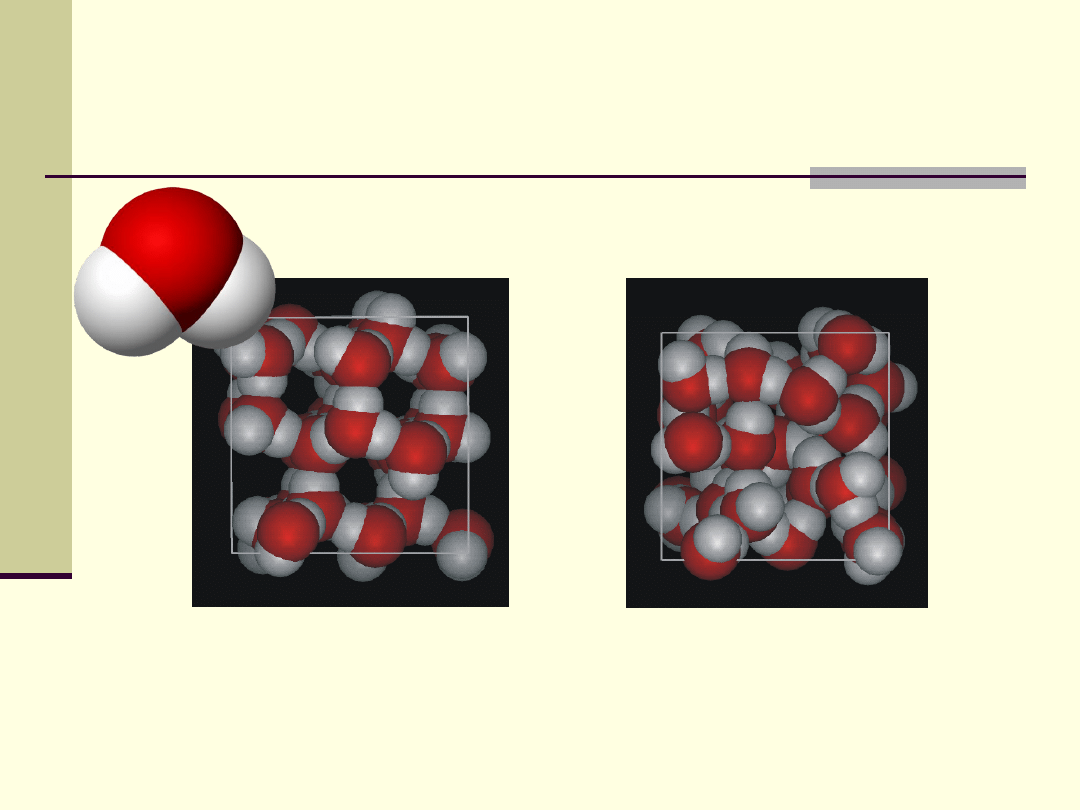
Struktura i właściwości fizyczne wody
Ciekła woda
Lód
W lodzie każda cząsteczka jest połączona czterema wiązaniami
wodorowymi innymi cząsteczkami, w ciekłej wodzie ze średnio 3,4.

Woda w stanie ciekłym zachowuje część wiązań wodorowych, co
wpływa na jej właściwości fizyczne (np. wysokie ciepła przemian
fazowych, duże napięcie powierzchniowe)
Struktura i właściwości fizyczne wody

Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
analityka podstawy spektroskopii 2012 2013
analityka met spektroskopowe 2012 2013
analityka przeplyw cieczy 2012 2013
analityka błony i potenc 2012 2013 (2)
analityka podstawy spektroskopii 2012 2013
analityka światło i met opt 2012 2013
analityka wstep 2012 2013
immunopatologia 2012-2013- całość, Analityka medyczna, Immunopatologia
analityka fale 2012 2013
immunologia wykłady cz.1 2012-2013, Analityka medyczna, Immunologia
materialy farmakologia IV rok analityka 2012 2013
analityka ultradz 2012 2013
analityka światło i met opt 2012 2013
Dowodzenie Zarzadzanie S 2012 2013
Biologiczne podstawy zachowań cz I Psychologia N 2012 2013
mat2 zest6 wggios r1c g10 sl 2012 2013
BwUE wyniki kolokwium 2012 2013
Homo i heteroglikany 2012 2013
więcej podobnych podstron