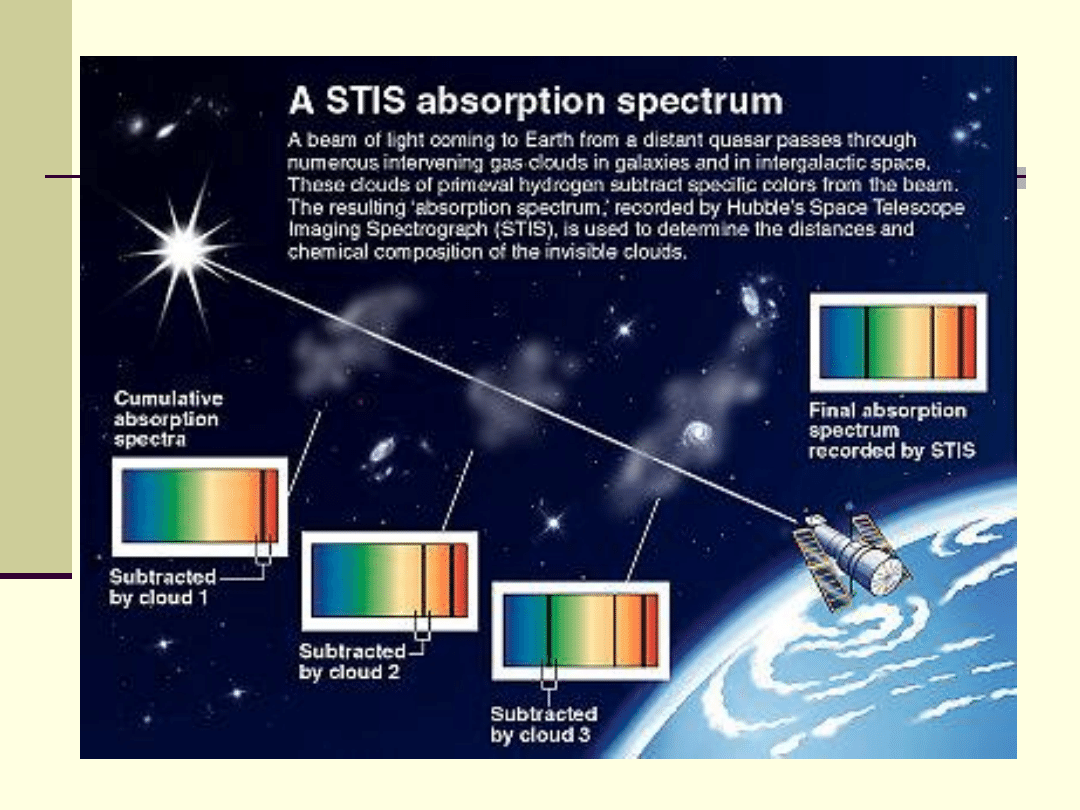
Wykłady z Biofizyki dla studentów kierunku analityka medyczna
Widmo promieniowania elektromagnetycznego
Podstawy fizyczne analizy widmowej
Hanna Trębacz
Katedra i Zakład Biofizyki
Uniwersytet Medyczny w Lublinie
2012/2013
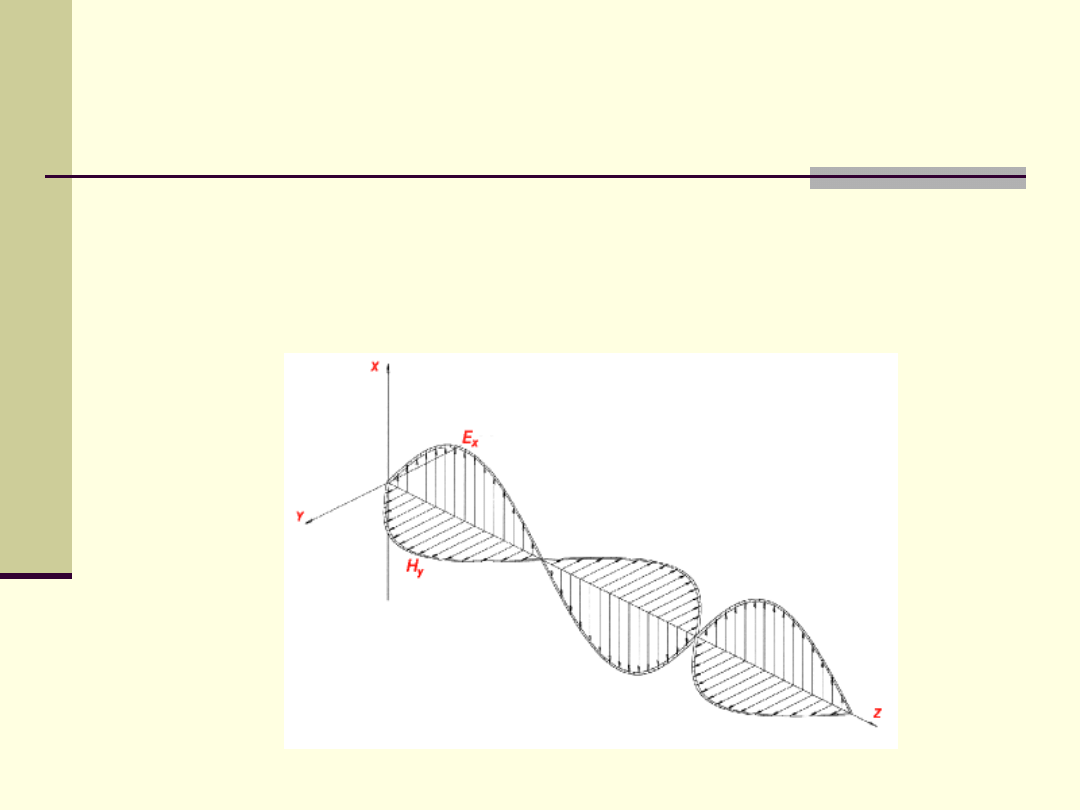
Promieniowanie elektromagnetyczne (fala
elektromagnetyczna)
– rozchodzące się w przestrzeni
zaburzenie pola elektromagnetycznego.
Składowa elektryczna i magnetyczna fali indukują się
wzajemnie.
Źródłem fali e-m jest zwykle oscylujący
ładunek elektryczny.
Promieniowanie elektromagnetyczne
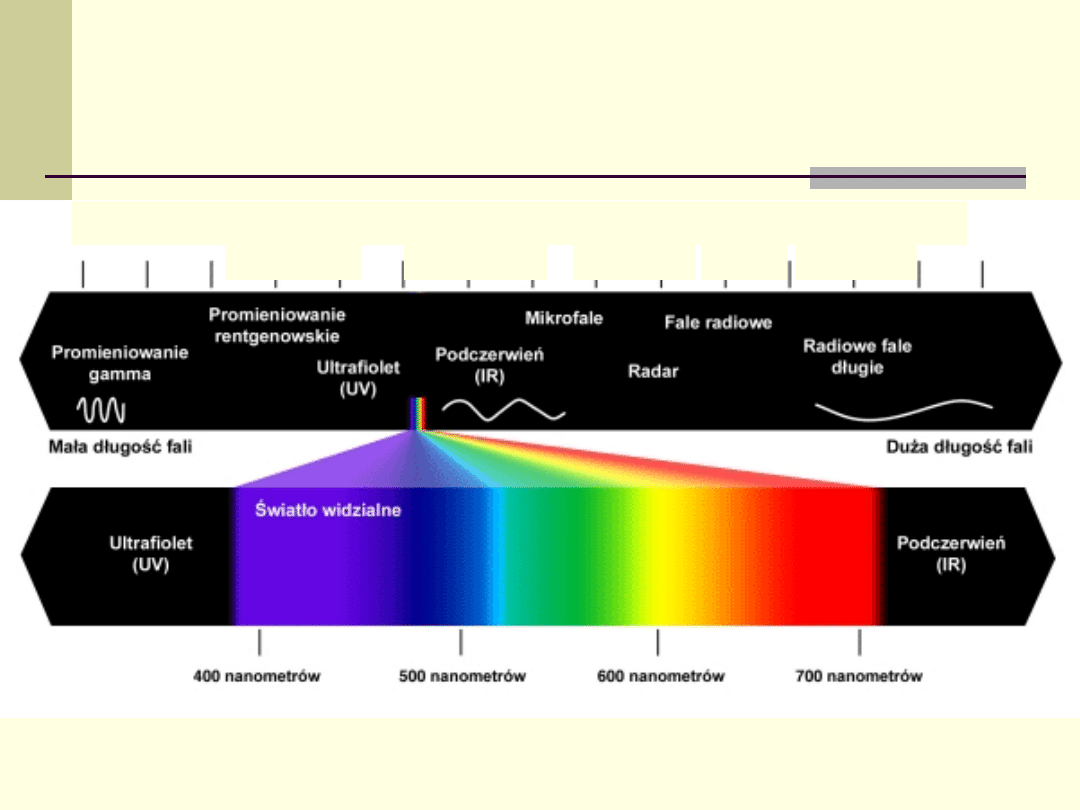
Widmo promieniowania
elektromagnetycznego
1 nanometr
1 metr
1 milimetr
1 mikrometr
1 kilometr
10
20
Hz
10
4
Hz
Promieniowanie e-
m opisuje się jak inne fale
(częstotliwość - f; długość fali - λ, energia - E).
Promieniowanie e-m wykazuje tzw. dualizm
korpuskularno
– falowy.
W próżni fale e-m rozchodzą się z prędkością 3x10
8
m/s.
Na rozchodzenie się fal w innych ośrodkach wpływają
właściwości materiałowe ośrodka.
Właściwości promieniowania e-m zależą od długości fali.
Właściwości fal e-m

Energia promieniowania e-m
Dwa różne aspekty używania terminu „energia”:
Strumień energii niesionej przez promieniowanie;
opisywany jako natężenie promieniowania [J/m
2
s]
(jest pochodną z natężenia promieniowania źródła).
Energia fotonu promieniowania (E =h
·f, gdzie h –
stała Plancka)
W obu przypadkach wpływ promieniowania na
ośrodek zależy od energii zaabsorbowanej przez
cząsteczki ośrodka
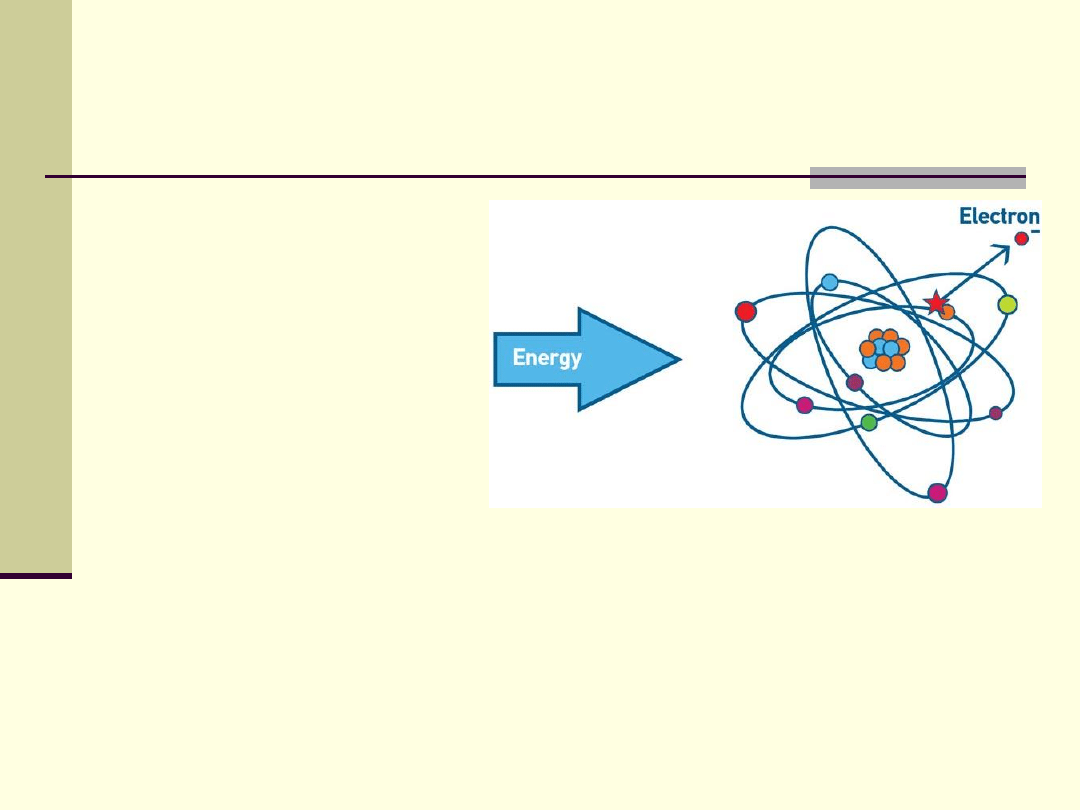
Energia promieniowania e-m
Promieniowanie
jonizujące-
wszystkie rodzaje
promieniowania, które
wywołują jonizację ośrodka
(tj. oderwanie elektronu od
atomu lub cząsteczki)
Większa energia fotonu
promieniowania
– większe
prawdopodobieństwo, że wywoła
on jonizację cząsteczek ośrodka
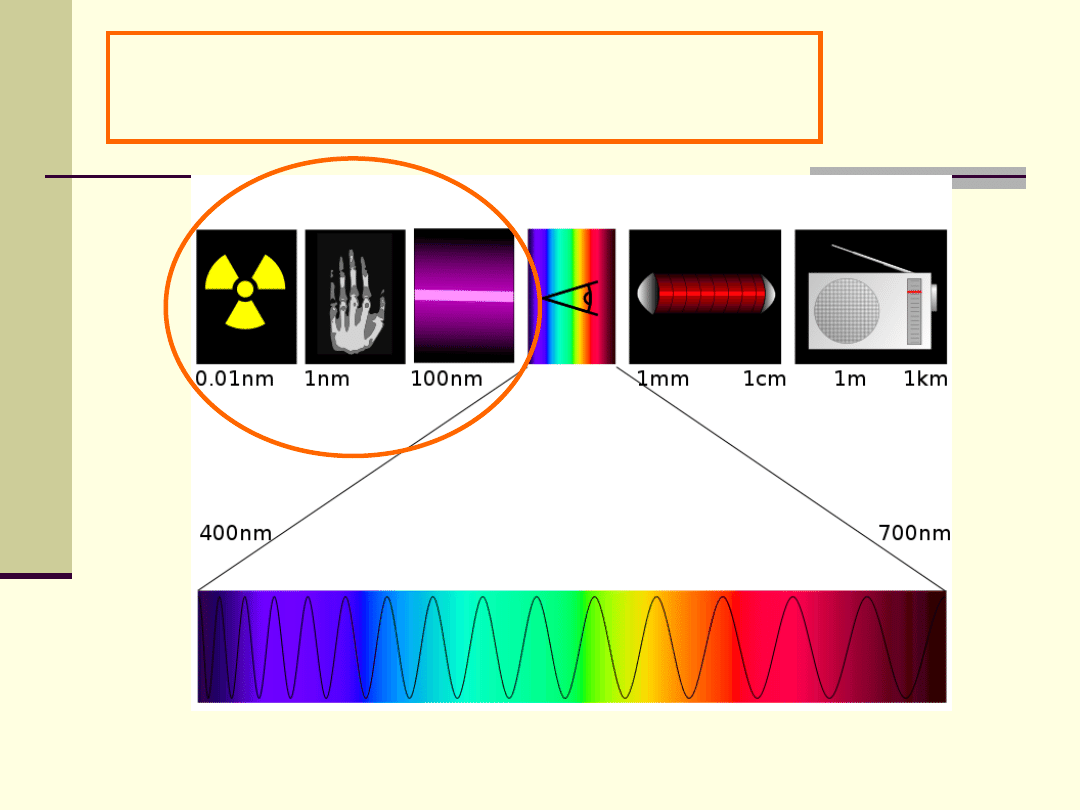
Promieniowanie jonizujące
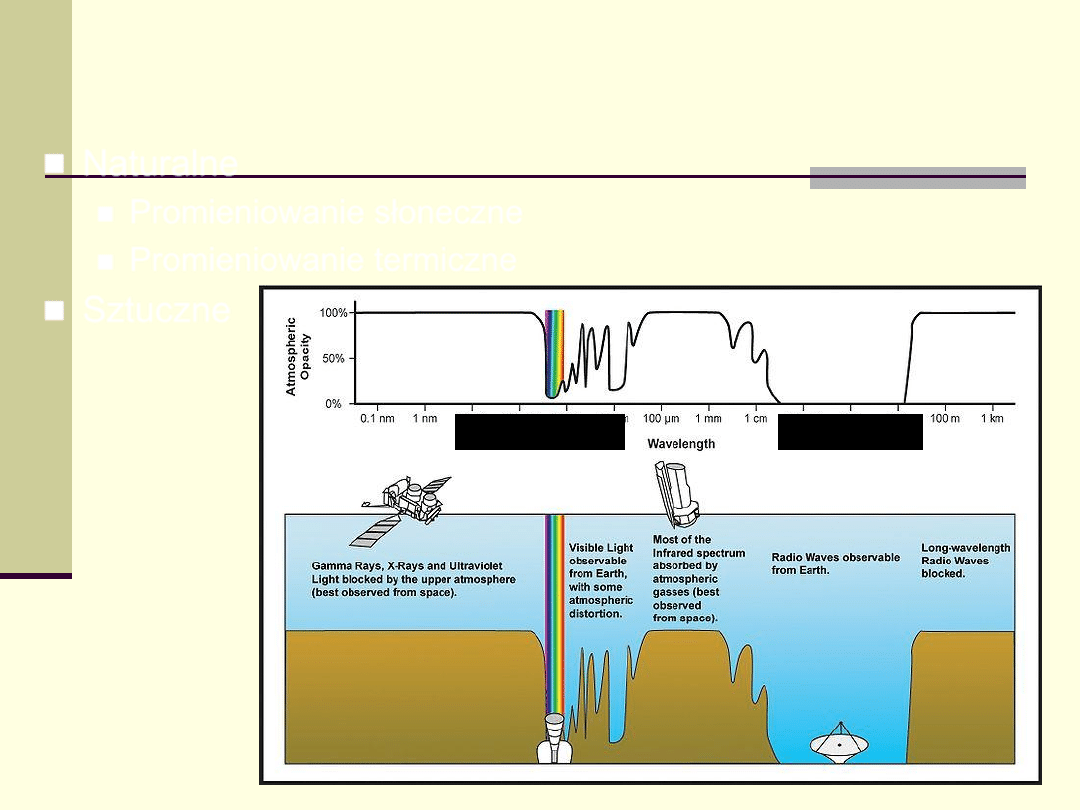
Naturalne
Promieniowanie słoneczne
Promieniowanie termiczne
Sztuczne
Źródła promieniowania elektromagnetycznego

Jak powstaje promieniowanie e-m?
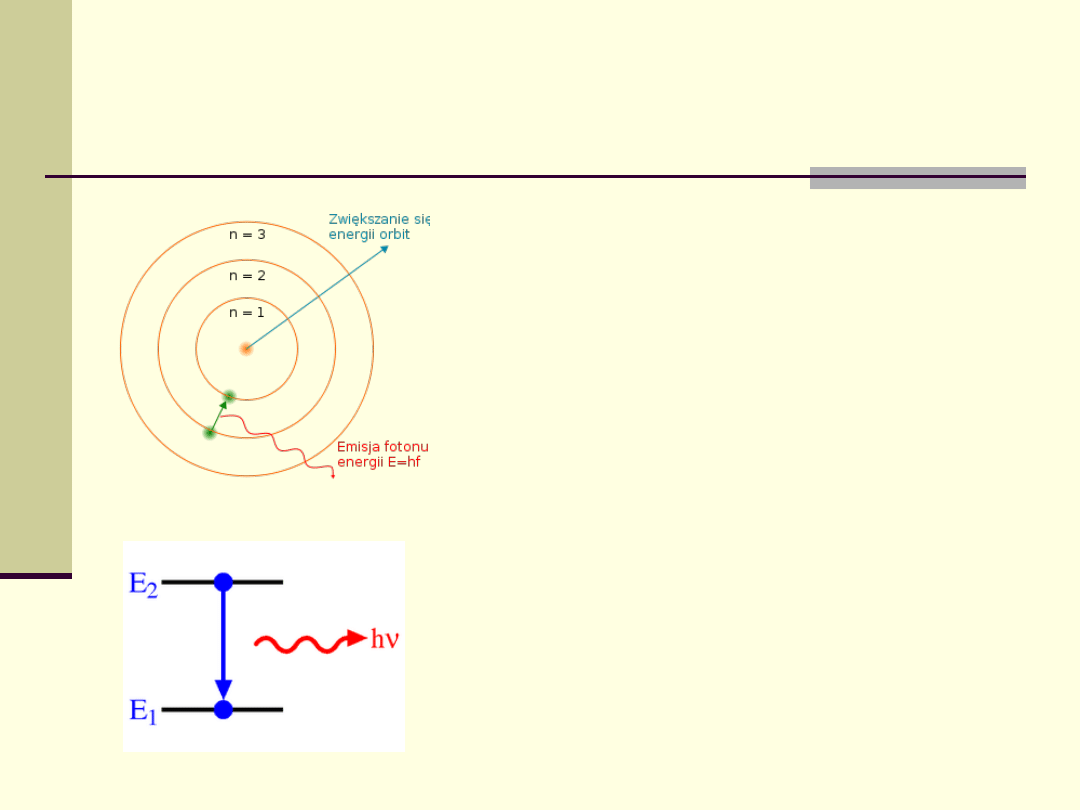
Każdemu orbitalowi przypisany jest jego
poziom energetyczny.
Elektron może znaleźć się na wyższym
poziomie energetycznym pochłaniając
foton o odpowiedniej energii lub
otrzymując tę energię ze zderzenia z
innym atomem lub cząstką.
Odwrotnie, elektron z wyższego poziomu
może przenieść się na niższy. Nadmiar
energii jest unoszony jako foton (emisja
spontaniczna) lub przejmowany przez
inny atom (przejście bezpromieniste).
Atom – poziomy energetyczne
Energia fotonów
Aby przejść pomiędzy stanami, elektron musi
pochłonąć lub wyemitować foton o energii
odpowiadającej różnicy pomiędzy energią potencjalną
dozwolonych stanów.
Energia fotonu określa jego częstotliwość (i długość
fali).
E
f
= h
c/
l =
h
f
gdzie: h jest tzw. stałą Plancka równą 6,63
10
–34
J
s
Każdy foton na określone miejsca w widmie
elektromagnetycznym.

Widmo charakterystyczne pierwiastka
Każdy foton na określone miejsca w widmie
elektromagnetycznym.
Każdy pierwiastek w stanie lotnym pobudzony do
świecenia ma charakterystyczny zestaw fotonów,
określonych przez ładunek jądra, wypełnienie
poszczególnych powłok elektronami i oddziaływania
pomiędzy elektronami.
Ten zestaw fotonów o określonych częstotliwościach
nazywamy widmem charakterystycznym pierwiastka.
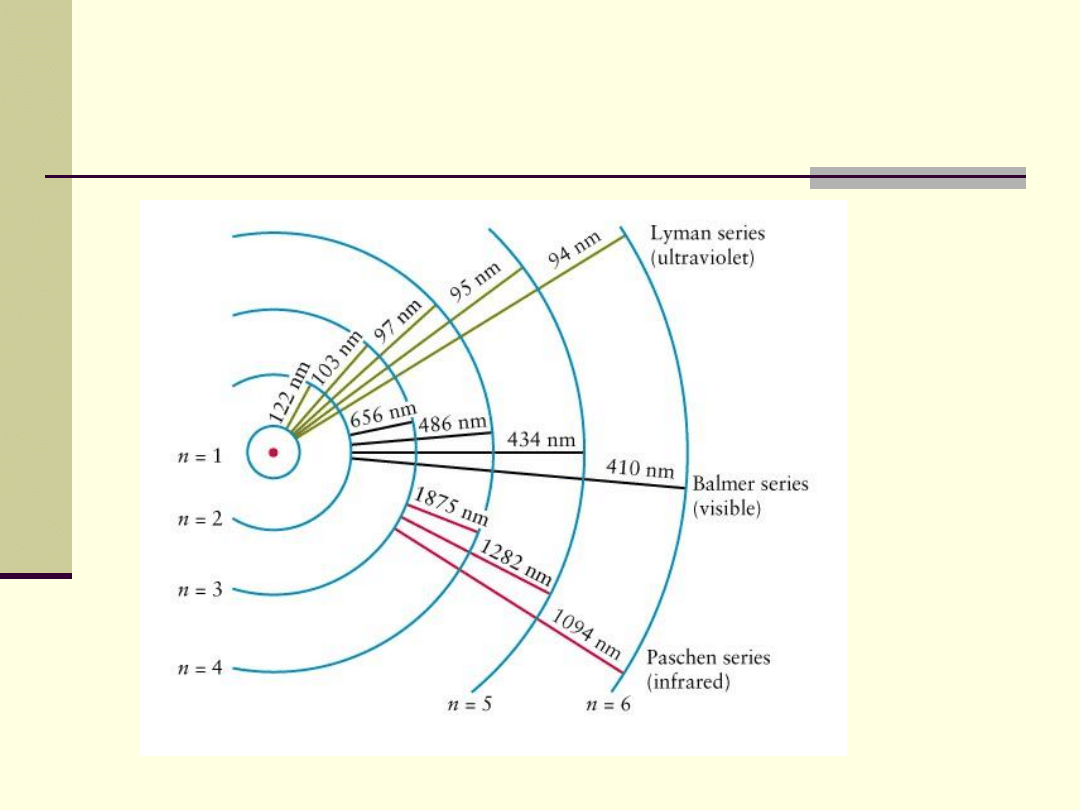
Poziomy energetyczne atomu wodoru
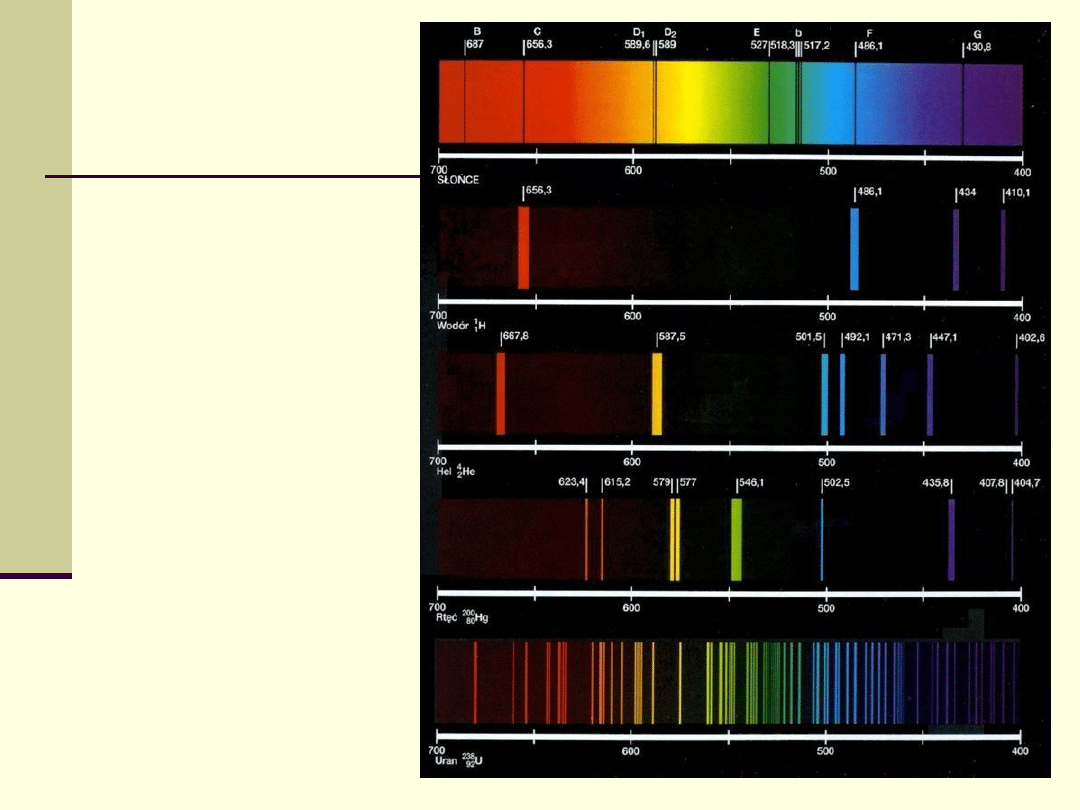
Widma
charakterystyczne
pierwiastków
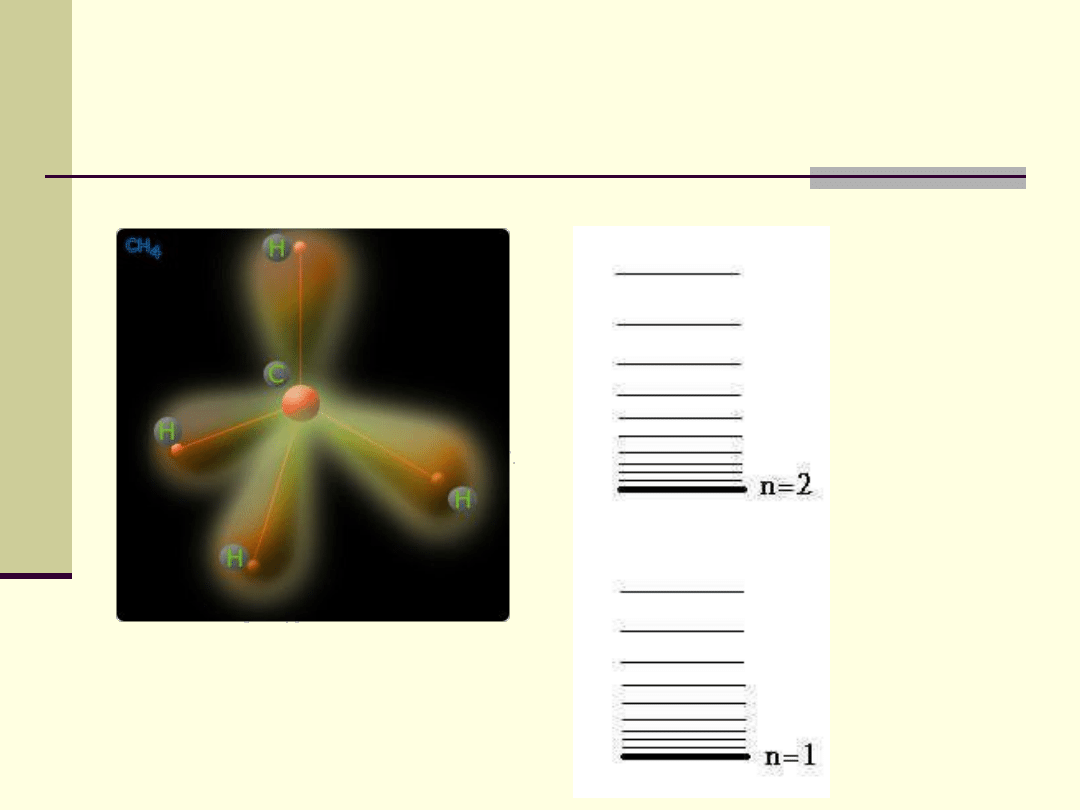
Poziomy energetyczne cząsteczek
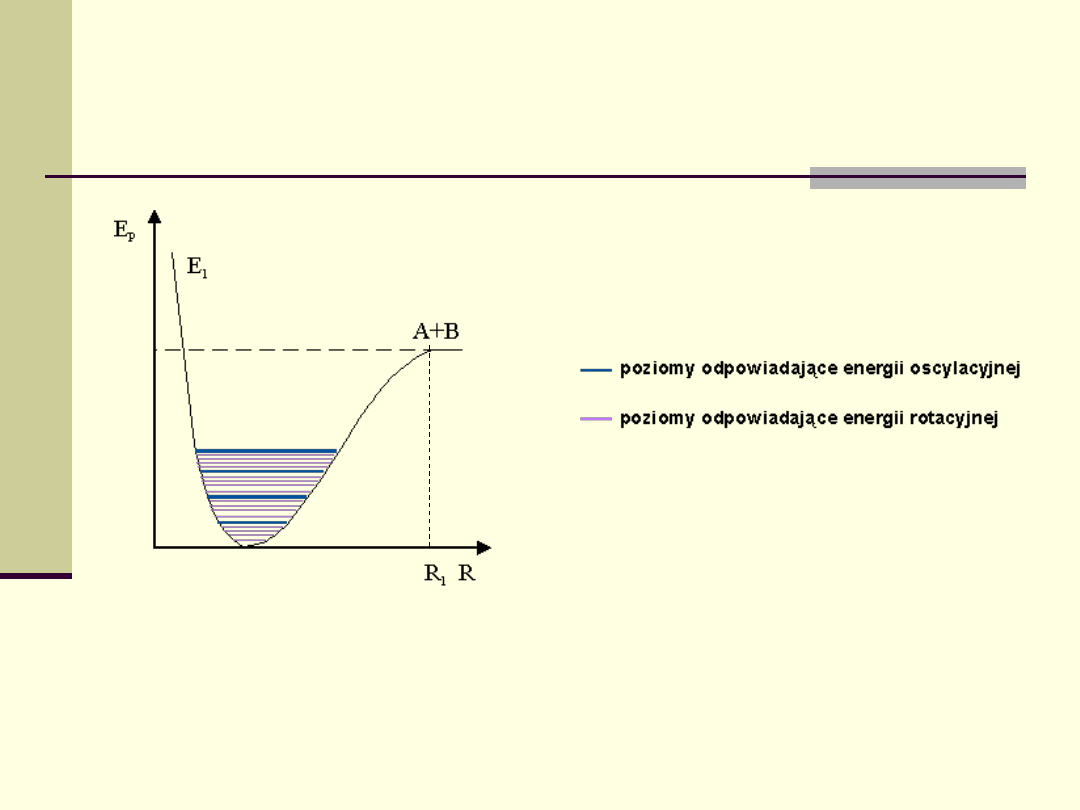
Krzywe energii potencjalnej stanu podstawowego E
1
cząsteczki
dwuatomowej
.
Poziomy energetyczne cząsteczek
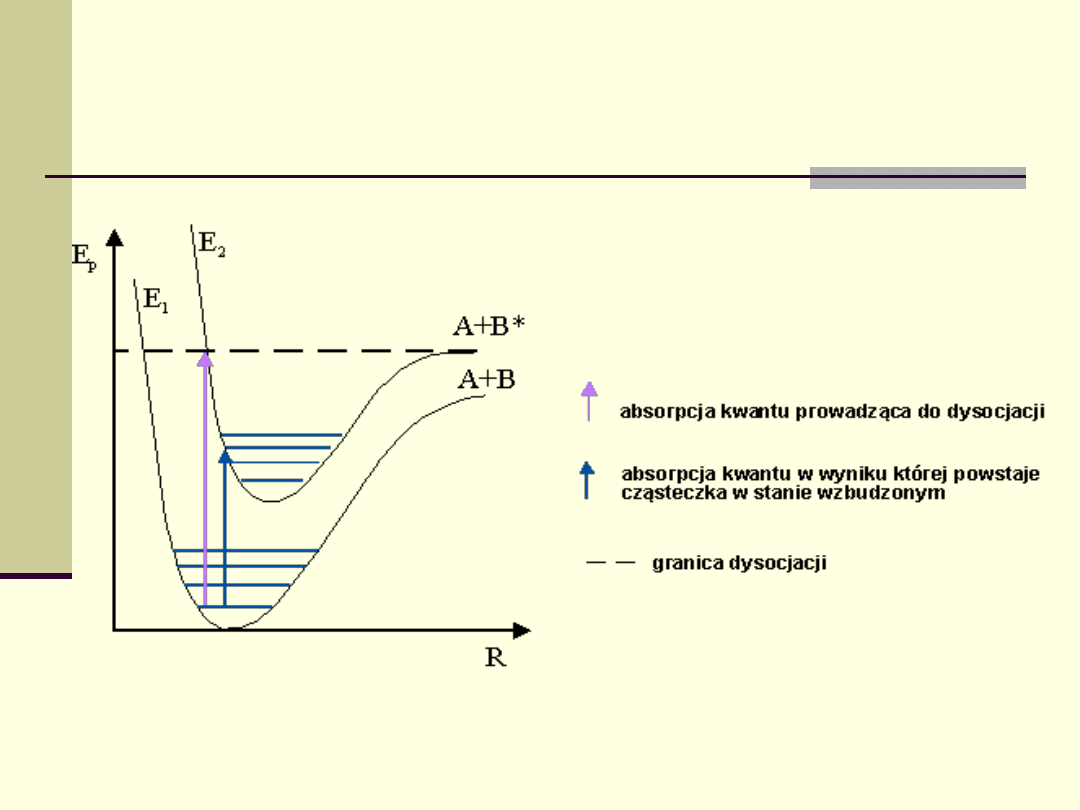
Poziomy energetyczne cząsteczek
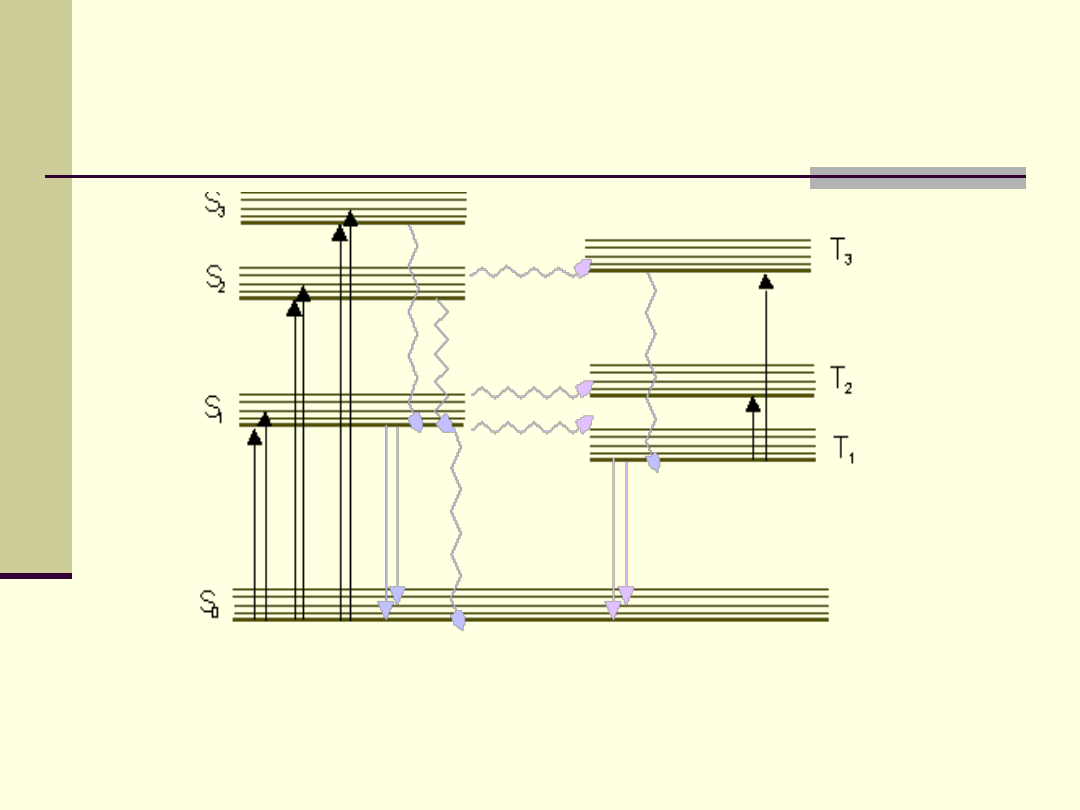
Złożoność poziomów
energetycznych cząsteczek
Układ poziomów energetycznych jest różny dla atomów
różnych pierwiastków i dla różnych cząsteczek.
Analiza widmowa
Widmo - zarejestrowany obraz promieniowania substancji
rozłożonego na poszczególne częstotliwości (lub długości fal lub
energie).
Analiza widmowa, inaczej analiza spektralna - metoda
jakościowego i ilościowego określania substancji na podstawie
widma (
w tym także metody wytwarzania widm).
Z pomiarów linii widmowych dla danej substancji można
wyznaczyć jej skład identyfikując pierwiastki w niej zawarte,
energie połączeń, a także układ cząsteczek i atomów w
cząsteczkach.
Do analizy widmowej
wystarczą śladowe ilości substancji.
Widmo charakterystyczne
Układ linii widmowych zależy od układu
poziomów energetycznych elektronów jest
różny dla atomów różnych pierwiastków i dla
różnych cząsteczek.
Układ linii widmowych jest
niepowtarzalny i charakterystyczny
dla danego pierwiastka lub cząsteczki.
Etapy analizy widmowej
Pobudzenie badanej substancji do świecenia (niekoniecznie w
zakresie widzialnym)
Rozdzielenie emitowanego promieniowanie na składowe
Porównanie widma substancji z widmami wzorcowymi w celu
określenia, jakie substancje (pierwiastki) wchodzą w jej skład,
Poprzez porównanie natężenia światła w uniach różnych
pierwiastków wchodzących w skład substancji określa się jej skład
procentowy,
Poprzez analizę poszerzenia liniii określa się ciśnienie gazu i
oddziaływania między cząsteczkami, rozszczepienie linii umożliwia
badanie pola magnetycznego, a przesunięcie oddalania się lub
energii grawitacyjnej.
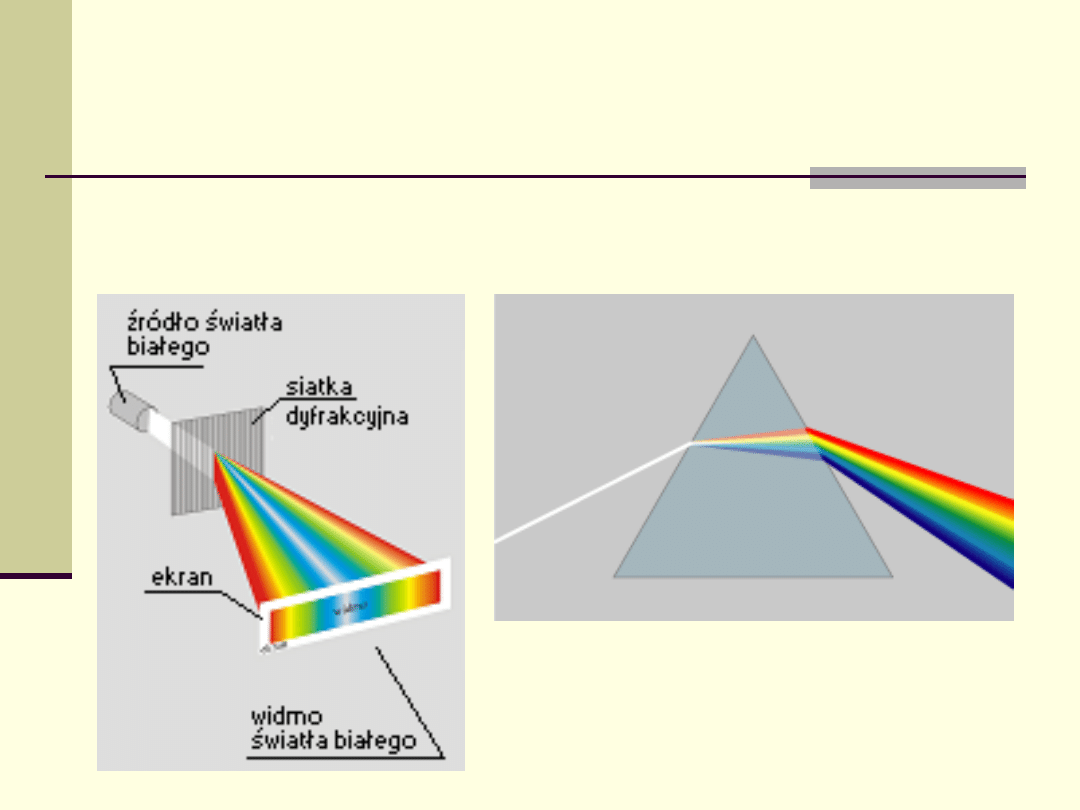
Badanie widm emisyjnych promieniowania
Światło ze źródła trzeba rozdzielić na poszczególne
linie widmowe
Rozszczepienie światła przez pryzmat
Analiza widmowa – rodzaje widm
Ze względu na wygląd widma
Widmo ciągłe
Widmo liniowe (atomowe)
Widmo pasmowe (cząsteczkowe)
Ze względu na sposób powstania
Widmo emisyjne
– powstaje w wyniku emisji
promieniowania przez ciało
Widmo absorpcyjne
– powstaje w wyniku
oddziaływania fali o widmie ciągłym z substancją.
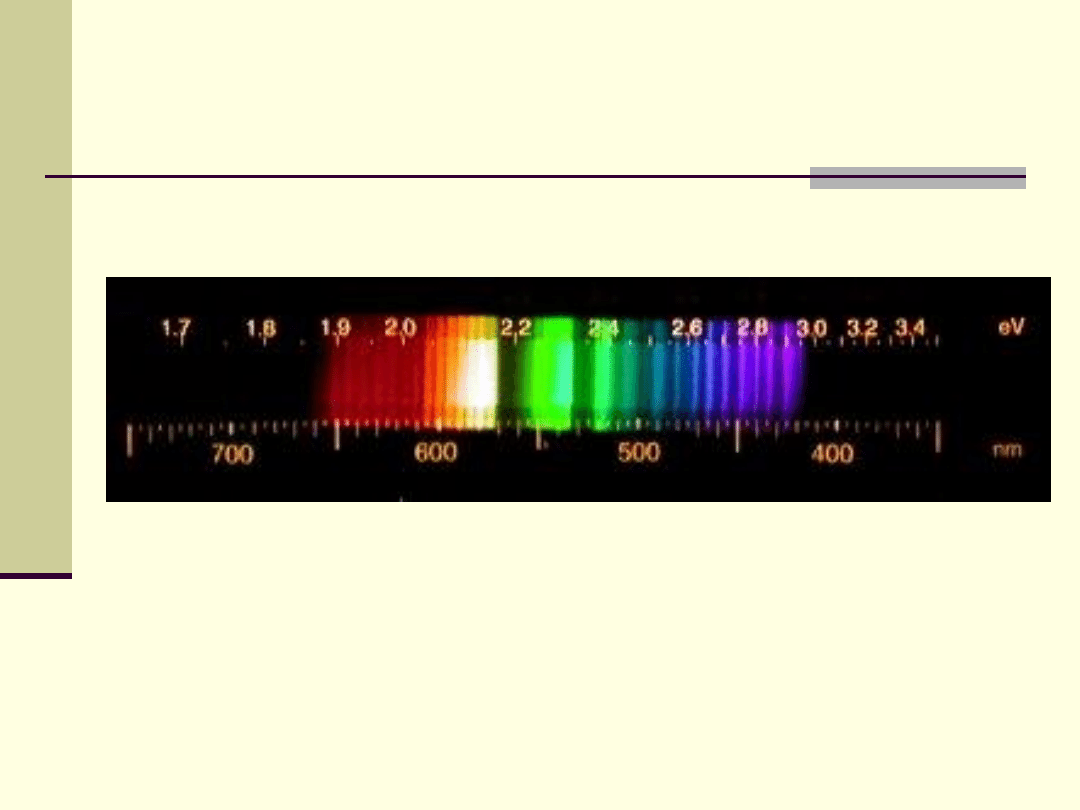
Widmo liniowe
Widmo liniowe lub dyskretne - widmo emisyjne
składające się z oddzielnych linii widmowych.
typowe dla nieoddziałujących ze sobą atomów, czyli
pierwiastków w stanie gazowym, w którym poziomy
energetyczne charakteryzujące stany wzbudzenia leżą
stosunkowo daleko od siebie
nazywane jest również widmem atomowym.
układ linii widmowych zależy od układu poziomów
energetycznych elektronów w atomie.

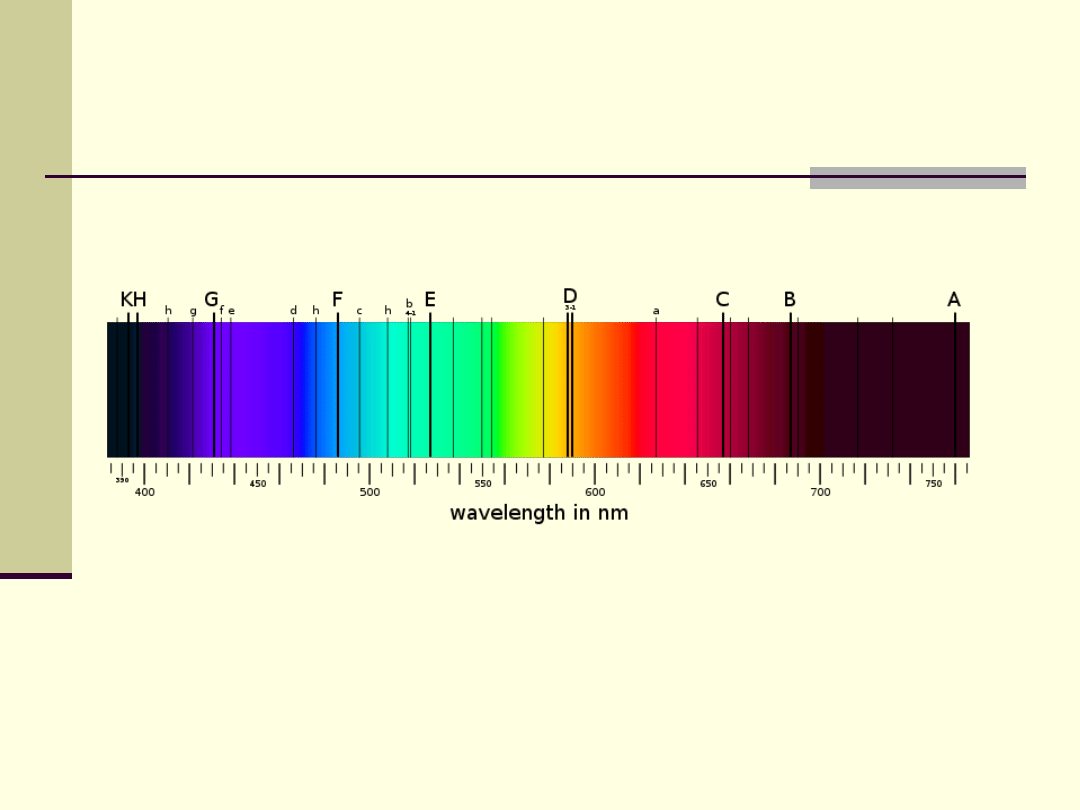
Przykłady widm emisyjnych liniowych
Liniowe widmo emisyjne wodoru
Liniowe widmo emisyjne żelaza
Liniowe widmo emisyjne azotu
Widma pasmowe
W wyniku emisji promieniowania w gazach
cząsteczkowych
złożony układ poziomów energetycznych,
ponieważ oprócz poziomów związanych z
konfiguracją elektronów dochodzą jeszcze
(poziomy elektronowe, poziomy oscylacyjne,
poziomy rotacyjne).
poziomy energetyczne leżą tak blisko siebie, że
zlewają się w całe pasma o różnej szerokości.
Widmo powietrza.
Szerokie pasma tlenu cząsteczkowego(O
2
), azotu
cząsteczkowego(N
2
),
oraz innych cząsteczek.
Przykład widma pasmowego
Widma absorpcyjne
W wyniku absorpcji światła przechodzącego
przez substancje (np. gaz) z widma światła
padającego zostają usunięte fotony o
określonej częstotliwości.
Na tej podstawie można stwierdzić, przez
jakie substancje przechodziło światło.
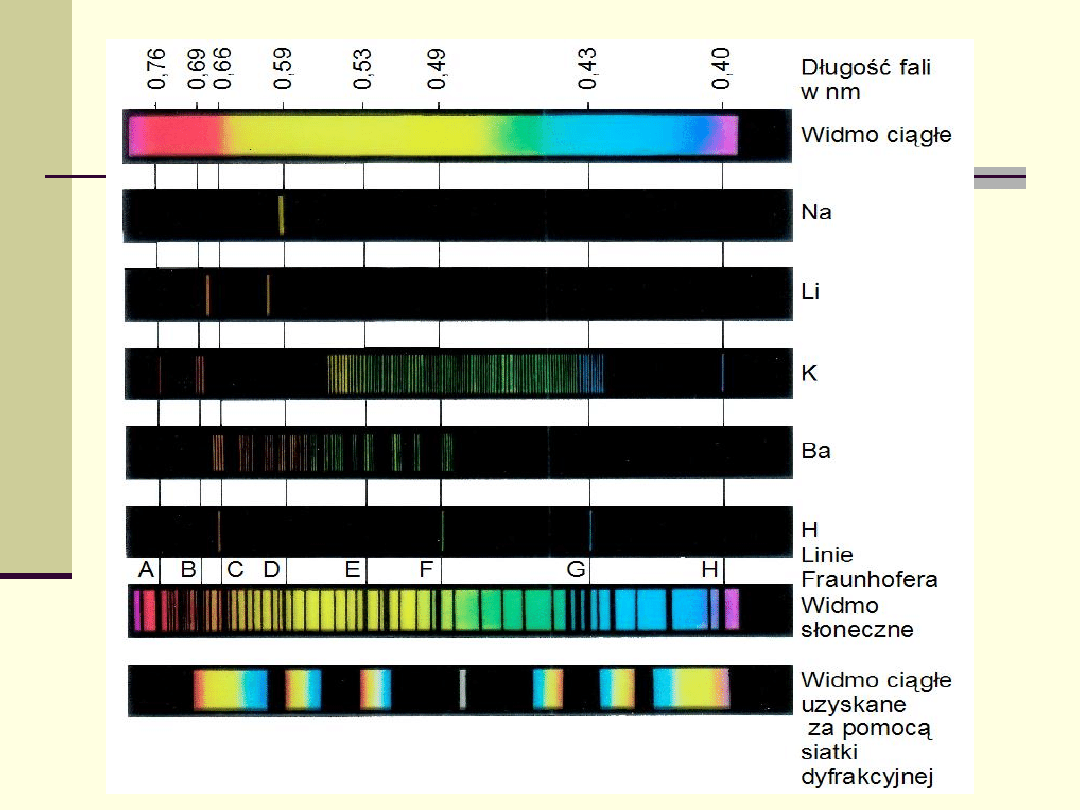
Widma absorpcyjne
Absorpcja w gazach atomowych
jeżeli widmo światła padającego jest widmem
ciągłym, powoduje to powstawanie w tym
widmie ciemnych linii.
Absorpcja w gazach cząsteczkowych
złożony układ poziomów energetycznych -
poziomy energetyczne zlewają się w całe
pasma o różnej szerokości.
Widma absorpcyjne
Liniowe widmo absorpcyjne
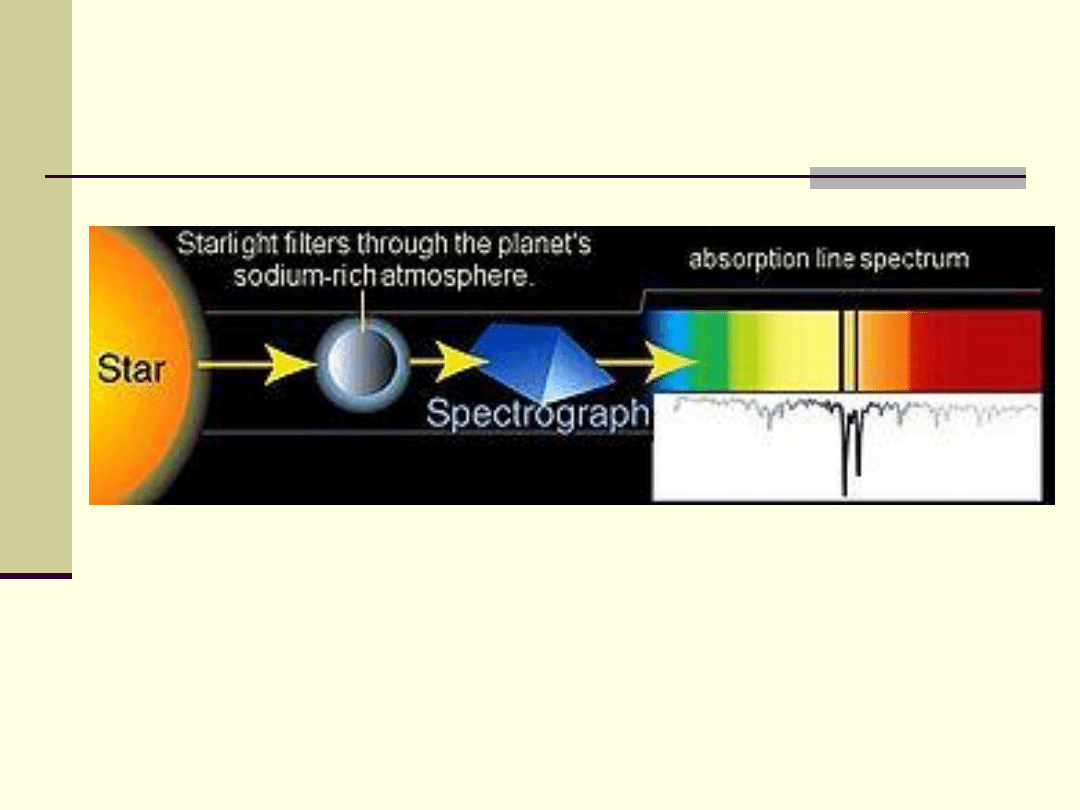
Spektroskopia absorpcyjna
– przykład zastosowania
Analiza chemiczna atmosfery planet z poza
układu słonecznego
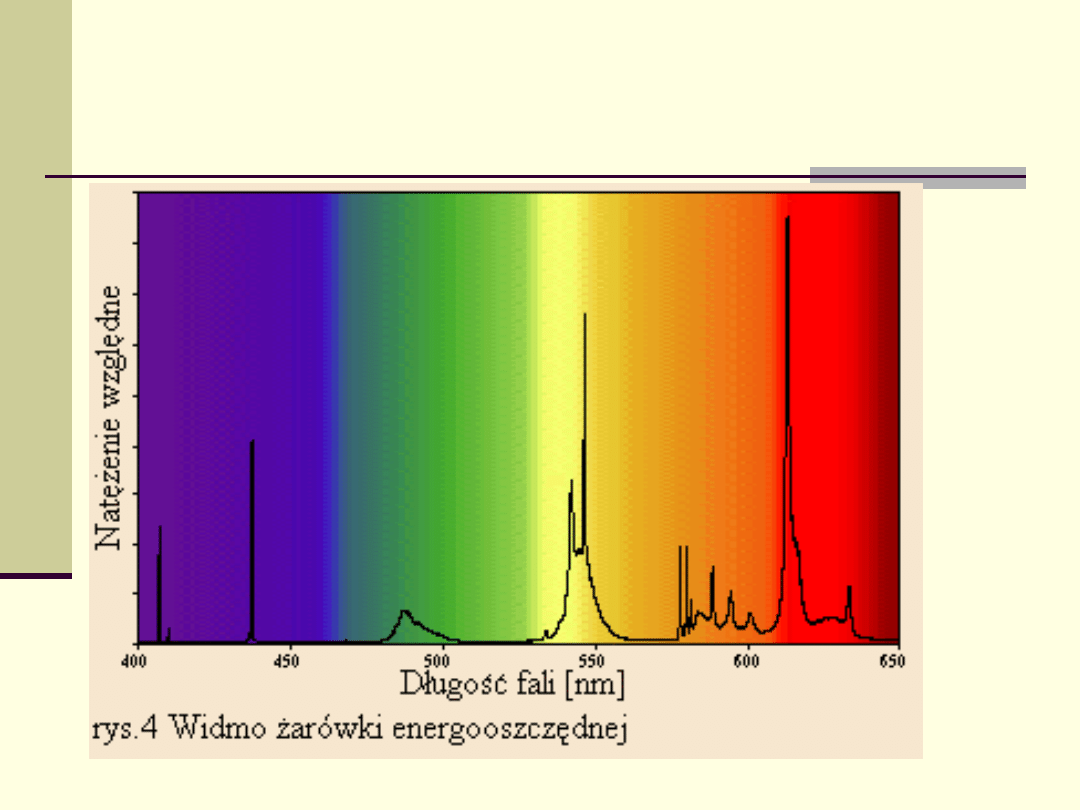
Przykład widma emisyjnego

Do zobaczenia za tydzień!
Wyszukiwarka
Podobne podstrony:
analityka met spektroskopowe 2012 2013
analityka czasteczka oddzialywania 2012 2013
analityka przeplyw cieczy 2012 2013
analityka błony i potenc 2012 2013 (2)
Biologiczne podstawy zachowań cz I Psychologia N 2012 2013
analityka światło i met opt 2012 2013
I9, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
I4, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
19. I Podstawy ekonomi do przesłania 2012-2013 pop stud RM, Ratownictwo Medyczne UMED - I rok, ekono
I12, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
analityka wstep 2012 2013
examprobny, STUDIA, studia II stopień, 3 semestr MSU FiR 2012 2013, PODSTAWY AUDYTY WEWNĘTRZBEGO, Po
Podstawy diagnozowania pedagogicznego Pedagogika S 2012 2013
I11, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
I5, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
I7, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
I10, Elektrotechnika AGH, Semestr I zimowy 2012-2013, Podstawy Informatyki Ćwiczenia
więcej podobnych podstron