1
CYKLOALKANY
NOMENKLATURA CYKLOALKANÓW
2. Rdzeń nazwy podstawionych cykloalkanów tworzy się poprzez
porównanie liczby atomów węgla w łańcuchu oraz w pierścieniu – nazwę
wyprowadza się od alkanu o większej liczbie atomów węgla
1. Rdzeń nazwy tworzy się poprzez dodanie przedrostka
CYKLO
do nazwy
alkanu o takiej samej liczbie atomów węgla
cyklo
heksan
cyklo
butan
cyklo
pentan
CH
3
metylo
cyklo
pentan
ALE
CH
3
CH
2
CH
2
CH
2
cyklo
propylo
butan
CYKLOALKANY
NOMENKLATURA CYKLOALKANÓW
3. Pozostałe reguły są takie same jak dla alkanów łańcuchowych
CH
3
CH
2
CH
2
CH
3
1,3-di
etylo
cyklo
heksan
1
3
CH
3
CH
2
CH
3
1-
etylo
-2-
metylo
cyklo
heksan
CH(CH
3
)
2
1-metyloetylo
cyklo
butan
C(CH
3
)
3
CH
3
1-
(1,1-dimetyloetylo)
-3-
metylo
cyklo
pentan
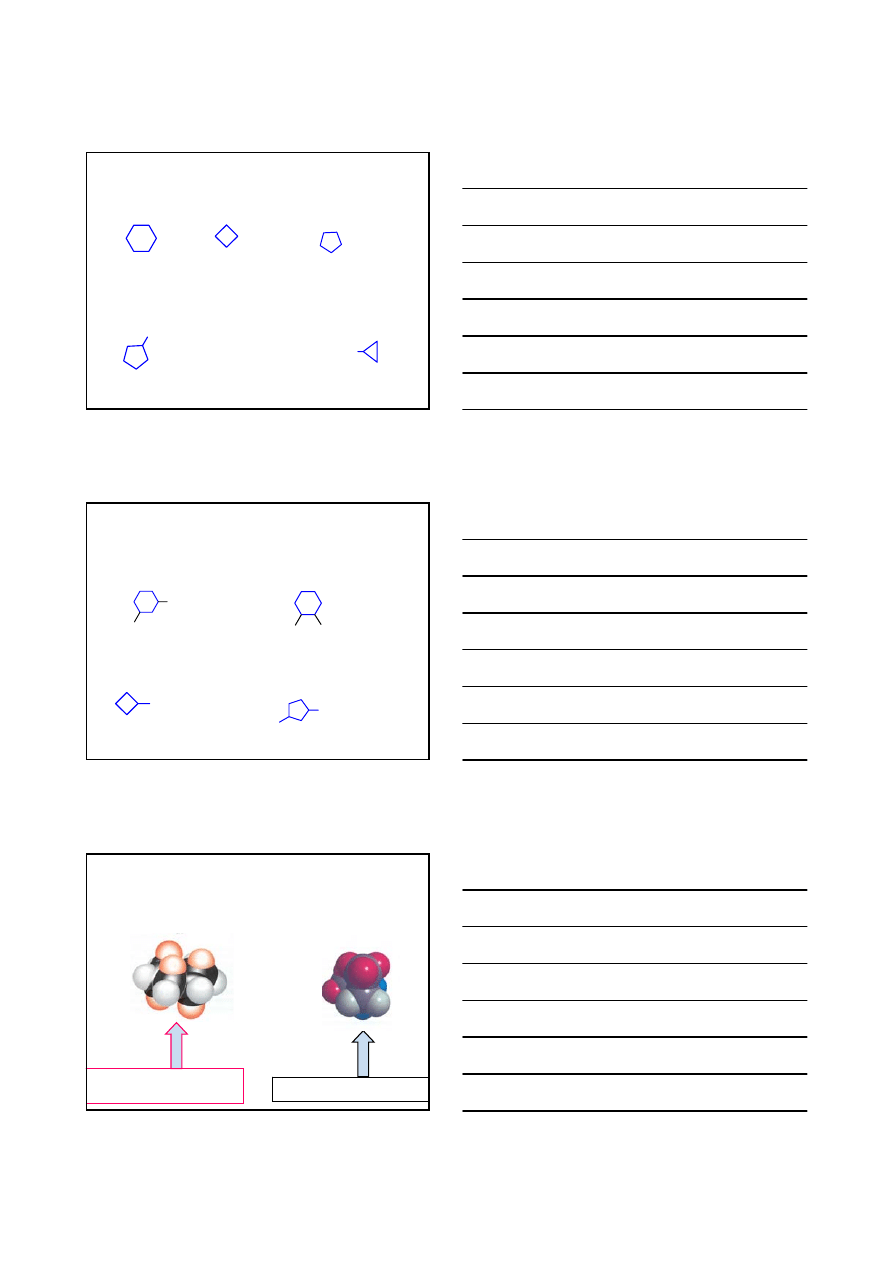
CYKLOALKANY C
n
H
2n
NIE REAGUJĄ Z KWASMI I ZASADAMI
cząsteczka ‘elastyczna’ – swobodny
obrót wokół wiązania C–C
n
-butan
cykloheksan
cząsteczka ‘sztywna’ – brak
swobodnego obrotu wokół wiązania
C–C
2
KONFORMACJE CYKLOALKANÓW
cykloalkan
cząsteczka ‘sztywna’ – brak swobodnego
obrotu wokół wiązania C–C
CH
3
H
H
3
C
H
CH
3
H
H
3
C
H
taki sam wzór sumaryczny
taki sam połączenia ze sobą atomów
różne rozmieszczenie atomów w
przestrzeni
STEREOIZOMERY
IZOMERY
GEOMETRYCZNE
KONFORMACJE CYKLOALKANÓW
CH
3
H
H
3
C
H
CH
3
H
H
3
C
H
różne właściwości fizyczne i chemiczne
IZOMERY GEOMETRYCZNE
cis trans
cis-
1,3-dimetylocyklopentan
trans-
1,3-dimetylocyklopentan
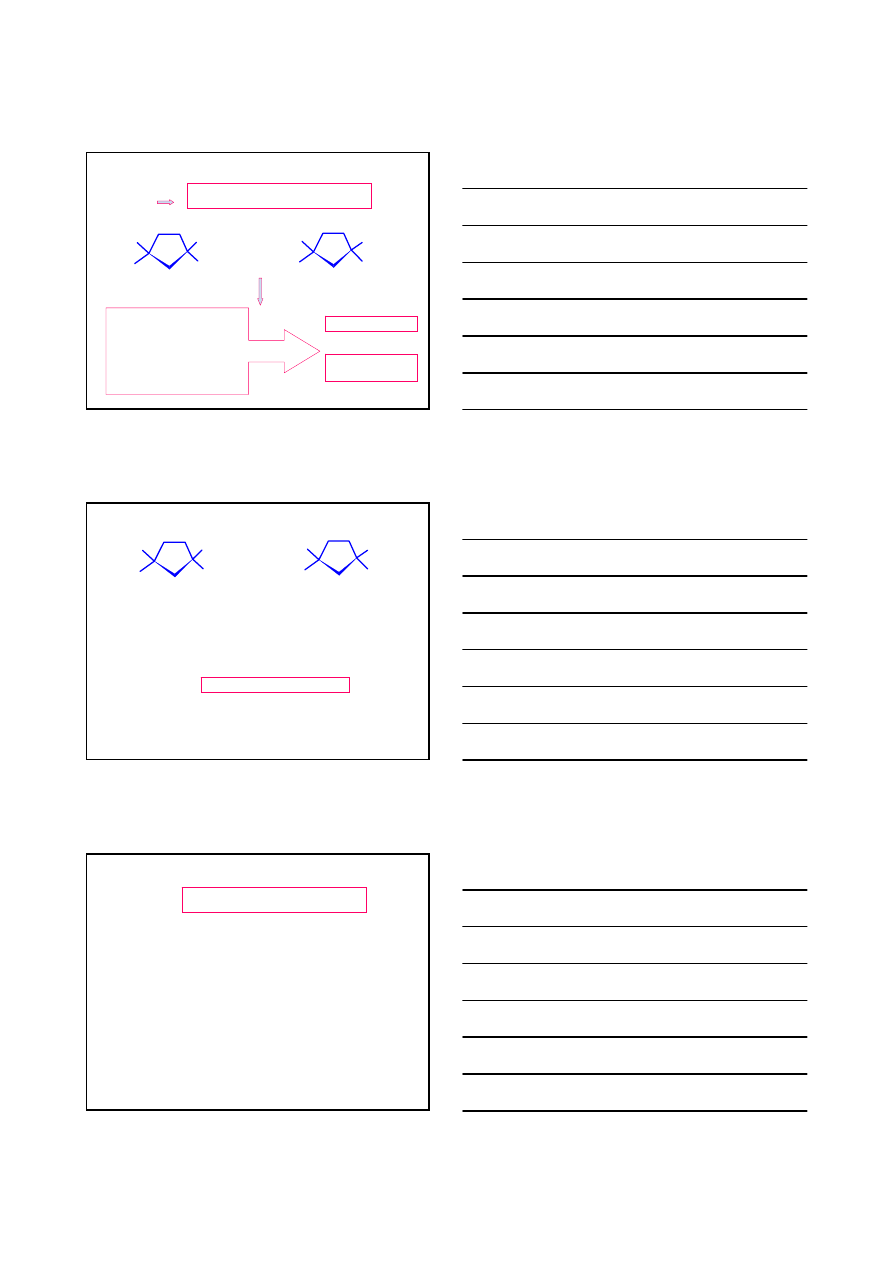
KONFORMACJE CYKLOALKANÓW
Naprężenia kątowe – wynikające z odchylenia kątów walencyjnych od
wartości 109
°28’
cząsteczka ‘sztywna’ – brak swobodnego
obrotu wokół wiązania C–C
Cykloalkany przyjmują konformacje o minimalnej energii, czyli tak aby
zminimalizować:
Naprężenia torsyjne – wynikające z naprzeciwległego ułożenia wiązań
przy sąsiadujących atomach węgla
Naprężenia steryczne – wynikające z oddziaływania odpychającego
zbliżonych do siebie grup atomów lub pojedynczych atomów
3
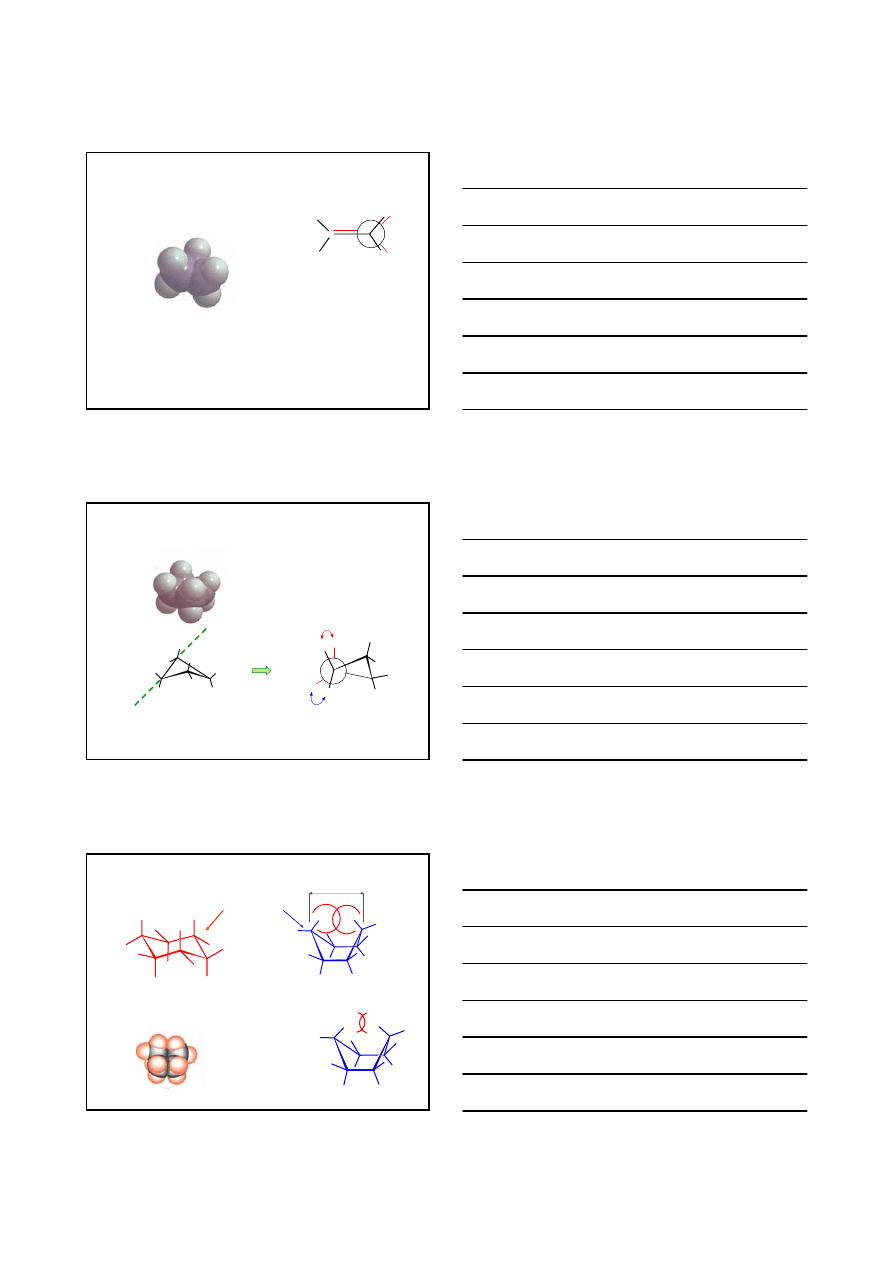
KONFORMACJE CYKLOALKANÓW
C
H
H
H
H
H
H
CYKLOPROPAN
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
KONFORMACJE CYKLOALKANÓW
CYKLOBUTAN
1
2
3
4
3
4
1
2
CYKLOHEKSAN
KONFORMACJE CYKLOALKANÓW
KRZESŁO
ŁÓDŹ
promień van der Waalsa atomu wodoru = 1.25 Å
1.82Å
2
×1.25 Å > 1.82 Å
H
H
1
4
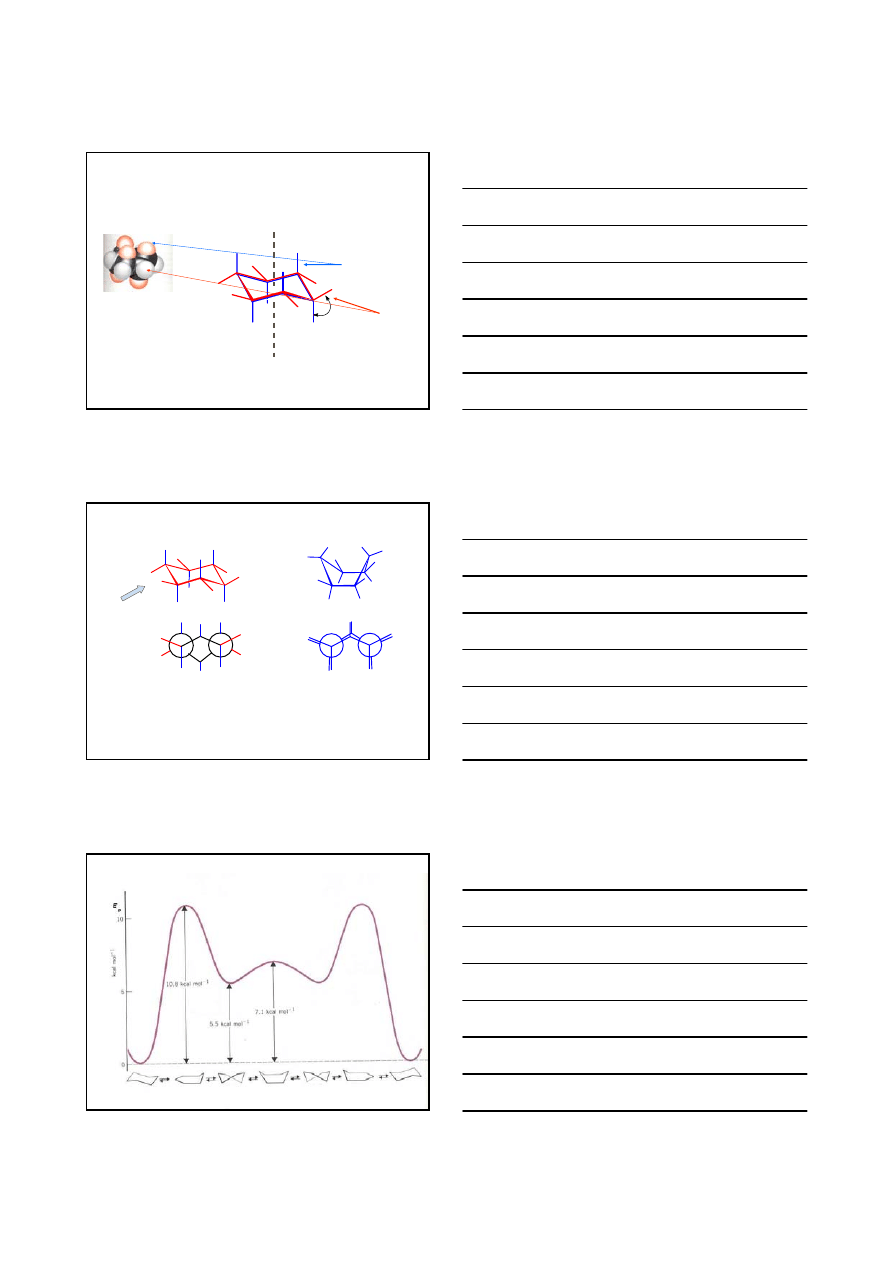
4
oś pierścienia
CYKLOHEKSAN
KONFORMACJE CYKLOALKANÓW
aksjalne
║do osi pierścienia
ekwatorialne
kąt z osią pierścienia
równy 109
°28’
CYKLOHEKSAN
KONFORMACJE CYKLOALKANÓW
1
2
3
4
5
6
ax
eq
ax
eq
ax
ax
ax
ax
eq
eq
6
5, 4
3
1, 2
6
5
4
3
2
1
6, 3
5, 4
1, 2
KONFORMACJE CYKLOHEKSANU
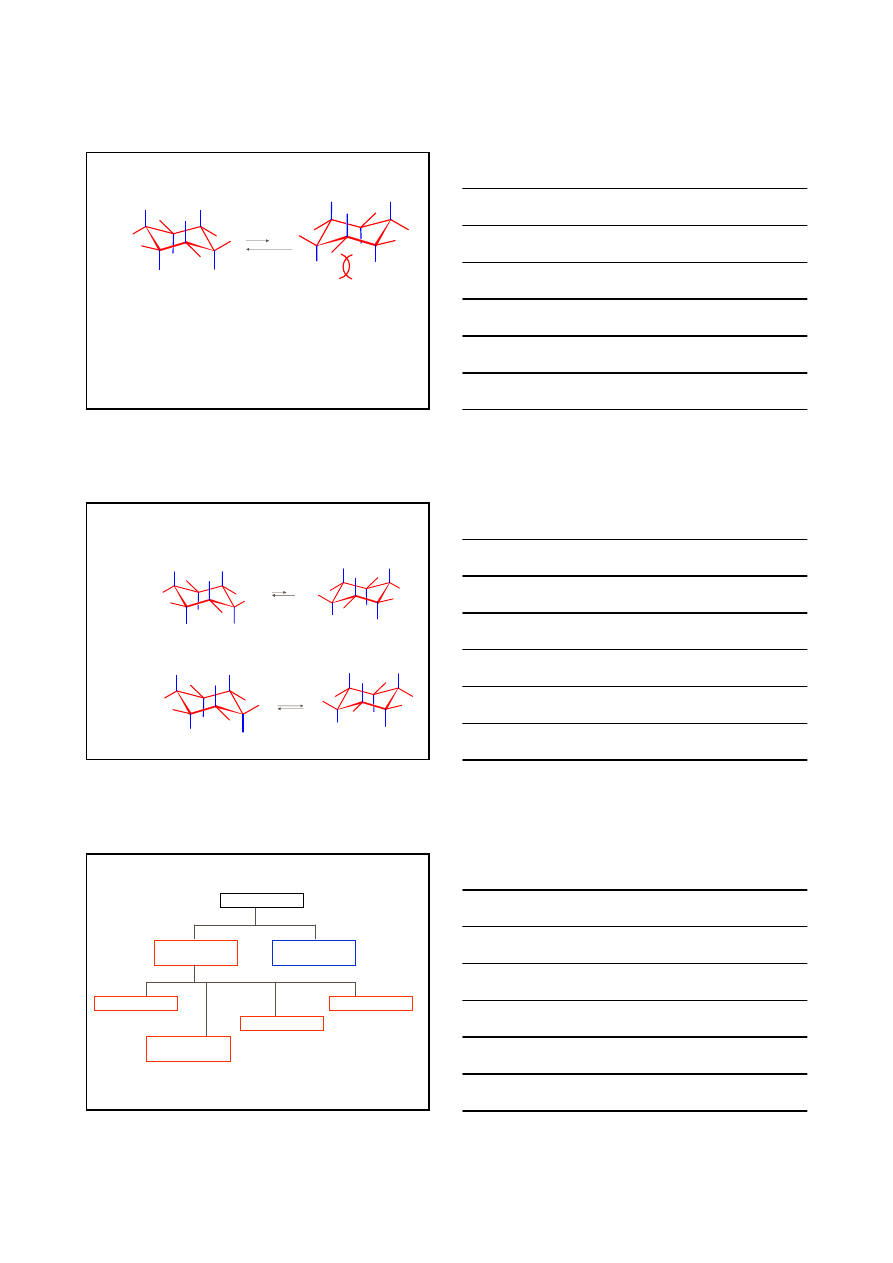
5
KONFORMACJE CYKLOHEKSANU
Me
bardziej stabilny o 1.8 kcal/mol
H
H
Me
KONFORMACJE CYKLOHEKSANU
Me
Me
Me
Me
trans
-1,4-dimetylocykloheksan
cis
-1,2-dimetylocykloheksan
Me
Me
M
Me
e
bardziej stabilny
równocenne energetycznie
WĘGLOWODORY
ALIFATYCZNE
WĘGLOWODORY
WĘGLOWODORY
AROMATYCZNE
ALKANY C
n
H
2n+2
ALKINY C
n
H
2n-2
ALKENY C
n
H
2n
CYKLOALKANY
C
n
H
2n
6
NOMENKLATURA WĘGLOWODORÓW NIENASYCONYCH
2. Atomy węgla numeruje się w ten sposób, aby atom węgla przy wiązaniu
wielokrotnym miał najniższy lokant
1. Wyznacza się najdłuższy łańcuch zawierający wiązanie wielokrotne i do
rdzenia nazwy alkanu o takiej samej liczbie atomów węgla dodaje się
końcówkę
– EN
dla alkenów lub
– IN/YN
dla alkinów
;
ALK
AN
ALK
EN
ALK
IN
CH
3
CH
3
CH
2
=CH
2
H – C
≡C – H
ET
AN
ET
EN
ET
YN
CH
3
CH
2
CH
2
=CHCH
3
CH
3
CH
2
C
≡CCH
2
CH
2
CH
3
1 2 3
2 1
2
-
PENT
EN
1 2 3
4 3 2 1
3
-
HEKS
YN
CH
3
CH
2
CCH
2
CH=CHCH
3
CH
3
CH
3
5,5-DIMETYLO
-2-
HEPT
EN
a nie 3-penten
a nie 4-heksyn
a nie 3,3-dimetylo-5-hepten
NOMENKLATURA WĘGLOWODORÓW NIENASYCONYCH
3. Jeżeli w cząsteczce jest obecnych więcej niż jedno wiązanie
wielokrotne, to atomy węgla numeruje się w ten sposób, aby suma
lokantów była jak najniższa, a atom węgla przy wiązaniu podwójnym
miał najniższy z możliwych lokant
H–C
≡C
–
CH
2
CH
2
CH=CH
2
1
-HEKS
EN
-5-YN
3,3-DIMETYLO
-1-
HEKS
EN
-5-YN
CHCCH
2
C
CH
3
CH
3
CH
CH
2
INNE
H–C
≡C
–
CH
2
CH
2
CH
2
OH
5
-HEKS
YN
-1-OL
Cl
CH
2
CH
2
CH=CH
2
4-CHLORO-
1
-BUT
EN
CHCCH
2
C
OH
CH
CH
2
1-
HEKS
EN
-5-YN
-3-OL
NOMENKLATURA WĘGLOWODORÓW NIENASYCONYCH
R – C
≡ C –
H
alkin
terminalny
wodór acetylenowy
PODSTAWNIKI
wyprowadzone z alkenów – końcówka
–enyl
wyprowadzone z alkinów – końcówka
–ynyl
CH
3
CH=CHCH
2
–
2-BUT
ENYL
CH
2
=CHCH
2
–
2-PROP
ENYL
CH
2
=CH–
ET
ENYL
zwycz.
ALLIL
zwycz.
WINYL
H–C
≡ C –
ET
YNYL
H–C
≡CCH
2
–
2-PROP
YNYL
7
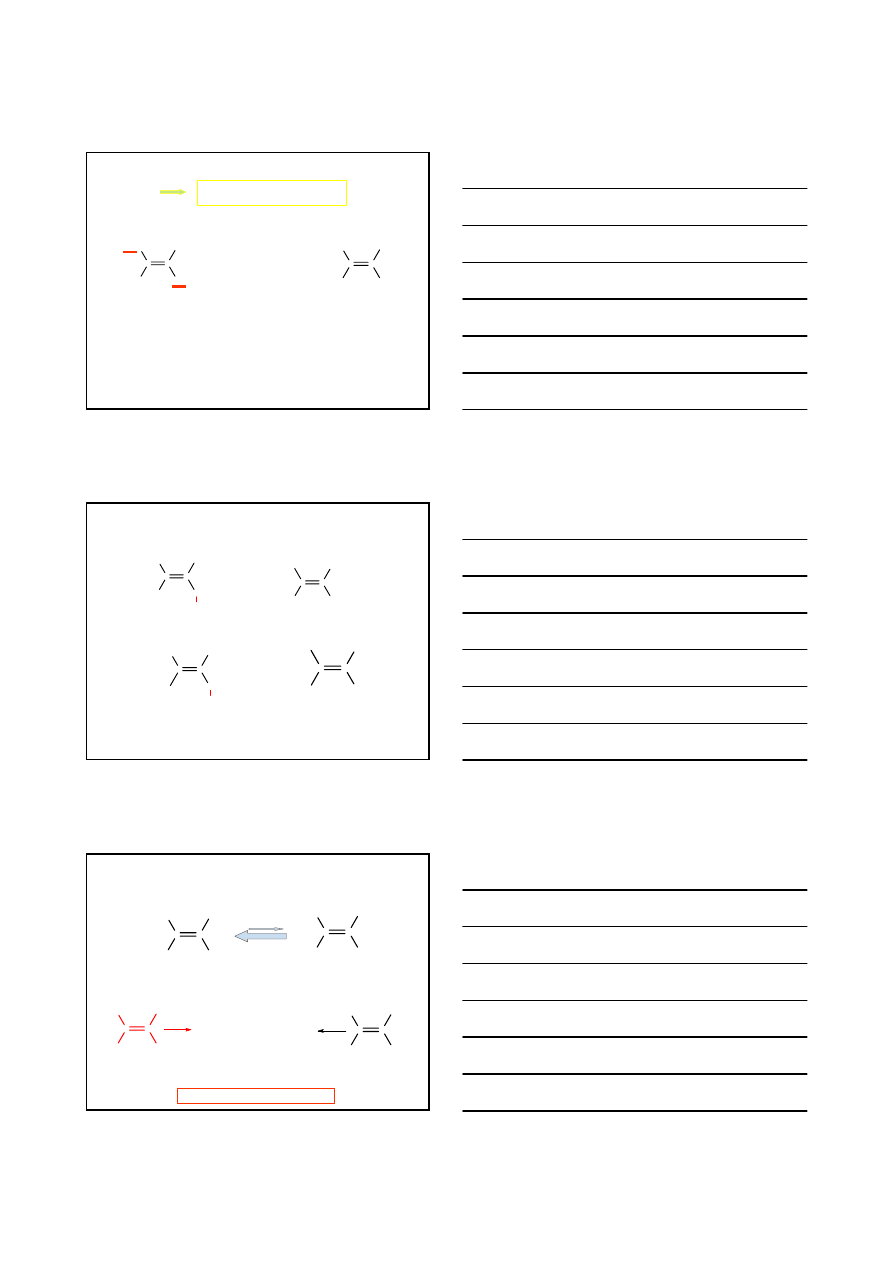
IZOMERIA GEOMETRYCZNA ALKENÓW
H
CH
3
C
C
CH
3
H
CH
3
CH
3
C
C
H
H
ALKEN
zahamowany swobodny obrót
wokół wiązania –C = C–
1. Ustala się starszeństwo podstawników przy każdym atomie węgla
wiązania podwójnego
2. Jeżeli starsze podstawniki znajdują się po tej samej stronie wiązania
podwójnego, to stereoizomer nazywamy – /
Z
/;
jeżeli po obu stronach
wiązania podwójnego – /
E
/
I > Br > Cl > F > n-C
6
H
13
- > CH
3
CH
2
- > CH
3
- > D > H > :
E
Z
Niem.
zusammen
Niem.
entgegen
CH
3
-
>
H
IZOMERIA GEOMETRYCZNA ALKENÓW
H
CH
3
CH
2
C
C
CHCH
3
H
CH
3
/E/
-
2-METYLO-3-HEKSEN
CH
2
CH
3
Cl
C
C
CH
3
H
/Z/
-1-CHLORO-2-METYLO
-
2-BUTEN
CH
3
CH
3
CH
2
C
C
CHCH
3
CH
3
CH
3
/E/
-
2,3,4-TRIMETYLO-3-HEKSEN
I
>
Cl
CH
3
<
Br
Br
I
C
C
CH
3
Cl
CH
3
CH
2
-
>
H
(CH
3
)
2
CH-
>
H
/Z/
-2-BROMO-1-CHLORO-1-IODO-1-PROPEN
ALKENY C
n
H
2n
1. TRWAŁOŚĆ ALKENÓW
H
CH
3
C
C
CH
3
H
CH
3
CH
3
C
C
H
H
/E/
/Z/
KATALIZATOR
76%
24%
CH
3
CH
3
C
C
H
H
H
2
/Pd
CH
3
CH
2
CH
2
CH
3
∆
H
E
= -116 kJ/mol
∆
H
Z
= -120 kJ/mol
H
CH
3
C
C
CH
3
H
H
2
/Pd
/E/
STABILNIEJSZY NIŻ
/Z/
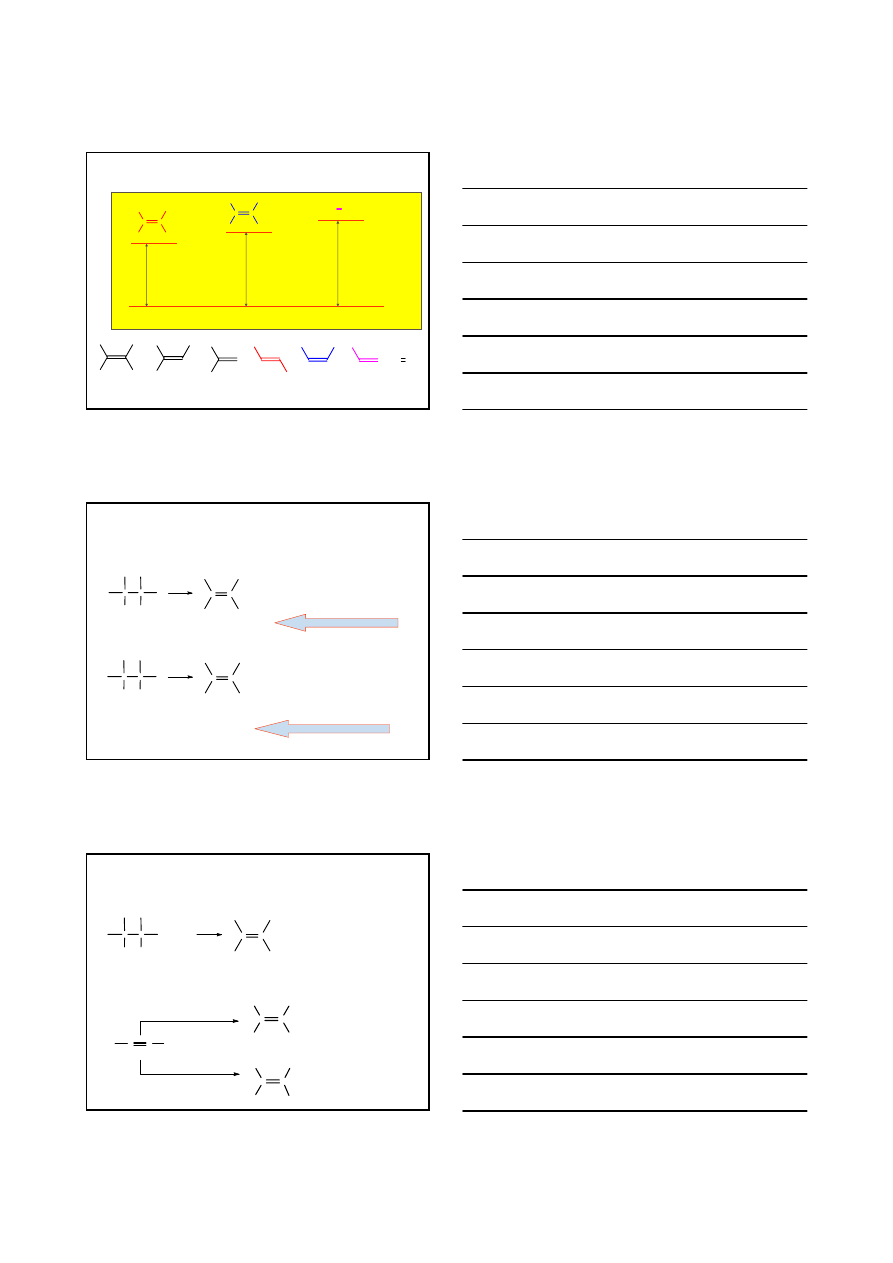
8
ALKENY C
n
H
2n
1. TRWAŁOŚĆ ALKENÓW
CH
3
CH
2
CH
2
CH
3
R
R
R
R
R
R
R
R
R
R
R
R
R
R
H
2
C CH
2
H
CH
3
C
C
CH
3
H
H
2
+
∆
H
E
= -27.6 kcal/mol
CH
3
CH
2
CH CH
2
H
2
+
∆
H
°= -30.3 kcal/mol
H
2
+
CH
3
CH
3
C
C
H
H
∆
H
Z
= -28.6 kcal/mol
ALKENY C
n
H
2n
2. OTRZYMYWANIE ALKENÓW
ELIMINACJA CZĄSTECZKI HALOGENOWODORU Z HALOGENKÓW ALKILOWYCH
DEHYDRATACJA ALKOHOLI
REAKTYWNOŚĆ ALKOHOLI
3° > 2° > 1°
+
KX
+
H
2
O
KOH
ALKOHOL
C
H
C
X
C
C
X: I > Br > Cl
3° > 2° > 1°
REAKTYWNOŚĆ HALOGENKU
Al
2
O
3
lub
KWAS
C
H
C
OH
C
C
+
H
2
O
ALKENY C
n
H
2n
2. OTRZYMYWANIE ALKENÓW
ELIMINACJA HALOGENU Z VICYNALNEGO DIHALOGENKU ALKILU
UWODORNIENIE ALKINÓW
+
Zn
X
2
C
X
C
X
C
C
+
Zn
H
2
/KATALIZATOR LINDLARA
C
R
C
R
R
R
C
C
H
H
K lub Na / NH
3
R
R
C
C
H
H
/E/
/Z/
9
ALKENY C
n
H
2n
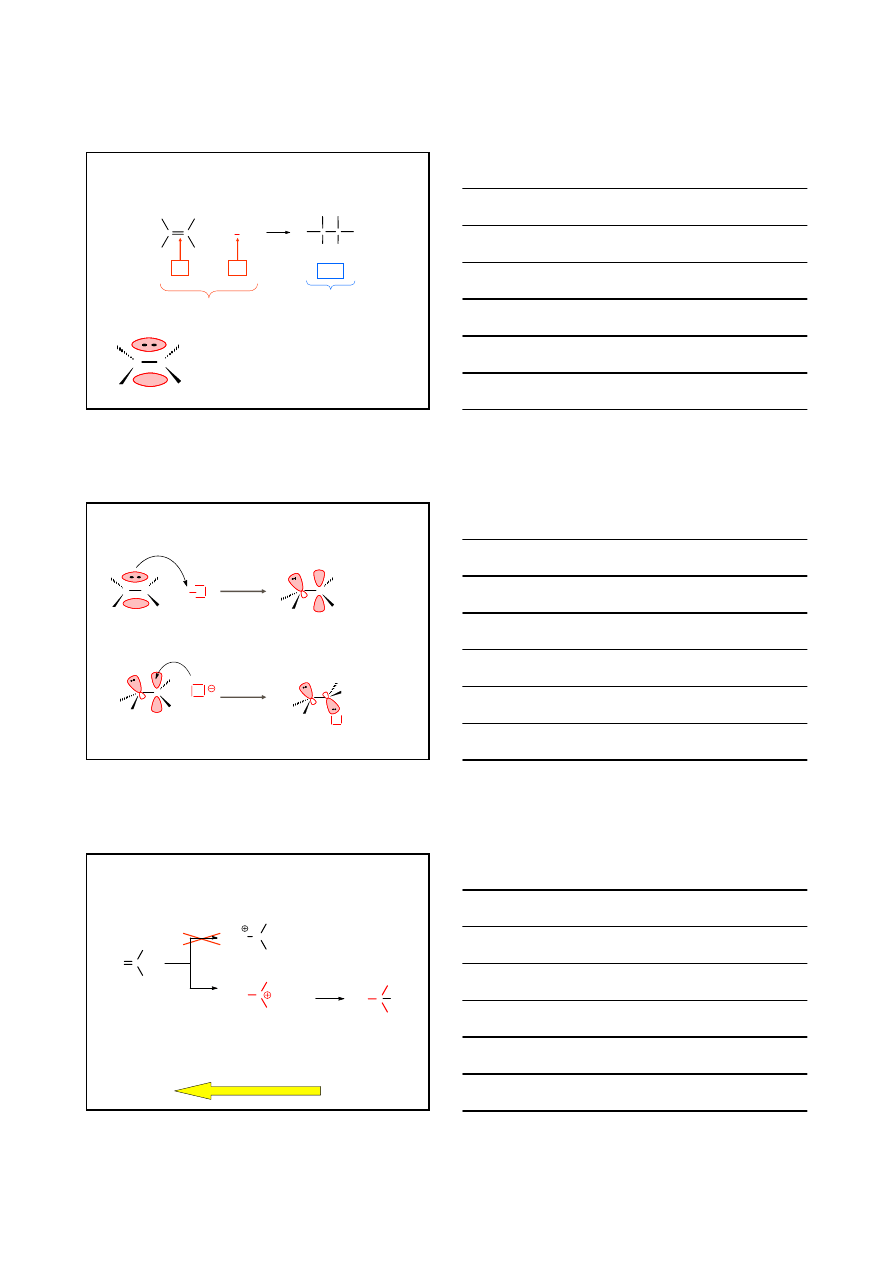
3. REAKCJE ALKENÓW
ADDYCJA ELEKTROFILOWA A
E
C
C
+
X Y
C
X
C
Y
π
σ
2×σ
wiązania rozpadające się
wiązania tworzące się
C
C
ELEKTROFILE:
CZĄSTKI NAŁADOWANE DODATNIO, np. H
+
CZĄSTKI NEUTRALNE, np. Br
2
KWASY LEWISA, np. BF
3
, AlCl
3
KATIONY METALI, np. Ag
+
, Hg
+2
, Pt
+2
ADDYCJA ELEKTROFILOWA A
E
MECHANIZM A
E
C
C
H X
wolno
C C
H
+
C
C
H
+
KARBOKATION
szybko
X
H
C
C
X
HALOGENOALKAN
ADDYCJA
ELEKTROFILOWA
A
E
REGUŁA MARKOWNIKOWA
CH
3
H
3
C C
CH
3
Br
SZYBKO
Br
-
Proton przyłącza się tak, aby powstał
bardziej stabilny
karbokation
STABILNOŚĆ KARBOKATIONÓW
3° > 2° > 1° > CH
3
+
2-BROMO-2-METYLOPROPAN
CH
3
H
2
C C
CH
3
CH
3
H
2
C CH
CH
3
CH
3
H
3
C C
CH
3
H
+
10
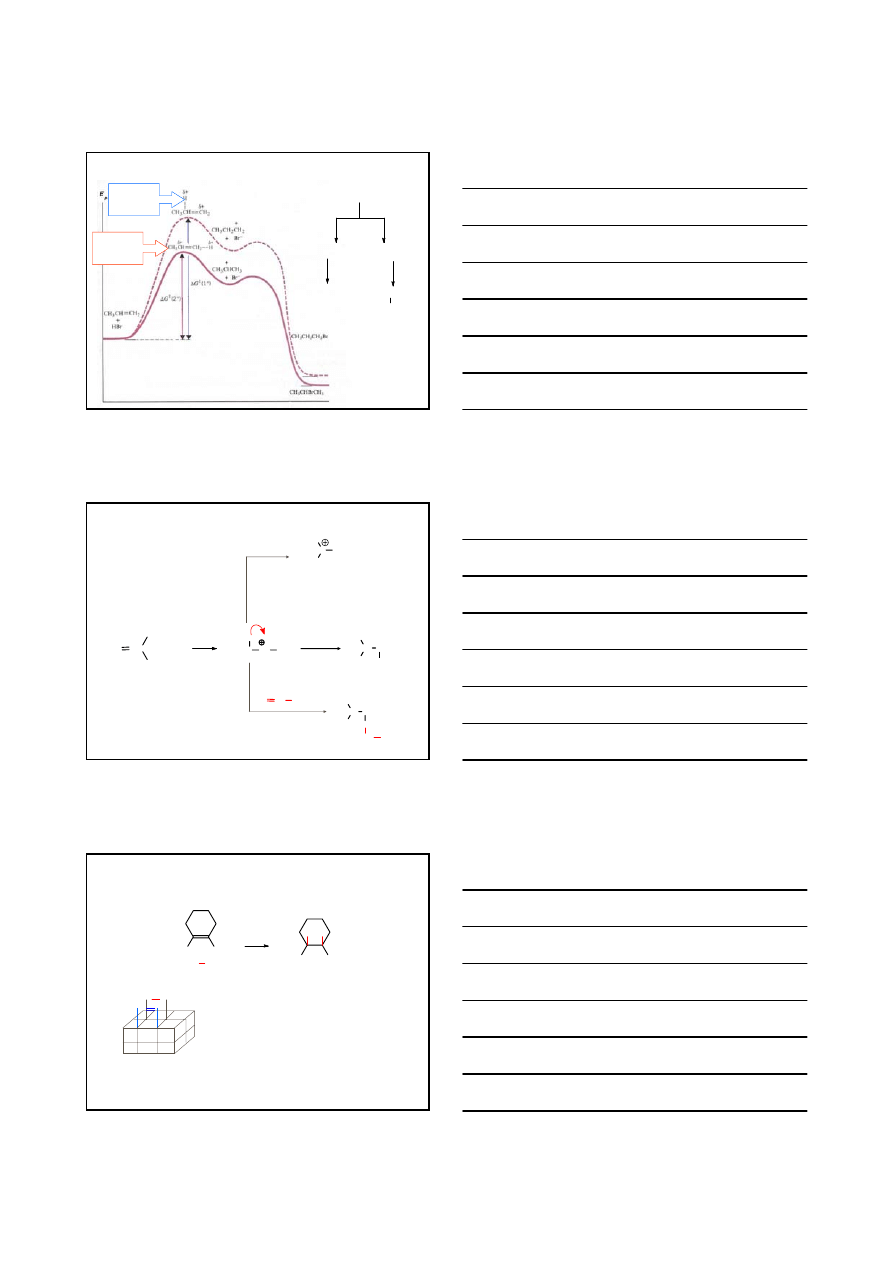
ADDYCJA ELEKTROFILOWA A
E
STAN
PRZEJŚCIOWY DLA
KARBOKATIONU
1
°
STAN
PRZEJŚCIOWY DLA
KARBOKATIONU
2
°
CH
3
CH=CH
2
CH
3
CH
2
CH
2
+
Br
-
Br
-
CH
3
CH
2
CH
2
Br
CH
3
CHCH
3
Br
H
+
CH
3
CHCH
3
+
2
°
1
°
REAKCJE KARBOKATIONÓW
CH
3
H
2
C CHCH
CH
3
H
+
+
(CH
3
)
2
C CH CH
3
H
H
3
C
C
H
3
C
CH
2
CH
3
H
3
C
CH
H
3
C
CHCH
3
Nu
INu, np. ROH
H
3
C
CH
H
3
C
CHCH
3
CH
2
CH CH(CH
3
)
2
1,2-PRZESUNIĘCIE
CH
2
CH CH(CH
3
)
2
DIMERYZACJA
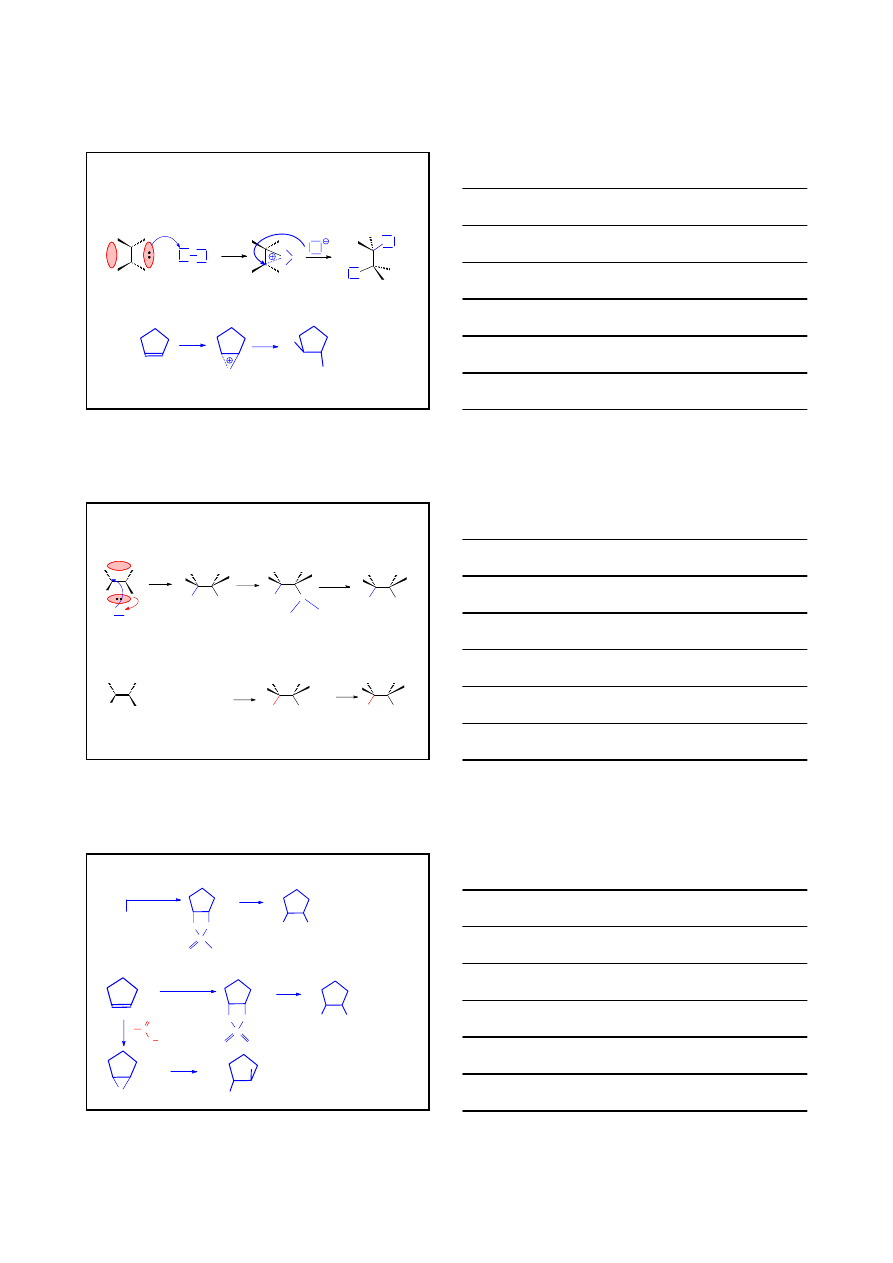
ADDYCJA ELEKTROFILOWA A
E
ADDYCJA WODORU DO ALKENU
A
E
syn
H
2
/KATALIZATOR
cis-
1,2-dimetylocykloheksan
H H
H
2
C CH
2
CH
3
H
3
C
H H
KAT.
CH
3
H
3
C
H
H
Ni
11
ADDYCJA ELEKTROFILOWA A
E
ADDYCJA BROMU DO ALKENU
A
E
anti
Br Br
wolno
Br
Br
szybko
Br
Br
+
δ
−
δ
trans
-1,2-dibromocyklopentan
Br
-
Br
Br
Br
Br
2
CCl
4
ADDYCJA ELEKTROFILOWA A
E
ADDYCJA
BOROWODORU
DO ALKENU – HYDROBOROWANIE ALKENÓW
R
H
BH
2
+
δ
−
δ
R
H
BH
2
R
H
B
H
2
O
2
/ OH
-
R
H
OH
OKSYRTĘCIOWANIE ALKENÓW
R
+
H
2
O
+ Hg(CH
3
COO
-
)
2
R
HO
Hg(CH
3
COO)
THF
R
HO
H
NaBH
4
OH
-
tzw.
ANTYMARKOWNIKOW
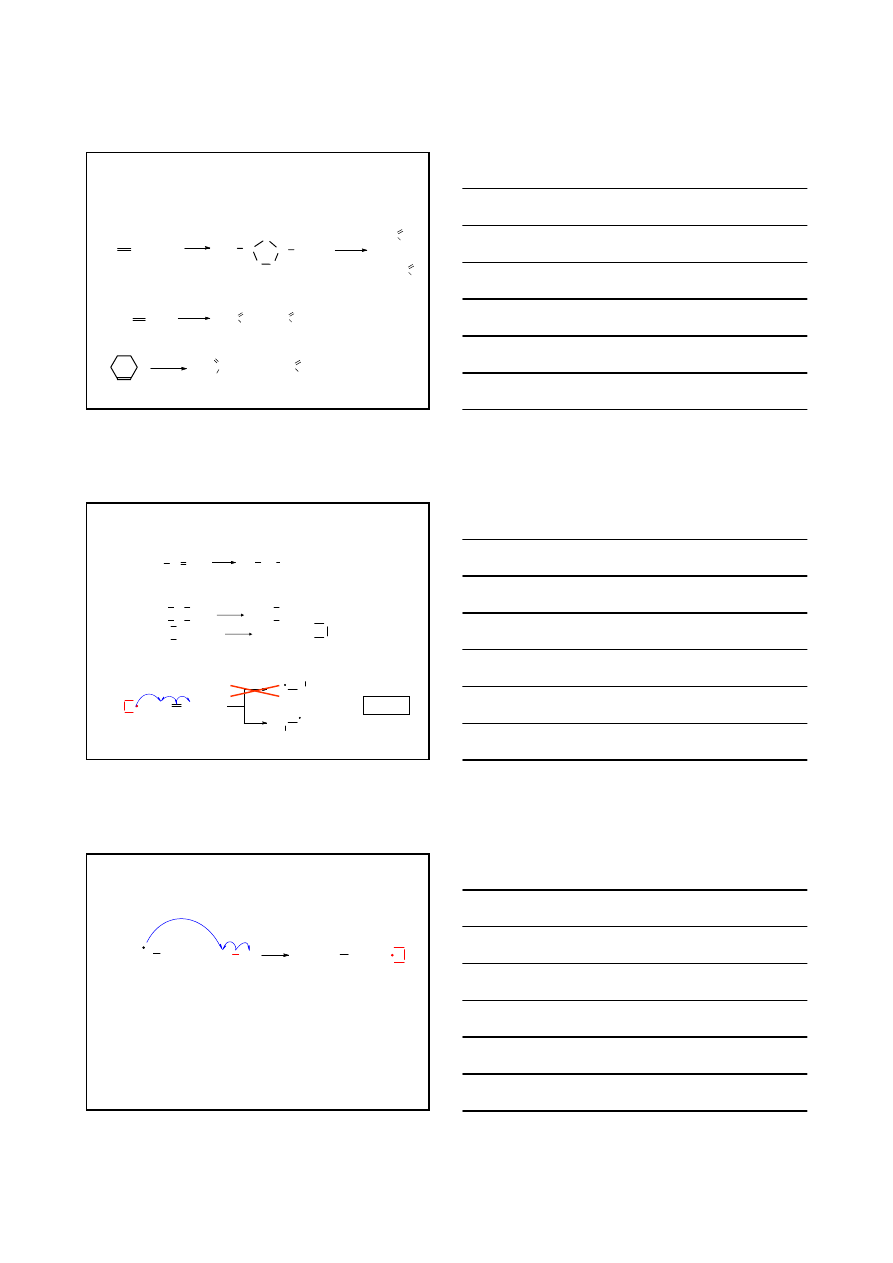
UTLENIANIE ALKENÓW
OH
-
HO
OH
KMnO
4
O
O
Mn
O
O
-
K
+
H
2
O
HO
OH
OsO
4
O
O
Os
O
O
NaHSO
3
CCl
4
H
2
O
OH
-
HO
OH
O
R C
O
O OH
12
UTLENIANIE ALKENÓW
OZONOLIZA ALKENÓW
CH
O O
CH
O
CH
2
CH
3
CH
3
O
3
-80
o
C
CH
3
CH
CHCH
2
CH
3
Zn, H
2
O
CH
3
C
O
H
CH
3
CH
2
C
O
H
+
1. O
3
2. Zn,H
2
O
CH
3
CH
CHCH
3
CH
3
C
O
H
CH
3
C
O
H
+
1. O
3
2. Zn,H
2
O
CCH
2
CH
2
CH
2
CH
2
C
O
H
O
H
REAKCJE RODNIKOWE ALKENÓW
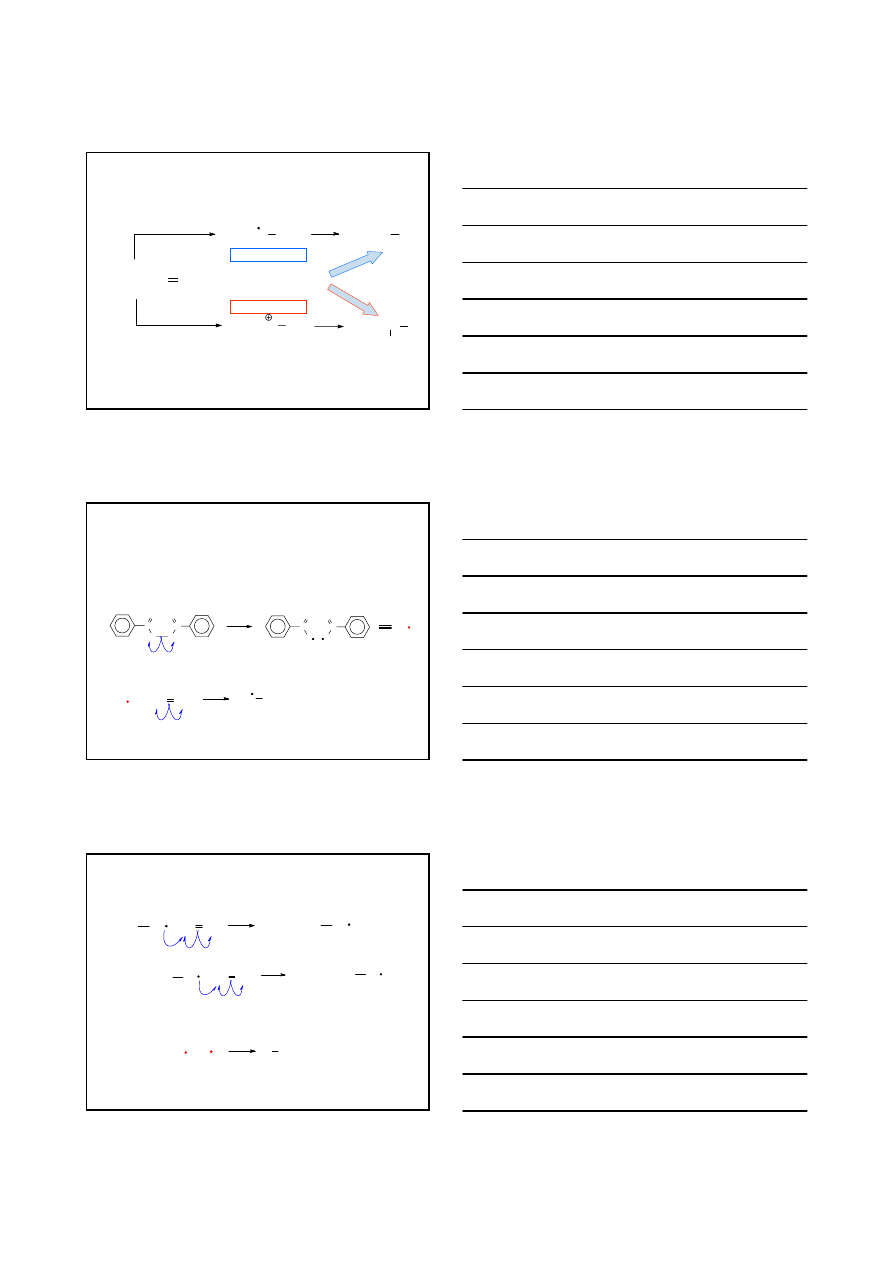
ADDYCJA RODNIKOWA HBr DO ALKENÓW
R CH CH
2
HBr
ROOR
R CH
2
CH
2
Br
MECHANIZM
1. Inicjacja reakcji rodnikowej
R – O – O – R 2 R – O
•
h
ν
2. Propagacja reakcji rodnikowej
R – O
•
+
H – Br
RO
H
+
•
Br
Br
H
2
C CHCH
2
CH
3
H
2
C
CHCH
2
CH
3
Br
H
2
C
CHCH
2
CH
3
Br
1
°
2
°
1
° < 2
°
ADDYCJA RODNIKOWA HBr DO ALKENÓW
2. Propagacja reakcji rodnikowej
CH
3
CH
2
CH CH
2
Br
CH
3
CH
2
CH
2
CH
2
Br
H Br
+ Br
itd.
13
REASUMUJĄC
CH
3
CH
2
CH CH
2
CH
3
CH
2
CH
2
CH
2
Br
CH
3
CH
2
CH CH
2
Br
CH
3
CH
2
CH CH
3
CH
3
CH
2
CH CH
3
Br
A
E
H
+
Br
-
A
R
ROOR Br
•
HBr
KARBOKATION 2
°
KARBORODNIK 2
°
ZG
OD
NIE
NIE
ZGO
DNI
E
POLIMERYZACJA ALKENÓW
POLIMERYZACJA – proces polegający na łączeniu małych cząsteczek, tzw.
monomerów, w duże cząsteczki - polimery
MECHANIZM
1. Rozkład katalizatora, np. nadtlenku benzoilu
2. Przyłączenie rodnika benzoiloksylowego do alkenu
C
O
O
O
O
C
h
ν
C
O
O
O
O
C
+
RO
RO
H
2
C CH
2
+
H
2
C CH
2
OR
POLIMERYZACJA ALKENÓW
MECHANIZM
3. Reakcja przedłużania łańcucha
n – krotnie
4. Zakończenie łańcucha
RO
CH
2
CH
2
H
2
C CH
2
RO
CH
2
CH
2
CH
2
CH
2
RO
/CH
2
CH
2
/
n-1
CH
2
CH
2
H
2
C CH
2
RO
/CH
2
CH
2
/
n
CH
2
CH
2
R
R
+
R R
14
REASUMUJĄC
H
2
/Pt, Ni lub Pd
H
H
AE syn
HX
(X = I, Br, Cl, F)
AE zgodnie z reg. Markownikowa
X
H
X
2
(X = I, Br, Cl, F)
AE anti
X
X
zgodnie z reg. Markownikowa
AE anti
HO
X
X
2
/H
2
O
(X = I, Br, Cl, F)
zgodnie z reg. Markownikowa
H
+
/H
2
O
AE anti
HO
H
zgodnie z reg. Markownikowa
REASUMUJĄC
1.RCO
3
H/CCl
4
2. H
+
/H
2
O
utlenianie anti
HO
OH
O
O
ozonoliza
1.O
3
2. Zn/H
2
O
HO
OH
1. KMnO
4
2. OH
-
1. OsO
4
2. NaHSO
3
LUB
utlenianie syn
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład11
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron