1
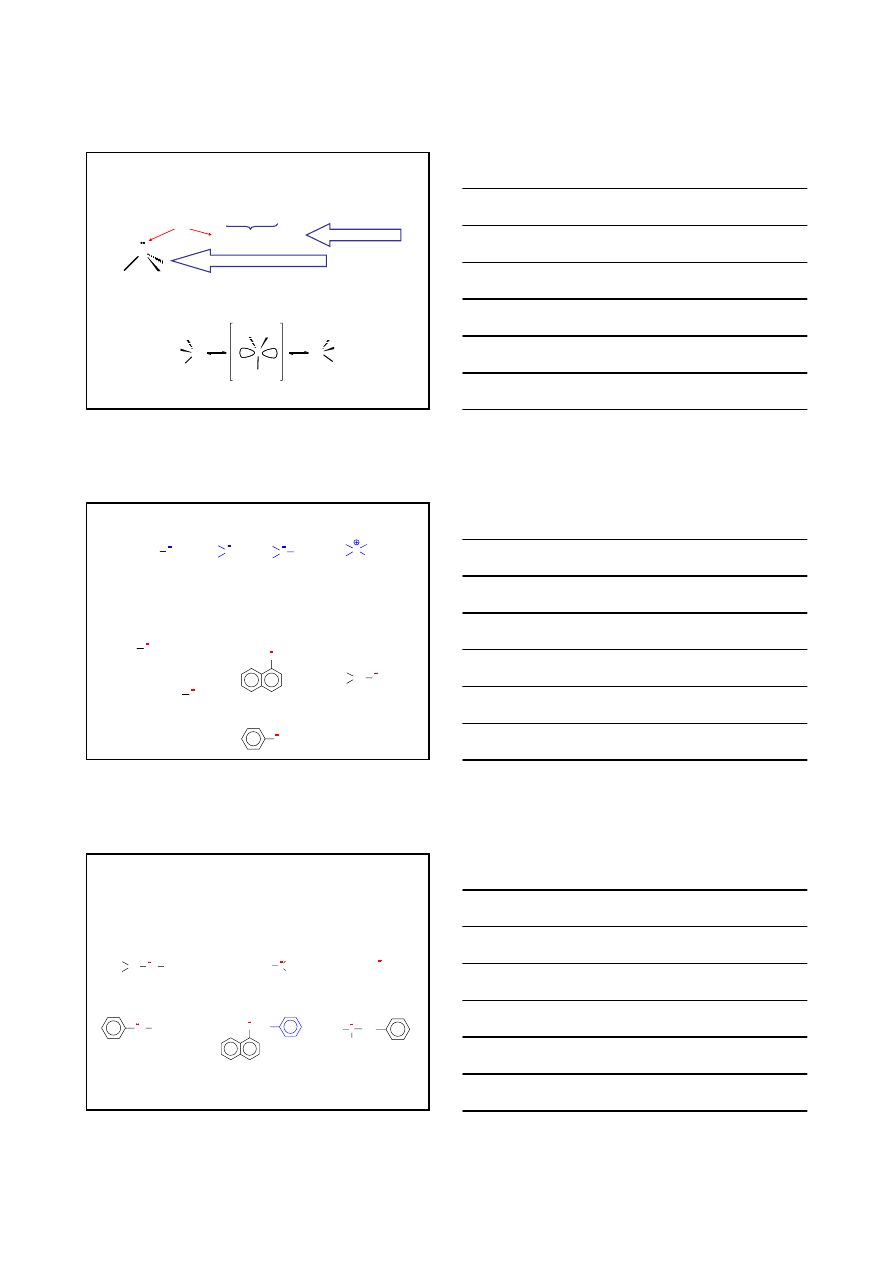
ZWIĄZKI ORGANICZNE ZAWIERAJĄCE ATOMY AZOTU
7
N
1s
2
2s
2
2p
3
okres 2; grupa V
(sp
3
)
2
(sp
3
)
1
(sp
3
)
1
(sp
3
)
1
2p
x
1
p
y
1
p
z
1
HYBRYDYZACJA sp
3
N
GEOMETRIA CZĄSTECZKI PIRAMIDALNA
niewiążąca para elektronów
N
R
R
1
R
2
N
R
R
1
R
2
N
R
R
1
R
2
INWERSJA AMIN
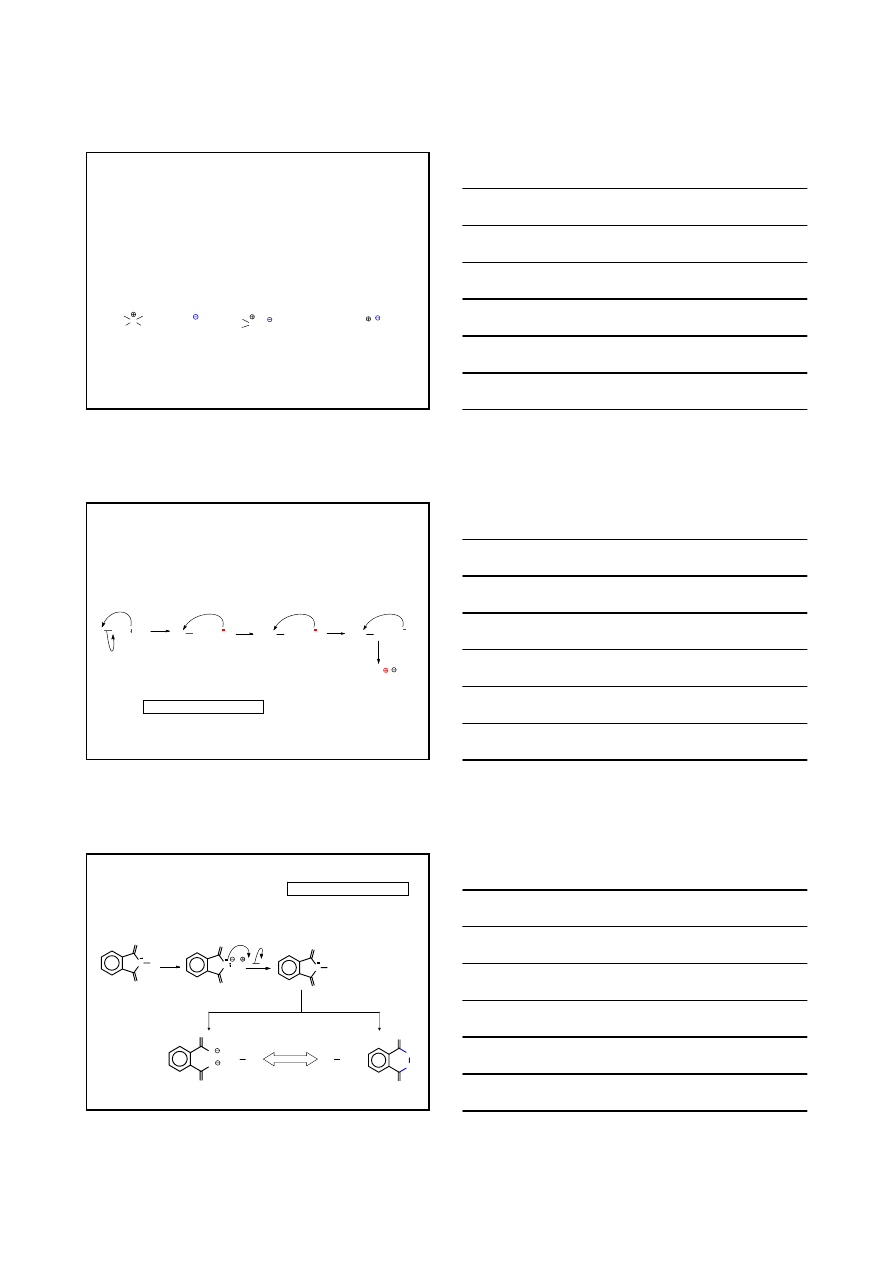
AMINY
formalnie są to pochodne amoniaku NH
3
R
NH
R
1
R
N
R
1
R
2
R
N
R
1
R
2
R
3
R NH
2
R: alkil, aryl
1°
2°
3°
kation ammoniowy
NOMENKLATURA AMIN
do nazwy alkilu dodaje się końcówkę „
-amina
”
pierwszorzędowych
CH
3
NH
2
metylo
amina
CH
3
CH
2
CH
2
CH
2
NH
2
n-
butylo
amina
NH
2
α-naftylo
amina
CH
3
CH
CH
3
NH
2
i-
propylo
amina
NH
2
anilina
AMINY
NOMENKLATURA AMIN
traktuje się je jako pochodne amin 1°
drugo- i trzeciorzędowych
trimetylo
amina
N
-
etylo-
N
-metylo-
n-
butylo
amina
N
-benzylo-
α-naftylo
amina
N
-
metylo-
i-
propylo
amina
N
-
i-
propylo
anilina
amina 1° – z najbardziej złożonym podstawnikiem
CH
3
CH
CH
3
NH
CH
3
CH
3
CH
2
CH
2
CH
2
N
CH
3
CH
2
CH
3
(CH
3
)
3
N
NH
CH(CH
3
)
2
NH
CH
2
N
-
α-naftylo-
benzylo
amina
CH
3
N
CH
2
H
3
C
N,N
-dimetylo
benzylo
amina
2
AMINY
NOMENKLATURA SOLI AMMONIOWYCH
wymienia się nazwy podstawników na atomie azotu w kolejności
alfabetycznej i dodaje się końcówkę „
-ammoniowy
”
określa się rodzaj anionu, np. bromek
chlorek
etylometylo-
i-
propylo
ammoniowy
H
N
H
3
C
CH
2
CH
3
CH(CH
3
)
2
Cl
H
3
C
NH
2
H
3
C
OH
wodorotlenek
dimetylo
ammoniowy
Br
(CH
3
CH
2
)
4
N
bromek
tetraetylo
ammoniowy
AMINY
OTRZYMYWANIE AMIN
NH
3
S
N
2
H
3
C
I +
H
3
C
I
S
N
2
CH
3
NH
2
+
H
3
C
I (CH
3
)
2
NH
S
N
2
+
(CH
3
)
3
N
H
3
C
I +
S
N
2
(CH
3
)
4
N
I
METODA NIEJEDNOZNACZNA
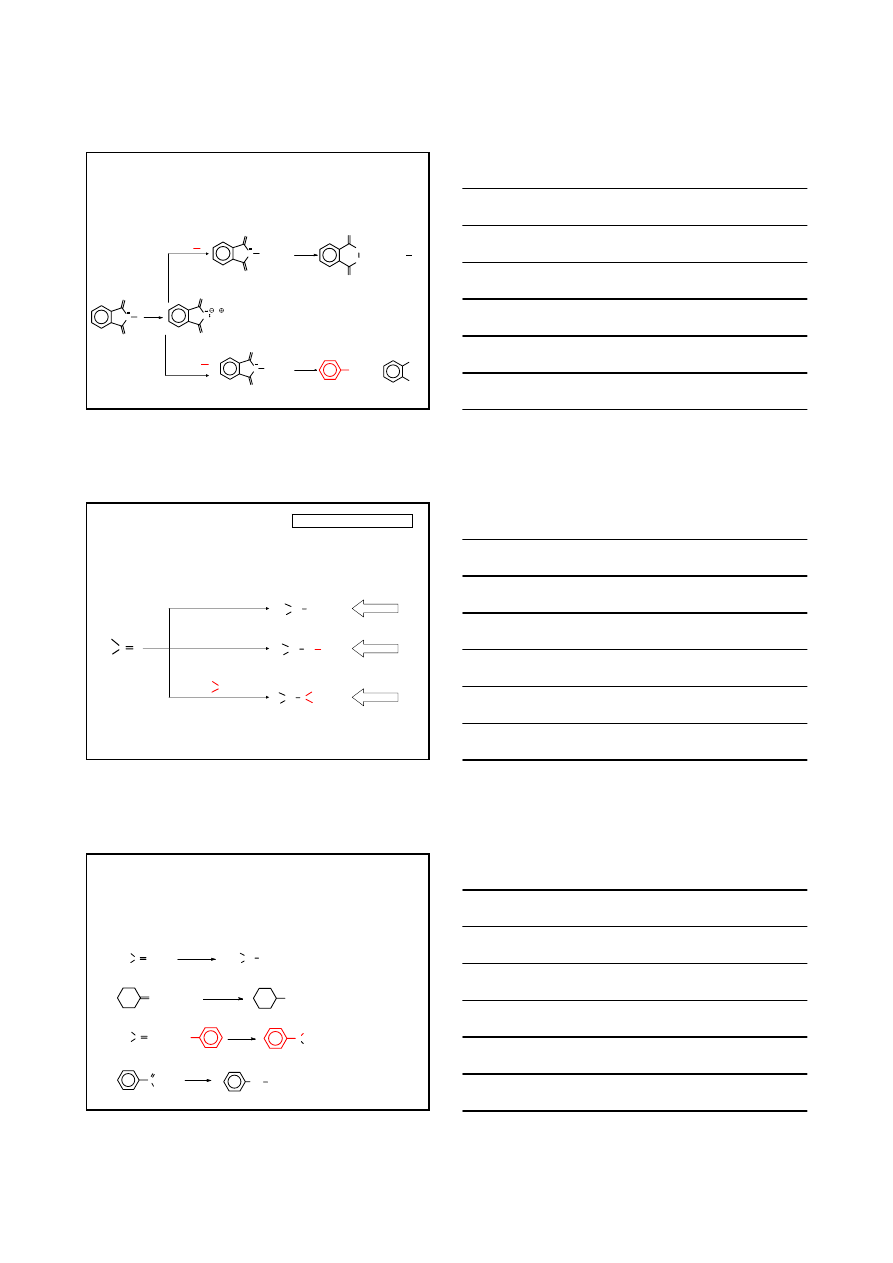
REAKCJE SUBSTYTUCJI NUKLEOFILOWEJ
AMINY
OTRZYMYWANIE AMIN
REAKCJE SUBSTYTUCJI NUKLEOFILOWEJ – METODA GABRIELA
N
O
O
H
KOH
N
O
O
K
ftalimid
R
X
N
O
O
R
(-KX)
N-
alkiloftalimid
OH
-
/H
2
O
NH
2
NH
2
/EtOH,
∆
NH
NH
O
O
R
NH
2
+
O
O
O
O
R
NH
2
+
AMINA 1
°
METODA JEDNOZNACZNA
R: ALKIL
X: Cl, Br lub I
3
AMINY
OTRZYMYWANIE AMIN
REAKCJE SUBSTYTUCJI NUKLEOFILOWEJ – METODA GABRIELA
PRZYKŁADY
N
O
O
H
KOH
N
O
O
K
(CH
3
)
2
CH
Br
N
O
O
CH(CH
3
)
2
(-KBr)
NH
2
NH
2
EtOH
NH
NH
O
O
(CH
3
)
2
CH
NH
2
+
ftalimid
ftalimidek potasu
N-
i
-propylo
ftalimid
CH
2
NH
2
+
COO
-
COO
-
C
6
H
5
CH
2
Cl
N
O
O
CH
2
C
6
H
5
(-KCl)
OH
-
/H
2
O
N-
benzylo
ftalimid
i
-propylo
amina
benzylo
amina
AMINY
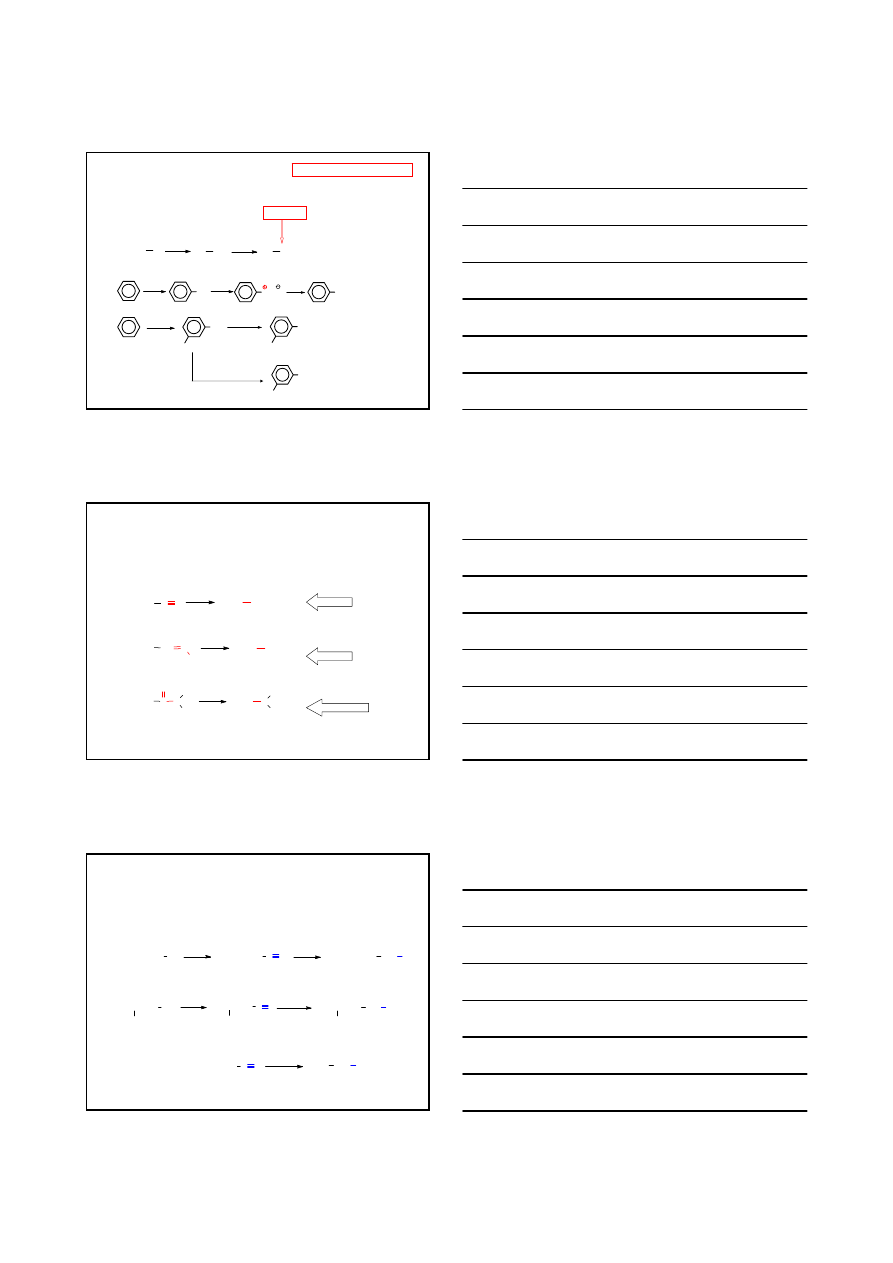
OTRZYMYWANIE AMIN
METODA JEDNOZNACZNA
METODA REDUKCYJNEGO AMINOWANIA
R'
C
R"
O
R'
CH
R"
NH R
RNH
2
[H]
NH
3
[H]
R'
CH
R"
NH
2
R'
CH
R"
N
R
R
NH
R
R
[H]
[H]: H
2
/Ni, 90 atm, 40–70°C
NaBH
3
CN lub LiBH
3
CN
AMINA 1°
AMINA 2°
AMINA 3°
AMINY
OTRZYMYWANIE AMIN
METODA REDUKCYJNEGO AMINOWANIA
PRZYKŁADY
NH
3
H
3
C
C
H
3
C
O +
H
3
C
CH
H
3
C
NH
2
NaBH
3
CN
i-
propylo
amina
CH
3
NH
2
+
LiBH
3
CN
O
NHCH
3
N-
metylo
cykloheksylo
amina
H
3
C-NH
+
H
3
C
C
H
3
C
O
H
2
/Ni
90 atm
40–70°C
N
CH
3
CH(CH
3
)
2
N-
metylo-N-
i-
propylo
anilina
H
2
/Ni
90 atm
40–70°C
C
O
H
+
NH
3
CH
2
NH
2
benzylo
amina
4
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja związków nitrowych
Ar
H
HNO
3
H
2
SO
4
Ar
NO
2
[H]
Ar
NH
2
[H]: Sn/HCl lub Fe/HCl
H
2
S, CH
3
CH
2
OH, NH
3
PRZYKŁADY
NO
2
HNO
3
H
2
SO
4
Sn/HCl
NH
3
Cl
NH
2
OH
-
anilina
m
-nitro
anilina
HNO
3
H
2
SO
4
,
∆
NO
2
O
2
N
H
2
S
NH
3
, EtOH
70-80%
NH
2
O
2
N
NH
2
H
2
N
1.
Fe/HCl
2.
OH
-
m
-fenylenodi
amina
METODA JEDNOZNACZNA
AMINY 1°
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
R
C N
R
CH
2
NH
2
[H]
[H]
R
CH
2
NH
2
R
CH N
OH
R
C N
R
O
R'
R
CH
2
N
R'
R
[H]
redukcja oksymów
redukcja nitryli
redukcja amidów
AMINA 1°
AMINA 1°
AMINA 1
°, 2°, 3°
R: alkil, aryl
H
2
, katalizator
LiAlH
4
[H]:
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja nitryli
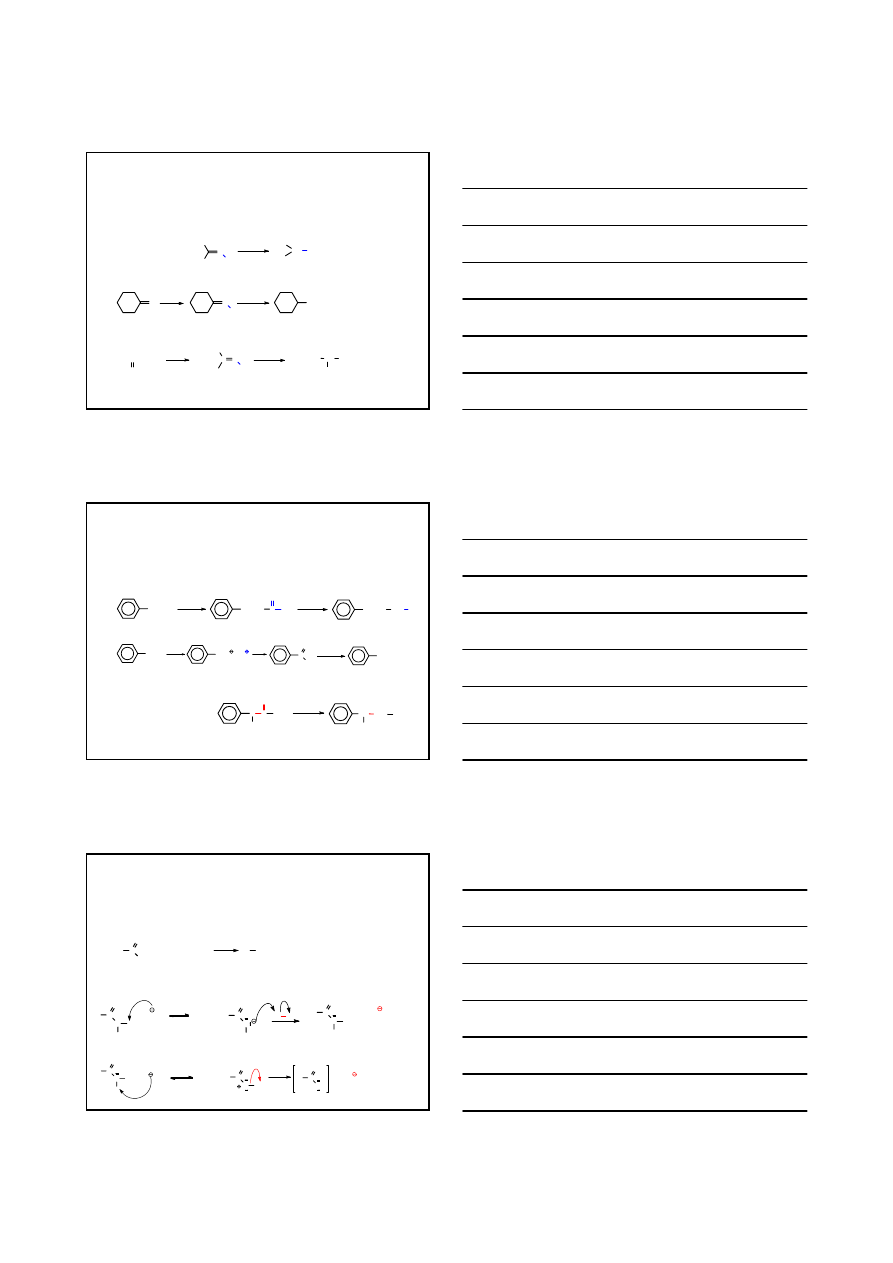
PRZYKŁADY
CH
3
CH
2
CH
2
Br
Na
CN
CH
3
CH
2
CH
2
C N
Ni/Raney
140°C
CH
3
CH
2
CH
2
CH
2
NH
2
bromopropan
n
-butyloamina
2-metylo-1-bromopropan
3-metylobutyloamina
CH
3
CHCH
2
Br
CH
3
Na
CN
CH
3
CHCH
2
C N
CH
3
1.LiAlH
4
2. H
2
O
CH
3
CHCH
2
CH
2
NH
2
CH
3
CH
3
CH
2
NH
2
1.LiAlH
4
2. H
2
O
CH
3
C N
acetonitryl
etyloamina
5
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja oksymów
PRZYKŁADY
cykloheksanon
cykloheksyloamina
2-butanon
sec
-butyloamina
H
3
C
H
3
C
N
OH
1.LiAlH
4
2. H
2
O
CH
3
CH
NH
2
CH
3
oksym acetonu
i
-propyloamina
CH
3
CCH
2
CH
3
O
NH
2
OH
CH
3
CH
2
C
H
3
C
N
OH
55%
Na, EtOH
CH
3
CH
2
CH CH
3
NH
2
NH
2
OH
O
N
OH
Na, EtOH
NH
2
60%
AMINY
OTRZYMYWANIE AMIN
METODY REDUKCYJNE
redukcja amidów
PRZYKŁADY
CH
2
NH
2
CH
3
COCl
TEA
CH
2
NH
C CH
3
O
1.LiAlH
4
2. H
2
O
CH
2
NH
CH
2
CH
3
N
-benzylo
acetamid
N
-
etylo
benzyloamina
N C
CH
3
O
CH
3
1.
LiAlH
4
2. H
2
O
NH CH
2
CH
3
CH
3
N
-metylo
acet
anilid
N
-etylo-
N
-metyloanilina
NH
3
COOH
COO
NH
4
∆
C
O
NH
2
1. LiAlH
4
2. H
2
O
C
H
2
NH
2
benz
amid
benzylo
amina
AMINY
OTRZYMYWANIE AMIN
METODY DEGRADACYJNE
przegrupowanie Hofmanna
R
C
O
NH
2
+
Br
2
+ NaOH
H
2
O
R
NH
2
+ 2Na
Br
+ Na
2
CO
3
+ 2H
2
O
MECHANIZM
R
C
O
N
H
H
+ OH
H
2
O +
R
C
O
N
H
Br Br
R
C
O
N
H
Br
+
Br
ETAP 1 – N-bromowanie amidu
AMID
N
-
BROMO
AMID
ETAP 2 – Eliminacja E
1,1
bromowodoru pod wpływem zasady
N
-
BROMO
AMID
NITREN
R
C
O
N
H
Br
+ OH
R
C
O
N
Br
H
2
O +
R
C
O
N
+
Br
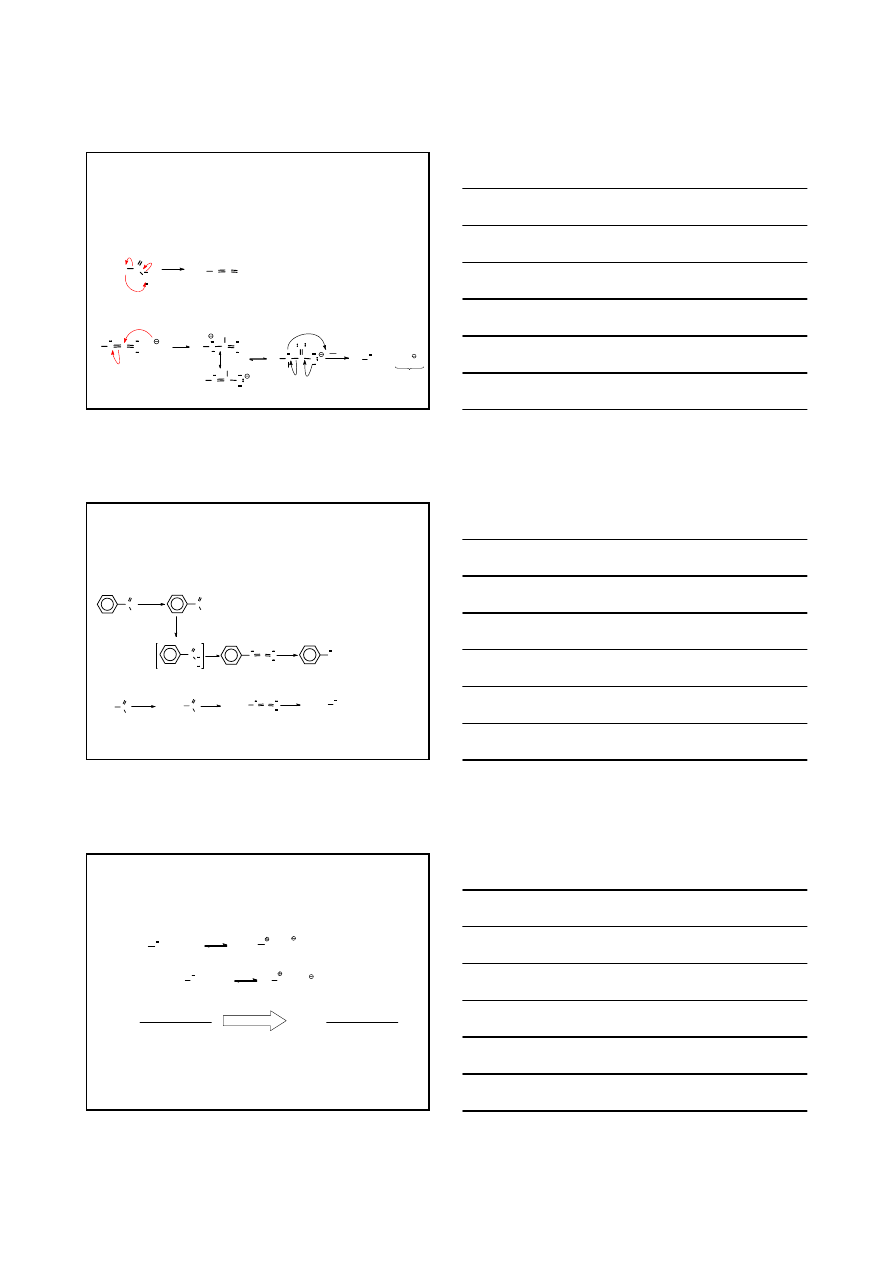
6
ETAP 3 – Przegrupowanie grupy alkil/aryl z atomu węgla na atom azotu z deficytem elektronowym
NITREN
AMINY
OTRZYMYWANIE AMIN
METODY DEGRADACYJNE
przegrupowanie Hofmanna
R
C
O
N
R
N C O
IZOCYJANIAN
ETAP 4 – Hydroliza i dekarboksylacja izocyjanianu pod działaniem zasady
+ OH
R
N C O
R
N C O
OH
R
N C O
OH
R
N C O
O
H
H
OH
R
NH
2
CO
2
+ OH
+
HCO
3
-
AMINY
OTRZYMYWANIE AMIN
METODY DEGRADACYJNE
przegrupowanie Hofmanna
PRZYKŁADY
C
O
OH
1.SOCl
2
2. NH
3
C
O
NH
2
Br
2
NaOH
C
O
N
N C O
H
2
O
NaOH
NH
2
+ 2NaBr + Na
2
CO
3
+ 2H
2
O
KWAS BENZOESOWY
ANILINA
(CH
3
)
2
CH C
O
OH
1.SOCl
2
2. NH
3
(CH
3
)
2
CH C
O
NH
2
NaOH
Br
2
(CH
3
)
2
CH N C O
H
2
O
NaOH
(CH
3
)
2
CH NH
2
+ 2NaBr + Na
2
CO
3
+ 2H
2
O
KWAS 2-METYLOPROPANOWY
i-
PROPYLOAMINA
AMINY
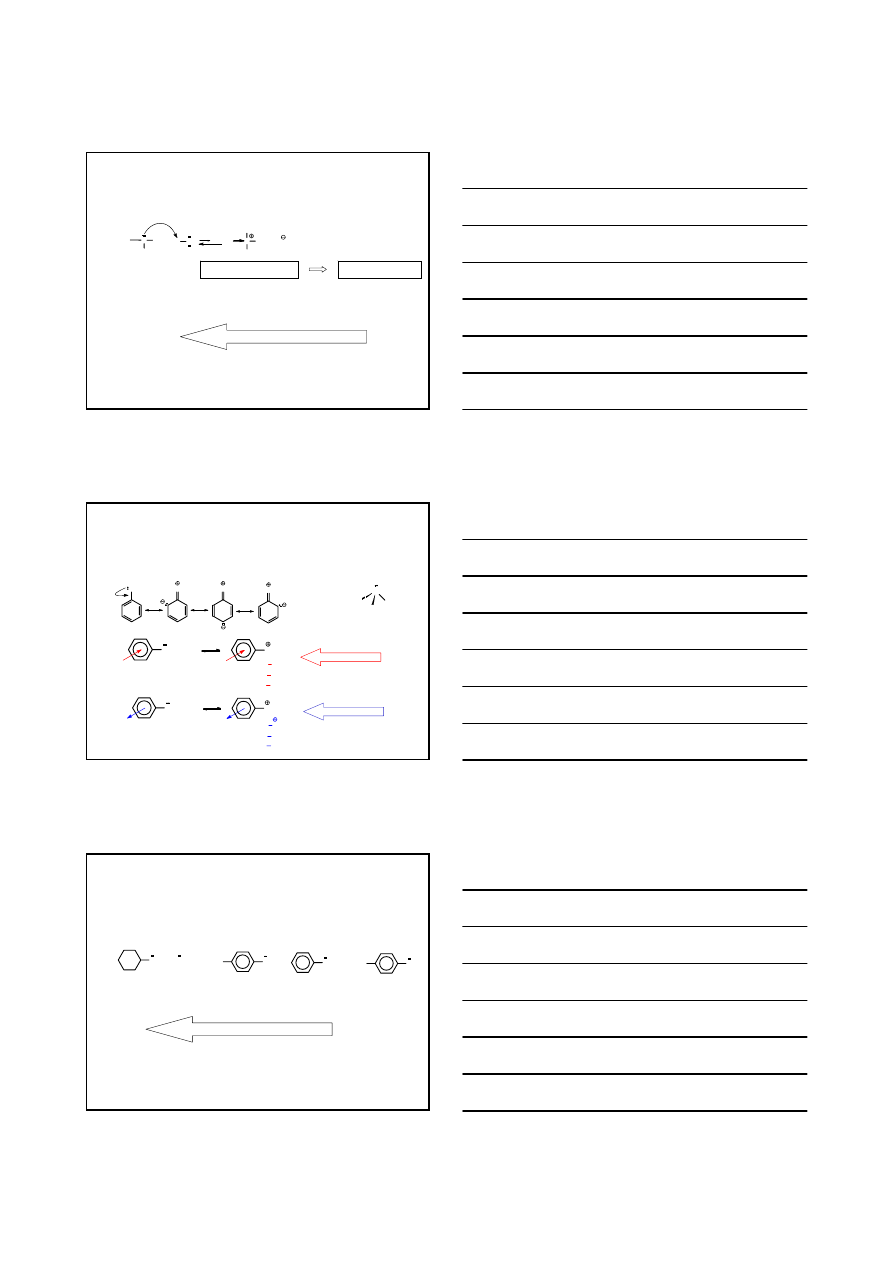
WŁAŚCIWOŚCI AMIN
CH
3
CH
2
NH
2
+ H
2
SO
4
HSO
4
CH
3
CH
2
NH
3
ZASADOWOŚĆ AMIN – zdolność amin do wiązania protonu
odszczepionego od cząsteczki kwasu przez atom azotu
K =
[RNH
3
+
][HO
-
]
[RNH
2
][H
2
O]
K
b
=
[RNH
3
+
][HO
-
]
[RNH
2
]
[H
2
O]
≈ 1
p
K
b
= - log K
b
R
NH
2
H
2
O
+
+ HO
R
NH
3
K
7
AMINY
WŁAŚCIWOŚCI AMIN
ZASADOWOŚĆ AMIN ALIFATYCZNYCH
R
N
H
H + H OH
R
N
H
H
H
+ OH
efekt +I grupy alkilowej
stabilizuje kation ammoniowy
FAZA GAZOWA
(CH
3
)
3
N (CH
3
)
2
NH CH
3
NH
2
NH
3
>
>
>
RNH
2
SILNIEJSZE ZASADY
OD AMONIAKU
ROZTWÓR WODNY
(CH
3
)
2
NH CH
3
NH
2
(CH
3
)
3
N NH
3
>
>
>
MOC ZASADY
pK
b
3.29
3.36
4.28
4.74
AMINY
WŁAŚCIWOŚCI AMIN
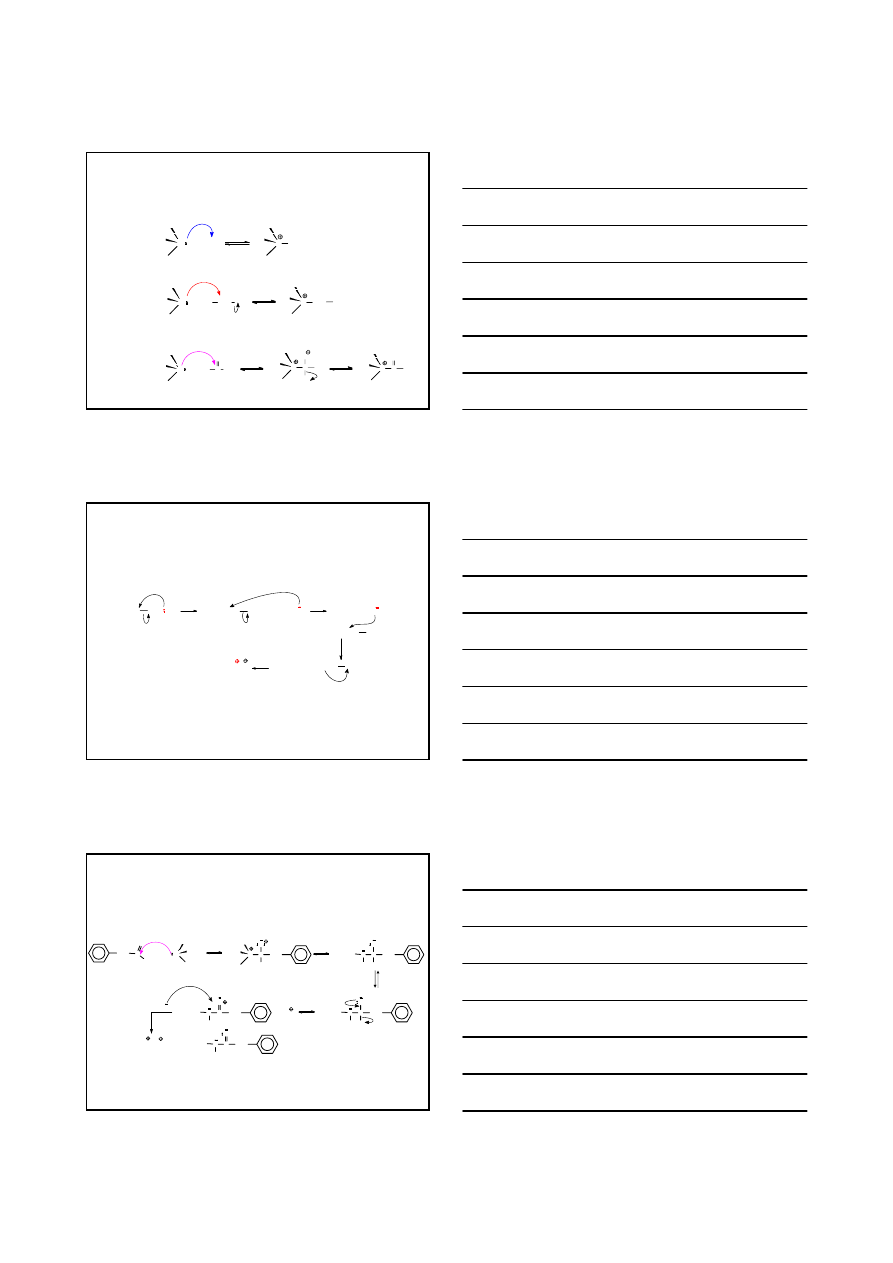
ZASADOWOŚĆ AMIN AROMATYCZNYCH
NH
2
NH
2
NH
2
NH
2
N
R
R
1
R
2
NH
2
G
+ H
+
G
NH
3
G: NH
2
OCH
3
CH
3
stabilizacja kationu
G: NH
3
NO
2
COOH
NH
2
G
+ H
+
G
NH
3
destabilizacja kationu
AMINY
WŁAŚCIWOŚCI AMIN
ZASADOWOŚĆ AMIN AROMATYCZNYCH
>
>
>
>
pK
b
3.38
4.74
8.70
9.42
13.0
NH
2
NH
3
O
2
N
NH
2
NH
2
CH
3
O
NH
2
ZASADOWOŚĆ AMINY
8
AMINY
REAKCJE AMIN
N
+ H
+
N
H
amina atakuje jako zasada
amina atakuje jako nukleofil w reakcjach alkilowania
S
N
amina atakuje jako nukleofil w reakcjach acylowania
S
Nacyl
N
+
N
CH
2
R
R CH
2
X
N
+
N
C R
O
R C Cl
O
N
C R
O
Cl
AMINY
REAKCJE AMIN
reakcje alkilowania
S
N
– przykłady
NH
3
S
N
2
CH
3
CH
2
CH
2
I +
CH
3
CH
2
CH
2
I
S
N
2
(CH
3
CH
2
CH
2
)
2
NH
CH
3
CH
2
CH
2
NH
2
+
CH
3
CH
2
CH
2
I
+
(CH
3
CH
2
CH
2
)
3
N
CH
2
CH
2
CH
3
I
S
N
2
S
N
2
(CH
3
CH
2
CH
2
)
4
N
I
jodek tetrapropyloammoniowy
AMINY
REAKCJE AMIN
reakcje acylowania
S
Nacyl
– przykłady
CH
2
C
Cl
O
+
N
CH
2
CH
3
H
H
N
CH
3
CH
2
C
CH
2
OH
Cl
H
N
CH
3
CH
2
H
H
C
CH
2
O
Cl
N
CH
3
CH
2
C
CH
2
OH
Cl
H
Cl
CH
3
CH
2
N
H
2
+
N
CH
3
CH
2
C
CH
2
O
H
H
CH
3
CH
2
N
H
3
Cl
+
N
CH
3
CH
2
C
CH
2
O
H
N
-etylofenyloacetamid
chlorek fenyloacetylu
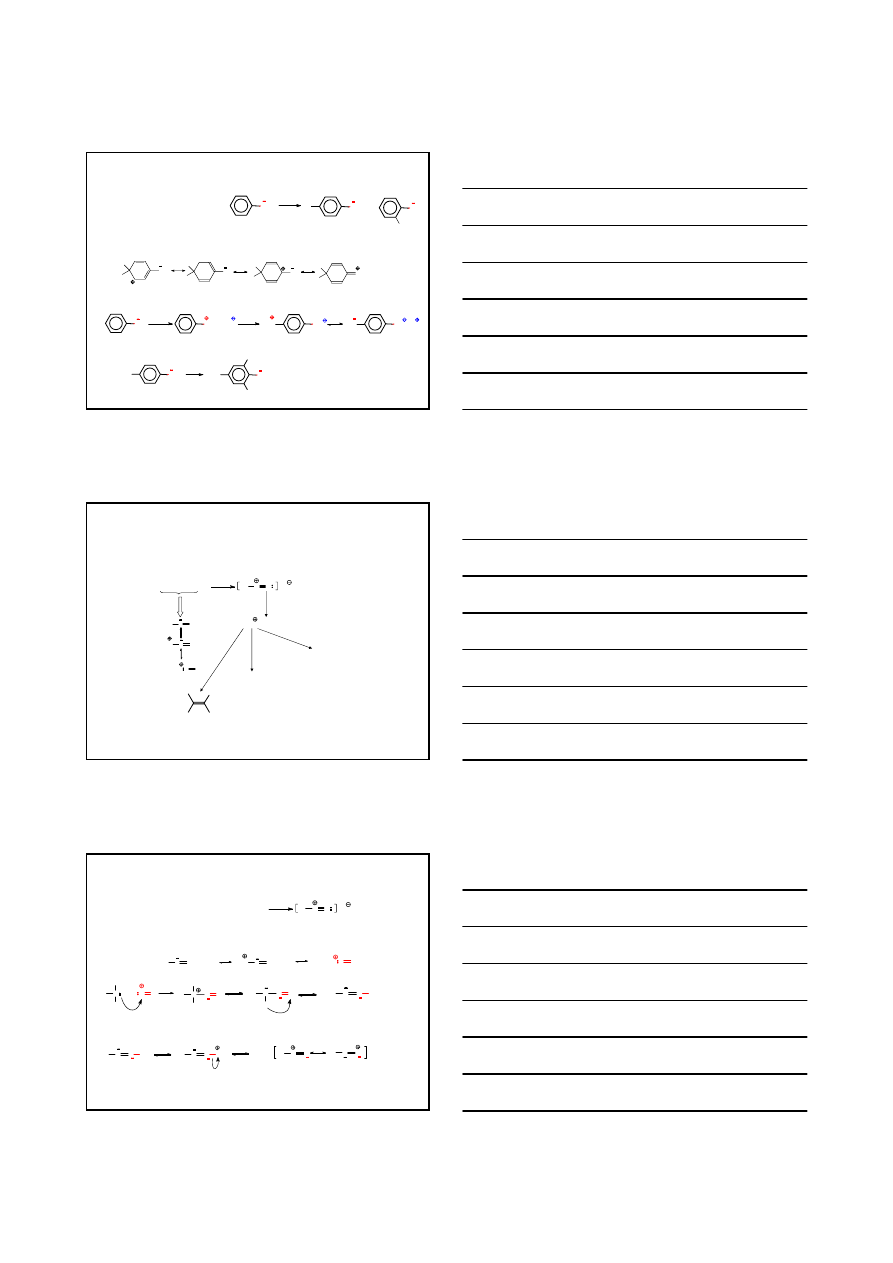
9
dla amin aromatycznych
grupa
–NH
2
ZWIĘKSZA GĘSTOŚĆ ELEKTRONOWĄ W PIERŚCIENIU;
KIERUJE PODSTAWNIK W POZYCJĘ orto- LUB para-
PRZYKŁADY
ANILINA
KWAS
p
-AMINO
BENZENO
SULFONOWY
KWAS SULFANILOWY
AMINY
REAKCJE AMIN
E
+
NH
2
NH
2
E
NH
2
E
+
H
2
SO
4
NH
2
∆
180-200°C
SO
3
Na
H
2
N
SO
3
H
3
N
NH
3
HSO
4
OH
-
NH
2
H
3
C
Br
2
NH
2
H
3
C
Br
Br
p-
TOLUIDYNA
2,6-DI
BROMO
-4-METYLO
ANILINA
NH
2
H
E
NH
2
H
E
NH
2
H
E
NH
2
H
E
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
1° aminy alifatyczne
R N N
Cl
+ NaCl + 2 H
2
O
HO
N
O
H
2
O
N
O
N
O
H
2
O +
R + N
2
S
N
Cl
-
R – Cl
S
N
H
2
O
R – OH
E
RNH
2
+ NaNO
2
+ 2 HCl
AMINY
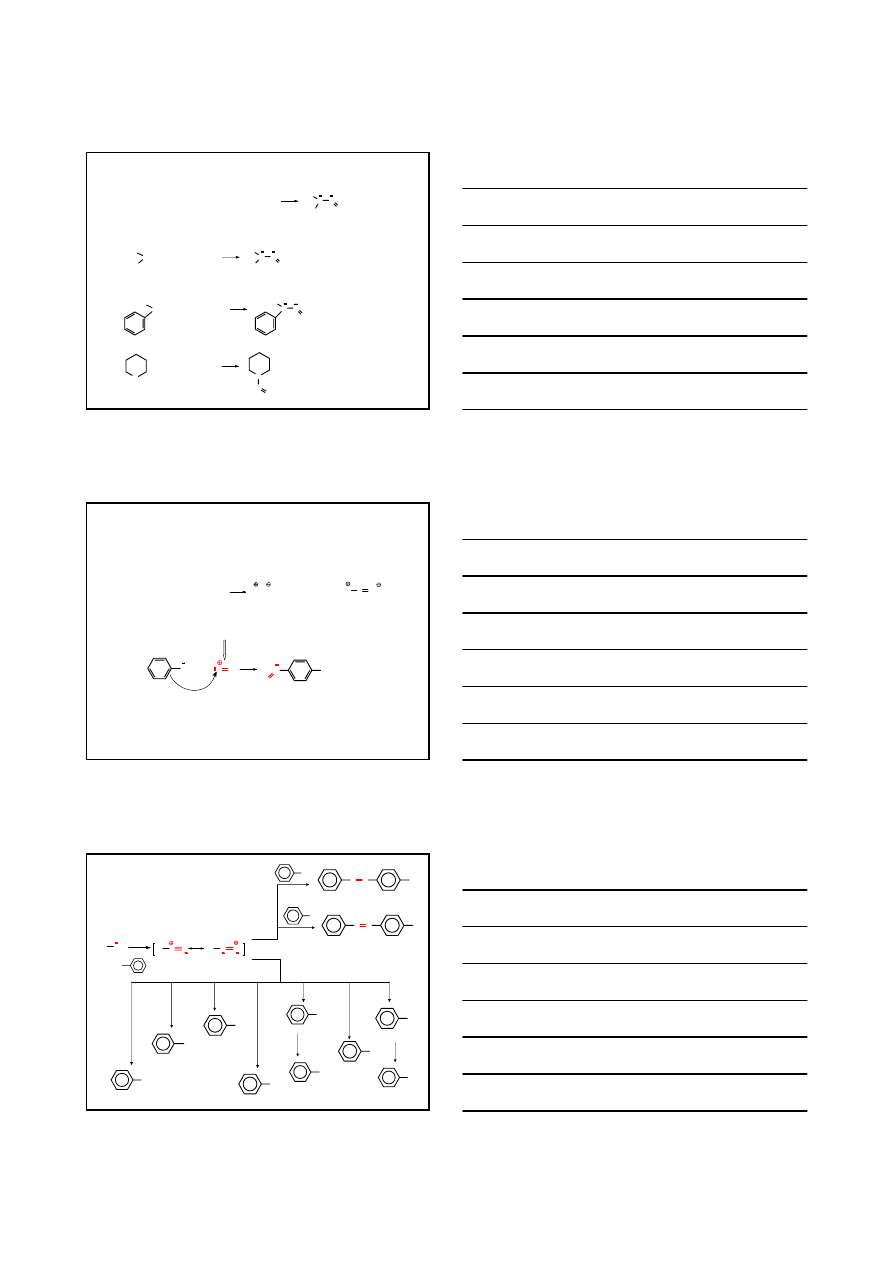
REAKCJE AMIN Z KWASEM AZOTOWYM III
1° aminy aromatyczne
ArNH
2
+ NaNO
2
+ 2 HCl
Ar N N
Cl
+ NaCl + 2 H
2
O
0-5°C
MECHNIZM
H
2
O
N
O
HO
N
O + H
3
O
+
+ H
2
O
N
O
2 H
2
O +
Ar N
H
H
N O
- H
+
Ar N
H
H
O
N
Ar N
H
O
N
1° amina
aromatyczna
N
-nitrozoamina
tautom eria
Ar N
O
H
N
kwas fenylodiazowy
Ar N
O
H
N
+ H
+
Ar N
O
H
2
N
Ar N
N
H
2
O +
Ar N
N
kation arenodiazoniowy
10
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
2° aminy
N
-nitrozoamina
PRZYKŁADY
+ NaNO
2
+ 2 HCl
H
3
C
N
H
3
C
N
O
+ NaCl + H
2
O
H
3
C
NH
H
3
C
N
-nitrozodimetyloamina
N
-nitrozo-N-metyloanilina
N
-metyloanilina
dimetyloamina
piperydyna
N
-nitrozopiperydyna
RR'NH + NaNO
2
+ 2 HCl
R
N
R'
N
O
+ NaCl + H
2
O
+ NaNO
2
+ 2 HCl
+ NaCl + H
2
O
H
3
C
NH
H
3
C
N N
O
N
H
+ NaNO
2
+ 2 HCl
N
N
O
+ NaCl + H
2
O
AMINY
REAKCJE AMIN Z KWASEM AZOTOWYM III
3° aminy
R
3
N N O
2 R
3
N + NaNO
2
+ 3 HCl
+ NaCl + H
2
O +
R
3
NH Cl
Cl
N(CH
3
)
2
N O
N(CH
3
)
2
N
O
SE
8°C, 90%
NaNO
2
+ HCl
p
-nitrozo-N,N-dimetyloanilina
REAKCJE SOLI DIAZONIOWYCH
Ar
NH
2
HNO
2
0-5°C
Ar
N
N
Ar
N
N
–N
2
∆, H
2
O
OH
FENOL
dla Ar =
CuCl
Cl
CHLOROBENZEN
CuBr
KI
Br
BROMOBENZEN
I
JODOBENZEN
CuCN
H
3
O
+
CN
BENZONITRYL
COOH
KWAS
BENZOESOWY
H
3
PO
2
H
NaBF
4
N
2
+
BF
4
-
∆
F
FLUOROBENZEN
NH
2
OH
p
-(fenyloazo)fenol
p
-(fenyloazo)anilina
N N
NH
2
N N
OH
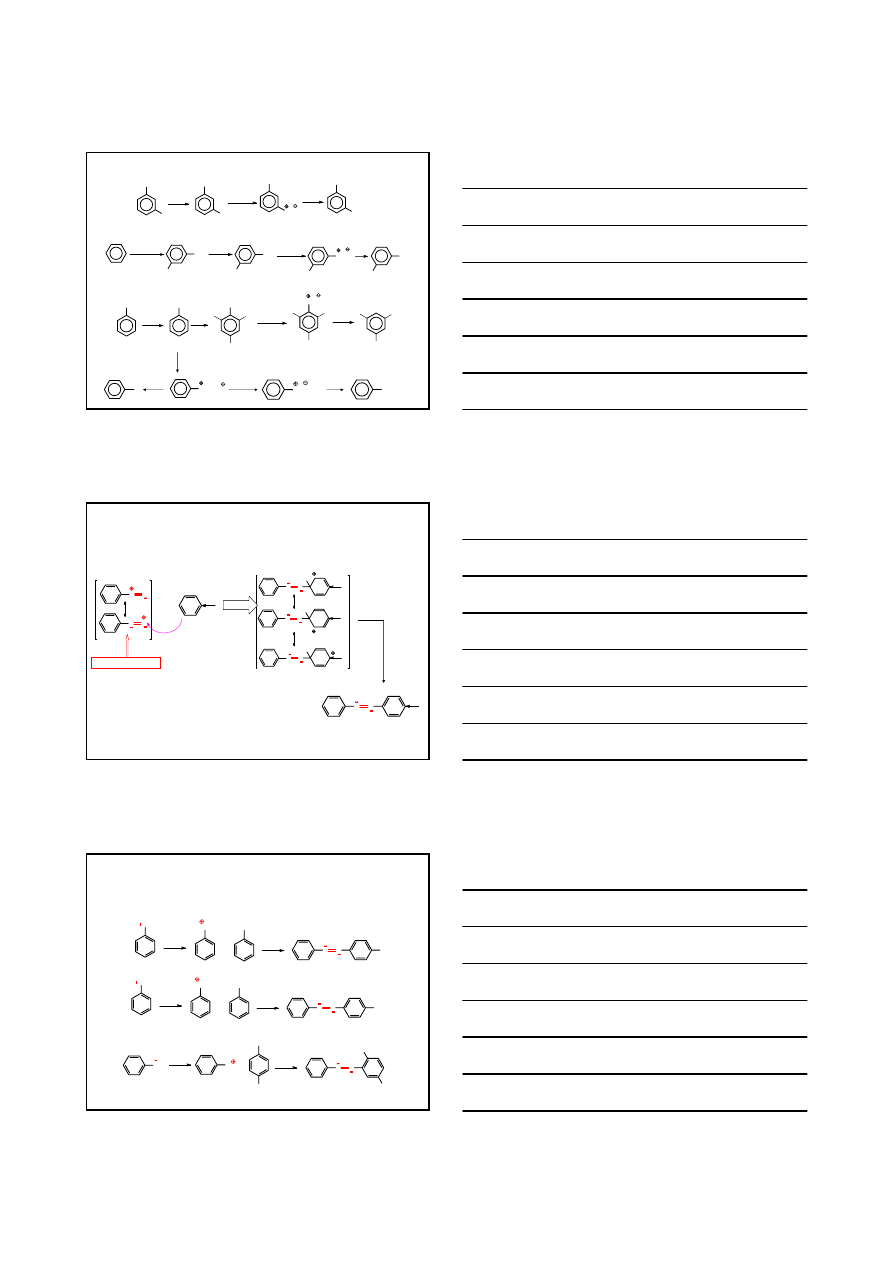
11
REAKCJE SOLI DIAZONIOWYCH
REAKCJE Z WYDZIELANIEM SIĘ AZOTU – PRZYKŁADY
HNO
3
/H
2
SO
4
∆
NO
2
O
2
N
NH
3
/H
2
S
C
2
H
5
OH
NH
2
O
2
N
NaNO
2
/HCl
H
2
O, 0-5°C
N
2
Cl
O
2
N
∆
OH
O
2
N
Br
NO
2
1. Sn/HCl
2. OH
-
Br
NH
2
NaNO
2
/HCl
H
2
O, 0-5°C
Br
N
2
Cl
∆
CuCl
Br
Cl
m
-
bromo
chloro
benzen
m
-
bromo
nitro
benzen
m
-dinitrobenzen
m
-nitrofenol
NO
2
1. Sn/HCl
2. OH
-
NH
2
NaNO
2
/HCl
H
2
O, 0-5°C
∆
H
3
PO
2
Br
2
NH
2
Br
Br
Br
N
2
Cl
Br
Br
Br
Br
Br
Br
anilina
1,3,5-tri
bromo
benzen
NaNO
2
/H
2
SO
4
N
2
HSO
4
KI,
∆
I
jodo
benzen
fluoro
benzen
∆
F
HBF
4
N
2
BF
4
REAKCJE SOLI DIAZONIOWYCH
REAKCJE
BEZ
WYDZIELANIA AZOTU, tzw. SPRZĘGANIA
N
N
N
N
SŁABY ELEKTROFIL
G
–NH
2
, –NHR, –NR
2
–OH
G:
N
N
H
G
N
N
H
G
N
N
H
G
S
Earom
G
N
N
– H
+
ZWIĄZEK AZOWY
REAKCJE SOLI DIAZONIOWYCH
REAKCJE
BEZ
WYDZIELANIA AZOTU, tzw. SPRZĘGANIA – PRZYKŁADY
N
2
NH
2
NaNO
2
/HCl
0-5°C
+
OH
CH
3
0°C
NaOH/H
2
O
N
N
HO
CH
3
p
-krezol
4-metylo-2-(fenyloazo)fenol
N
2
NH
2
NaNO
2
/HCl
0-5°C
+
OH
0°C
NaOH/H
2
O
OH
N
N
p
-(fenyloazo)fenol
(oranż)
N
2
NH
2
NaNO
2
/HCl
0-5°C
+
N(CH
3
)
2
0°C
CH
3
COO
-
/H
2
O
N(CH
3
)
2
N
N
N,N-
dimetylo-p-(fenyloazo)anilina
(żółta, tzw. żółcień masłowa)
N,N-
dimetyloanilina
chlorek benzenodiazoniowy
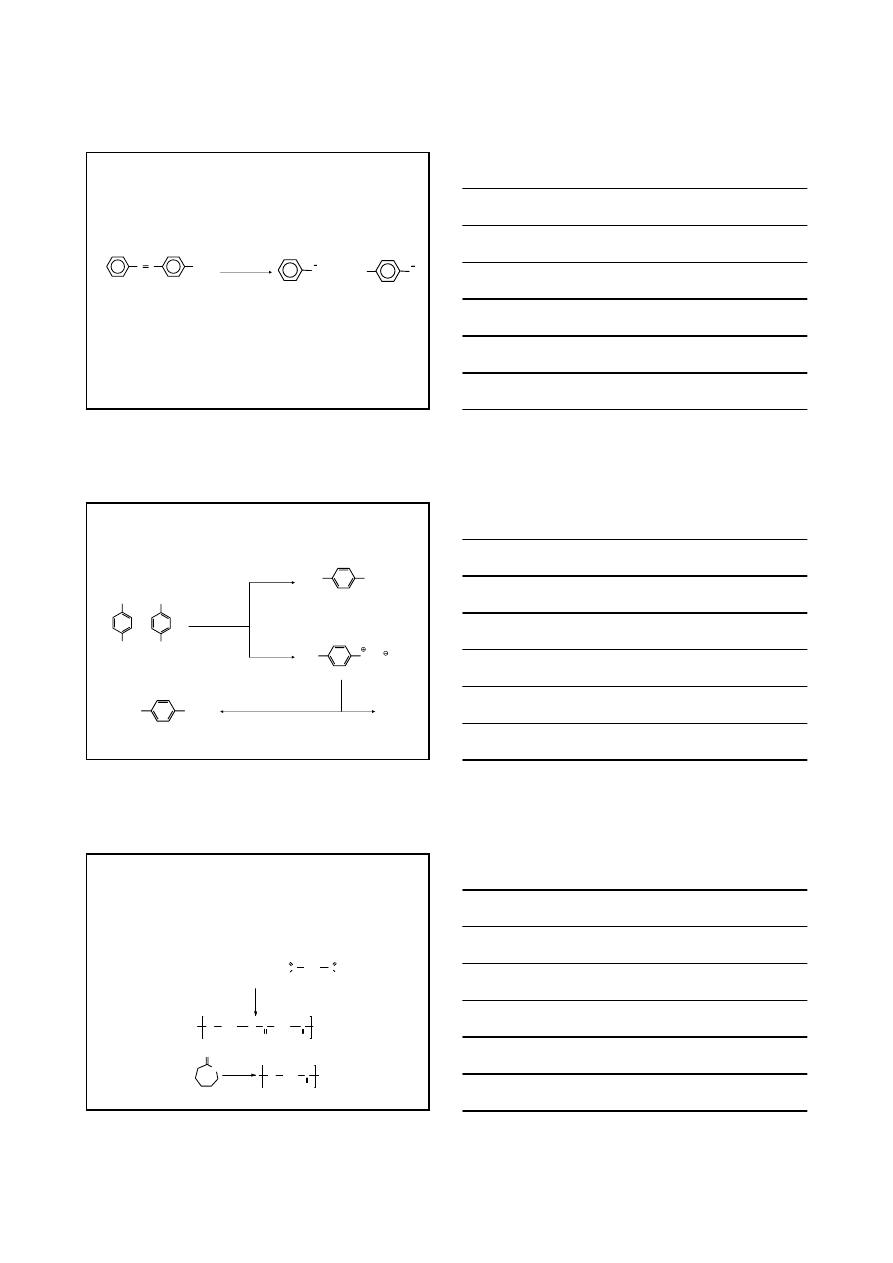
12
REAKCJE REDUKCJI ZWIĄZKÓW AZOWYCH
SnCl
2
NH
2
NH
2
H
2
N
+
N N
NH
2
ROZDZIELANIE MIESZANIN ZWIĄZKÓW NITROWYCH I AMIN
NH
2
CH
3
NO
2
CH
3
+
1.
HCl/H
2
O
2.
eter etylowy
WARSTWA ETEROWA
WARSTWA WODNA
NO
2
CH
3
NH
3
Cl
CH
3
NH
2
CH
3
1.
NaOH/H
2
O
2.
eter etylowy
WARSTWA ETEROWA
WARSTWA WODNA
NaCl
POLIAMINY
DIAMINY, KTÓRE ZNALAZŁY ZASTOSOWANIE W PRZEMYŚLE
O
C
HO
(CH
2
)
4
C
O
OH
+
H
2
NCH
2
(CH
2
)
4
CH
2
NH
2
200-300°C
-nH
2
O
NH
(CH
2
)
6
NH
C
O
(CH
2
)
4
C
O
n
1,6-diaminoheksan
(heksametylenodiamina)
kwas adypinowy
nylon-6,6 (n = 50 – 100)
NH
(CH
2
)
5
O
C
n
NH
O
250-270°C
nylon-6
ε-kaprolaktam
H
2
NCH
2
CH
2
CH
2
CH
2
NH
2
1.5-diaminopentan
(kadaweryna)
DIAMINY WYSTĘPUJĄCE W PRZYRODZIE
H
2
NCH
2
CH
2
CH
2
CH
2
CH
2
NH
2
1.4-diaminobutan
(putrescyna)
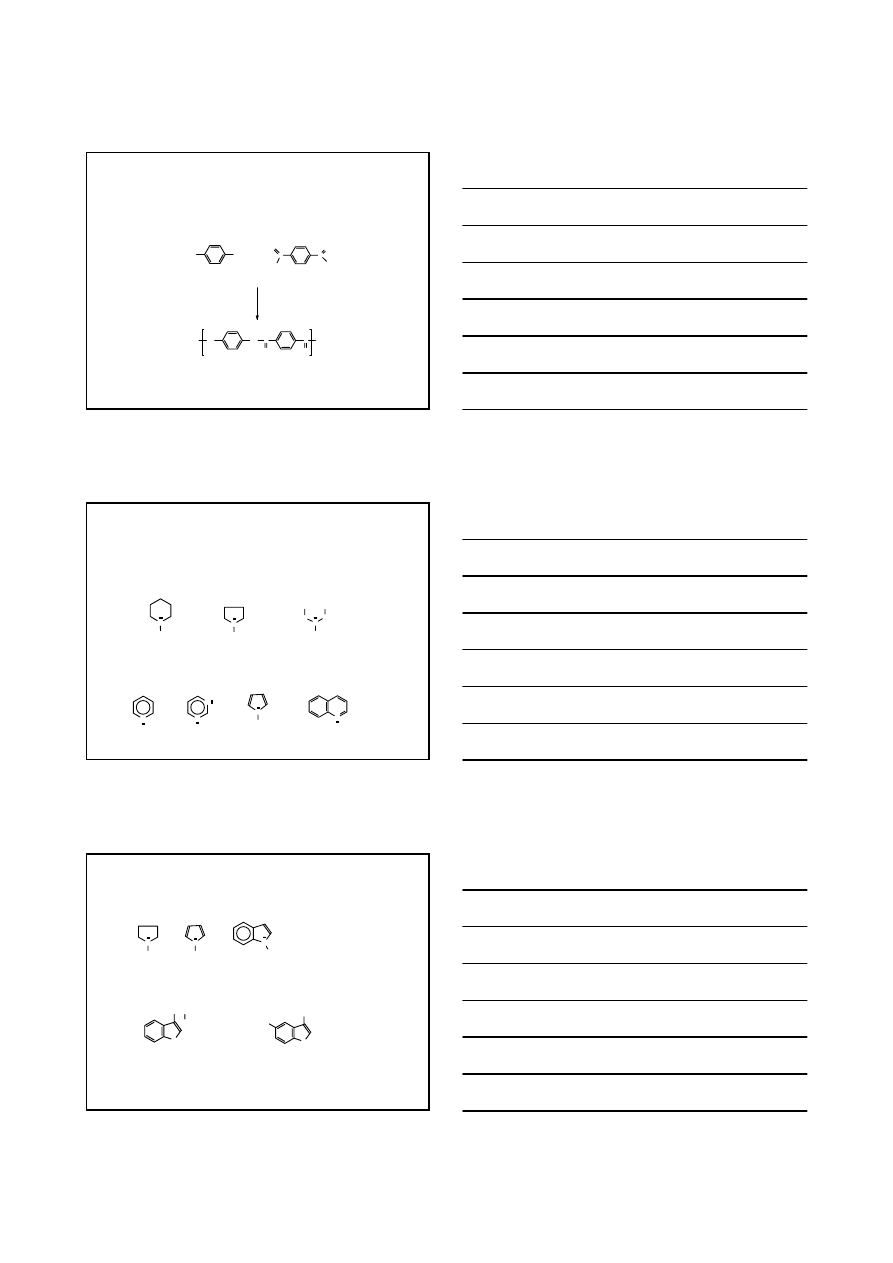
13
POLIAMINY
DIAMINY, KTÓRE ZNALAZŁY ZASTOSOWANIE W PRZEMYŚLE
H
2
N
NH
2
p
-fenylenodiamina
+
C
O
Cl
C
O
Cl
chlorek tereftaloilu
zasada
HN
NH
C
O
C
O n
kevlar – poliamid niepalny
(łodzie, propelery, itp.)
AMINY HETEROCYKLICZNE
AMINY HETEROCYKLICZNE JAKO ZASADY
zasadowość niearomatycznych amin heterocyklicznych jest porównywalna z zasadowością amin acyklicznych
N
H
N
H
CH
2
CH
3
C
C
N
H
H
3
H
2
piperydyna
pK
b
= 2.80
pirrolidyna
pK
b
= 2.89
dietyloamina
pK
b
= 3.02
aromatyczne aminy heterocykliczne są znacznie słabszymi zasadami niż niearomatyczne aminy cykliczne
N
N
N
N
H
N
pIrydyna
pK
b
= 8.77
pirymidyna
pK
b
= 11.30
pirol
pK
b
= 13.60
chinolina
pK
b
= 9.50
AMINY HETEROCYKLICZNE
PIĘCIOCZŁONOWY PIERŚCIEŃ Z JEDNYM ATOMEM AZOTU
N
H
N
H
N
H
pirrolidyna
t
w
= 89°C
pirol
t
w
= 131°C
indol
t
w
= 235°C
t
t
= 52°C
N
H
CH
2
CHCO
2
H
NH
2
N
H
CH
2
CH
2
NH
2
HO
tryptofan
serotonina
(neurotransmiter)
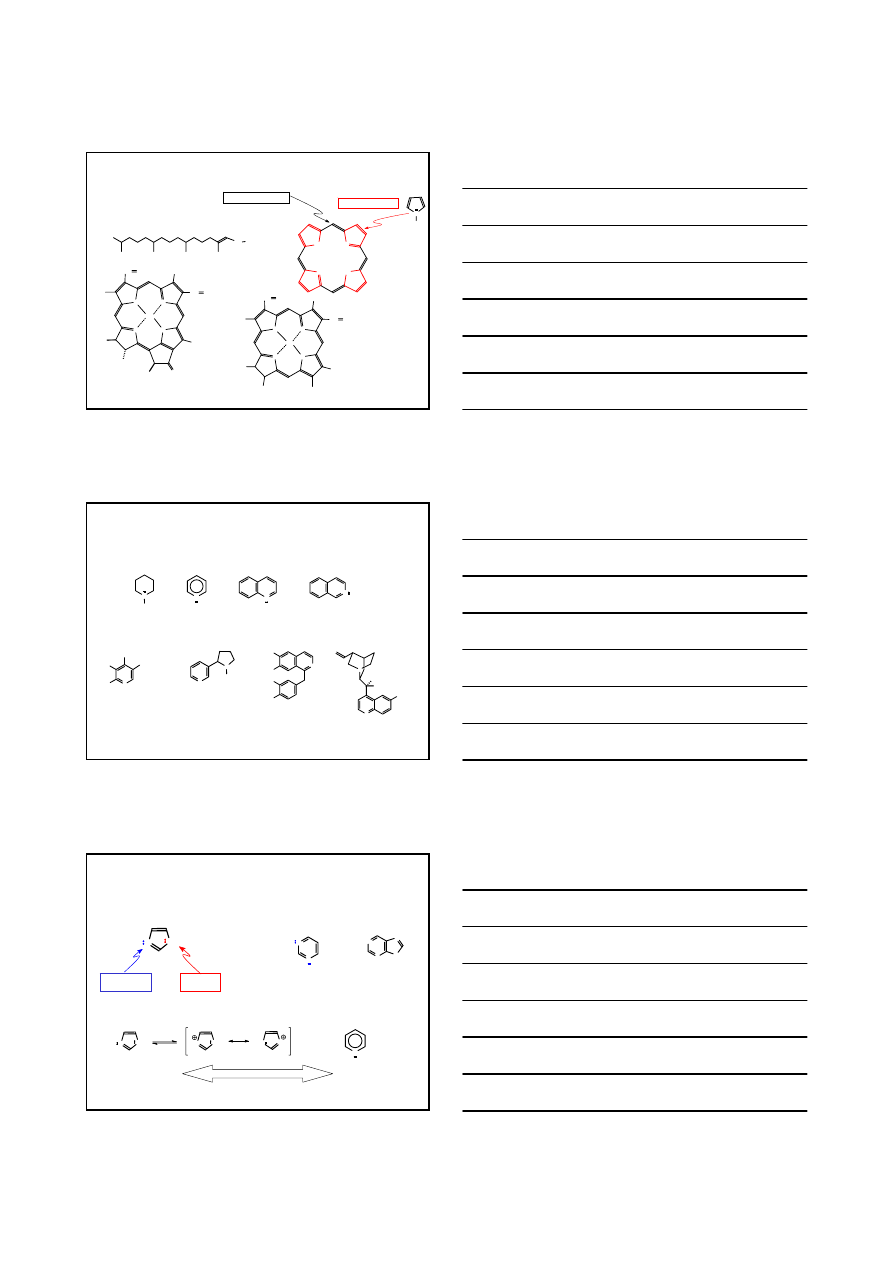
14
AMINY HETEROCYKLICZNE
PIĘCIOCZŁONOWY PIERŚCIEŃ Z JEDNYM ATOMEM AZOTU
N
HN
NH
N
N
H
pierścień pirolowy
PORFIRYNA
(czerwone kryształy)
mostek metylenowy
N
N
N
N
CH
H
3
C
CH
2
H
3
C
CH
2
CH
2
CO
2
H
CH
2
CH
2
CO
2
H
CH
3
CH
CH
3
CH
2
Fe
N
N
N
N
CH
H
3
C
CH
2
H
3
C
RO
2
CCH
2
CH
2
CH
3
CH
CH
3
CH
2
Mg
O
CH
3
O
2
C
chlorofil
α – kompleks o barwie
zielonej
hemoglobina – kompleks
o barwie brązowej
CH
2
R =
AMINY HETEROCYKLICZNE
SZEŚCIOCZŁONOWY PIERŚCIEŃ Z JEDNYM ATOMEM AZOTU
N
H
N
N
N
piperydyna
t
w
= 106°C
pIrydyna
t
w
= 115°C
chinolina
t
w
= 237°C
Izochinolina
t
w
= 243°C
t
t
= 26.5°C
N
HO
H
3
C
CH
2
OH
R
N
N
CH
3
N
H
3
CO
H
3
CO
H
3
CO
H
3
CO
N
N
OH
H
OCH
3
–CH
2
OH pirydoksyna
– CHO pirydoksal
–CH
2
NH
2
pirydoksyamina
R:
nikotyna
papaweryna
(lek przeciw skurczowy)
chinina
(lek przeciw malaryczny)
AMINY HETEROCYKLICZNE
PIERŚCIENIE Z DWOMA ATOMAMI AZOTU
N
NH
N
N
N
N
N
N
H
atom azotu typu
pirydynowego
atom azotu
pirolowego
imidazol
t
w
= 263°C
t
t
= 91°C
pirymidyna
t
w
= 124°C
t
t
= 22°C
puryna
t
t
= 217°C
N
pIrydyna
K
b
= 2.3
×10
-9
N
NH
+
H
+
H
N
NH
H
N
NH
K
b
= 1.2
×10
-7
100
× SILNIEJSZA ZASADA NIŻ PIRYDYNA
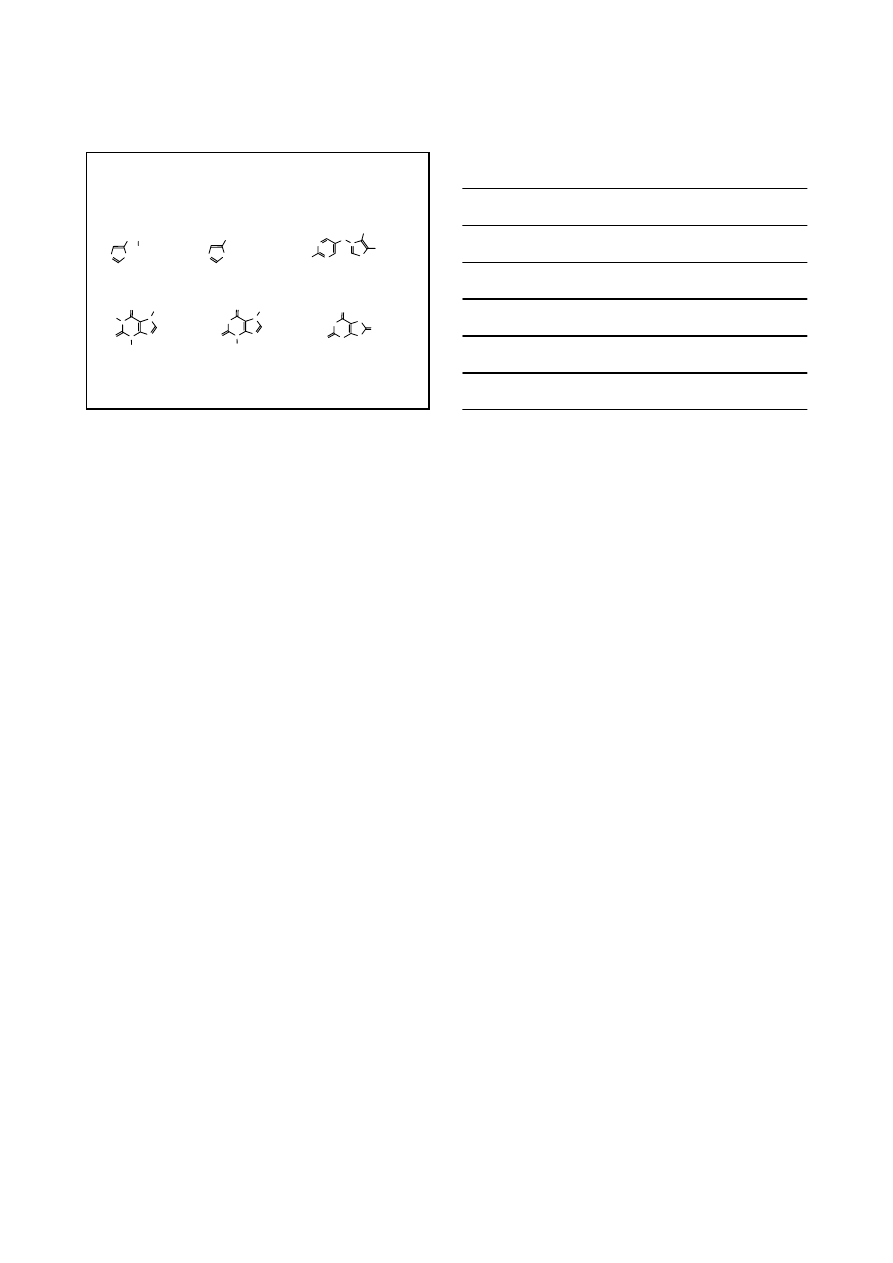
15
AMINY HETEROCYKLICZNE
PIERŚCIENIE Z DWOMA ATOMAMI AZOTU
WYSTĘPOWANIE W PRZYRODZIE
N
NH
CH
2
CHCO
2
H
NH
2
N
NH
CH
2
CH
2
NH
2
histydyna
histamina
+
N
N
C
H
2
N
S
CH
3
CH
2
CH
2
OH
H
3
C
tiamina (witamina B
1
)
N
N
N
N
O
O
CH
3
H
3
C
CH
3
kofeina
HN
N
N
N
O
O
CH
3
CH
3
teobromina
HN
N
H
H
N
N
H
O
O
O
kwas uracylowy
Wyszukiwarka
Podobne podstrony:
Chemia organiczna podstawy wykład1
Chemia organiczna podstawy wykład5
Chemia organiczna podstawy wykład6
Chemia organiczna podstawy wykład9
Chemia organiczna podstawy wykład4
Chemia organiczna podstawy wykład8
Chemia organiczna podstawy wykład7
Chemia organiczna podstawy wykład12
Chemia organiczna podstawy wykład3
Chemia organiczna podstawy wykład10
Chemia organiczna podstawy wykład11
więcej podobnych podstron