
Chemia Ogólna i Nieorganiczna
Analiza jakościowa – analiza kationów, anionów
i soli farmakopealnych

Analiza roztworu
Wprowadzenie odczynników:
wytrącenie osadów
rozpuszczenie osadów
zmianę barwy roztworu
wydzielenie gazu
pęcherzyki gazu widoczne w cieczy reakcyjnej
wyczuwalny zapach gazu, np. amoniaku,
wyczuwalny zapach substancji lotnej, np. kwasu octowego
Wysoka czułość w wykrywaniu rozpuszczonych
jonów.
Miara czułości – najmniejsze stężenie jonu, poniżej którego efekt
reakcji nie jest zauważalny
Analiza jakościowa:
analiza kationów
analiza anionów

Analiza jakościowa w skali „półmikro” – odczynniki,
reakcje
Reakcje, odczynniki grupowe – pozwalają na wytrącenie
określonej grupy jonów (w pewnych określonych
warunkach) i rozdzielenie jonów znajdujących się
w roztworze, na grupy analityczne;
Reakcje, odczynniki charakterystyczne – pozwalają na
rozdział jonów w obrębie danej grupy (systematyczny
bieg analizy);
Reakcje, odczynniki specyficzne – pozwalają na wykrycie
danego jonu w obecności innych;
Reakcje, odczynniki selektywne – pozwalają na wykrycie
pewnej ograniczonej grupy jonów;
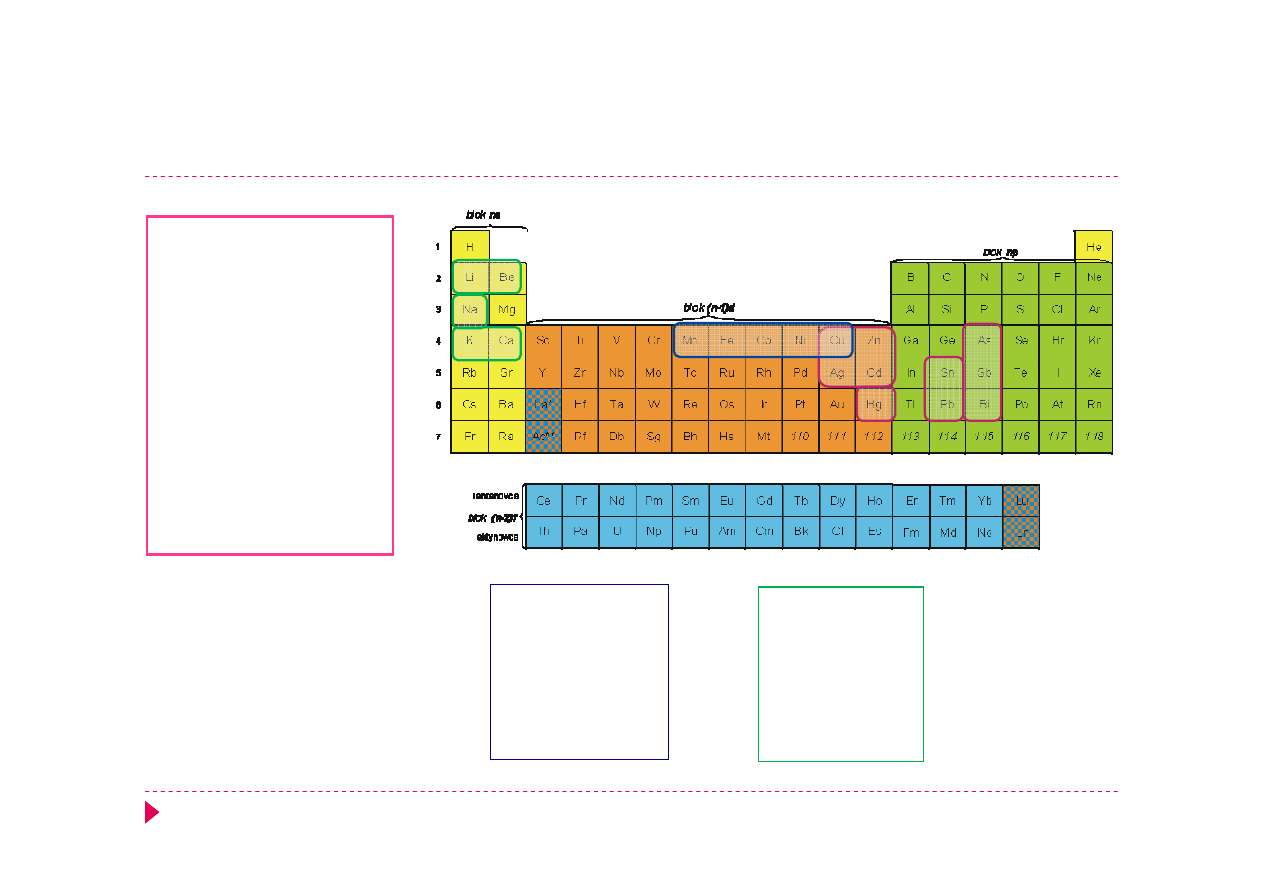
Właściwości pierwiastków – grupy analityczne
Cu
+
2, 8,18
Ag
+
2, 8,18,18
Zn
2+
2, 8,18
As
3+
2, 8,18,2
Sb
3+
2, 8,18,18,2
Bi
3+
2, 8,18,32,18,2
Cd
2+
2, 8,18,18
Hg
2+
2, 8,18,32,18
Sn
2+
2, 8,18,18,2
Pb
2+
2, 8,18,32,18,2
Mn
2+
2, 8,13
Fe
2+
2, 8,14
Co
2+
2, 8,15
Ni
2+
2, 8,16
Cu
2+
2, 8,17
Li
+
2
Be
2+
2
Na
+
2, 8
K
+
2, 8,8
Ca
2+
2, 8,8
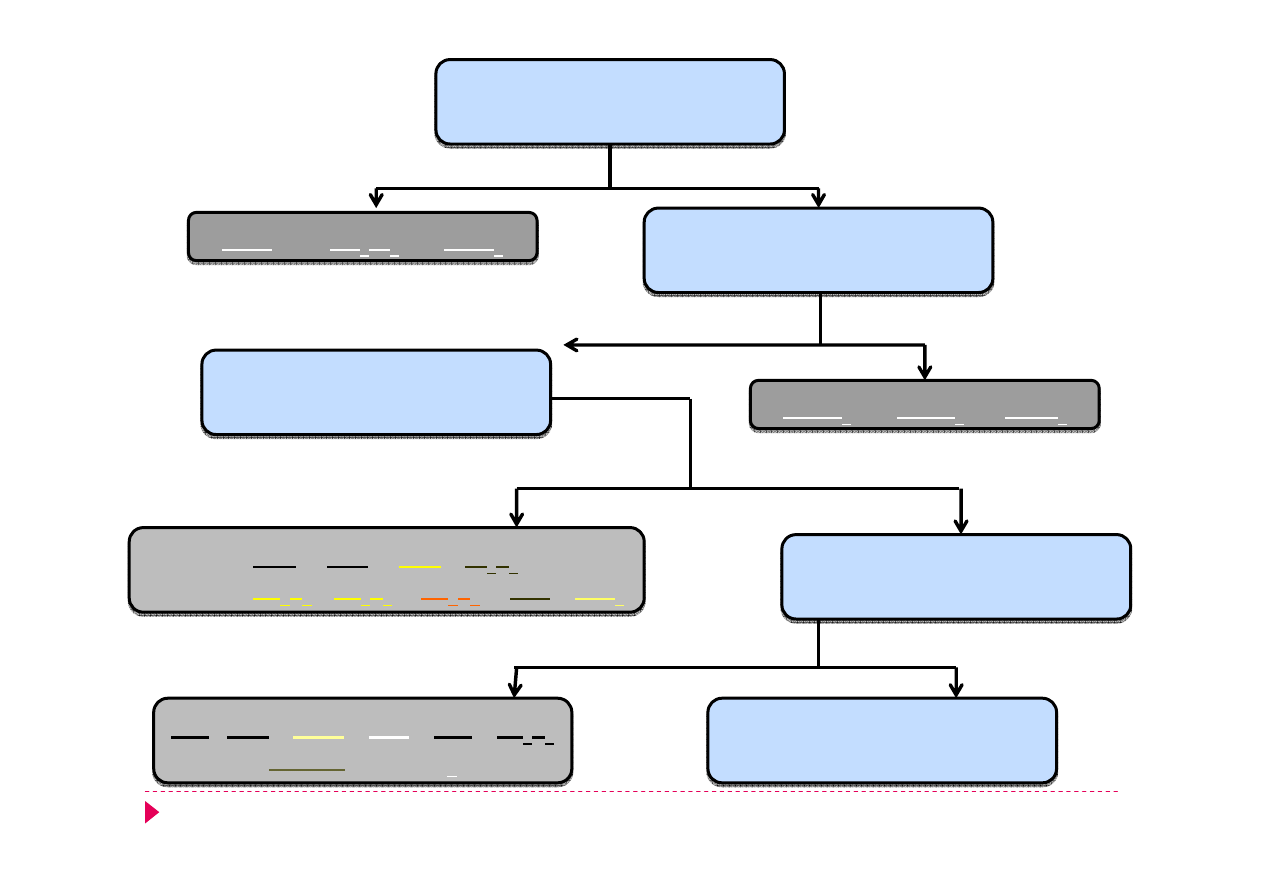
roztwór zawierający
nieznane kationy grup I - V
roztwór zawierający
nieznane kationy grup I - V
AgCl
Hg
2
Cl
2
PbCl
2
AgCl
Hg
2
Cl
2
PbCl
2
roztwór zawierający
kationy grup II - V
roztwór zawierający
kationy grup II - V
BaSO
4
CaSO
4
SrSO
4
BaSO
4
CaSO
4
SrSO
4
roztwór zawierający
kationy grup III - V
roztwór zawierający
kationy grup III - V
III A:
HgS
CuS
CdS
Bi
2
S
3
III B:
As
2
S
3
As
2
S
5
Sb
2
S
3
SnS
SnS
2
III A:
HgS
CuS
CdS
Bi
2
S
3
III B:
As
2
S
3
As
2
S
5
Sb
2
S
3
SnS
SnS
2
roztwór zawierający
kationy grup IV - V
roztwór zawierający
kationy grup IV - V
roztwór zawierający
kationy grup V
roztwór zawierający
kationy grup V
NiS CoS
MnS
ZnS
FeS
Fe
2
S
3
Cr(OH)
3
Al(OH)
3
NiS CoS
MnS
ZnS
FeS
Fe
2
S
3
Cr(OH)
3
Al(OH)
3
+
HCl
(3 mol/l)
+
H
2
SO
4
(1,5 mol/l)
+
HH
4
Cl
+
NH
3
(aq)
+
AKT
ΔT
ΔT
+
H
2
SO
4
(1 mol/l)
+
AKT
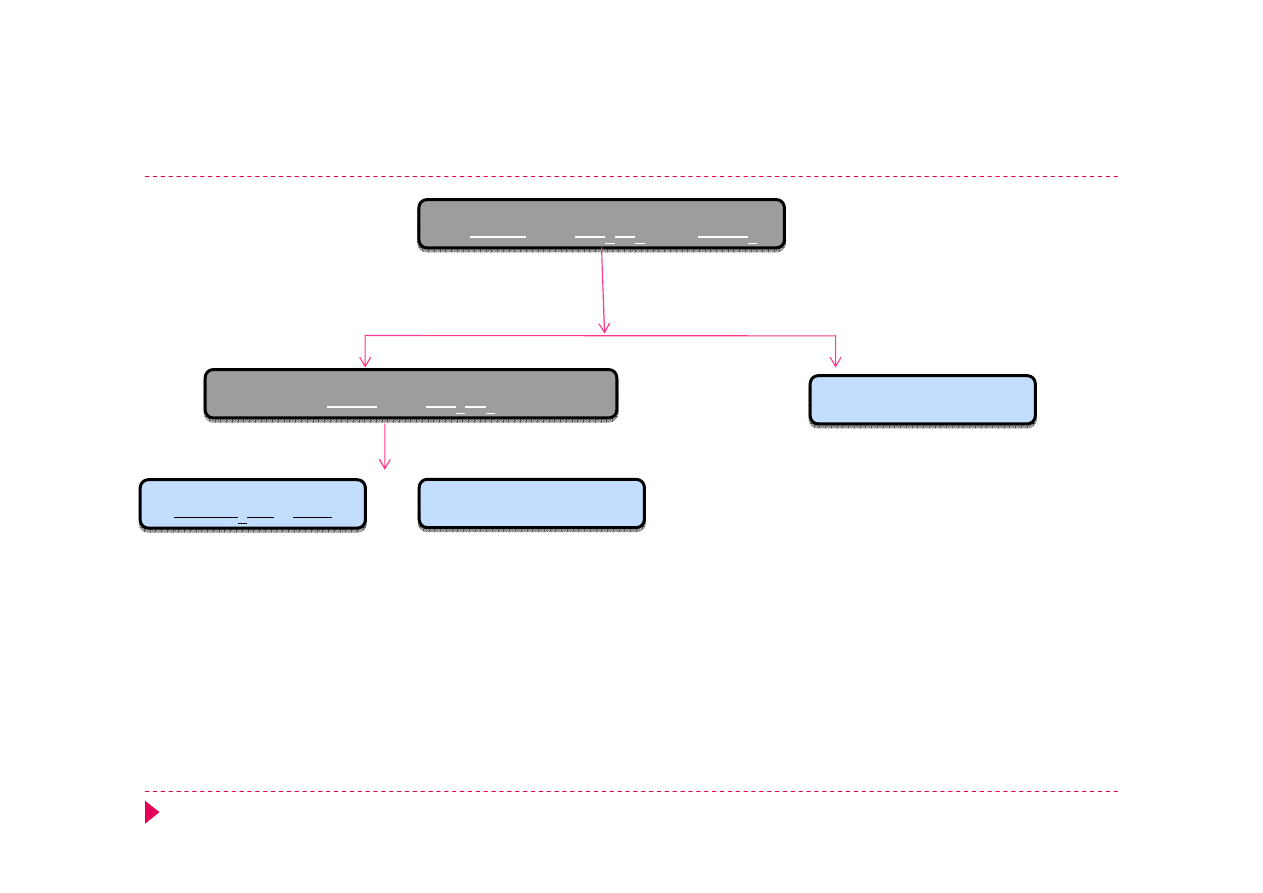
Analiza kationów, grupa I
AgCl
Hg
2
Cl
2
PbCl
2
AgCl
Hg
2
Cl
2
PbCl
2
H
2
O, ΔT
Pb
2+
2Cl
-
Pb
2+
2Cl
-
AgCl
Hg
2
Cl
2
AgCl
Hg
2
Cl
2
3 Hg
0
+ 12 Cl
-
+ 2NO
3
-
+ 8 H
+
→ 3 HgCl
4
2-
+ 6e
-
+ 2 NO
-
+ 4 H
2
O
AgCl + 2 NH
3
· H
2
O → Ag(NH
3
)
2
+
+ Cl
-
Ag(NH
3
)
2
+ Cl
-
Ag(NH
3
)
2
+ Cl
-
HgNH
2
Cl, Hg
0
HgNH
2
Cl, Hg
0
NH
3
· H
2
O stęż.
Hg
0
+ 4 Cl
-
→ HgCl
4
2-
+ 2e
-
/· 3
NO
3
-
+ 4 H
+
+ 3e
-
→ NO
-
+ 2 H
2
O /· 2
woda królewska -
mieszanina st
ęż
onych kwasów
HNO
3
(1) i
HCl
(3)
HgNH
2
Cl + 6 Cl
-
→ HgCl
4
2-
+ N
2
+ 6e
-
+ 4H
+
NO
3
-
+ 4 H
+
+ 3e
-
→ NO + 2 H
2
O /· 2
2 HgNH
2
Cl + 6 Cl
-
+ 2NO
3
-
+ 4 H
+
→ 2 HgCl
4
2-
+ N
2
+ 2 NO
-
+ 4 H
2
O
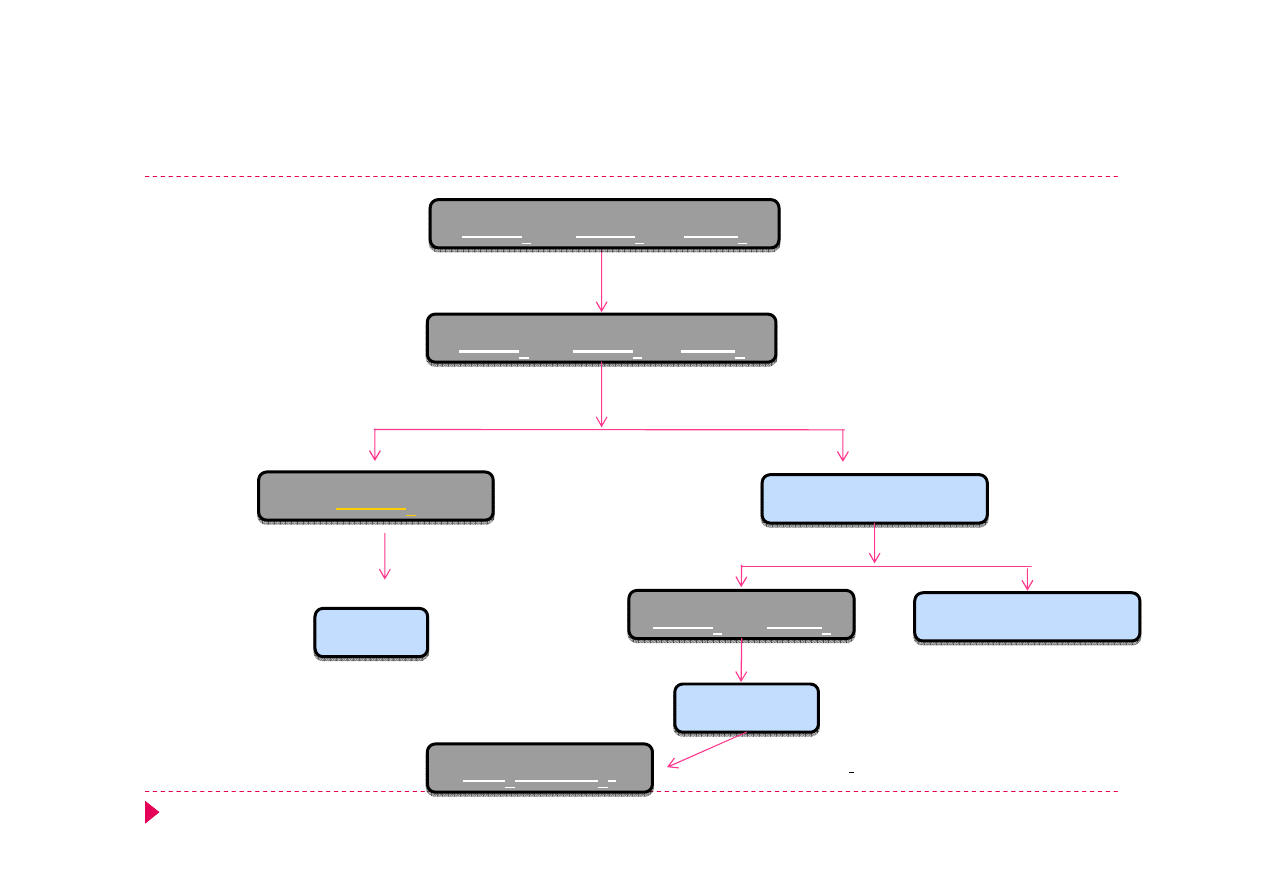
Analiza kationów, grupa II
Na
2
CO
3 stęż.
, ΔT
Ca
2+
Sr
2+
Cr
2
O
7
2-
Ca
2+
Sr
2+
Cr
2
O
7
2-
BaCrO
4
BaCrO
4
Ba
2+
Ba
2+
HCl
nierozp. w CH
3
COOH
BaSO
4
CaSO
4
SrSO
4
BaSO
4
CaSO
4
SrSO
4
BaCO
3
CaCO
3
SrCO
3
BaCO
3
CaCO
3
SrCO
3
CH
3
COOH (6M) , CrO
4
2-
CaCO
3
SrCO
3
CaCO
3
SrCO
3
CrO
4
2-
CrO
4
2-
Na
2
CO
3
CH
3
COOH (6M)
Ca
2+
Sr
2+
Ca
2+
Sr
2+
CaK
2
[Fe(CN)
6
]
CaK
2
[Fe(CN)
6
]
K
4
[Fe(CN)
6
]
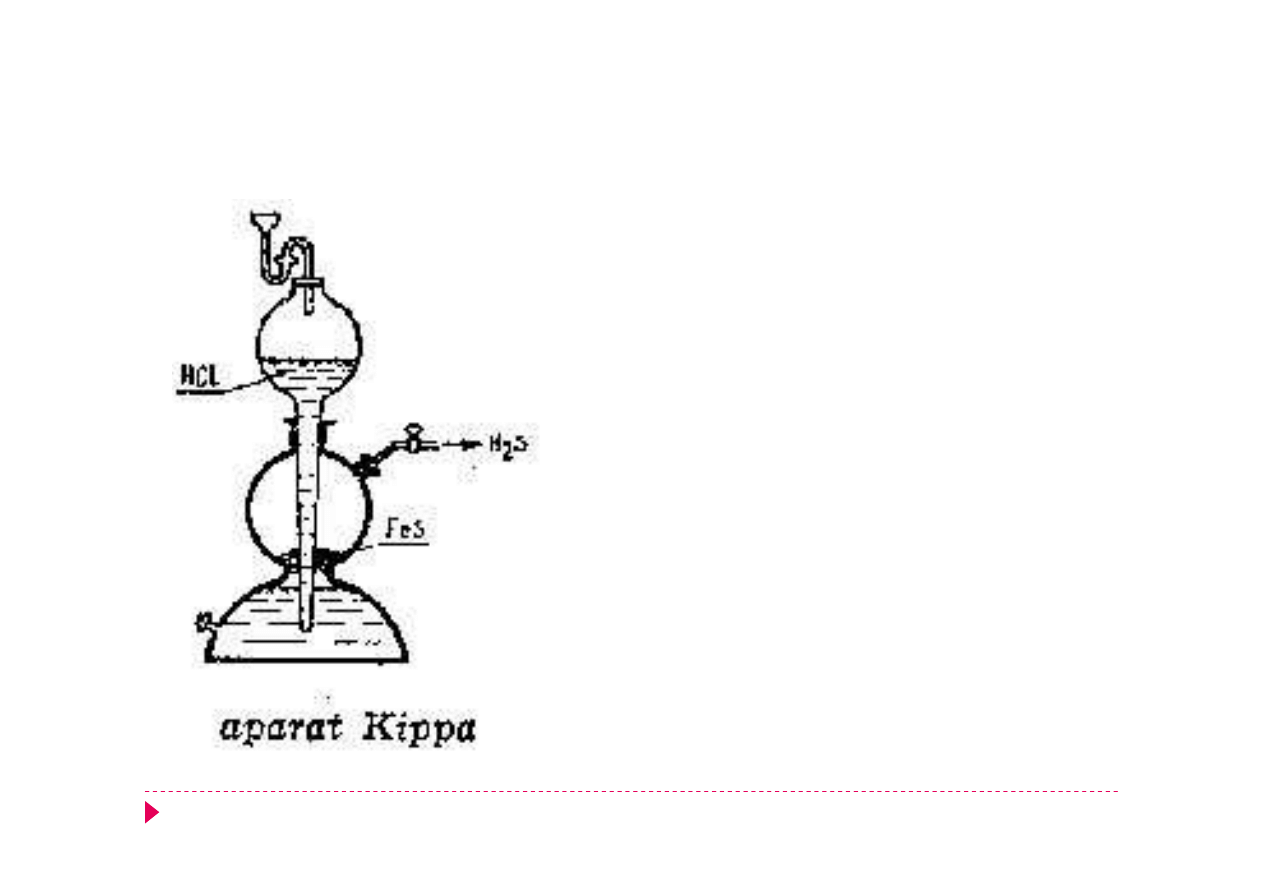
Aparat Kippa
Przyrząd szklany, służący do otrzymywania
ciągłego strumienia gazów, powstających w
czasie reakcji chemicznej.
FeS + 2HCl -> FeCl
2
+ H
2
S.
Po zamknięciu kurkiem ciśnienie gazu
wypycha kwas i reakcja zostaje przerwana.
Aparat został opracowany przez Petrusa
Jacobusa Kippa (1808 - 1864) aptekarza z
Delft.
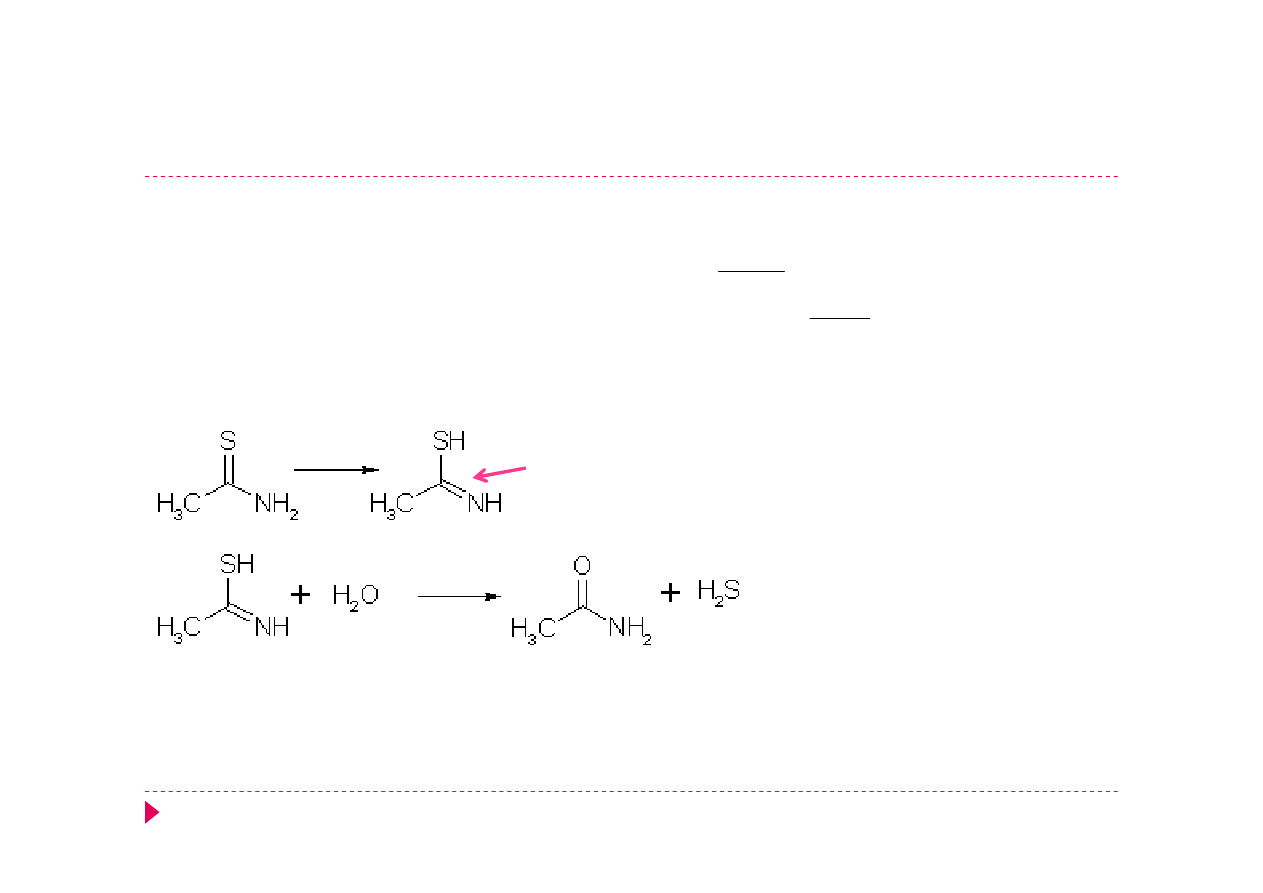
Amid kwasu tiooctowego AKT
Hydroliza:
CH
3
CSNH
2
+ 2 H
2
O → CH
3
COO
-
+ NH
4
+
H
2
S
CH
3
CSNH
2
+ 2 H
2
O + H
+
→ CH
3
COOH + NH
4
+
+
H
2
S
CH
3
CSNH
2
+ 3 OH
-
→ CH
3
COO
-
+ NH
4
+
+
OH
-
+
S
2-
H
2
S + H
2
O ⇄ H
3
O
+
+ HS
-
HS
-
+ H
2
O ⇄ H
3
O
+
+ S
2-
•
Środowisko kwasowe – hydroliza w temperaturze pokojowej.
•
Obniżenie pH roztworu i podwyższenie temperatury – szybszy
rozkład
forma tioenolowa

Wytrącanie siarczków
Siarczki gr III K
SO
od 10
-28
do 10
-72
Siarczki gr IV K
SO
od 10
-15
do 10
-27
Najbardziej rozpuszczalny siarczek gr III CdS
K
SO
= 3,6 ·10
-28
Najmniej rozpuszczalny siarczek gr IV
ZnS
K
SO
= 1,2 ·10
-27
Osad siarczku tym łatwiej ulega rozpuszczeniu im wi
ę
kszy jest jego
iloczyn rozpuszczalno
ś
ci
du
ż
e [S
2-
], [H
+
]

Kationy grupa III
Podgrupa A, tworzą tiozasady:
Hg
2+
, Bi
3+
, Cu
2+
, Cd
2+
Nierozpuszczalne w zasadach i siarczku amonu
Podgrupa B, tworzą tiokwasy:
Sn
2+
, Sn
4+
, As
3+
, As
5+
, Sb
3+
, Sb
5+
Rozpuszczalne w zasadach i siarczku amonu
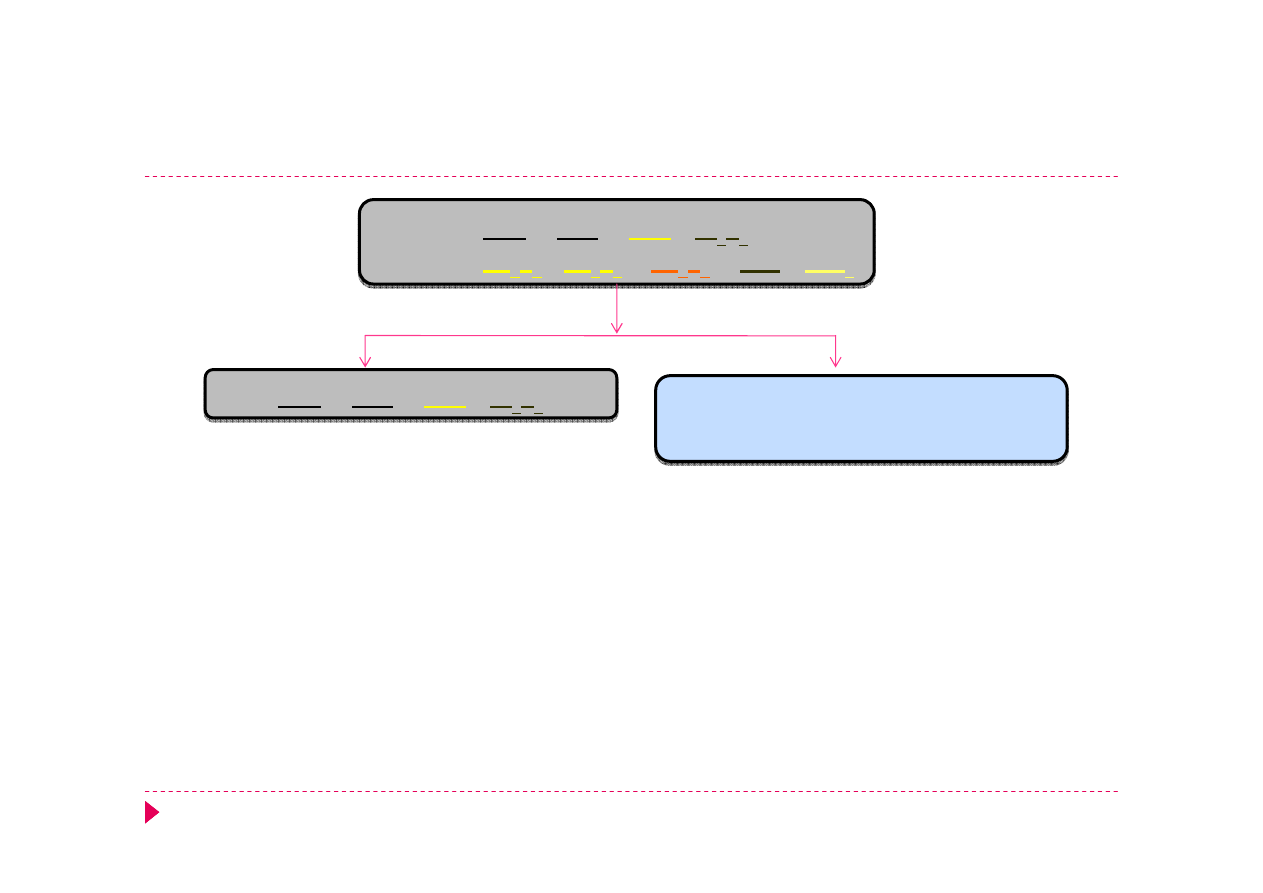
Analiza kationów grupa III
III A:
HgS
CuS
CdS
Bi
2
S
3
III B:
As
2
S
3
As
2
S
5
Sb
2
S
3
SnS
SnS
2
III A:
HgS
CuS
CdS
Bi
2
S
3
III B:
As
2
S
3
As
2
S
5
Sb
2
S
3
SnS
SnS
2
KOH, H
2
O
2
AsO
4
3-
SbS
4
3-
As
2
S
5
Sn(OH)
6
2-
SbS
2
-
SnS
3
2-
SO
4
2-
OH
-
AsO
4
3-
SbS
4
3-
As
2
S
5
Sn(OH)
6
2-
SbS
2
-
SnS
3
2-
SO
4
2-
OH
-
HgS
CuS
CdS
Bi
2
S
3
HgS
CuS
CdS
Bi
2
S
3
3 SnS + 6 OH
-
+ 3H
2
O
2
→ SnS
3
2-
+ 2SnO
3
2-
+ 6 H
2
O
3 SnS + 12OH
-
→ SnS
3
2-
+ 2SnO
3
2-
+ 6e
-
+ 6 H
2
O
H
2
O
2
+ 2e
-
→ 2OH
-
/· 3
As
2
S
3
+ 6 OH
-
→ AsS
3
3-
+ AsO
3
3-
+ 3 H
2
O
As
2
S
5
+ 6 OH
-
→ AsS
4
3-
+ AsO
3
S
3-
+ 3 H
2
O
3SnS
2
+ 6OH
-
→ Sn(OH)
6
2-
+ 2SnS
3
2-
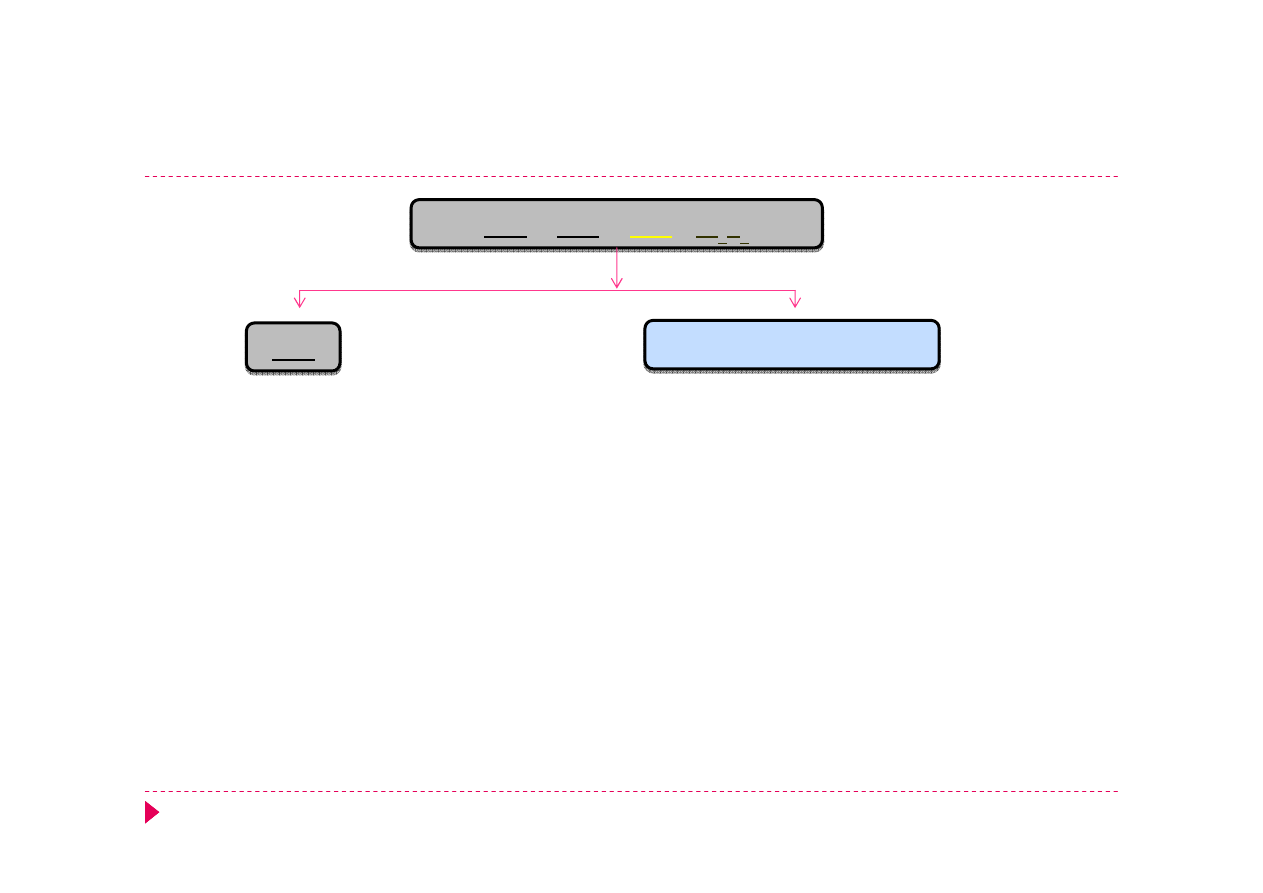
Analiza kationów grupa IIIA
HgS
CuS
CdS
Bi
2
S
3
HgS
CuS
CdS
Bi
2
S
3
HNO
3
HgS
HgS
Cu
2+
Cd
2+
Bi
2+
Cu
2+
Cd
2+
Bi
2+
3 CuS + 2 H
+
+ 2 NO
3
-
→ 3Cu
2+
+ 2NO + 4 H
2
O + 3S
0
CuS → Cu
2+
+ S
0
+ 2e
-
/·3
NO
3
–
+ 2 H
+
+ 3e
-
→ NO + 2 H
2
O/ ·
2
HCl + HNO
3
(6 mol/l)
3 HgS + 2NO
3
-
+ 8H
+
+ 12Cl
-
→ 3HgCl
4
2-
+ 3S
0
+ 2NO + 4 H
2
O
HgS + 4Cl
-
→ HgCl
4
2-
+ S
0
+ 2e
-
/
·
3
NO
3
-
+ 4H
+
+ 3e
-
→ NO + 2 H
2
O
/
·
2
2HgCl
4
2-
+ SnCl
4
2 -
→ + Hg
2
Cl
2
+ SnCl
6
2-
+ 4Cl
-
+ 2NO + 4 H
2
O
2HgCl
4
2-
+ 2e
-
→ + Hg
2
Cl
2
+ 6Cl
-
SnCl
4
2 - +
2Cl
-
→ + SnCl
6
2-
+ 2e
-
Hg
2
Cl
2
+ SnCl
4
2-
→ Hg
0
+ SnCl
6
2-
Hg
2
Cl
2
+ 2e
-
→ 2Hg
0
+ 2Cl
-
SnCl
4
2-
+ Cl
-
→ SnCl
6
2-
+ 2e
-
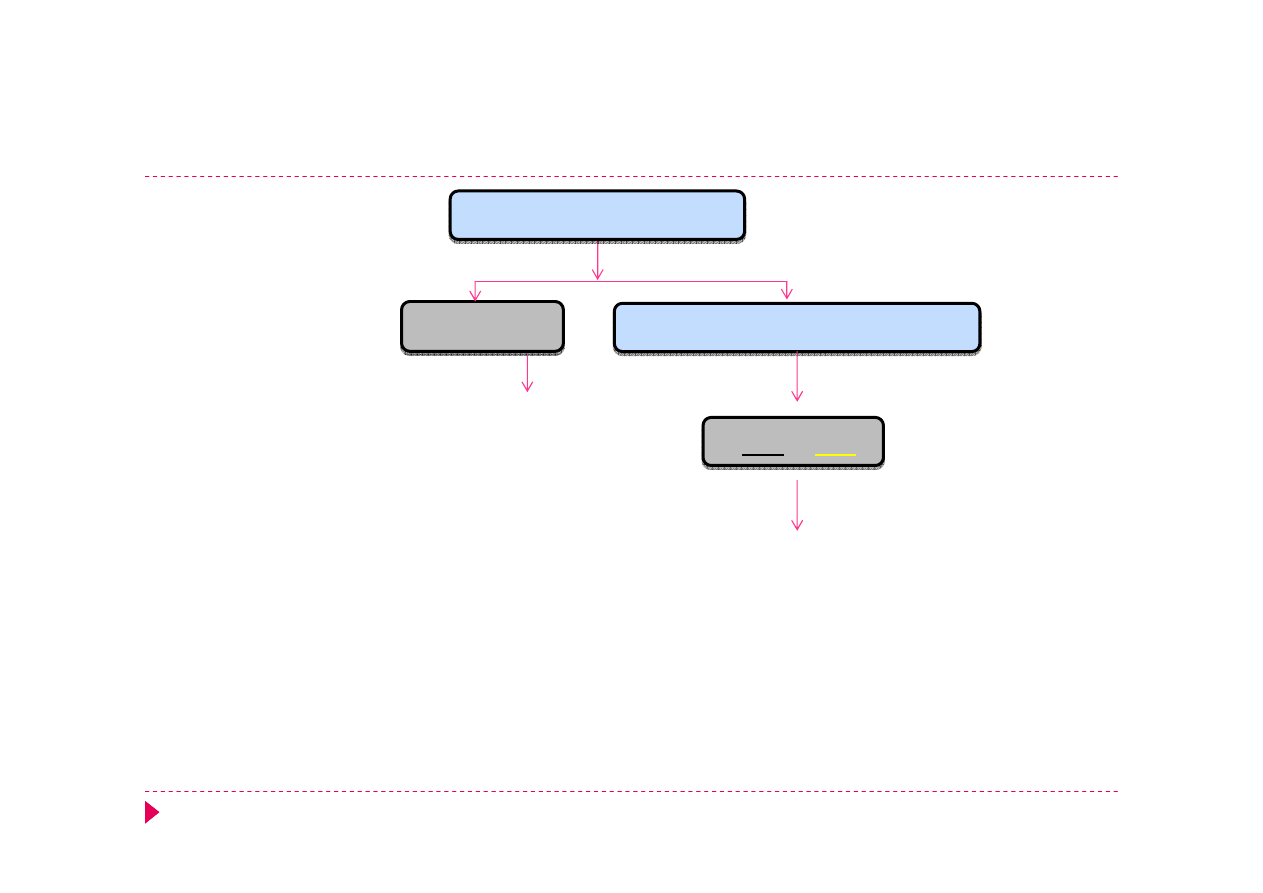
Analiza kationów – grupa IIIA
Cu
2+
Cd
2+
Bi
2+
Cu
2+
Cd
2+
Bi
2+
NH
3
· H
2
O
Cu(NH
3
)
4
2+
Cd(NH
3
)
4
2+
Cu(NH
3
)
4
2+
Cd(NH
3
)
4
2+
Bi(OH)
3
Bi(OH)
3
Bi
3+
+ 3 NH
3
· H
2
O ⇄ Bi(OH)
3
+ 3NH
4
+
Bi
3+
+ 3OH
-
→ Bi(OH)
3
NH
3
+ H
2
O ⇄ NH
4
+
+ OH
-
2Cu
2+
+ 2 NH
3
· H
2
O + SO
4
2-
→ [Cu(OH)
2
]SO
4
+ 2NH
4
+
[Cu(OH)
2
]SO
4
+ 8 NH
3
· H
2
O → 2Cu(NH
3
)
4
2+
+ 2OH
-
+ SO
4
2-
AKT
CuS
CdS
CuS
CdS
6M HCl
CdS + 2H
+
+ 4 Cl
-
⇄ CdCl
4
2-
+ H
2
S
2Bi(OH)
3
+ 3Sn(OH)
3
-
+ 3OH
-
→ 2Bi
0
+ 3
Sn(OH)
6
2-
Bi(OH)
3
+ 3e
-
→ Bi
0
+
3OH
-
/
·
2
Sn(OH)
3
-
+ 3OH
-
→ 3
Sn(OH)
6
2-
+ 2e
-
/
·
3
SnCl
2
+ 2OH
-
→
Sn(OH)
2
+ 2Cl
-
Sn(OH)
2
+ OH
-
⇄
Sn(OH)
3
-
SnCl
2
, NaOH
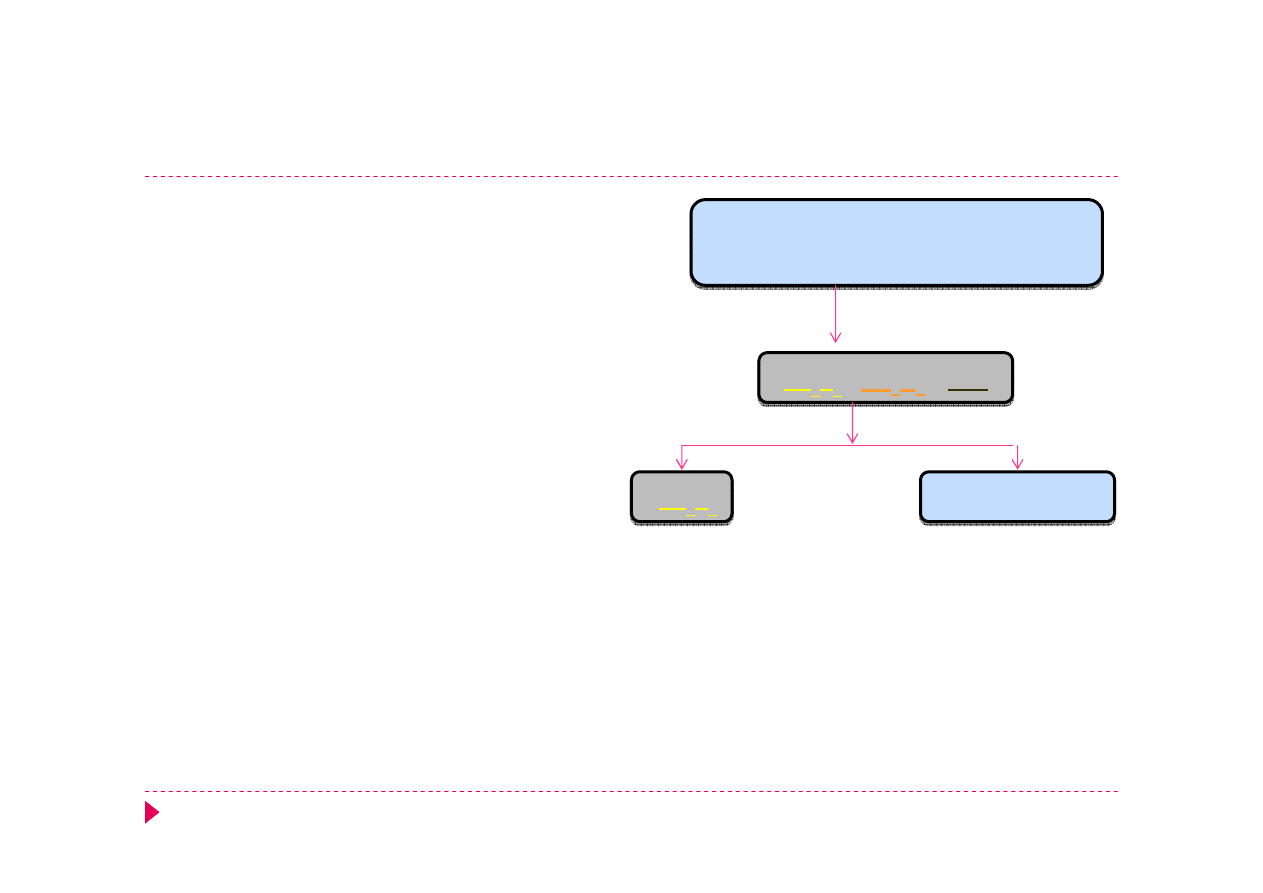
Analiza kationów – grupa IIIB
Reakcja maskowania
Cu(NH
3
)
4
2+
+ CN
-
→ Cu(CN)
4
3-
+ (CN)
2
+ NH
3
Cu(NH
3
)
4
2+
+ e
-
→ Cu(CN)
4
3-
+ 4NH
3
2CN
-
→ (CN)
2
+ 2e
-
AsO
4
3-
SbS
4
3-
As
2
S
5
Sn(OH)
6
2-
SbS
2
-
SnS
3
2-
SO
4
2-
OH
-
AsO
4
3-
SbS
4
3-
As
2
S
5
Sn(OH)
6
2-
SbS
2
-
SnS
3
2-
SO
4
2-
OH
-
ΔT HCl + AKT
As
2
S
3
Sb
2
S
3
SnS
As
2
S
3
Sb
2
S
3
SnS
As
2
S
3
As
2
S
3
HCl
[SnCl
6
]
2-
Sb
3+
[SnCl
6
]
2-
Sb
3+
As
2
S
3
+ 12 OH
-
+ 14H
2
O
2
→ 2AsO
4
3-
+ 3SO
4
2-
+ 20 H
2
O
H
2
O
2
+ 2e
-
→ 2OH
-
/·14
As
2
S
3
+ 40 OH
-
→ 2AsO
4
3-
+ 3SO
4
2-
+ 20 H
2
O + 28e
-
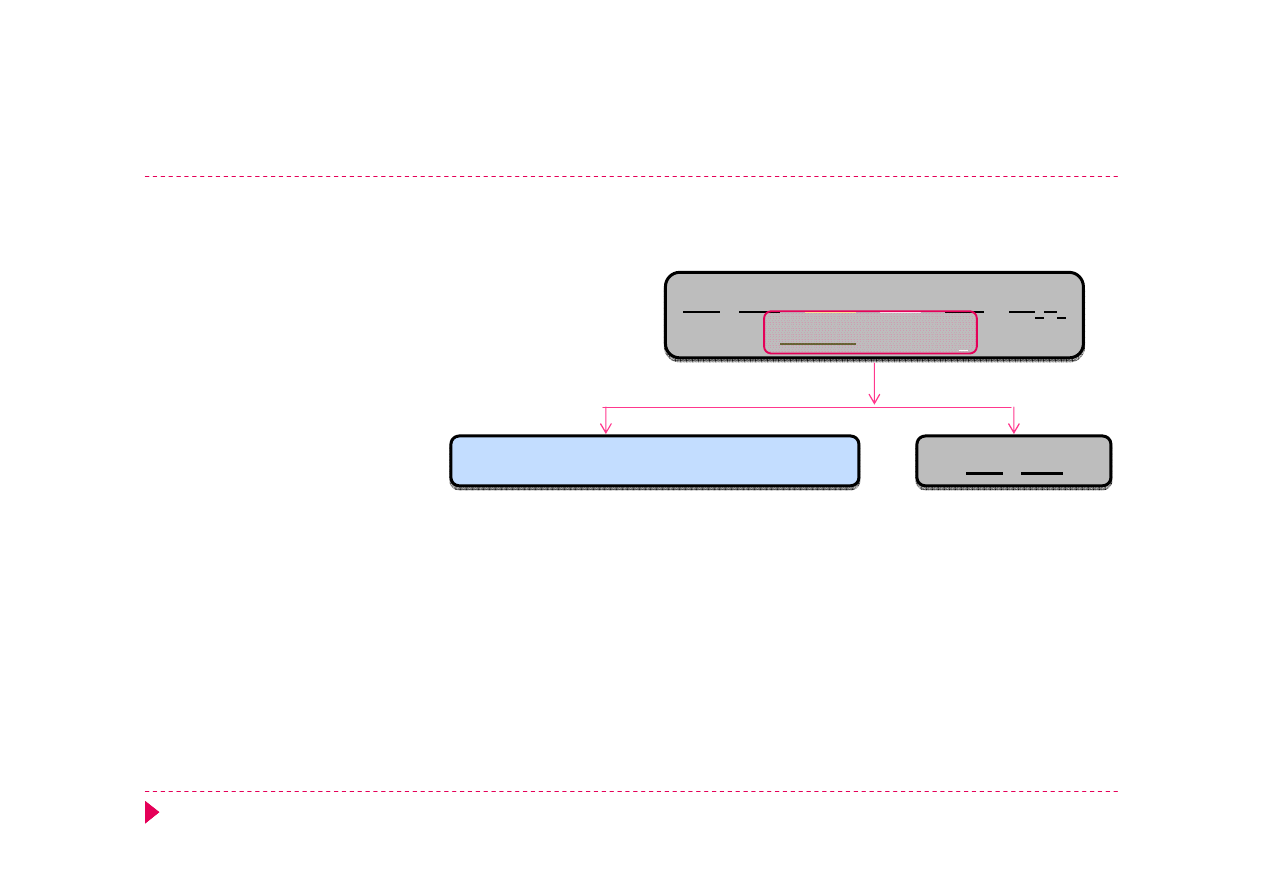
Analiza kationów – grupa IV
CH
3
CSNH
2
+ 3 OH
-
+ H
2
O
→
CH
3
COO
-
+ NH
3
·
H
2
O
+
HS
-
NiS CoS
MnS
ZnS
FeS
Fe
2
S
3
Cr(OH)
3
Al(OH)
3
NiS CoS
MnS
ZnS
FeS
Fe
2
S
3
Cr(OH)
3
Al(OH)
3
2Al
3+
+ 3S
2-
+ 6H
2
O → 2
Al(OH)
3
+ 3H
2
S
S
2-
+ H
2
O → HS
-
+ OH
-
HS
-
+ H
2
O → H
2
S
+ OH
-
S
2-
+ 2H
2
O → H
2
S
+ 2OH
-
/
·
3
HCl
NiS CoS
NiS CoS
Mn
2+
Zn
2+
Fe
2+
Fe
3+-
Cr
3+-
Al
3+
Mn
2+
Zn
2+
Fe
2+
Fe
3+-
Cr
3+-
Al
3+
HCl (6 mol/l), H
2
O
2
3 NiS + H
2
O
2
+ 6 H
+
→ Ni
2+
+ S
0
+ 2 H
2
O
3 NiS → Ni
2+
+ S
0
+ 2e
-
H
2
O
2
+ 2 H
+
+ 2e
-
→ 2 H
2
O
Ni
2+
+
dmgH
2
+
NH
3·
aq
Co
2+
+
SCN
-
+ alkohol amylowy
Co(
SCN)
4
2-
Fe(
SCN)
6
3-
Reakcja maskowania
Fe(
SCN)
6
3-
+ 6F
-
→
FeF
6
3-
+ 6SCN
-
CH
3
CSNH
2
+ 3 OH
-
→
CH
3
COO
-
+ NH
4
+
+
OH
-
+
S
2-
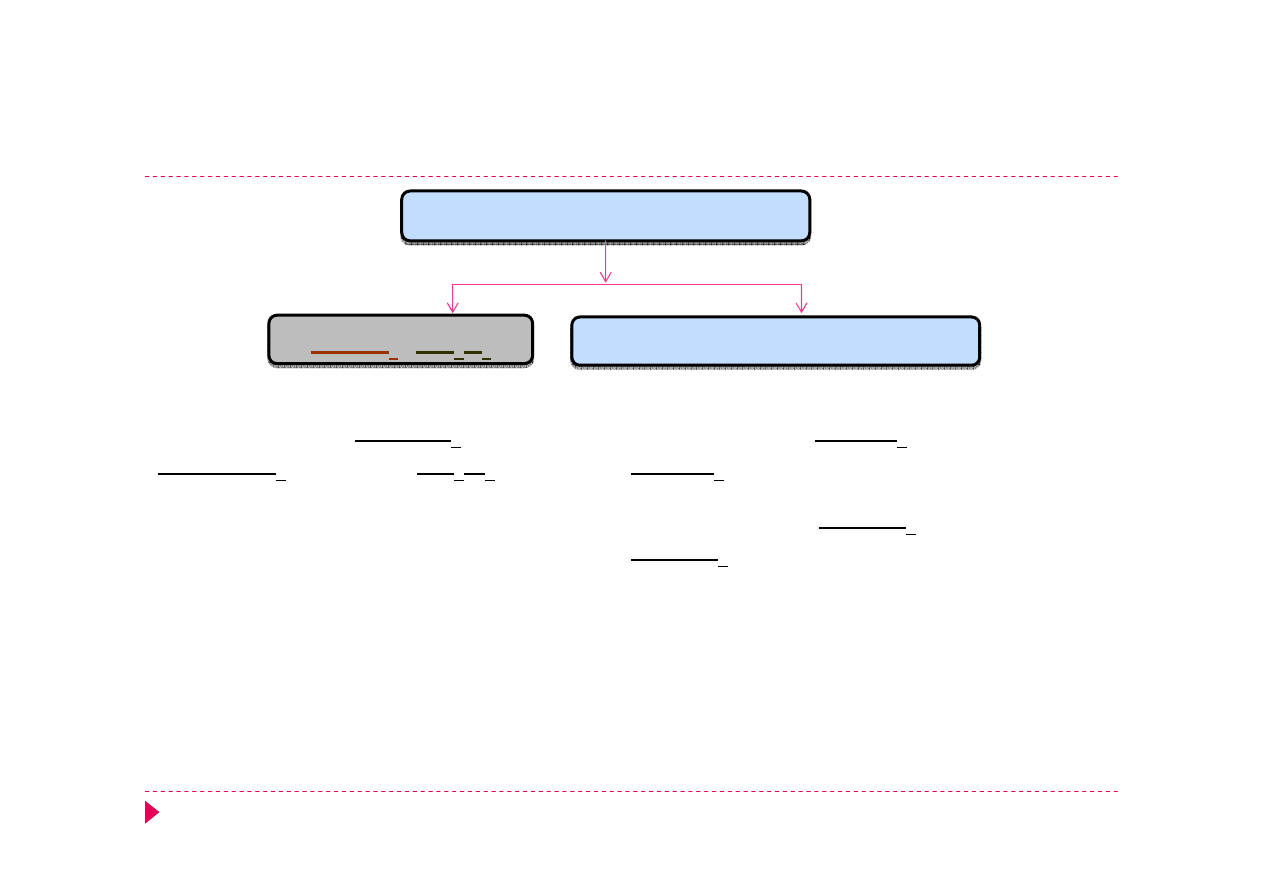
Analiza kationów – grupa IV
Mn
2+
Zn
2+
Fe
2+
Fe
3+
Cr
3+
Al
3+
Mn
2+
Zn
2+
Fe
2+
Fe
3+
Cr
3+
Al
3+
NaOH, H
2
O
2
Fe(OH)
3
Mn
2
O
3
Fe(OH)
3
Mn
2
O
3
CrO
4
2-
Zn(OH)
4
2-
Al(OH)
4
-
CrO
4
2-
Zn(OH)
4
2-
Al(OH)
4
-
Al
3+
+ 3 OH
-
→
Al(OH)
3
Al(OH)
3
+ OH
-
→
[Al(OH)
4
]
-
Cr
3+
+ 3 OH
-
→
Cr(OH)
3
Cr(OH)
3
+ OH
-
→
[Cr(OH)
4
]
-
Cr(OH)
4
-
+ 3 H
2
O
2
+ 2 OH
-
→ 2CrO
4
2-
+ 8 H
2
O
Cr(OH)
4
-
4 OH
-
→ 2CrO
4
2-
+ 4 H
2
O + 3e
-
/ ·2
H
2
O
2
+ 2e
-
→ 2OH
-
/·3
Mn
2+
+ 2 OH
-
→
Mn(OH)
2
2 Mn(OH)
2
+ H
2
O
2
→
Mn
2
O
3
+ 3 H
2
O
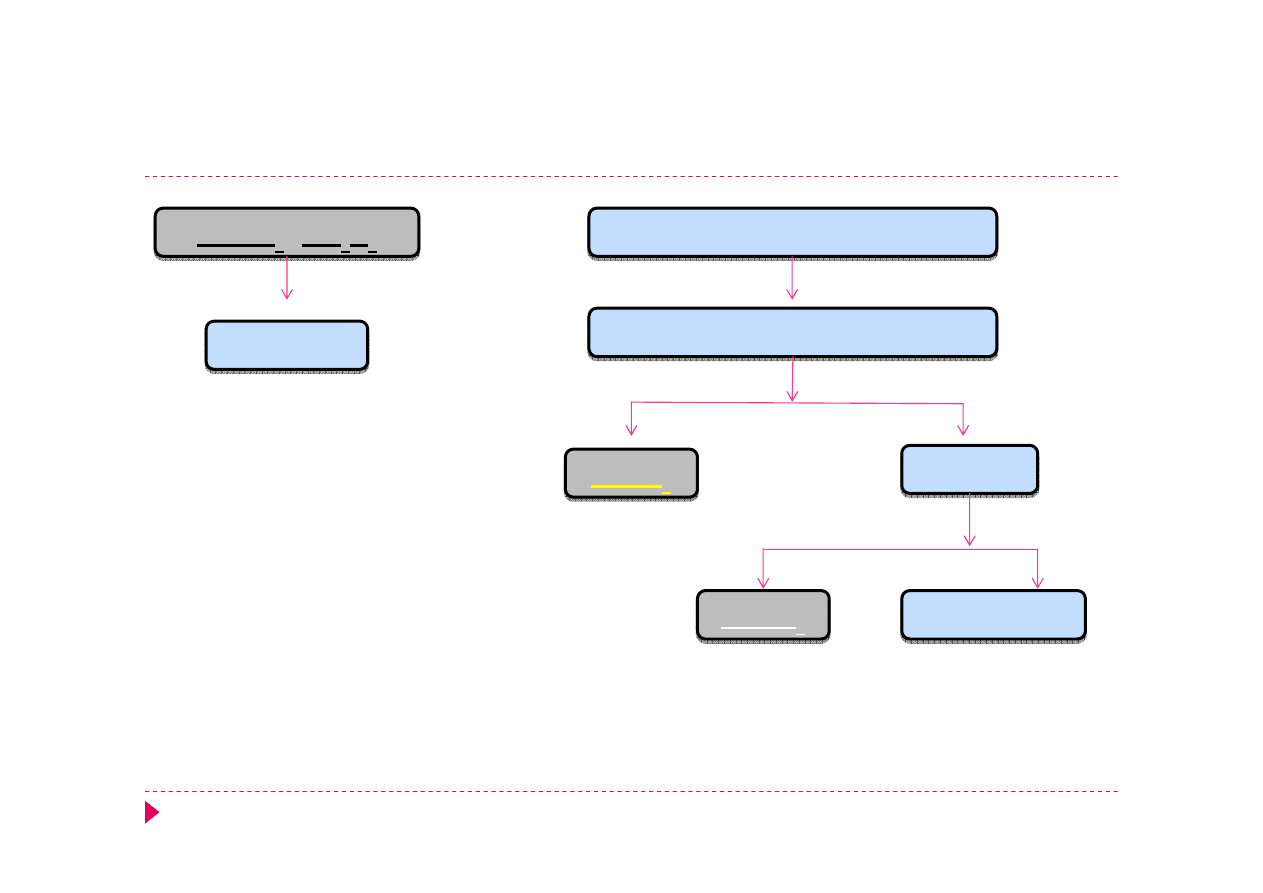
Analiza kationów – grupa IV
Fe(OH)
3
Mn
2
O
3
Fe(OH)
3
Mn
2
O
3
Fe
3+
Mn
2+
Fe
3+
Mn
2+
H
2
SO
4,
H
2
O
2
CrO
4
2-
Zn(OH)
4
2-
Al(OH)
6
3-
CrO
4
2-
Zn(OH)
4
2-
Al(OH)
6
3-
CH
3
COOH
Cr
2
O
7
2-
Zn
2+
Al
3+
Cr
2
O
7
2-
Zn
2+
Al
3+
Pb(CH
3
COO)
2
PbCrO
4
PbCrO
4
Zn
2+
Al
3+
Zn
2+
Al
3+
NH
3
aq
Al(OH)
3
Al(OH)
3
[Zn(NH
3
)
6
]
2+
[Zn(NH
3
)
6
]
2+
Reakcja Crumma
2 Mn
2+
+ 5 Pb
3
O
4
+ 24H
+
+ 8H
2
O → 2 MnO
4
-
+ 15 Pb
2+
+ 16 H
+
+ 12 H
2
O
Mn
2+
+ 4H
2
O → MnO
4
-
+ 8 H
+
+ 5e
-
/·2
Pb
3
O
4
+ 24H
+
+ 8H
2
O → 2 MnO
4
-
+ 15 Pb
2+
+ 16 H
+
+ 12 H
2
O /·5

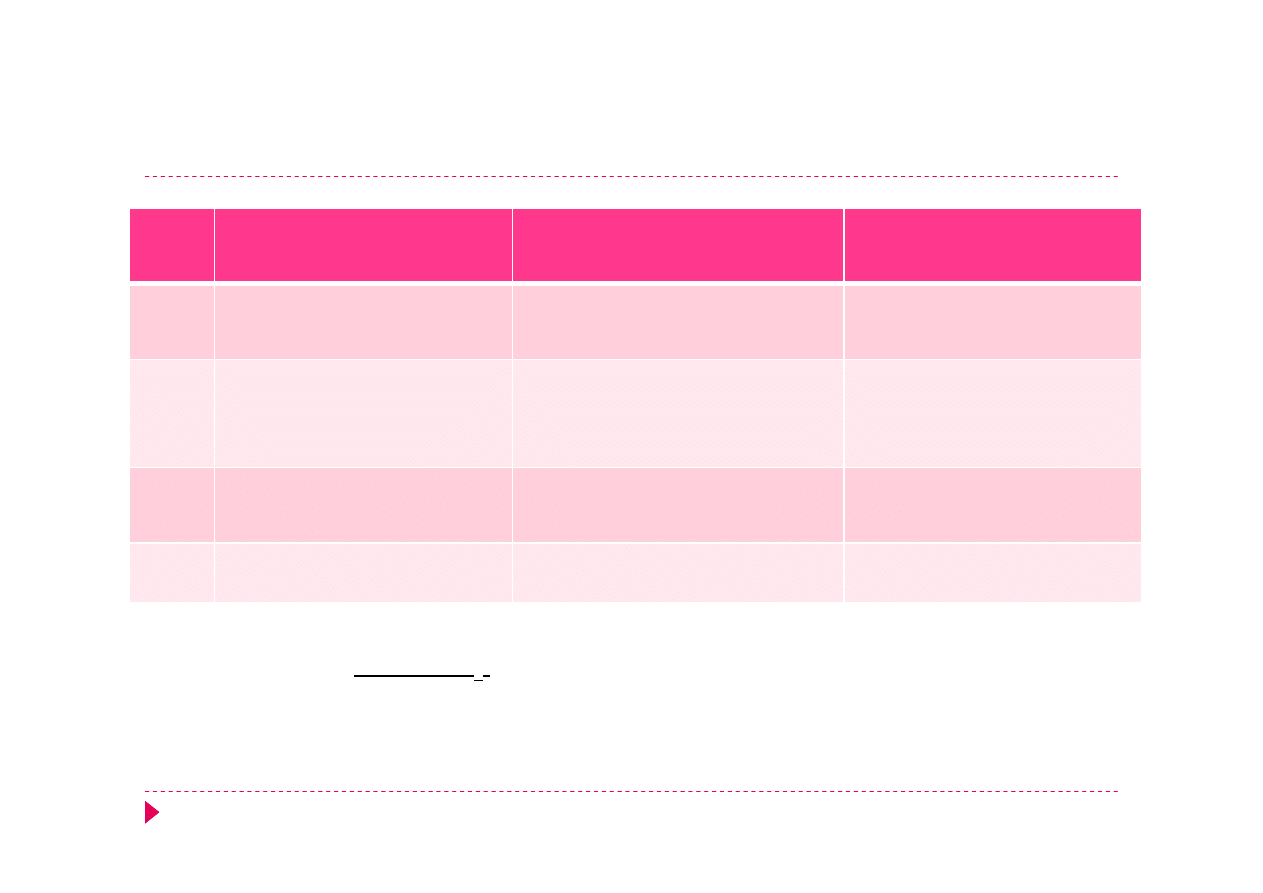
Analiza kationów – grupa V
NaOH
Odczynnik Nesslera
K
2
[HgI
4
] + NaOH
HClO
4
Mg
2+
Mg
2+
+ 2OH
Mg(OH)
2
Biały osad
-
-
NH
4
+
NH
4
+
+ OH
-
NH
3
+ H
2
O
NH
4
+
+ 2[HgI
4
]
2-
+ 4OH
-
(Hg
2
NH
2
O)I + 7 I
-
+ 3 H
2
O
Czerwonobrunatny osad
-
K
+
-
-
K
+
+ ClO
4
-
KClO
4
Biały osad
Na
+
-
-
-
Na
+
+ Sb(OH)
6
-
→ Na[
Sb(OH)
6
]
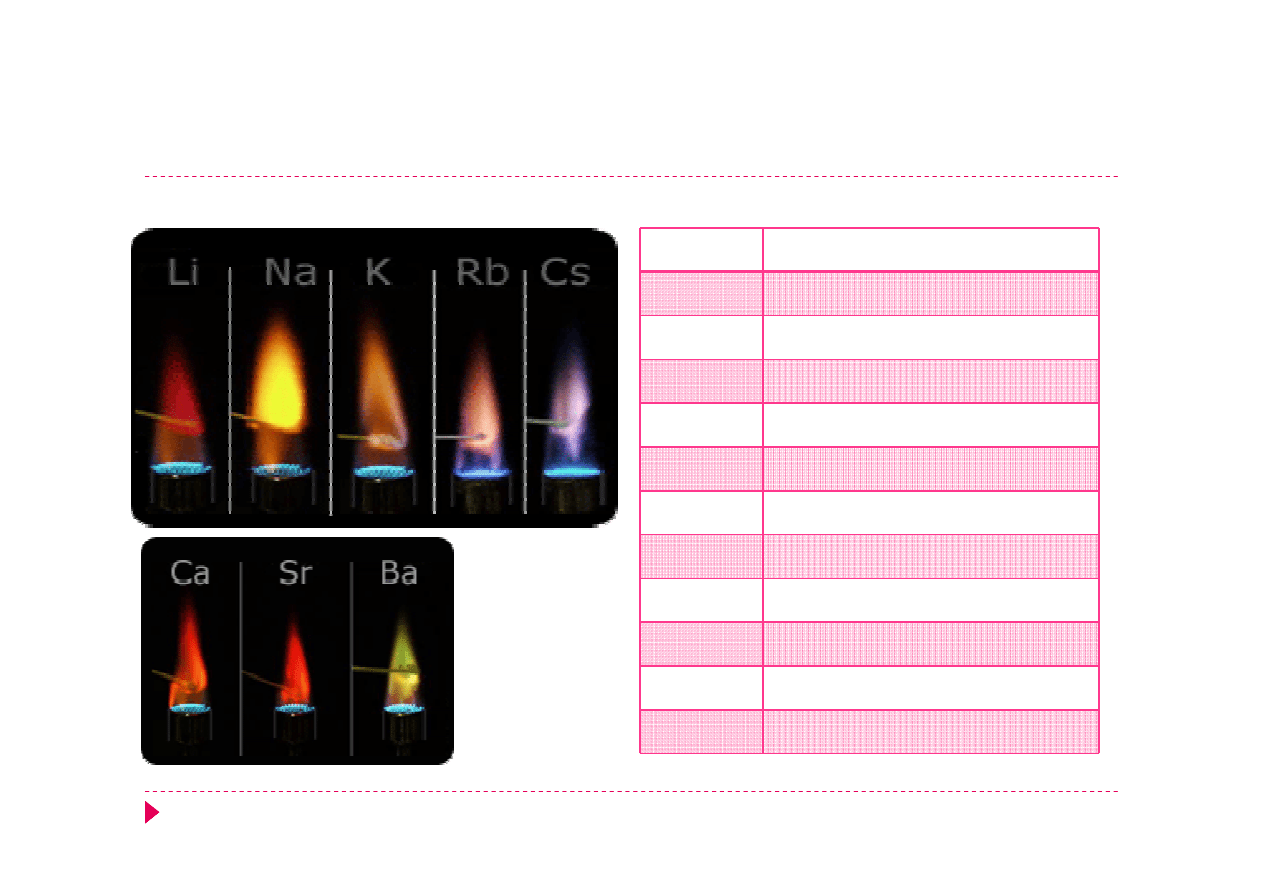
Próba płomieniowa
Metal
Barwa płomienia
Li
Karminowoczerwony
Na
Żółty
K
Fioletowy
Rb
Różowoczerwony
Cs
Niebieskoróżowy
Ca
Ceglastoczerwony
B
Zielony
In
Fioletowoniebieski (indygo)
Cu
Zielony, zielononiebieski
Sr
Karminowy
Ba
żółozielony
Reakcje charakterystyczne kationów
Tworzenie barwnych związków kompleksowych
wykrywanie Fe
3+
Fe
3+
+ 6 SCN
-
⇄ [Fe(SCN)
6
]
3-
intensywne krwistoczerwone zabarwienie
4 Fe
3+
+ 3 [Fe(CN)
6
]
4-
⇄ Fe
4
[Fe(CN)
6
]
3
ciemnoniebieski
(„błękit pruski”)
wykrywanie Fe
2+
3 Fe
2+
+ 2 [Fe(CN)
6
]
3-
⇄
Fe
3
[Fe(CN)
6
]
2
ciemnoniebieski
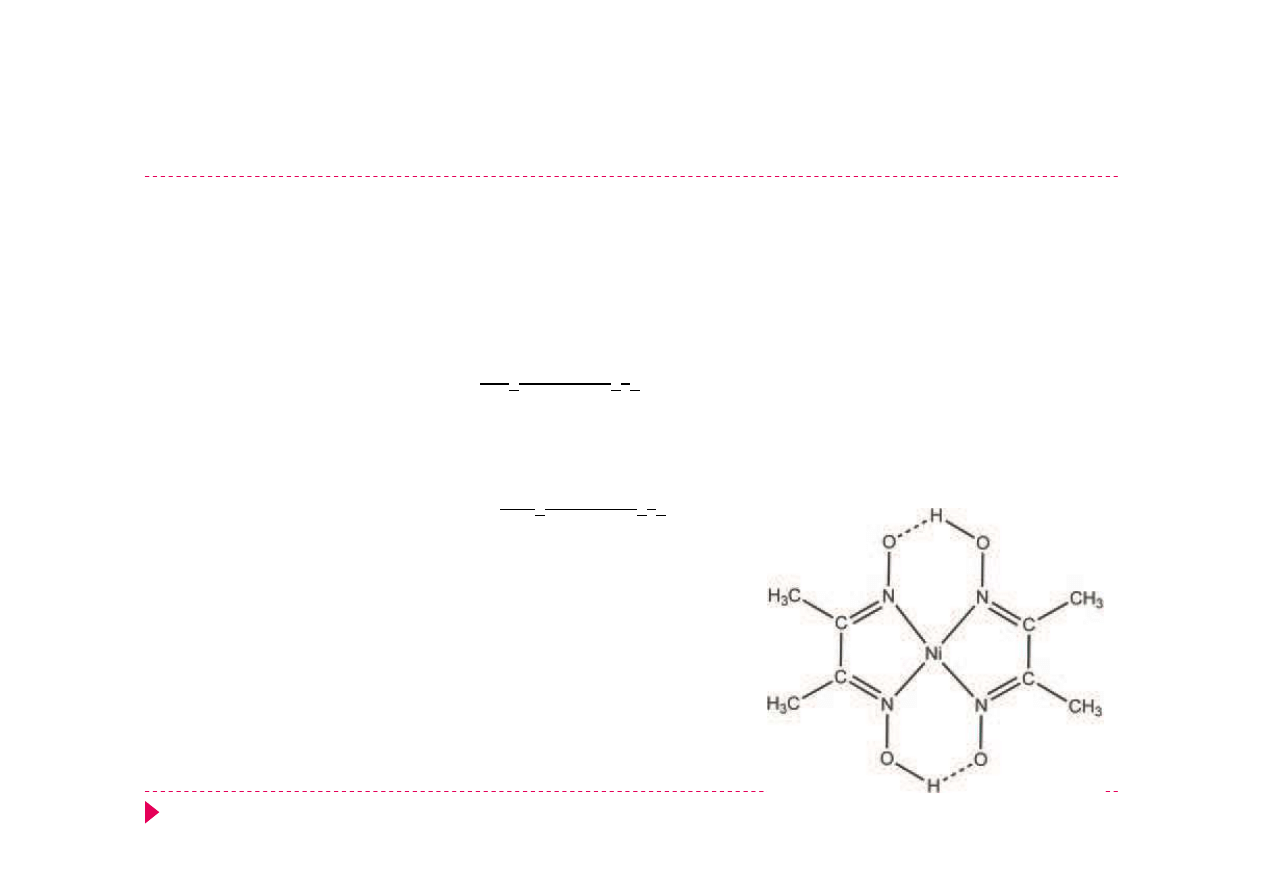
wykrywanie Ni
2+
Ni
2+
+ 2 dmgH
-
⇄
[Ni(dmgH)
2
]
czerwony
dmgH
2
- dimetyloglioksym

Reakcje charakterystyczne kationów
Reakcje redoks
utlenianie Cr
3+
2 Cr
3+
+ 3 H
2
O
2
+ 10 OH
-
→
2 CrO
4
2-
+ 8 H
2
O
żółte zabarwienie
2 Cr
3+
+ 3 S
2
O
8
2-
+ 7 H
2
O →
2 Cr
2
O
7
2-
+ 6 SO
4
2-
+ 14 H
+
pomarańczowe zabarwienie
utlenianie Mn
2+
Mn
2+
+ 5 PbO
2
+ 4 H
+
→ 2 MnO
4
-
+ 5 Pb
2+
+ 2 H
2
O
fioletowe zabarwienie
redukcja Sn
2+
i Sn
4+
[SnCl
6
]
2-
+ 4 Zn + 4 H
+
→
SnH
4
(g) + 4 Zn
2+
+ 6 Cl
-
błękitne zabarwienie płomienia podczas spalania SnH
4
Wyszukiwarka
Podobne podstrony:
Analiza jakościowa kationów, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Laborki
Laboratorium 4 Reakcje utleniania i redukcji, Studia - Inżynieria materiałowa, Chemia ogólna i nieor
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
Laboratorium 2 i 3 Reakcje chemiczne, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna
Teoria do I i II gr. anionów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kati
Kompleksy i elektrochemia notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z
prop IV notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kationów i anionó
IV i V gr. kationów notatka + hydroliza, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia koń
Pytania na kolosa z II grupy kationów, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, 2 grupa kati
III i IV gr anionów notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z katio
propa II ściąga, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kationów i anionó
chemia kol końcowe, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kationów i ani
kationy cz.2 pyt, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, kolokwia, kationy II
AG, Science ^^, Farmacja, 1 rok, Chemia, Ogólna i nieorgan, kolokwia, kationy I
V - VII aniony notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z kationów i
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
rownowagi1, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
Nazewnictwo IUPAC, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganiczna, Klasyfikacja i na
więcej podobnych podstron