
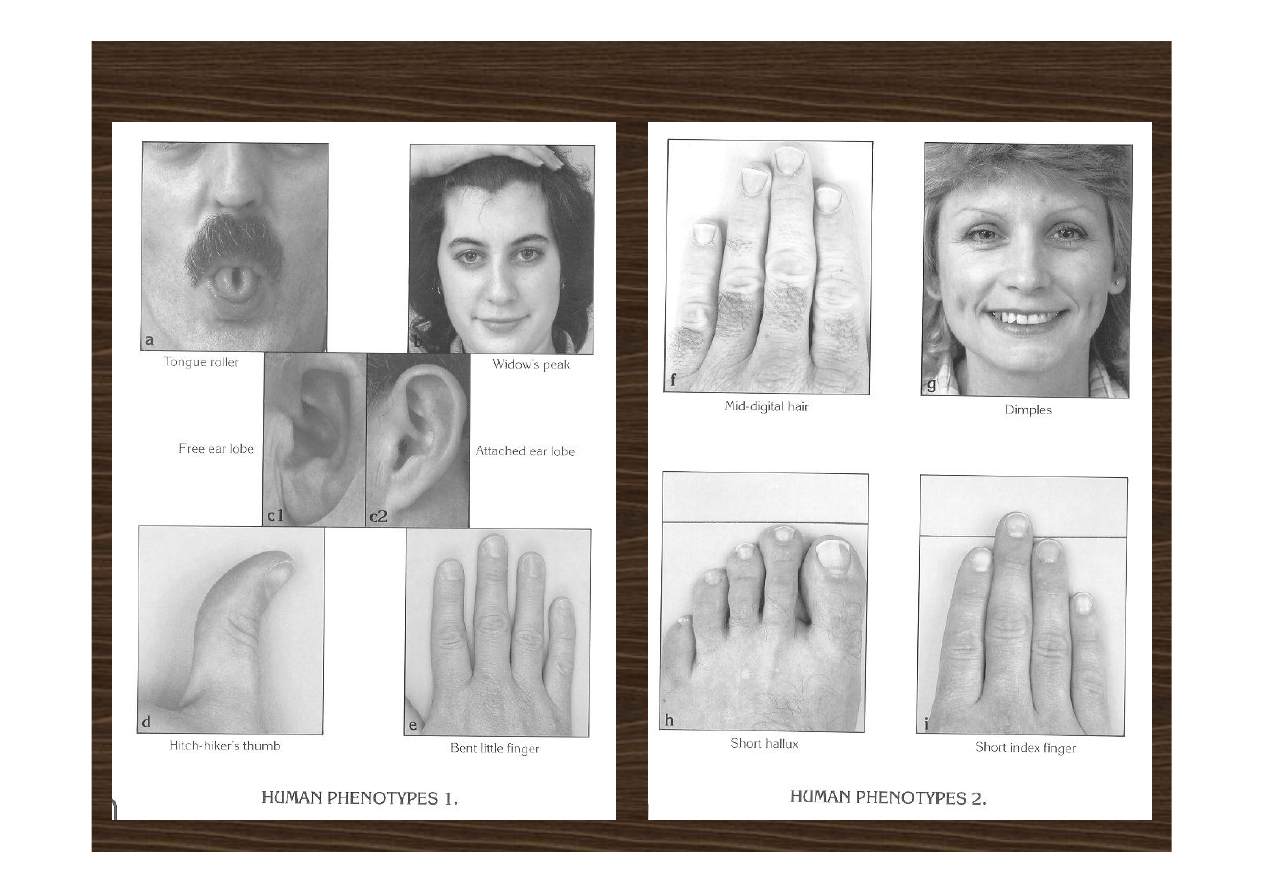
genetyka człowieka
choroby genetyczne człowieka:
* jednogenowe
* wielogenowe
* spowodowane aberracjami chromosomowymi
* mitochondrialne
* spowodowane zaburzeniami piętnowania genów (zespół
Pradera-Williego zdarza się raz na 10 000-30 000
urodzeń)
* o nieznanej etiologii, ale rodzinnym występowaniu

Częstość występowania chorób genetycznych (cech) różni
się między grupami etnicznymi.
Mukowiscydoza pojawia się 1/2000 urodzin u Amerykanów,
których przodkowie byli rasy kaukaskiej i pochodzili
z Europy Wschodniej, jest dużo rzadsza u potomków
zachodnich Afrykańczyków, u których z kolei częstość
anemii sierpowatej (rzadkiej u rasy kauskaskiej) wynosi
1/600 urodzin.
W porównaniu z innymi grupami etnicznymi potomkowie
Greków i Włochów znad Morza Śródziemnego mają
wysoką częstość thalassemii, Żydzi z Europy Wsch. -
choroby Tay-Sachsa, francuscy Kanadyjczycy z
Quebeku – tyrozynemii.
Szacuje się, że każdy z nas jest nosicielem 1-8
recesywnych mutacji.
Większość mendlowsko dziedziczonych chorób pojawia się
1/10 000 - 1/100 000 urodzeń, sumarycznie dając 1%
częstość.

Wśród losowo wybranych 10 000 poczęć w USA ok. 800
będzie z zaburzeniami chromosomowymi:
140 przypadków 45, X
(139 spontanicznych poronień, 1 żywo
urodzony z zespołem Turnera)
110 z trisomią chr. 16
(100% poronień)
20 z trisomią chr. 18
(19 poronień, krótki okres przeżycia
jedynego żywo urodzonego)
40 z trisomią chr. 21
(≥25 poronień, 10 urodzeń z zespołem
Downa)
liczne inne zaburzenia
(poronienia wszystkich płodów z doda-
tkowymi innymi autosomami, 15 urodzeń z dodatkowym chr.
X lub Y, 20 urodzeń z różnymi rearanżacjami
chromosomowymi – wśród nich co najmniej 4 z zesp.
Downa)
Ogółem 750 spontanicznych poronień.
Kariogram - zestaw chromosomów
jednej komórki, sfotografowany i
uszeregowany według określonych
zasad – chromosomy homologiczne
ułożone w pary zgodnie z wielkością i
położeniem centromeru.
Kariotyp - kariogram typowy i
reprezentatywny dla danego osobnika.
Rozróżniamy pojęcia kariogram i
kariotyp ze względu na mozaicyzm.
Mozaicyzm polega na tym, że badana
osoba może mieć dwie lub więcej linie
komórkowe o różnym składzie
chromosomowym np. część komórek
prawidłowych i część z dodatkowym
lub zmienionym chromosomem/ami.
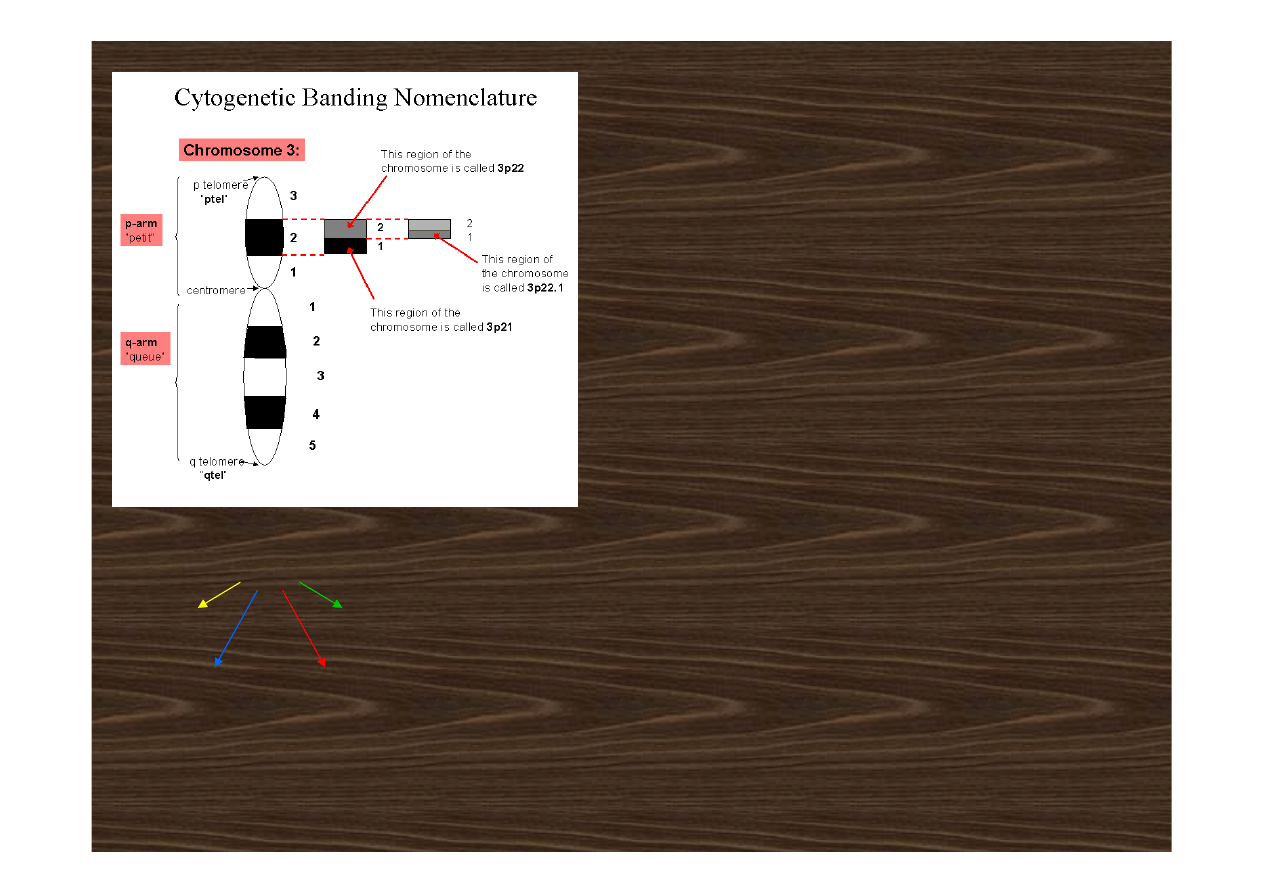
Idiogram – schematyczny rysunek
charakterystycznego wzoru prążków
na chromosomach. Każde ramię
chromosomu podzielone jest na
regiony numerowane od 1 do 4,
począwszy od centromeru do
telomeru. Prążki w każdym regionie są
kolejno numerowane zaczynając
również od centromeru.
Np. zapis
6
p
2
2
oznacza:
numer
numer
chromosomu
prążka
ramię
numer
chromosomu
regionu

genetyka człowieka a analiza rodowodów
5 000 dość rzadkich ludzkich chorób jest spowodowanych
mutacjami pojedynczych genów jądrowych
analiza rodowodów wykazuje, że dziedziczą się jako:
• choroby autosomalne recesywne
• choroby autosomalne dominujące
• choroby sprzężone z płcią recesywne
• choroby sprzężone z płcią dominujące
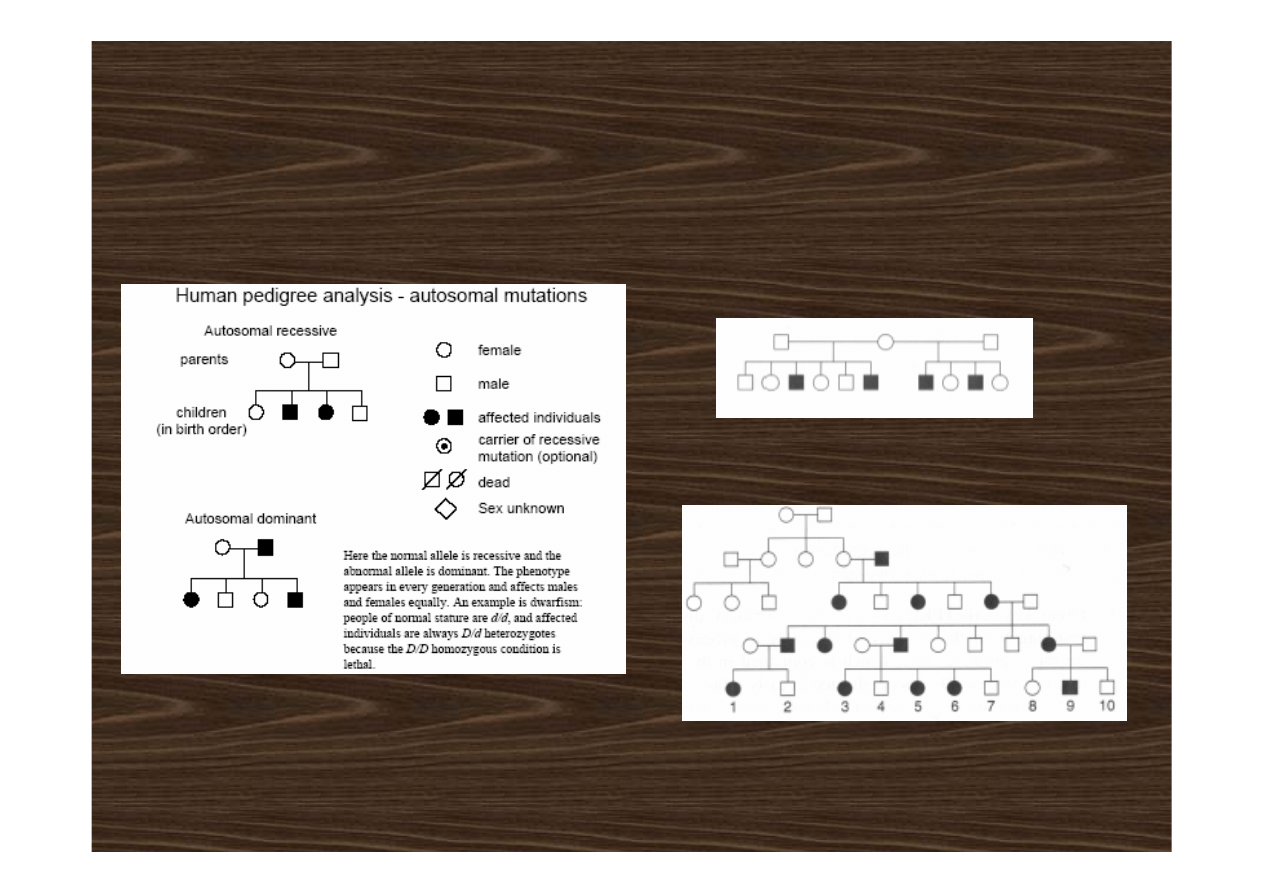
choroby autosomalne recesywne
choroby autosomalne dominujące
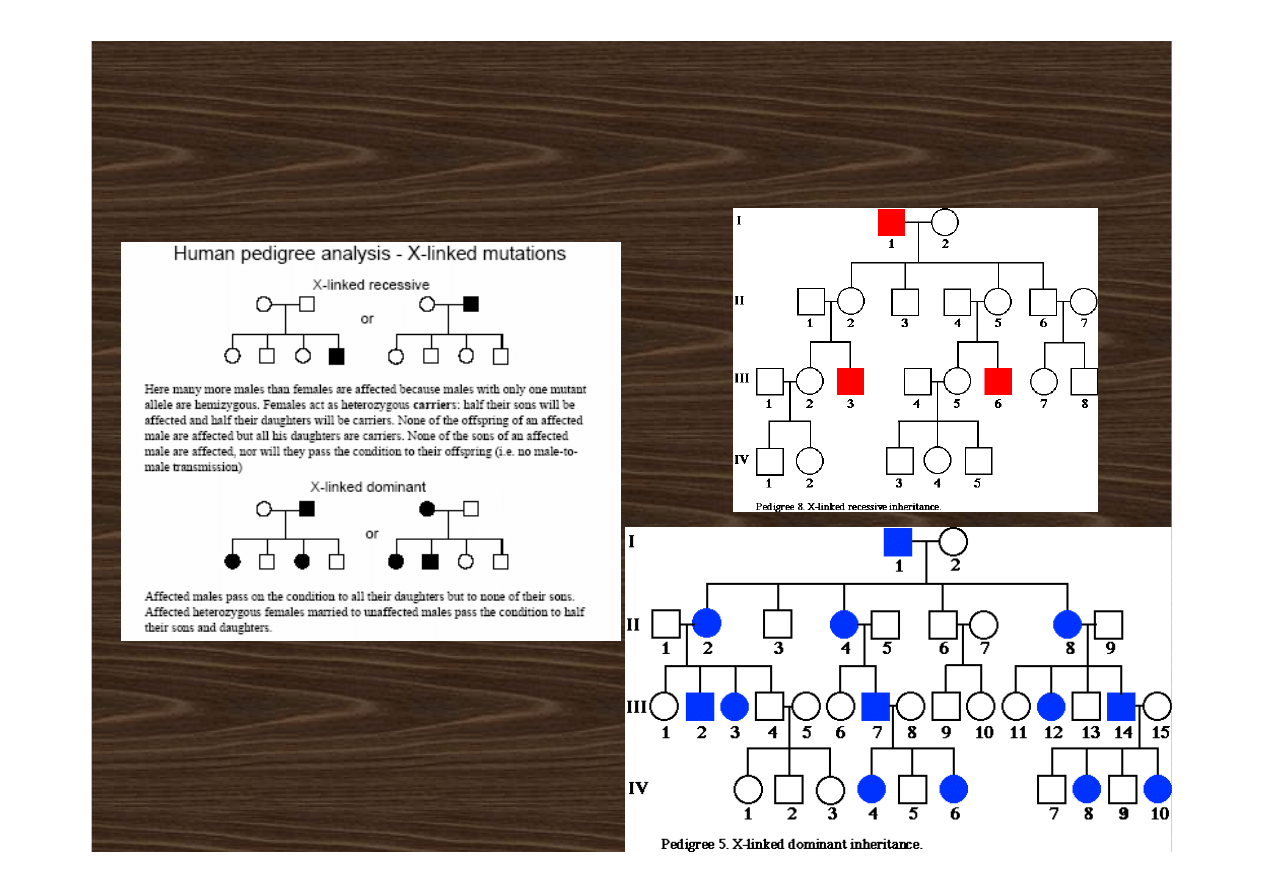
choroby sprzężone z płcią recesywne
choroby sprzężone z płcią dominujące
choroby spowodowane mutacjami genomu
mitochondrialnego
Dom
Dom
Dom
rec
rec
Dom
Dom
Dom
Dom
Dom
u ♂
rec
u ♀

utrzymywanie się w populacji szkodliwych alleli
dominujących wynika z :
(i) zmiennej ekspresywności np. zespół Marfana
(ii) późnego ujawnienia fenotypowego (np. pląsawica
Huntingtona ujawnia się średnio w 35-45 roku
życia)
(iii) wysokiej częstości nowych mutacji (np. 85%
przypadków karłowatości achondroplastycznej,
gen tej karłowatości mutuje 10-krotnie częściej
niż wynosi normalne tempo mutacji u człowieka)
(iv) niekompletnej penetracji

Zespół kruchego chromosomu X
• najczęstsza przyczyna dziedzicznego upośledzenie umysłowego -
średnio nasilonego u dotkniętych chłopców, delikatnego u
dziewcząt
• związany ze wzrastającą (>200) liczbą powtórzeń CGG w genie
FMR1 na chr.X, średni zakres liczby powtórzeń (41-60) jest
normalnie stabilny, ale może wzrosnąć 10-30%, gdy jest
przenoszony przez matkę; allel w zakresie permutacyjnym (61-
200) przenoszony przez matkę zawsze zmienia wielkość (zwykle
ekspansja),
• dziedziczone w sposób sprzężony z płcią dominujący, 16-25
przypadków/10 000 chłopców
• chłopcy z zesp. kruchego X zwykle mają nienormalne (wydłużone)
twarze, duże uszy, wydatna szczękę, przerost jąder
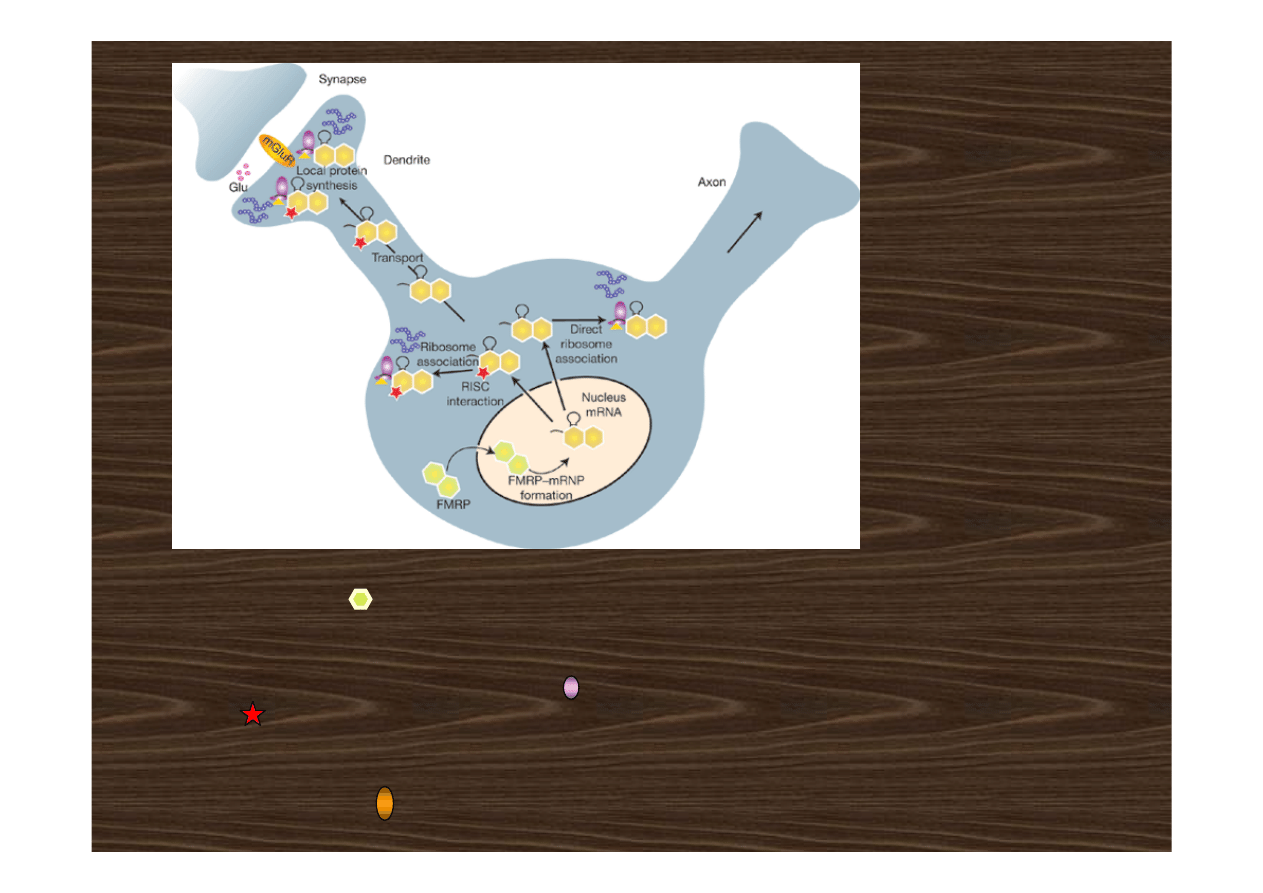
Model funkcjonowania białka FMRP (ang. fragile X mental retardation protein) w
neuronach. FMRP dimeryzuje w cytoplazmie po czym wkracza do jądra neuronu dzięki
NLS (ang. nuclear localization signal). FMRP tworzy kompleks z mRNP poprzez
oddziaływanie ze specyficznymi mRNA (hairpin structure) i białkami. FMRP−mRNP jest
transportowany z jądra dzięki NES białka FMRP. W cytoplazmie FMRP−mRNP albo
bezpośrednio wiąże się z rybosomami lub oddziałuje z RISC (ang. RNA-induced silencing
complex; ) przed asocjacją z rybosomem. Oba typy kompleksów FMRP−mRNP regulują
syntezę białek. Alternatywnie oba typy kompleksów mogą być transportowane do
dendrytów by regulować lokalną syntezę białek specyficznych mRNAs w odpowiedzi na
sygnały stymulacji synaptycznej takie jak aktywacja metabotropowego receptora
glutaminianu (mGluR; ).
Jin i in. 2004 Nature Cell
Biology 6: 1048 -1053
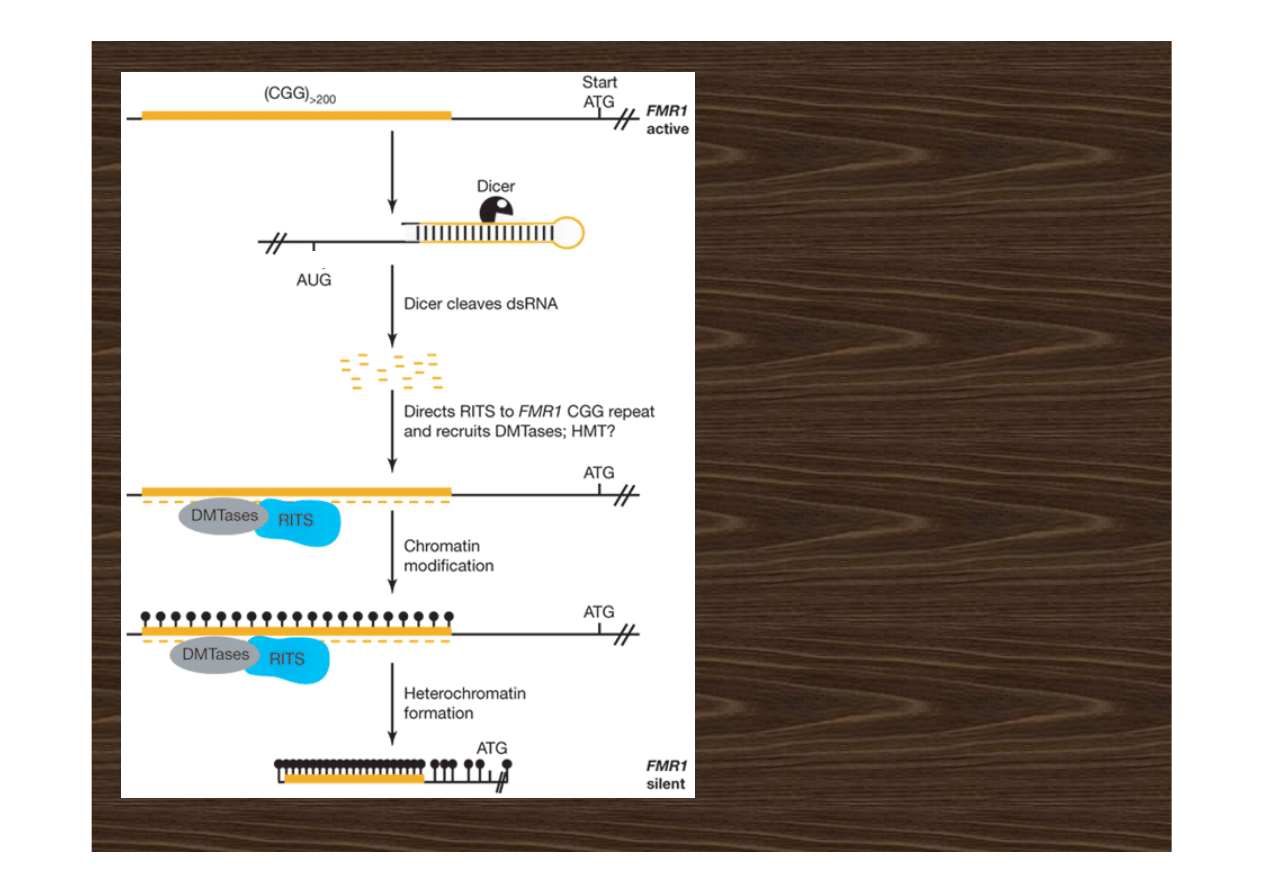
Model zależnej od RNAi
metylacji zwiększonej liczy
powtórzeń CGG u osób z
zespołem kruchego X.
W 5' UTRze zmutowanego genu
(
FMR1
) CGG może występować w
1000 kopii. Choroba ujawnia się
przy > 200 powtórzeniach.
Wcześnie w rozwoju transkrypty
zmienionego genu tworzą
struktury hairpin cięte przez
nukleazę Dicer na 20-nt siRNA,
które wchodzą w skład RITS i
odszukują homologiczne
sekwencje DNA. W miejscu
związania RITS gromadzą się
metylotransferazy DNA i/lub
metylotransferazy histonów
i inicjują lokalną metylację 5’
UTRu
FMR1
– prowadzi to do
heterochromatynizacji
i transkrypcyjnego wyciszenia
locus
FMR1
.
Jin i in. 2004 Nature Cell
Biology 6: 1048 -1053

Aktualnie znanych jest 218 ssaczych miRNA - mają
sekwencje homologiczne do ok. 2 000 ludzkich genów
konserwowanych u ssaków (w tym 250 genów
konserwowanych jako geny docelowe u ssaków i ryb).
Geny miRNA stanowią ok. 1% ludzkich genów i regulują
produkcję białek kodowanych przez ≥10% wszystkich
ludzkich genów.
miRNA wykazują specyficzność rozwojową, tkankową bądź
komórkową. U nicieni szacuje się, że średnio komórka
zawiera ok. 1000 cząstek miRNA, ale w niektórych typach
komórek jest ich > 50 000.

Mapowanie ludzkich genów z użyciem
markerów
molekularnych
(gdy choroby są rzadkie nie można znaleźć
rodzin z więcej niż jedną chorobą i badać ich segregacji)
Markery molekularne – sekwencje DNA, które są:
* polimorficzne – mają co najmniej dwa allele często występujące
w populacji ludzkiej, im więcej alleli tym lepiej
* łatwe do zbadania (poprawnego rozróżnienia alleli)

powszechnie używane typy markerów:
1.
single nucleotide polymorphisms (SNP)
W ludzkiej populacji różnica pojedynczych nukleotydów pomiędzy
dwoma osobami pojawia się z częstością raz na ok. 1 000 pz.
Wzorzec dziedziczenia SNP ustala się na podstawie
sekwencjonowania niewielkiego regionu DNA członków rodziny
dotkniętej schorzeniem.
2.
restriction fragment length polymorphisms (RFLP)
Enzymy restrykcyjne tną DNA w specyficznych palindromowych
sekwencjach. Mutacja punktowa w miejscu restrykcyjnym
uniemożliwia jego cięcie – oba sąsiadujące po lewej i prawej
stronie miejsca restrykcyjne pozostaną nie rozdzielone w wyniku
trawienia restryktazą, co prowadzi do polimorfizmu długości
fragmentów restrykcyjnych.
3.
simple sequence length polymorphisms (SSLP)
dotyczy dwu
typów powtórzeń:
•
minisatelitów
(zwany też variable number of tandem repeats,
VNTR
) o długości jednostki powtórzonej rzędu kilkudziesięciu
nukleotydów
•
microsatelitów
(inaczej simple tandem repeats,
STR
), których
powtórzenia są długości 2-4 nukleotydów.

wykrywanie rekombinantów przy użyciu markerów DNA
przykład RFLP
Po wyizolowaniu DNA, potrawieniu enzymem restrykcyjnym i rozdzieleniu
elektroforetycznym fragmentów różniących się wielkością można określić
czy badany osobnik jest homo- czy heterozygotą pod względem
fragmentów restrykcyjnych o dł. 3 i 5 kpz. Analiza rodowodu wykaże, że
allel
A
segreguje z fragmentem 5 kpz, a allel
a
z 3 kpz. W dużych
wielopokoleniowych rodzinach możemy wykryć rekombinantów „A z 3 kpz”
i „a z 5 kpz” - ich częstość pozwala obliczyć odległość miejsca RFLP od
locus A/a.
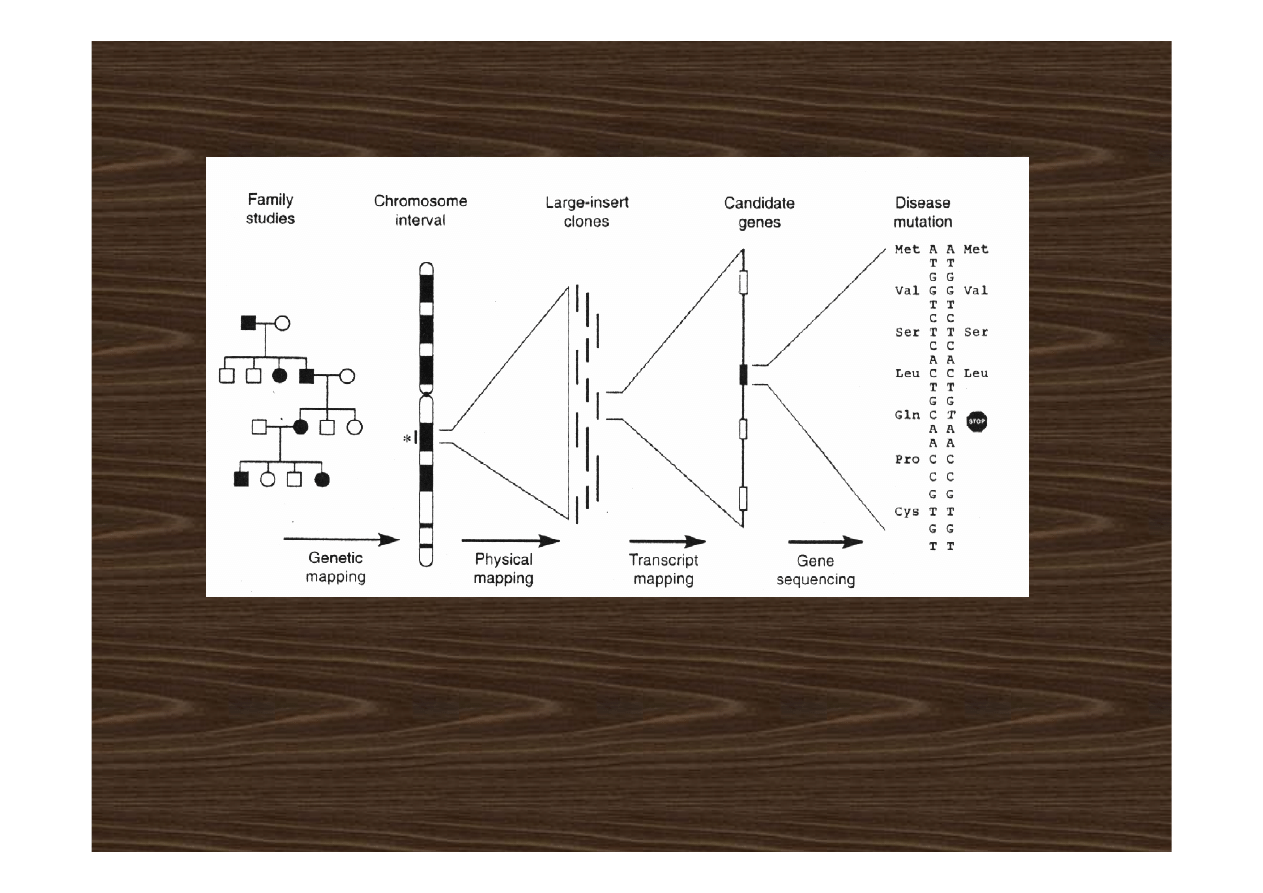
Etapy klonowania pozycyjnego
Pierwsza mapa ludzkiego genomu (1987) była oparta o ~400 RFLPów
odległych średnio o >10 cM. Mapa z 1994 zawierała ~6 000 markerów
o średniej odl. 0,7 cM.

Genetyczne mapowanie ludzkich genów za pomocą markerów DNA
mapa męskiego genomu ma dł. ~2500 cM, żeńskiego ~4500 cM
u mężczyzn 1cM = 1,1 Mb, u kobiet 1 cM = 0,7 Mb; średnio ~0,9
Mb/cM (ludzki genom zawiera ~3 000 Mb, gdzie 1 Mb = 10
6
pz)
w teorii dla wykrycia sprzężenia loci odległych o 40 cM wystarcza
10 mejoz, gdy częstość rekombinacji wynosi 35% potrzeba 85
mejoz…, z ludzkich rodowodów trudno otrzymać dane z więcej
niż 50 mejoz – więc markery nie mogą być bardziej odległe niż
20 cM w całym genomie
stąd dla wykrycia sprzężenia genu choroby potrzeba min. 200
markerów DNA, a lepiej użyć 400-500 markerów

od choroby do genu
• określ sposób dziedziczena na podstawie analizy rodowodów
• zbierz próbki DNA od możliwie największej liczby rodzin dotkniętych
badaną chorobą i genotypuj każda próbę 400-500 markerami DNA
markerami rozłożonymi w całym genomie
• zidentyfikuj region „kandydata” z genem choroby poprzez
komputerową analizę otrzymanych danych
• jeśli jest dostępnych więcej markerów przeszukaj nimi wskazany
region by znaleźć marker najbliżej sprzężony
• przeszukując bazę danych ludzkiego genomu regionu „kandydata”
wskaż geny “kandydatów”
• porównaj sekwencje genów „kandydatów” u osób dotkniętych chorobą
i zdrowych by zidentyfikować mutacje powodującą chorobę
W wielu przypadkach możliwe jest ograniczenie regionu “kandydata” do
~1 cM (~1 Mb), co średnio odpowiada 11 genom. Gdy jeden z genów
‘kandydatów” ma mutację związaną z chorobą, potwierdzenie, że
powoduje ona chorobę wymaga in. metod (uzyskania transgenicznej
myszy ze zmutowanym genem). Identyfikacja genu pozwala na
przedobjawowe testowanie członków rodziny z ryzykiem zachorowania,
biochemiczną analizę produktu genu w celu określenia jego funkcji,
rozwój nowych terapii.

Do klasycznych wskazań do diagnostyki przedurodzeniowej należą:
- wiek matki powyżej 35 (38) roku życia
- wiek ojca powyżej 55 (60) roku życia
- nosicielstwo zrównoważonych translokacji chromosomowych, fuzji
centrycznych, wybranych markerów chromosomowych itp. przez
jedno lub oboje rodziców
- posiadanie dziecka z aberracją chromosomową (wskazania niekiedy
natury psychologicznej, gdy ryzyko powtórzenia się aberracji
u kolejnych dzieci szacuje się jako małe; możliwe nieinwazyjne
badania przesiewowe)
- ryzyko wystąpienia chorób monogenowych dziedziczących się
autosomalnie dominująco lub recesywnie (w przypadkach chorób,
w których diagnostyka jest możliwa)
- ryzyko wystąpienia chorób sprzężonych z chr.X (w przypadkach
chorób, w których diagnostyka jest możliwa; o wykluczeniu ryzyka
może decydować też samo kryterium płci płodu)
- ryzyko wystąpienia lub powtórzenia się wad rozwojowych CUN
(w przypadkach wad, w których diagnostyka jest możliwa; możliwe
nieinwazyjne badania przesiewowe)
- ryzyko wystąpienia lub powtórzenia się u kolejnego dziecka
wybranych typów wad rozwojowych (wskazania niekiedy natury
psychologicznej, gdy ryzyko powtórzenia się wady u kolejnych
dzieci szacuje się jako małe; w części typów wad możliwe
nieinwazyjne badania przesiewowe)

Zaniechanie informacji o diagnostyce przedurodzeniowej
w przypadkach zaistnienia powyższych wskazań jest błędem
w sztuce lekarskiej. Jest natomiast prawem rodziców rezygnacja
z badań, np. ze względów światopoglądowych.
rodzaje i częstość występowania chorób genetycznych
% populacji
zaburzenia chromosomowe
0,7
zaburzenia jednogenowe (autosomalne dominujące, autosomalne
recesywne i związane z płcią)
1,0
skumulowane zaburzenia genetyczne (nowotwory)
30
zaburzenia częściowo uwarunkowane genetycznie (wrodzone
wady rozwojowe, choroby przewlekłe u osób dorosłych)
60
Dominujące choroby autosomalne są zazwyczaj związane z produkcją białek
strukturalnych albo nośnikowych, a nie enzymatycznych. Kiedy zmutowane geny
kodują syntezę enzymów (np. w ostrej napadowej porfirii), albo syntezę białek
receptorowych (np. gdy występuje niska gęstość receptorów lipoproteinowych w
rodzinnej hipercholesterolemii), obniżenie o 50% aktywności enzymatycznej lub
ilości receptorów przekracza margines bezpieczeństwa i wywołuje objawy choroby.
Document Outline
- genetyka człowieka
- choroby autosomalne recesywne choroby autosomalne dominujące
- choroby sprzężone z płcią recesywne choroby sprzężone z płcią dominujące
- choroby spowodowane mutacjami genomu mitochondrialnego
- Mapowanie ludzkich genów z użyciem markerów molekularnych (gdy choroby są rzadkie nie można znaleźć rodzin z więcej niż jedną
Wyszukiwarka
Podobne podstrony:
4 Charakterystyka chorób genetycznych człowieka
Choroby genetyczne człowiekai ich diagnostyka Biologia
Choroby genetyczne czlowieka 2
Kolokwium choroby gen bud i f kom, mutacje, tkanki,pasożyty,genetyka,wady,etapy rozwojowe
Choroby genetyczne człowiekai ich diagnostyka Biologia
318 choroby genetyczne czlowiek Nieznany
Choroby genetyczne czlowieka
19101-choroby genetyczne człowieka(2), semestr IV, genetyka, Genetyka
choroby gen, Biologia, Genetyka
Choroby Genetyczne człowieka
Choroby genetyczne u człowieka spowodowane są mutacjami
Choroby genetyczne człowieka, SZKOŁA, Biologia
bakterie chorobotwórcze dla człowieka
bakterie chorobotwórcze dla człowieka
BIOLOGIA Choroby genetyczne człowieka
więcej podobnych podstron