Fotosynteza
![]()
Węgle kopalne
Szungit - 96% - 99% zawartości pierwiastka węgla. Stosowany, jako barwnik
Antracyt - ponad 94% zawartości pierwiastka węgla. Stosowany, jako opał
Kamienny - 72% - 78% zawartości pierwiastka węgla. Stosowany, jako opał i surowiec do syntez organicznych
Brunatny - od 65%-78% zawartości pierwiastka węgla. Stosowany, jako opał.
Torf - 55%-65% zawartości pierwiastka węgla. Stosowany, jako opał, izolacja i do produkcji leków.
Alotropia węgla
Diament:
-krystaliczny
-stały
-przeźroczysty
-najtwardszy minerał
-nie przewodzi prądu
-ma budową tetraedryczną
-brak swobodnych elektronów
-przewodzi ciepło
-używane w jubilerstwie i do produkcji wierteł
b) grafit:
-stały
-miękki
-ciemnoszary
-przewodzi prąd
-odporny na wysokie temperatury
-przewodzi ciepło
-budowa warstwowa. W obrębie warstwy tworzy wiązania kowalencyjne, ale między warstwami zaledwie wiązania van der Wadasa.
-ma swobodne elektrony
c) Fluereny:
-kształt cząsteczek jest piłki futbolowej albo nanorurki
-prawdopodobnie zostaną wykorzystane, jako nadprzewodniki lub bardzo cienkie i wytrzymane włókna.
-miękkie
-bladożółte
-idealnie symetryczne
Budowa atomu węgla
Stan podstawowy
![]()
: ![]()
Stan wzbudzony
![]()
: ![]()
Atomy węgla występujące w związkach organicznych są zawsze czterowartościowe
Chemia organiczna, to chemia związków węgla oprócz:
-tlenku węgla (II)
-tlenku węgla (IV)
-kwasu węglowego
-kwasu cyjanowego
-kwasu cyjanowodorowego
-soli tych kwasów
e) Atomy węgla łączą się bezpośrednio między sobą, co nazywamy katenacją
f) Atomy węgla tworzą ze sobą wiązania : pojedyncze, podwójne, potrójne
g) Związki organiczne ulegają izomeriom, mogą tworzyć struktury łańcuchowe lub pierścieniowe
Węglowodory to związki zbudowane z węgla i wodoru, które dzielimy na:
Alkany
![]()
- wzór ogólny
Alkany wszystkie wiązania mają pojedyncze
a) Tabelka alkanów
Metan ![]()
![]()
Etan ![]()
![]()
Propan ![]()
![]()
Butan ![]()
![]()
Pentan ![]()
![]()
Heksan ![]()
![]()
Heptan ![]()
![]()
Oktan ![]()
![]()
Nonan ![]()
![]()
Dekan ![]()
![]()
nazwy alkanów kończą się na „an”
Alkany tworzą SZEREG HOMOLOGICZNY i jest to zbiór związków, ułożonych w taki sposób, że następny od poprzedniego różni się grupą -CH![]()
-
Metan:
Właściwości fizyczne:
-gaz
-bezbarwny
-bezwonny
-nierozpuszczalny w wodzie
-lżejszy od powietrza
-palny
b) Otrzymywanie metanu
![]()
![]()
octan sodu węglan sodu
![]()
Węglik
Glinu
![]()
Spalanie metanu
-całkowite ![]()
-półspalanie ![]()
-niecałkowite ![]()
Reakcja substytucji (podstawiania) to reakcja, w której atom wodoru zostaje podstawiony innym atomem, lub grupami atomów
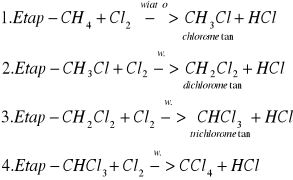
Alkeny - są to węglowodory, które zawierają w swoich łańcuchach jedno wiązanie podwójne między atomami węgla
![]()
- wzór ogólny
a)Tabelka alkenów
Eten ![]()
![]()
Propen ![]()
![]()
Buten ![]()
![]()
Penten ![]()
![]()
Heksen ![]()
![]()
Hepten ![]()
![]()
Okten ![]()
![]()
Nonen ![]()
![]()
Deken ![]()
![]()
Izomeria alkenów
-izomeria położenia wiązania podwójnego
![]()
- pent-1-en
![]()
-pent-2-en
-izomeria położenia podstawnika
- 3-chloro-pent-1-en
-3-chloro-pent-1-en
-izomeria łańcuchowa
![]()
- pent-1-en
- 2-metylo-but-1-en
c) Alkeny, które zawierają od 2-4 atomów węgla, to gazy, od 5-10 atomów węgla, to ciecze, wyższe, są to ciała stałe
d) Wraz ze wzrostem liczby atomów węgla, w cząsteczce wzrasta temperatura topnienia i wrzenia, oraz gęstość
Alkeny są bardzo reaktywne, ulegają reakcji spalania na trzy sposoby, ulegają addycji, polimeryzacji, otrzymywane są w reakcjach eliminacji
Eten (etylen)
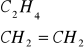
Otrzymywanie:
- depolimeryzacja polietylenu
Polietylen etylen
-odwodnienie alkoholu etylowego
![]()
Reakcja eliminacji - to reakcja, w której od dwóch sąsiadujących atomów węgla odrywają się atomy lub grupy atomów i w tym miejscu, powstaje wiązanie podwójne
Alkeny spalają się na trzy sposoby: całkowicie, półspalanie, niecałkowicie
Eten odbarwia wodę bromową i manganian (VII) potasu - ulega reakcji addycji
Reakcja addycji - to reakcja, w której do atomów węgla związanych wiązaniem podwójnym przyłącza się prosta cząsteczka i jednocześnie pęka wiązanie Л
Reakcja addycji
a) Reakcja etenu z bromem lub chlorem
![]()
- 1,2-dibromoetan
Reakcja etenu z bromowodorem lub chlorowodorem
![]()
-1-chloroetan
Reakcja etenu z wodorem
![]()
-etan
Reakcja etenu z wodą
![]()
- alkohol etylowy
Polimeryzacja - reakcja wielu małych cząsteczek (monomerów) ze sobą, w której powstaje jedna, duża cząsteczka (polimer)
Etylen polietylen
REAKCJA DIMOLIMERYZACJI JEST ODWROTNA DO POLIMERYZACJI!
Nazewnictwo
Wiązanie podwójne ma pierwszeństwo w numeracji łańcucha węglowego
3,5-dimetylo-heks-2-en
Alkiny - są to węglowodory nienasycone, zawierające jedno wiązanie potrójne między atomami węgla
![]()
Tabelka Alkinów
Etyn ![]()
![]()
Propyn ![]()
![]()
Butyn ![]()
![]()
Pentyn ![]()
![]()
Heksyn ![]()
![]()
Heptyn ![]()
![]()
Oktyn ![]()
![]()
Nonyn ![]()
![]()
Dekyn ![]()
![]()
Alkiny ulegają izomerii położenia podstawnika, łańcuchowej, położenia wiązania potrójnego
![]()
-pent-1-yn
![]()
-pent-2-yn
Alkiny, które zawierają od 2-4 atomów w cząsteczce, to gazy. Reszta to ciecze i ciała stałe.
Ze wzrostem liczby atomów węgla w łańcuchu węglowym rośnie temperatura topnienia i wrzenia, oraz gęstość
Alkiny są bardzo reaktywne, ulegają spalaniu, addycji i polimeryzacji
Etyn (Acetylen)
![]()
![]()
![]()
Otrzymywanie acetylenu metodą karbidową
![]()
Węglik cetylen wodorotlenek
Wapnia wapnia
Reakcja addycji
Reakcja etynu z chlorem lub bromem
![]()
1,1,2,2-tetrachloroetan
Reakcja etynu z wodorem
![]()
-etan
Reakcja etynu z chlorowodorem lub bromowodorem
![]()
-1,1dibromometan
Reakcja etynu z wodą
-Etanal
Jeżeli w cząsteczce znajduje się wiązanie podwójne i potrójne, to wtedy wiązanie podwójne ma pierwszeństwo w numeracji łańcucha. Jeśli w cząsteczce jest tylko wiązanie potrójne, to ono ma pierwszeństwo
Np. 3-chloro-2metylohept-2-en-5-yn
Aromaty - są to związki o budowie pierścieniowej, płaskiej i wiązaniu zdelokalizowanym.
Benzen
![]()
-półstrukturalny
- strukturalny
Właściwości fizyczne benzenu
-ciecz
-bezbarwny
-charakterystyczny zapach
-nie rozpuszcza się w wodzie
-dobrze rozpuszczalna w rozpuszczalnikach organicznych
-lżejsza od wody
b)benzen spala się na trzy sposoby (na powietrzu niecałkowicie, kopcącym płomieniem)
c) Otrzymywanie benzenu
Sposób pierwszy - destylacja smoły węglowej
Sposób drugi - trymeryzacja acetylenu
- Benzen
d) Substytucja
-Reakcja benzenu w obecności bromu lub żelaza
![]()
![]()
Bromobenzen bromowodór
e) Reakcja addycji benzenu z bromem lub chlorem w obecności światła
![]()
1,2,3,4,5,6-heksachlorocykloheksan
-Reakcja addycji benzenu z wodorem w obecności katalizatora
![]()
cykloheksan (![]()
)
NITROWANIE - reakcja związku aromatycznego ze stężonym kwasem azotowym (V) w obecności stężonego kwasu siarkowego (VI) (produkt uboczny - woda)
![]()
+![]()
Nitrobenzen woda
22. SULFONOWANIE - jest to reakcja aromatu ze stężonym kwasem siarkowym (VI) (produkt uboczny - woda)
![]()
![]()
Kwas benzenosulfenowy i woda
Homologi benzenu
![]()
n ≥ 6
Benzen
![]()
Toluen (metylobenzen)
![]()
Etylobenzen
![]()
23.
o-ksylen
m-ksylen
p-ksylen
Właściwości fizyczne toluenu
-ciecz
-bezbarwna
-charakterystyczny zapach
-lżejsza (ciecz) od wody
-nie rozpuszcza się w wodzie, ale rozpuszcza się w rozpuszczalnikach
Organicznych
Toluen spala się na trzy sposoby (na powietrzu niecałkowicie)
Substytucja toluenu z bromem lub chlorem w obecności światła
![]()
![]()
Chlorofenylometan chlorowodór
c) Reakcja substytucji toluenu z żelazem lub chlorem w obecności żelaza
2![]()
+![]()
o-bromotoluen p-bromotoluen bromowodór
d) Nitrowanie toluenu
2![]()
+2![]()
o-nitrotoluen p-nitrotoluen woda
Sulfonowanie toluenu
2
+![]()
+2![]()
Kwas o-toluenosulfonowy kwas-p-toluenosulfonowy woda
Rodzaje podstawników
Podstawniki I rodzaju -to takie, które kierują drugi podstawnik w pozycję orto i para
Podstawniki II rodzaju - to takie, które kierują podstawnik w pozycję meta
Naftalen
![]()
1, 4,5 i 8 są to α
A pozostałe β
Naftalen:
-biały
-stały
-charakterystyczny zapach
-łatwo sublimuje
-krystaliczny
-nie rozpuszcza się w wodzie, ale dobrze rozpuszczalny w benzenie
Spala się na trzy sposoby (na powietrzu niecałkowicie)
Ulega reakcjom substytucji:
a)fluorowcowaniu
b) nitrowaniu
c) sulfonowaniu
a) 2
+![]()
+2HBr
α-bromonaftalen β-bromonaftalen bromowodór
b)
2![]()
+2![]()
α-nitronaftalen β-nitronaftalen
c)
2
+![]()
+2![]()
Kwas α-naftalenofulfenowy kwasβ-naftalenosulfenowy
Wyszukiwarka
Podobne podstrony:
chemia Alkeny,Alkany,Alkiny
cw 2 czesc dosw SS, Szkoła, Chemia
przemiany jadrowe, Nauka, CHEMIA, Szkoła, Chemia ogólna
Chemia - Etanol i metanol - wszystko w jednym(1), Szkoła, Chemia
stopien, szkoła, chemia
Chemia raport, Szkoła, Chemia budowlana
ściąga chemia wykład, Studia, Sem 1,2 +nowe, ALL, szkoła, Chemia
cw 1 czesc dosw SS zm, Szkoła, Chemia
Okres połowicznego rozpadu izotopu pierwiastka promieniotwórczego, szkola, chemia
Alkany nie reag, CHEMIA, Chemia organiczna
reakcje w roztworach wodnych, Nauka, CHEMIA, Szkoła, Chemia ogólna
stopien, szkoła, chemia
Iloczyn rozpuszczalnosci -zadania kl.I WORD2003, szkoła, chemia
promieniotwórczość naturalna, Nauka, CHEMIA, Szkoła, Chemia ogólna
olej, Szkoła, Chemia
zelazo chrom mangan, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
zestaw zadan -wydajnosc reakcji R WORD2003, szkoła, chemia
typy reakcji chemicznych reakcje redoks, Nauka, CHEMIA, Szkoła, Chemia ogólna
więcej podobnych podstron