1.Przewód pokarmowy człowieka, funkcje jego fragmentów, skład i rola soków trawiennych.
Przewód: jama ustna, przełyk, żołądek, dwunastnica, jelito cienkie, grube i proste, odbytnica. Soki trawienne: ślina - wydzielana przez gruczoły ślinowe do jamy ustnej, 1,5 l/24h, składniki: woda, mucyna, zw. org., sole min., substancją czynną śliny jest α-amylaza dekstrynotwórcza (hydrolizuje skrobię na dekstryny), mucyna jest subst. białkową, nadaje śliskość pokarmowi. sok żołądkowy - bezbarwna, kwaśna ciecz ph. 1,5 - 2,5, wydzielana przez błonę śluzową żołądka, 2 l/24h, skład: woda, kw. solny, zw. org., sole min., substancjami czynnymi są enzymy: a) hydrolizujące białka: pepsyna hydrolizuje białka na polipeptydy, chymozyna przekształca kazeinę mleka na parakazeinę b) hydrolizujące tłuszcze: lipaza przekształca tłuszcze na glicerynę i kw. tłuszczowe. sok trzustkowy - subst. zasadowa, mętna ciecz, ph. 8, 0,5 l/24h, wydzielany przez trzustkę do dwunastnicy, skład: woda, subst. białkowe, sole min., enzymy hydrolizujące białka ( trypsyna, protaminaza, chymotrypsyna, karboksypeptydaza), enzymy hydrolizujące tłuszcze (lipaza), enzymy hydrolizujące węglowodany (amylaza, maltaza), enzymy hydrolizujące kw. tłuszczowe (nukleinaza). sok jelitowy - zasadowa, mętna ciecz, ph. 7,1 - 7,6, wydzielana przez błony śluzowe jelita cienkiego, 3 l/24h, skład: woda, sucha pozostałość, enzymy hydrolizujące białka (amino-, dwu- karboksypeptydazy, enterokinaza), enzymy hydrolizujące tłuszcze (lipaza), enzymy hydrolizujące kw. nukleinowe (nukleinaza), czynniki aktywne soku , enzymy, hydrolizują składniki odżywcze na substancje proste, które mogą być wchłaniane do krwioobiegu przez ścianki jelit, żółć - wydzielana przez pęcherzyk żółciowy do dwunastnicy, 0,3 l/24h, nie zawiera enzymów, nie jest sokiem trawiennym, jej składniki emulgują tłuszcz w soku trzustkowym, skład: kw. cholowy, kw. dezoksycholowy, kw. litocholowy.
2. Budowa i podział aminokwasów.
Aminokwasy-białka są z nich zbud, zw. dwufunkcyjne, b. są zbud. z 20 standard.aminokw,19 to α-aminokw. z pierwszorzęd. gr. aminową -NH3 i gr. karboksyl. -COOH, są one połącz. z centr. at. węgla Cα tak jak at. Wodoru i zmienny łańcuch boczny R: R-CH-NH2-COOH, R to rodnik lub wodór, gdy R jest resztą aminokw. to węgiel C2 staje się asymetr. dając 2 izomery optyczne (wyjątek- prolina). Projekcja Fischera- do rys. wzorów: L-stereizomery przedst. się umieszczając gr. COOH na górze a -NH2 po lewej str. 20 standatd. aminokw. różni się jedynie strukt. łańcucha bocznego. A. mogą być:1-kw, oboj, zasad; 2-mieć rodnik a małej/ dużej masie;3-mieć łańcuchy boczne aromat/alifat;4-mieć rodniki polarne/niepolar;5-mieć łańcuchy boczne sztywne/ giętkie; 6-tworzyć wiąz. wodorowe/ nie.
A) Hydrofobowe A alifatyczne- GLY, ALA, VAL, LEU, ILE, MET, PRO, CYS, wyjątek cysteina jest tam wiązanie mostkowe dwuśarczkowe (włosy).
B) Hydrofobowe A aromatyczne- Phe, Try, Trp; mają arom. pierścień są hydrof.
C) Polarne A obdarzone ładunkiem na R: Arg, Lys, His, Asp, Glu; zawierają polarne hydrofilowe łańcuch boczne 1. Arg, i Liz obdarzone w łańcuchu bocznym w gr. aminowej zawierającą proton. 2. pH=7 His + lub bez ładunku 3. gr. karboksylowa w Asp, Glu w pH=7 jest gr -.
D) Polarne A nieobdarzone ład. w gr. R- 1. Ser, Thr są p. bo mają C-OH i two. wiąz. H. 2. Asn, Gln, łańcuch boczny, amidowych pochodnych nie są obdarzone protonem, ale mogą tw. wiąz. H
Naz.: A-H glicyna (Gly, G); A-CH3 alanina (Ala, A); A-CH<(CH3)2 walina (Val, V); A-CH2-CH<(CH3)2 leucyna (Leu, L); A-CH2-CH2-S-CH3 metionina (Met. M.) A∨ prolina (Pro, P); A- CH2-SH cysteina (Cys. C); A- CH2-B fenyloalanina (Phe); A- CH2-B-OH tyrozyna (Tyr); A- CH2-<|N \H>B tryptofan (Trp); A-(CH2)3-NH-C-(=NH2+)(-NH2) arginina (Arg, R); A-(CH2)4-NH3+ lizyna (Lys, K); A- CH2-<|N \H|N+H> histydyna (His, H), A- CH2-COO - asparaginian (Asp, D); A-(CH2)2-COO-- glutaminian (Glu, E); A- CH2OH seryna (Ser, S); A- CH\(CH3)-OH treonina (Thr, T); A- CH2-CO-NH2 asparagina (Asn, N); A-(CH2)2-CO-NH2 glutamina (Gln, Q);
3. Właściwości amfoteryczne aminokwasów, punkt izoelektryczny, metoda rozdziału mieszaniny aminokwasów.
Właść. fiz. aminokw- bezbarw. subst. krystal, rozp. w wodzie, rozkład. się zanim osiągną pkt. topnienia, zawier. zasad. gr. aminowe i kwaso. gr. karboksyl, są amfoterami, ulegają wewnątrzcząst. r. kwas-zasada i wyst. gł. w formie jonu dipolowego lub obojnaczego. Jon obojnaczy ma właść. soli. Jako amfoteryczne aminokw. reagują jak kw. lub zasad. w zal. od warónków. W wodnym kwaśnym roztw. jon obojnaczy przyłącza proton kation:. W roztw. zasad. traci protonanion. Pkt. izoelektryczny- istnieje pośrednie pH przy którym istnieje równowaga między formą kationową i anionową-takie pH to pkt.izoelektr.aminokw. Pkt. ten zależy od strukt. aminokw: aminokw. o oboj. łańcuchach (pH 5.0-6.7),z kwasow. rodnikami (niskie pH) a zasadowe(wysokie pH). Różnice pkt. izoelektr. wykorzyst. się do rozdziału miesz. aminokw. na czyste składn= Elektrofaza- roztwór różnych aminokw. umieszcza się pośrodku paska bibuły, zostają one zwilżone roztw. buforu o znanym pH i do końca paska przyłącza się elektrody, napięcie el. powoduje iż aminokw. o ład.- migrują do elektrody +,aminokw. o ład.+ do elektrody -,ponieważ aminokw. różnią się szybk. migracji to można je od siebie separować.
4. Reakcje aminokwasów.
1.A+alk.=ester H2N-CH\R1-COOH+HOR2 -(HCl)HOH+H2N-CH\R1-CO-OR2 2. z HNO2=hydroksykwas (met. van Slyke'a) H2N-CH\R-COOH+HNO2HOH+ HO-CH\R-COOH+N2 3. reak. z ninhydryną (met. kolorymetrii) 4. 1-fluoro-2,4-(dinitrobenzen)* + AHF + 1-NH-CH\R-COOH-2,4-()* Syn.: 1. reak. Hella-Volharda-Zielińskigo α-bromowanie k. za pomocą Br2 i PBr3 oraz nukleofilowe podstawienie bromokwasu amoniaku: CH3CH\CH3-CH2-[CH2]*COOH—(Br2, PBr3HOH)... -[CH\Br]*...—(nadmiar NH3) CH3CH\CH3-CH2-A 2. synteza α-A met. Streckera: B-CH2CHO—(NH4Cl,KCN,w.)B-CH2CH\NH2-C≡N—(H3O+)B-CH2CH\NH2COOH 3. redukcyjne aminowanie α-oksykwasów: CH3C\O-COOH—(NH3, NaBH4)Ala.
5. Peptydy, wiązanie peptydowe-jego struktura i formy rezonansowe.
Peptydy: polimery A, wyst. wiązanie peptydowe tzn. gr. aminowa jednego A łączy się z gr. karbo. drugiego A itd. np.: alanina+seryna=alanyloseryna; wiązanie peptydowe ma bud. o istotnym znaczeniu dla struktury białka, wiązanie C=O i N-H są w nim równoległe z niewielkim skręceniem w stosunku do wiązania C-N, jest to efektem występowania 2 form rezonansowych wiązania podwójnego O=-- C-N<H⇔(O-)>C=N+<H wiązanie peptydowe jest płaskie i wyst. w 2 formach: cis (ta sama) i trans
Kowalencyjność wiąz. w peptydach- at. azotu gr. peptydowej nie jest zasad, nakładanie powod. że wiąz C-N ma char. wiąz. podwójn. Wiąz. peptydowe (amidowe): wiąz. C=O i N-H są w nim równoległe z niewielkim skręc. w stos. do wiąz. C-N. Wiąz peptydowe jest płaskie i wyst. w dwu formach: trans [C(=O,-C-)-N(-C-,H)]i cis[C(-C-,=O)-N(-C-,-H) (przy prolinie-cis).Wiąz. to łączy sąsiednie aminokw. w łańcuchu białkowym czy peptydowym, sąsiednie łańcuchy w białkach, zakrzywia łańcuch tworząc pętlę. Drugim kowalencyjnym wiąz. jest wiąz. między resztkami cysteinowymi: RS-SR lub CyS-CyS.
6. Klasyfikacja białek, podstawowe białka krwi oraz mleka.
1) b. proste (proteiny)-wyniku hydrolizy dają jedynie A, dzielimy na: a)protaminy- charkter zasadowy zaw. dwu-A (Arg, Lys, Orn, His), niezaw. A aromat. roz. się w w. wyst. wyłącznie u zwierząt. Nie ulegają działaniu pepsyny, są trawione przez enzymy jelit; b)histony- zasadowe, zaw. A egzogenne i dipeptydy, wyst. w jądrach kom. w połączeniu z k. nukleinowymi, w limfocytach, mleczku ryb i w hemoglobinie; c)albuminy- kwasowe zaw. A siarkowe (Cys) roz. się w w. i rozcieńczonych solach wyst. u zierząt i roślin np.: leukozyna żyta, legamina grochu, ovoalbumina jaj; d)globuliny- słabo kwaśne zaw. głównie Arg, Asp, Glu, His, Lys nieroz. w w. ale w rozcięczonych solach, wchodzą skł. hemoglobiny np.: globulina mleka, glucynina soi, fazolenina fasoli; imuoglobuliny- zwane przeciwciałami (białka obronne w krwi) e)prolaminy- odczyn obojętny, zaw. dużo glutaminianu, Pro, N amidowego a mało Lys, roz. się w rozcięczonych k. i zasadach, a nie w w. i roztworach soli, wyst. w nasionach trawy i przenicy; f)glutaliny- obojętne zaw. dużo Pro i k. Glu, Lys i Trp, roz. w rozcięczonych k. i zasadach a nie w w., alkoh. i roztworach soli, wyst. w nasionach zbóż np.: gluten mąki g)skleroproteiny- wys. w org. zwierząt w tkankach podporowych i osłaniających. Mają strukturę włóknistą wydłużoną. Zbud. z nich tkanka ma dużą elastyczność i wytrzymałość należą do nich kreatyna, kolagen, fybroina.
2)B. złożone (proteidy)- hydrloiza daje A, węglowodany, tłuszcze, k. nukleinowe. a)nukloprodeidy (k. nukleinowe, zasady pirymidowe i purynowe)-obejmują gr. białek i polipeptydów (głównie zasadowych), które są związane w kompleksy z k. nukleinowymi (DNA, RNA), wiązaniami kowalencyjnymi, wyst. w jądrach kom. ; b)glikoproteidy- wyst. u roślin i zwierząt, zaw dużo S, mało C, i N oraz oligosacharydy roz. w w. wyst. jako śluzowate subst. błon przewodu pokarmowego oraz w ścięgnach są niemi przeciwciała, białka surowicy, enzymy; c)lipoproteidy- b. sprzężone z lipidami ich gr. niebiałkową są k. tłuszczowe lub steryny, a lecytoprotein: fosfadydy. Wyst. głównie w bogatych tłuszcz zarnistościach, plazmy krwi i żółtku jaj; d)chromoproteidy- gr. białek których skł. niebiałkowym jest subst. barwna a części białkowa globina np.: chemoglobina, chloroplastyna roślin; e)metaloproteidy- zaw. różne jony met. związane bezpośrednio z białkiem np.: ferredoksyny, ferrytyna.
3)b. krwi- a)hemoglobina- białko z gr. hemoprotein, roz. się w w, Hem. zbudowana jest z 4 pierścieni pirolowych połączonych wiązaniami metinowymi C-CH-C po przez jon Fe2+ Rola Hem. polega na transporcie O2 (nie zmienia stopnie utl.) za pośrednictwem naczyń krwo, pod działaniem czyników utl. przechodzi w methemoglobine zaw. Fe+3, powstaje w czasie gotowania mięsa.;
b)fibrynogen i fibryna- stanowią odrębną gr. białek odp. za krzepnięcie krwi, rozp. w wodzie, pod działaniem np. sacharydy fibrynogen -> fibryne (powoduje krzepnięcie krwi)
4)b. mleka- stanowi 3% mleka krowiego zaw. kazeine- jest fosfoprotoiną bo ma foforany związane estrowo z gr. -OH, seryny i treoniny. (np.: sery twarogowe) albumine i globuline.
5)b. serwatki- po oddzieleniu z mleka wytrąconej kazeiny pozostaje żółty roztwór serwatka zawierająca, albumine i globuline
7. Podział białek wg ich budowy przestrzennej-struktura białek.
1. b. fibrylarne (włókienkowe) np.: kreatynę, kolagen, składają się z łańcuchów polipeptydowych ułożonych obok siebie w długie włókna, nie rozp. się w w. dlatego budują tkanki konstrukcyjne.
2. b. globularne (kłębuszkowe)- rozp. w w., swobodnie przemieszczają się w obrębie komórki
Struktura b.- łańcuch polipeptydowy b. fałduje się dzięki czemu powstaje specyficzny kształt b. czyli konformacja (przestrzenne ułożenie atomów tworzące cztery poziomy struktury b.) To fałdowanie łańcucha jest spowodowane rotacją wokół Cα-N i Cα -C.
Struktura 1°- liniowa sekwencja A połączonych wiąz. peptydowymi oraz innymi kowalencyjnymi.
Struktura 2°- wys. regularne pofałdowanie regionów łańcuch polipeptydowego np.: helisa α, struktura β, wiązania H tworzą się między O karbonylowym wiązania peptydowego a H z NH2 czwartego A, w strukturze β wiązania H powstają miedzy wiązaniami peptydowymi różnych łańcuchów polipeptydowych, płaskie wiązanie peptydowe sprawia że łańcuch polipeptydowy przyjmuje postać pofałdowanej kartki z łańcuchami bocznymi A↑ i ↓ tej warstwy, jest bardzo sztywna i wytrzymała.
Struktura 3°- b. rozp. w w. fałdują się pod wpływem energ. wymogu dzielenia nie polarnych A od wodnego hydrofilowego otoczenie, są one chowane w hydrofobowym wnętrzu struktury b.
Struktura 4°-powstaje między wieloma łańcuchami polipeptydowymi w b. te oddziaływania to wiązania kowalencyjne (disufidowe), niekowlencyjne (siły elektrostatyczne, wiązania H, oddziaływania hydrofobowe), wiązania Wan der Waalsa.
8. Rodzaje wiązań w peptydach i białkach. Rodzaje wiąz. utrwalaj. wtórną strukt. białek= gr. uczestniczące: -CH-C(=O)-HN-,-C(=O)-HN-CH-[wodorowe], HC-OH,HO-CH [wodorowe]; wiązania: HC-S-S-CH [disulfidowe], HC-C(=O)-O-NH2-CH [jonowe], HC-C(=O)-O-CH [estrowe], HC-C(=O)--S-CH [tioestrowe].
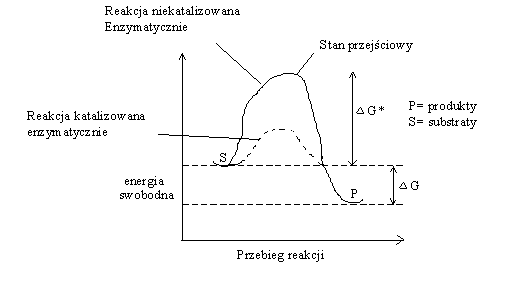
9. Rola i funkcje enzymów w organizmie.
Enzymy- katalizat. biochem, zwiększają szybkość r. nie ulegając zmianie, nie przesuwają równowagi r. Prawie wszystkie to białka, nie zmien. stanu energ. substr ,i prod, wpływają na barierę energet. r- E potrzebna do zainicjowania r. i przeprowadz. substr. w stan przejściowy-enzymy go stabilizują i zmniejsz. ΔG* (różnica E swob. między st. przejść. a substr- inform. o szybk. r).[ ΔG<0-r. energet. korzyst, ΔG>0 r. termodyn. niekorzyst]. ΔG- jest niezależna od drogi rea. i nie informuje o szybkości procesu o sz. rea. decyduje ΔG* Specyfika enzymu- aktywne i wydajne, katalizują jedną r, pasują do jedn. substr, wrażliwe na czynniki środow.
10. Budowa enzymów i teorie ich działania na przykładzie β-amylazy w stosunku do skrobi.
Chem. bud. enzymów- większ. to białka globularne, niektóre a)proteiny (z aminokw)- enzymy jednoskładnik- ich aktywn. związ. jest z gr specyficznie powiązanych aminokwasów b)proteidy- enzymy dwuskładnik. (zawier. część białkową- apoenzym i gr. prostetyczną (kofaktor) = haloenzym. Aktywnośc e. d. pochodzi od kofaktora. K. mogą być jony nieorg. Zn, Fe, Cu, Mn lub małe cząst. organiczne- koenzymy (witaminy) np. kozymaza. Rolą apoenzymu jest odpowiednie ustawienie kofaktrora w przestrzenienzymy. Mechanizm rea.- w indukownaego dopasowania struktura enzymu pod wpływem zbliżającego się substratu ulegają gr. funk. A. kontaktowych X, Y znalazły się w najbardziej korzystnym położeniu w stosunku do reaktywnych miejsc substratu. Reak. β-amylazy.
11. Aktywność enzymów i wpływ na nią czynników zewnętrznych; aktywatory i inhibitory.
Aktywn. enzymu- E. wyodrębnione z org. najczęściej nie są zupełnie czyste. by kreślenie ilości enzymu w preparacie należy zmierzyć jego wydajność w r. służy do tego jednostka aktywn. e.- liczba obrotów (LO)- liczba drobin substr. przereagowująca z jedną cząst. enzymu. Stężenie e. można wyznaczyć met. spektroskopowymi.
Wpływ czynn. zewn. na aktywn- T (pow. pewnej aktywn. spada z powodu temp. denaturacji białka enzymu- dezaktywac), pH (cecha char. enzymu, pod wpływ. dużego pH białko enzymu denaturuje się).
Aktywatory enzymów- subst. chem. nie denatyruj. białka enzymu, nie biorą. udziału w r enzymatycz. ale zwiększ. aktywn. enzymy: 1-osłaniające (proenzym), w proc. aktywacji usuwają gr. chem. maskującą aktywną część enzymu, 2-odhamowujące- czynn. redukujące przywrac. aktywn. enzymów zahamowaną w środ.utl. 3-czynne- jony Mn, Zn, Mo, Co są skład. niektórych enzymów, 4-emulgatory-sole kw. żółciowych, uczestniczą w hydrol. tłuszczów przez lipazy, 5-peptyzujące białko enzymu- zwiększ. aktywn. powierzchniową enzymu.
Inhibitory enzymów- subst. hamujące aktywn. enzymów w środ. r: 1-blokujące gr. czynne enzymu to narkotyki, HCN, CO blokują enzymy metaloproteidowe a gr. -SH są blok. przez O2, As, Hg; 2-hamowanie kompetencyjne (przez konkurencję) a)nagromadz. prod. r b)obecność połączeń o zbliżonej strukt. do bud. substr, c)obecność zw. o bud. podobnej do gr. prostetycznej enzymu: ApoKo(aktywny)+ In<=> Apo+ Ko+ In<=> ApoIn(nieakt)+ Ko; PABA-> SSAA.
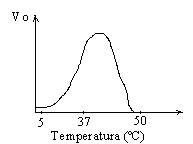
Wpływ temp. : - powyżej pewnej temp. aktywność spada z powodu temp. denaturacji białka enzymu (dezaktywacja). Każdy enzym ma swoisty zakres optymalnej temp.
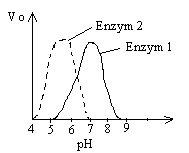
Wpływ stężenia jonów wodorowych - wartośc optymalnego pH jest cechą charakterystyczną enzymu. Niekiedy pokrywa się ono z pkt. izoelektrycznym białka enzymatycznego. Pod wpływem wysokiego pH białko enzymu denaturuje się.
12. Podział i nazwy enzymów i najważniejsze reakcje enzymatyczne.
Klasyfikacja według naz. zwyczajowych i naz. oznacz. czwórką liczb:1-klasa, 2-określa gr, wiąz, izomerię, 3-określa podklasy enzymów katalizujących substr, 4-nr enzymu w podklasie. Naz. enzymów: a)od naz. katalizowanych rea. dodając końcówkę -aza (np. hydrolaza- katalizuje reakcję hydrolizy), b)od nazw substr. r. dodając końcówkę -aza.
Hydrolazy (hydrolizują substr. przy udziale wody M-L+HOHM-OH+H-L) dzielimy je na 9 gr.:
Esterazy (hydrolizują estry na kw. i alk. Ac-O-R+HOH⇔Ac-OH+R-OH): a).kw. karboksylowych-hydroliz. estry kw. org R-C(=O)-O-R+HOH⇔R-C(=O)-OH+R-OH, np. lipazy, pektazy; b)fosfoesterazy: fosfomonoesterazy- hydroliz. fosforany jednoalkil: H-O-P(-OH,=O)-O-R+HOH⇔H-O-P(-OH,=O)-O-H+R-OH, fosfodwuesterazy- hydroliz. fosforany dialkilowe i przekształc. je w fosforany monoalkil. R-O-(P-OH,=O)-O-R+HOH⇔RO-P(-OH,=O)-O-H+R-OH; c) sulfatazy siark- hydroliz estry kw. siark H-O-S(=O,=O)-O-R+HOH⇔H-O-S(=O,=O)-O-H+R-OH.
Glikolidazy (hydroliz. wiąz.. glikozydowe w glikozydach i oligo- i poli- sacharydach): a)oligosachardazy; b)polisacharydazy np. α -amylaza
Amidazy (hydroliz. wiąz. C-N za wyjątkiem wiąz. peptydowego -CO-NH-: X-C(-X,-X)-N(-X)-X+HOH⇔X-C(-X,-X)-OH+H-N(-X)-X): a)aminazy- odhydrloiz. gr. aminowe pod post. amoniaku:
X-CH2-NH2+ HOH⇔X-CH2-OH+ NH3; b)acyloamidazy (hydroliz. gr. amidowe na amoniak i kw.) X-C(=O)-NH2+ HOH⇔ X-C(=O)-OH+ NH3; c)amidynazy (hydroliz .gr. amidynowe) X-NH-C(=NH)-NH2+ HOH⇔ X-NH2+O=C(-NH2)-NH2.
Proteazy (hydroliz. wiąz. peptydowe) X-C(=O)-NH-X+HOH⇔X-C(=O)-OH+H2N-X a)proteinazy; b)peptydazy
Fosfoamidazy- hydroliz. wiąz. P-N: X-N(-X)-P(-OH,=O)-OH+HOHX-N(-X)-H+HO-P(-OH,=O)-OH.
Polifosfatazy- hydroliz. wiąz. bezwodnikowe -P-O-P- w resztach kw. pirofosfor. X-P(-OH,=O)-O-P(-OH,=O)-X+HOH⇔X-P(-OH,=O)-OH+HO-P(-OH,=O)-X.
Halogenazy- hydrolit. odszczepiają at. chlorowców X-C(-X,-X)-Cl+HOH⇔X-C(-X,-X)-OH+HCl
Hydrolazy węglowo-siarkowe- hydroliz. wiąz. C-S: X-C(-X,-X)-S-R+HOH⇔X-C(-X,-X)-OH+R-SH: tioeterazy (R-S-R+HOHR-SH+R-OH), tioglikozydazy, tioesterazy (hydroliz. wiąz. C-S w tioestrach
R-C(=O)-S-R+HOH⇔R-C(=O)-OH+R-SH).
H. węglowo- hydroliz wiąz. C-C met. hydrolitycz. X-C(-X,-X)-(C-X,-X)-X+HOH⇔X-C(-X,-X)-OH+H-C(-X.-X)-X.
Transferazy- przenoszą at. lub gr. at. X z donora D na akceptor A: D-X+A-LD-L+A-X. Nie należą do nich hydrolazy i oxyreduktazy): transmetylazy- przenoszą rodnik metylo. -CH3:D-CH3+A-HD-H+
+A-CH3, transacylazy, transglikozydazy: D-glikozyl+ A-HD-H+A- glikozyl, transfosfatazy- przenoszą resztę kw.fosforo.-OPO3H2: D-OPO3H2+A-H⇔ D-H+A-OPO3H2, transminazy- przenoszą gr. aminową -NH2: D-CH(-X)-NH2+A-C(-X)=O⇔D-C(-X)=O+ A-CH(-X)-NH2, transdenilazy- D- kw. adenilowy +A-HD-H+A- kw. adenilowy, transpeptydazy- przenoszą reszty aminokw. D-CO-NH-CH(-R)-COOH+A-COOH⇔ D-COOH+A-CO-NH-CH(-R)-COOH, transsulfurazy- przenoszą at. S: D-SX+A-H⇔ D-H+A-SH
Oxydereduktazy- kataliz. r. utl. i red. w org. żywych: a)dehydrogenazy- kataliz. r. utleniając. odwodor. A=H2+BA+B=H2): tlenowe-przenoszą at. H na tlen powietrza dająd nadtl. wodoru A=H2+ +O2A+HOOH, beztlen- przenoszą at. H na inne niż O akceptory A=H2+BA+B=H2; b)oksydazy- przenoszą H z substr. na O powietrza dając wodę: 2A=H2+O2⇔2A+2HOH): monofenolooksydaza, askorbinaza, polifenoloksydazy, transelektronazy; c)peroksydazy- przenoszą at. H na wodę utlenioną A=H2+HOOHA+2HOH, wyst w tkankach, katalaza- rozkł. nadtl. wodoru na O i wodę 2HOOH2HOH+O2.
Liazy i syntazy- kataliz. r. rozerw. lub tworzą wiąz. chem: 1-desmolazy- rozryw. lub tworzą wiąz. C-C: X-C(-X,-X)-C(-X,X)-XX-C(C-X,-X)- + -C(-X,-X)-X): dekarboksylazy i karboksylazy- kataliz. r przyłącz. i odszczep.CO2: R-C(=O)-OHR-H+CO2, dekarboksylazy ketokw-powod.dekarboksylac.CO2,np.O=C(-CH3)-COOHCO2+O-C(-CH3)-H, dekarboksylazy aminokw- kataliz. r. dekarboksylacji aminokw. dając aminy H2N-CH(-R)-COOHCO2+H2N-CH2-R; 2-karboligazy-kataliz.r.kondensacji acylinowej aldehydów X-C(-H,=O)+C(-H,=O)-XX9C(-H,-OH)-C(=O)-X, 3-liazy triozofosforanów, adolaza drożdży; 4-hydrazy-kataliz.przył.do substr. lub odryw. od niego cząst. wody H-A-OHA+HOH; 5-liazy i syn. węglowo- azot- rozryw. lub syntez. wiąz. C-N, demoniakazy- odszczep. amoniak od substr. powod. utw. wiąz. C=C w jego cząst X-CH(-NH2)-CH2-XX-CH=CH-X+NH3; 6-hydrogenazy-kataliz.rozszczep. H cząsteszkow. na H at.H2⇔2H; 7-liazy wodoro- odszczep. lub przył. H do substr A=H2A+H2.
Izomerazy i racemazy- kataliz. przekształcenia wewn- cząst: 1-izomerazy: fosfoglukomutaza: glukozo-1-fosforanglukozo-6-fosforan, izomeraza fosfotrioz; 2-racemazy- kataliz. racemizację substr. L-XD-H -izomerantimer.
13. Węglowodany, podział i rola w organiźmie.
Węglowodany-w org. i DNA, mat. z którego syntezują białka, tłuszcze i inne subst, są wielohydroksyl. pochodnymi aldehydów i ketonów, wzór CnH2nOn.Podział: 1-cukry proste, jednocukrowce, monosacharydy, monozy, 2-cukry złożone, wielocukrowce, poliozy: oligosacharydy i kilkucukrowce, polisacharydy i wielocukrowce. W r. hydrol: polisacharydoligosacharydmonosacharyd. Są syntezowane w proc. fotosyntezy: 6CO2+6H2O⇔6O2+C6H12O6->celuloza,skrobia. Główne źródło E w org.
14. Budowa monosacharydów - struktura i konfiguracje Fischera i Hawortha.
Monosacharydy - cukry proste o ogólnym wzorze CNH2NON, zawierające 3 - 10 at. C. W zależności od liczby at. O w cząsteczce nazywają się triozy, tetrozy, pentozy, itd. Monosacharydy dzieli się na ALDOZY (wielohydroksyaldehydy) i KETOZY (wielohydroksyketony).
Aldehyd glicerynowy - najprostsza aldoza, ma jeden asymetryczny (chiralny) at. C - ma więc 2 enancjomery:
prawoskrętny (konfiguracja R) lewoskrętny (konfiguracja S)
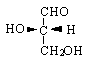
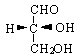
PROJEKCJA FISHERA - dzięki niej można wzory stereogeniczne pokazać na płaszczyźnie
1) tetraetryczny at. C przedstawiony jest w projekcji przez 2 skrzyżowane linie. Linia pozioma pokazuje wiązania wychodzące ponad płaszczyznę papieru, a linia pionowa - gr. znajdujące się pod płaszczyzną papieru.
2) karbonylowy at. C umieszcza się w górnej części projekcji
Aldehyd R-glicerynowy ma więc wzór projekcyjny:
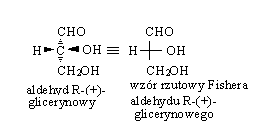
Fisher wprowadził również nomenklaturę stereochemiczną - stosuje on „D” do przedstawienia (+)aldehydu glicerynowego, w którym gr. OH jest po stronie PRAWEJ; jego enancjomer z gr. OH po LEWEJ stronie oznacza się jako aldehyd L(-) glicerynowy. Gr. aldehydowa jest na górze.
Fisher tym systemem objął również inne monosacharydy. Obowiązuje zasada - jeżeli najbardziej oddalony od gr. aldehydowej lub ketonowej asymetryczny at. C ma taką samą konfigurację jak aldehyd D- glicerynowy to związek jest D-cukrem. Jeśli konfiguracja jest taka jak w L-aldehydzie to jest L-cukrem.
PROJEKCJA HAWORTHA - to rodzaj projekcji chemicznej charakterystycznej dla półacetalowych (cyklicznych) odmian cukrów. W projekcji Hawortha używa się uproszczonych wzorów perspektywicznych. Chociaż oddają one rzeczywisty wygląd cząsteczek półacetalowych odmian cukrów znacznie lepiej niż wzory Fischera, nie uwzględniają pewnych istotnych szczegółów ich struktury (kąty wiązań, pofałdowanie łańcucha węglowego). Przy przedstawianiu wzorów cukrów za pomocą projekcji Hawortha stosuje się następujące reguły:
- grupę CH2OH pisze się zawsze do góry (ponad płaszczyzną pierścienia; ew. wyjątki w przypadku istnienia w związku kilku grup CH2OH)
- we wzorach cukrów szeregu D w przypadku anomerów α grupa hydroksylowa przy pierwszym atomie węgla jest skierowana do dołu (pod płaszczyznę pierścienia)
- we wzorach cukrów szeregu D w przypadku anomerów β grupa hydroksylowa przy pierwszym atomie węgla jest skierowana do góry (ponad płaszczyznę pierścienia)
- we wzorach cukrów szeregu L sytuacja jest odwrotna
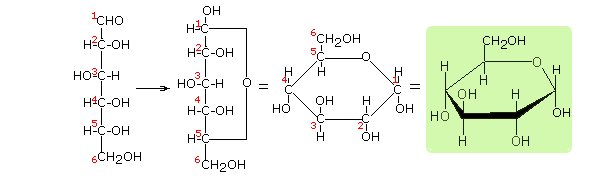
Wzór Hawortha - glukoza
Tafelkowe projekcje Hawortha nie dają trójwymiarowego obrazu konformacji cząsteczkowej. w rzeczywistości cząsteczki cukrów mają budowę krzesełkową.
15. Aktywność optyczna cukrów - mutarotacja.
Optyczna aktywność cukrów zwierających kilka asymetrycznych at. C nie jest jednoznacznie określona poprzez przynależność do określonej rodziny: D lub L.D-monoza może skręcać płaszczyznę polaryzacji światła w lewo, a L-monoza w prawo. Dlatego rzeczywistą skręcalność w prawo oznacza się dodatkowym symbolem (+), a w lewo (-).
MUTAROTACJA - zjawisko samorzutnego zmieniania się skręcalności właściwej roztworu monosacharydu wraz z upływem czasu. Mutarotację tłumaczy się przechodzeniem anomeru α w formę anomeru β poprzez formę łańcuchową i ustaleniu się stanu równowagi pomiędzy tymi trzema formami w roztworze wodnym.
Przykład:
Gdy rozpuścimy α-D-glukozę, to jej skręcalność spada z +112º do +52º. Gdy rozpuścimy β-D-glukozę skręcalność zmienia się z +19º do +53º.
Dwa diastereoizomery α i β nazywane są ANOMERAMI, a hemiacetalowy at. C - centrum anomerycznym.
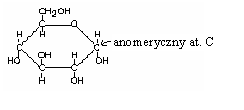
Skręcalność właściwą cukrów w roztworze można wykorzystać w obliczeniu zawartości obu anomerów w tym roztworze. Np. skręcalność D-glukozy [α]= +112º , [β]= +19º , a roztworu w stanie równowagi +52º. Obliczenie zawartości obu form w roztworze:
112 - 52 60
---------- x 100 = ---- x 100 = 64,5% [β] formy α jest 100 - 64,5 = 35,5%
112 - 19 93
Mutarotacja przebiega przez odwracalne otwarcie pierścienia każdego z anomerów do otwarto-łańcuchowego aldehydu, oraz ponowne zamknięcie do drugiej formy cyklicznej. Zdolność przechodzenia form w siebie nosi nazwę INTERKONWERSJI.
16. Reakcje chemiczne monosacharydów: reaktywność grup hydroksylowych i karbonylowych.
Reakcje monos: właśc. chem- podobne do alkoh- gr.- OH mogą być przekształc. w estry i etery, cukry rozp. się w wodzie, przez jej odpar. dają syropy, cukry nie rozp. się w rozpuszczalnik. org. Red. mozos- aldozy i ketozy red. się do odpowied. alkoh. wielohydroksyl -D-glukopiranoza C(-H,=O)-C(-H,-OH)-C(-OH,-H)-C(-H,-OH)-C(-H,-OH)-CH2OHNaBH4, H2OCH2OH-C(-H,-OH)-C (-OH,-H)--C(-H,-OH)-C(-H, -OH)-CH2OH [adiltol], przy red. ketoz C gr. ketonowej staje się C* i powst .dwa stereizom. CH2OH-C(=O)-C(-OH,-H)-C(-H,-OH)-C(-H,-OH)-CH2OHred,+2HCH2OH-C(-H,-OH)-C(-OH,-H)-C(-H,-OH)-C(-H,-OH)-CH2OH [D-sorbitol]+CH2OH-C(-OH,-H)-C(-OH,-H)-C(-H,-OH)-C(-H,-OH)-CH2OH[D-mannitol], silne środki red. redukują do węglowod. CH(=O)-(CH-OH)n-CH2OH redCH2OH-(CH-OH)n-CH2OHredCH3-(CH2)n-CH3, CH2OH-C(=O)-(CH-OH)n-CH2OHredCH2OH-C(=O)-(CH-OH)n-CH2OHredCH3-CH2-(CH2)n-CH3 Utl. aldoz: słabe środki- powst. kw. aldonowesilny utlkw. dwukarboksyl CH(=O)-(CH-OH)n-CH2OHutlCOOH-(CH-OH)n-CH2OHutlCOOH-(CH-OH)n-COOH, glukoza tak samokw. cukrowy. Oksydacja aldoz: z odczynn. Tallensa- powst lustro srebro. R-CHO+2Ag(NH3)2++3OH-RCOO-+2Ag+4NH3+2H2O, z oczynn. Benedicta RCH=O+2Cu2++5OH-RCOO-+Cu2O+3HOH.Cukry red. reag. z nimi Utl. ketoz: uleg. częśc. degradacji CH2OH-C(=O)-C(-OH,-H)-C(-H,-OH)*2-CH2OHutlH-COOH+COOH-C(-OH,-H)-C(-H,-OH)*2-COOH albo COOH-COOH+COOH-C(-H,-OH)*2-COOH.
17. Produkty utleniania i redukcji aldoz. \Prod. utl. i red. węglowod: C(-H,=O)-C(-H,-OH)-C(-OH,-H)-C(-H,-OH)*2-CH2OH:NaBH4CH2OH-...,Br2 i H2OC(-HO,=O)-...,HNO2C(-HO,=O)-...-C(-HO,=O),ROH i H Clglikozyd. +16-utl.aldoz
. 18. Najważniejsze dwucukrowce - maltoza, laktoza, sacharoza - budowa i zastosowanie. Produkcja sacharozy.
MALTOZA - glukoza + glukoza - to cukier słodowy; występuje w kiełkujących nasionach zbóż. Powstaje podczas hydrolizy skrobi pod działaniem amylaz.
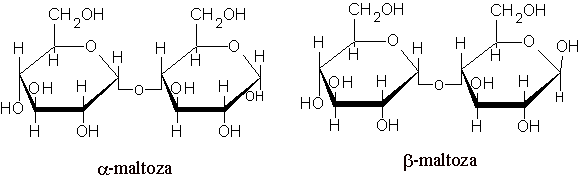
Jest cukrem redukującym. Utlenia się na kw. maltobionowy. Jest 2,5 razy mniej słodka od sacharozy. Używa się ją do środków spoż. dla dzieci oraz jako dodatek do produktów dietetycznych i cukierniczych.
LAKTOZA - glukoza + galaktoza - to cukier mleczny; znajduje się w mleku zwierząt.
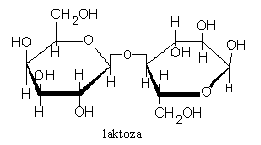
Jest znacznie mniej słodka od sacharozy. Nie ulega fermentacji z drożdżami zwykłymi, ale pod działaniem drożdży laktozowych. Bakterie kwasu mlekowego przekształcają ją w kw. mlekowy, co stanowi podstawę procesu kwaśnienia mleka. Enzym laktaza hydrolizuje ją na galaktozę i glukozę. Laktozę otrzymuje się z serwatki po oddzieleniu kazeiny. Jest cukrem redukującym. Utlenia się ją do kw. laktobionowego.
SACHAROZA - glukoza + fruktoza - cukier trzcinowy, buraczany; najważniejszy disacharyd o zastosowaniach przemysłowych.
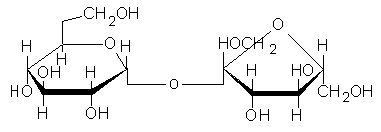
Jest najbardziej rozpowszechniona w przyrodzie. Występuje we wszystkich fotosyntezujących roślinach, a zwłaszcza w ich korzeniach. Jest bezbarwna, krystaliczna, rozpuszczalna w wodzie. Jest cukrem redukującym. Nie wykazuje zjawiska mutarotacji. Sama sacharoza nie ulega fermentacji, ale łatwo hydrolizuje i produkty jej
hydrolizy są fermentowane przez drożdże i bakterie. Sacharoza ogrzana powyżej temp. topnienia ulega karmelizacji.
Sacharozę otrzymuje się na dużą skalę przem. z :
- trzciny cukrowej przez wytłoczenie soku, jego oczyszczanie i doprowadzenie do wykrystalizowania
- z buraka cukrowego przez ekstrakcję ciepłą wodą w dyfuzorach, oczyszczenie soku dyfuzyjnego w kolejnych procesach defekacji Ca(OH)2 i saturacji CO2, zagęszczenie oczyszczonego soku w wyparkach próżniowych i odwirowanie wydzielonych kryształków sacharozy. Dalej sacharozę poddaje się rafinacji.
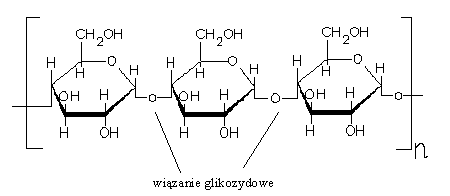
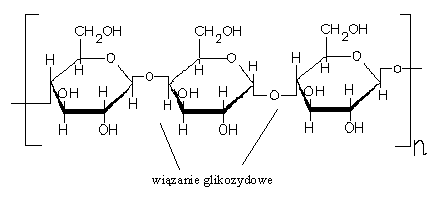
19. Cukry złożone: struktura i właściwości wiązań glikozydowych na przykładzie sacharozy i skrobi.
Cukry złożone są produktami kondensacji dwóch lub więcej cząsteczek cukrów prostych i podczas hydrolizy rozkładają się na cukry proste. Są to połączenia wielocząsteczkowe, gdzie poszczególne reszty monosacharydów w łańcuchu polisacharydu są powiązane glikozydowo za pośrednictwem hydroksyli półacetylowych i innych gr. hydroksylowych reszt aminokwasów.
Wiązanie glikozydowe - Wiązanie chemiczne tworzone przez grupę hydroksylową znajdującą się przy atomie węgla pierścieniowej formy cukru prostego. Jeśli w tworzeniu wiązania glikozydowego uczestniczy grupa hydroksylowa innej cząsteczki, powstaje wiązania O-glikozydowe (np. w dwucukrach i wielocukrach). Może również w tworzeniu tego wiązania uczestniczyć grupa =NH.
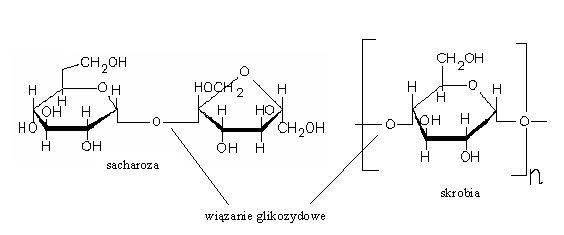
Wyjątkowe połączenie glikozydowe, w którym udział biorą grupy hydroksylowe połączone z węglami C1-C2. Ponieważ wiązanie glikozydowe blokuje oba karbonyle, sacharoza nie jest cukrem redukującym, nie ulega mutarotacji i nie tworzy osazonu.
20. Budowa i właściwości skrobi.
SKROBIA - stanowi materiał zapasowy i odżywczy roślin i jest najważniejszym pożywieniem węglowodanowym zwierząt i ludzi. Syntezowana jest w tzw. chloroplastach zielonych części roślin w procesie fotosyntezy; to polimer glukozy, w którym jednostki monosacharydów połączone są wiązaniem 1,4`-α-glikozydowym. Ziarna skrobi składają się z 2 warstw:
- AMYLOZY (20% masy skrobi) - łatwo rozp. w wodzie na roztwór koloidalny o małej lepkości; zbudowana jest z reszt α-D-glukopiranowych połączonych wiązaniami 1,4`; ma budowę kłebkową.
- AMYLOPEKTYNY - trudno rozp. w wodzie; tworzy gęste, kleikowate roztwory; jest silnie rozgałęziona, zawierając wiązania 1,6`-α-glikozydowe na rozgałęzieniach.
Właściwości skrobi:
Skrobia hydrolizuje podczas gotowania z rozcieńczonymi kwasami lub pod wpływem enzymów diastazy (α- i β- amylazy). W wyniku hydrolizy skrobia pęka na dekstryny, maltozę i w końcu glukozę. Proces ten nazywa się też scukrzaniem skrobi, bo powstają słodkie produkty.
+(n-1)H2O
(C6H10O5)n x (C6H10O5)n/x n/2 C12H22O11 n C6H12O6
Skrobia dekstryny maltoza glukoza
Zastosowanie skrobi:
-skrobia ziemniaczana - cukiernictwo, krochmal, zagęszczanie farb i barwników, produkcja alkoholu.
-skrobia jęczmienna - piwowarstwo
-skrobia zbożowa - gatunkowe alkohole
-skrobia ryżowa - pudry, zasypki, żywienie dietetyczne, budynie, kisiele, kremy.
21. Wszystko o celulozie. Reakcje polisacharydów na przykładzie celulozy. Zastosowanie produktów tych reakcji.
CELULOZA (błonnik) - najbardziej rozpowszechniony w przyrodzie polisacharyd. Jest to składnik drewna i błon komórkowych roślin. Czysta celuloza jest biała, włóknista, bez zapachu i smaku. Nie rozp. się w wodzie, alkaliach, kw. i rozpuszczalnikach org. W kwaśnych roztworach stopniowo i nieodwracalnie ulega hydrolizie. Odporność celulozy na hydrolizę wykorzystuje się by oddzielić ja od innych ulegających hydrolizie subst. Rośliny syntezują celulozę z CO2 i H2O korzystając z en. słonecznej.
Produkcja celulozy:
- metoda sulfitowa (siarczynowa) - drewno lub słomę ogrzewa się z roztworem kwaśnego siarczynu wapnia. Hydrolizuje on domieszkę ligniny, pozostawiając niezmienioną celulozę w postaci gąbczastej masy. Po jej przemyciu wodą i przepuszczeniu przez sita można celulozę prasować na arkusze. Pozostające prod. uboczne tej metody są szkodliwe dla środowiska.
- metoda siarczanowa - rozdrobnione drewno ogrzewa się ługiem sodowym i siarczanem sodu. Lignina ulega hydrolizie, pozostaje celuloza - prasowana w arkusze lub bloki. Pozostały ług jest regenerowany do ponownego użycia. Takie celulozowanie jest ekologiczne.
Struktura celulozy:
Jest ona nierozgałęzionym polimerem glukozy połączonej wiązaniami 1,4`-glikozydowymi. Zbudowana jest ona z prostych łańcuchów złożonych z jednostek celobizowych. Łańcuchy powiązane są między sobą wiązaniami wodorowymi - O - H….O - H. Włókna te mają dużą wytrzymałość i elastyczność - są owinięte spiralnie wokół osi centralnej. Z celulozy zbudowane są: drewno, bawełna, konopie, len, słoma.
Reakcje celulozy:
a) hydroliza enzymatyczna - pod wpływem celulazy (bakterie, grzyb domowy) przekształca się w celobiozę (dwucukrowiec), następnie β-D-glukopiranozę, która poprzez interkonwersję daję D-glukozę.
b) estryfikacja - każda jednostka glukozy zawiera 3 gr. - OH. Można je modyfikować stosując związki reagujące z alkoholami. Działając na celulozę bezwodnikiem octowym otrzymujemy octan celulozy. Estryfikacja kw. azotowym daje azotan celulozy (nitroceluloza).
Nitrocelulozy stosowane są do produkcji: celuloidu - tworzywa sztucznego do wyrobu drobnych przedmiotów użytkowych, folii, oklein; jedwab chardoneta - włókno; lakierów, emalii; bawełny strzelniczej.
c) alkalizowanie celulozy - celuloza z roztworami wodorotlenków alkalicznych (MOH) nie ulega hydrolizie, ale daje ALKALICELULOZĘ, o charakterze alkoholanu. Pod wpływem wody rozpada się na MOH i hydrocelulozę o innej strukturze podatnej na barwienie (merceryzowanie włókien i tkanin bawełnianych)
d) eteryfikowanie celulozy - etery celulozy tworzą się w reakcji halogenów alkilowych z alkalicelulozą:
[C6H7O2(OH)3]n + NaOH alkaliceluloza (+CH3I) [C6H7O2(O-CH3)3]n
Metylo-, etylo-, benzyloceluloza są stosowane jako kleje, zagęszczacze farb, preparaty kuracji odchudzających.
e) reakcja celulozy z disiarczkiem węgla
celuloza (+NaOH) alkaliceluloza (+CS2) celulozoksantogenian sodowy
Produkuje się z niego sztuczny jedwab wiskozowy i celofan.
22. Budowa, reakcje i zastosowanie tłuszczów. Hydroliza i utwardzanie tłuszczów.
Tłuszcze występują w przyrodzie jako subst. zapasowe i odżywcze roślin i zwierząt. W organizmach zwierzęcych tłuszcze znajdują się we wszystkich tkankach, a w roślinach - w owocach i nasionach. Tłuszcze mają dużą wartość kaloryczną, gdyż zawierają znacznie mniej tlenu niż białka czy węglowodany.
Budowa tłuszczy:
Tłuszcze są estrami gliceryny i kw. tłuszczowych, czyli glicerydami kw. tłuszczowych. W cząsteczce gliceryny mogą być zestryfikowane 1,2 lub 3 gr. hydroksylowe:
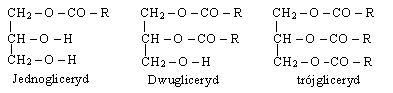
Każda cząst. może zawierać trzy identyczne lub trzy różne reszty kw. tłuszczowego. Wyróżniamy trójglicerydy mieszanie lub proste. W zależności od rozmieszczenia 3 reszt kwasowych w drobinie tłuszczu mogą istnieć 3 izomery - powoduje to, iż w przyrodzie występuje ogromne bogactwo tłuszczów naturalnych (masło, smalec, soja, kukurydza, słonecznik, len). Skład tł. naturalnego zależy od rodzaju zwierzęcia lub rośliny. Zmienia się on w zależności od karmienia i wegetacji, np. temp. otoczenia.W tł. naturalnych występują kw. tłuszczowe nasycone, nienasycone, hydroksykwasy tłuszczowe, cykliczne kw. tłuszczowe i kw. o anormalnej budowie. Wł. chem. tłuszczy wynikają z obecności w nich wiązań estrowych, wiązań C=C i gr. - OH.
Reakcje:
a) utlenianie tłuszczy - nienasycone reszty kwasowe utleniają się na powietrzu lub enzymatycznie. W wyniku utlenienia powstają gr. - OH, CHO, C=O oraz kw. dwukarboksylowe. Reakcje te zachodzą podczas jełczenia tł.
b) uwodornienie tłuszczy - podczas działania H na tłuszcz zawierający reszty kw. nienasyconych następuje przyłączenie H do wiązań podwójnych i reszt kw. nienasyconych ulegają przekształceniu w reszty kw. nasyconych:
CH3 - (CH2)7 - CH = CH - (CH2)7 - COOH + (H2, kat) CH3 - (CH2)7 - CH2 - CH2 - (CH2)7 - COOH
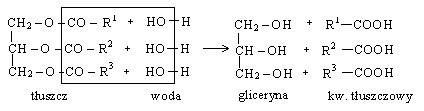
Proces ten nazywa się UTWARDZANIEM tłuszczy. c) hydroliza tłuszczy - nosi też nazwę zmydlania tł.; prowadzi do powstania gliceryny i kw. tłuszczowych.
Proces ten prowadzi się:
- w śr. kwaśnym - polega na katalicznym działaniu jonów wodorowych w procesie hydrolizy. Reakcję prowadzi się ogrzewając tłuszcz z rozcieńczonym kw. siarkowym do temp. powyżej 100ºC w naczyniu zamkniętym. Produktami są wolne kw. tłuszczowe i gliceryna. Kw. tł. tworzą górną warstwę na powierzchni wodnego r-ru gliceryny
- w śr. alkalicznym - polega na ogrzewaniu tł. w r-rze NaOH lub KOH:

- wodą w obecności katalizatora - polega na ogrzewaniu tł. wodą z dodatkiem ZnO lub MgO jako katalizatora do temp powyżej 100ºC w autoklawie. Uzyskuje się czyste kw. tł. tworzące górną warstwę nad wodnym r-rem gliceryny
- wodą bez katalizatora - pod wysokim ciśnieniem i w wysokiej temp. rozpuszczalność kw. w wodzie jest znacznie większa. Proces ten może być prowadzony w sp. ciągły i daje w wyniku czyste kw. tł. i czystą glicerynę
- zmydlanie metodą enzymatyczną - przebiega pod działaniem enzymów z gr. lipaz w temp. 30-40ºC, dając w wyniku wolne kw. tł. i czystą glicerynę
Zastosowanie:
- produkcja mydeł
- produkcja farb i lakierów
- w lecznictwie - maści, czopki, kremy, zastrzyki
- w przem. spoż. - oleje, masło
23. Nasycone i nienasycone tłuszcze roślinne i zwierzęce. Metody ich otrzymywania.
Nasycone kw. tłuszczowe mają ogólny wzór CNH2NO2 lub CNH2N+1COOH. Kwasy te zawierają parzystą liczbę at. C i ich łańcuch jest nierozgałęziony. Do C10 kwasy są cieczami, powyżej - ciałami stałymi o temp. topnienia wzrastającej wraz z liczbą at. C. Niższe kw. tł. łatwo rozp. się w wodzie, dalsze coraz trudniej. Kw. tł. do C10 mają zapach zjełczałego tłuszczu.
Podział:
Kwas |
Występowanie |
Kw. octowy |
tłuszcz z nasion roślin balsaminowatych |
Kw. n-mirystynowy |
masło, olej kokosowy, tł. zwierzęce |
Kw. n-laurylowy |
masło, olej wawrzynowy, kokosowy |
Kw. n-palmitynowy |
tł. roślinne i zwierzęce |
Kw. n-stearynowy |
tł. roślinne i zwierzęce |
Kw. n-arachidonowy |
olej arachidowy |
Nienasycone kw. tłuszczowe zawierają w cząsteczce jedno lub więcej wiązań podwójnych. W zależności od stopnia nasycenia tworzą:
Szereg |
Cecha szeregu |
Najważniejszy kwas |
Występowanie |
Szereg kw. olejowego |
1 wiąz. podwójne |
Kw. olejowy |
Oleje roślinne |
Szereg kw. linolowego |
2 wiąz. podwójne |
Kw. linolowy |
Oleje schnące i półschnące |
Szereg kw. linolenowego |
3 wiąz. podwójne |
Kw. linolenowy |
Oleje: lniany, knopny |
Kw. o wyższym st. nasycenia |
4-5 wiąz. podwójnych |
Kw. arachidonowy |
Masło, tł. zwierzęce |
Hydroksykwasy tłuszczowe |
1 lub więcej gr. - OH |
Kw. rycynolowy |
Olej rącznikowy (rycynowy) |
Cykliczne kw. tłuszczowe |
5-członowe pierścienie alicykliczne |
Kw. czoulmugrowy |
Olejek czoulmugrowy |
Kw. o anormalnej budowie |
Nieparzysta liczba at. C lub łańcuch rozgałęziony |
Kw. izowalerianowy |
Tł. bakterii, lanolina |
Temp. topnienia kw. nienasyconych są niższe niż temp. topnienia kw. nasyconych. Niektóre z tych kw. są niezbędne do normalnego przebiegu funkcji życiowych organizmu zwierzęcego, a ich brak wywołuje choroby.
Metody otrzymywania:
- wytapianie - do otrzymywania stałych tł. zwierzęcych
a) na sucho - ogrzewanie tkanek w kotłach
b) na mokro - wytapianie tkanek przy użyciu pary wodnej lub gorącej wody
- wytłaczanie - prowadzi się w prasach hydraulicznych (ciśnienie do 600 atm) lub prasach ślimakowych w sp. ciągły. Wytłaczanie prowadzi się w temp. pokojowej lub 30-60ºC. Pozostałości po pierwszym wytłoczeniu wytłacza się jeszcze kilkakrotnie uzyskując gorsze tł. na cele techniczne. Istnieje również metoda Chayneya - pozyskiwanie tłuszczów z kości, owoców, śledzi i wątroby ryb, w której tkankę umieszcza się w kotle z zimną wodą i działa się na nią ultradźwiękami, co powoduje rozerwanie ścian kom. i olej wypływa na pow. wody.
- ekstrakcja - do otrzymywania tł. roślinnych. Ekstraktami są benzyna krakingowa w temp. 70-100ºC lub alkohol etylowy. Roztwór oleju z rozpuszczalnikiem ogrzewa się odparowując rozpuszczalnik, który używa się wielokrotnie. Oleje ekstrakcyjne są czystsze niż wytłaczane, ale mają gorsze wł. smakowe dlatego poddaje się je rafinacji.
24. Substancje tłuszczopodobne.
LIPOIDY - subst. tłuszczopochodne towarzyszące tłuszczom naturalnym. Najważniejsze z nich to:
fosfatydy
lipochromy
sterole
woski
Mają znaczenie fizjologiczne, gdyż ich niedobór prowadzi do stanów chorobowych. W procesach technologicznych produkcji żywności istotne jest zachowanie tych subst. bez zmian. Ich cechą jest występowanie wraz z tłuszczami oraz rozpuszczalność w tłuszczach.
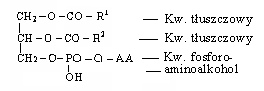
FOSFATYDY - estry kw. fosforowego. Dzielą się na fosfoglicerydy i sfingolipidy. Stanowią one 40% błony komórkowej, reszta to białko. Fosfoglicerydy zawierają glicerynę z dwoma gr. - OH zestryfikowanymi kw. tłuszczowymi i trzecią - zestryfikowaną kw. fosforowym, którego reszta jest zestryfikowana aminoalkoholem:
W niektórych fosfatydach zamiast gliceryny znajduje się sfingozyna:
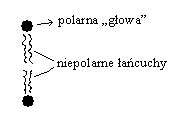
Fosfoglicerydy - są głównymi skł. lipidowych błon kom. roślin i zwierząt; mają długie niepolarne „ogony” związane z polarną jonową „głową”.
Wł. fosfatydów:
Są one dobrze rozp. w eterze, alkoholu i chloroformie, a nierozp. w CH3COOH i acetonie. Selektywna rozp. powoduje, iż można je oddzielić od tł. W wodzie pęcznieją i częściowo tworzą roztwór koloidalny. Mają wł. hydrofilowe, hydrofobowe i lipofilowe i dlatego dobrze emulgują tł. Polarna budowa, aktywność powierzchniowa, wiązanie C=C oraz 4 wiązania estrowe, powodują, iż są one bardzo reaktywne i uczestniczą w procesach metabolicznych. Transportują tłuszcz poprzez krew i ściany kom. Ich rozkład daje kw. fosfatydowe występujące w zielonych częściach roślin.
Otrzymuje się je z olejów roślinnych lub żółtka jaj przez ekstrakcję alkoholem etylowym lub parą wodną.
Stosuje się do prod. czekolady, margaryny, preparatów odżywczych.
Występują w błonach kom., tkance nerwowej i mózgu. W roślinach zawierają je nasiona i korzenie. Duża ich ilość występuje w żółtku jaj. Dzielą się na:
- cholinofosfatydy (lecytyny)
- kolaminofosfatydy (kefaliny)
- serynofosfatydy (serynokefaliny)
- sfingofosfatydy (sfingomieliny)
- acetalofosfatydy
- inozytofosfatydy
LIPOCHROMY - żółte, czerwone, fioletowe i inne barwniki rozp. w tł. zarówno w stanie wolnym jak i związane z lipidami i tłuszczami. Należą do nich:
- karotenoidy - są pochodnymi izoprenu, gdyż w ich budowie wielokrotnie on się powtarza; chromoformem, który nadaje barwę tym połączeniom jest długi łańcuch sprzężonych wiązań C=C. Należą do nich węglowodory (karoteny, likopina), alkohole (ksantofil, luteina) i kwasy (krocetyna).
--karoteny - są czerwonymi barwnikami różnych części roślin, a w szczególności korzeni, np. marchwi.
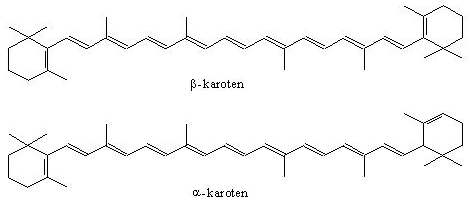
Karoteny zawarte w tł. pod działaniem światła katalizują proces utleniania tł., a w ciemności działają jak antyutleniacze. Są prowitaminami A.
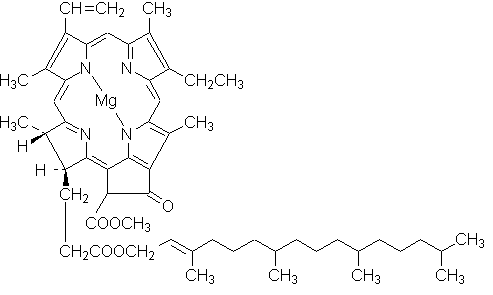
--chlorofil - zielony barwnik roślinny uczestniczący w procesie asymilacji. W roślinach występuje w
chloroplastach zawierając dodatkowo część białkową tworząc chloroplastynę. Bardzo łatwo rozp. się w tł.
WOSKI - to estry wyższych kw. tł. i wyższych alkoholi jednohydroksylowych:
![]()
Znacznie trudniej ulegają hydrolizie niż tł. W przewodzie pokarmowym ludzi i wyższych zwierząt nie ulegają trawieniu ze względu na brak enzymów hydrolizujących je. Są produkowane na bardzo niewielką skalę i stosowane są do wyrobu świec, past do butów i podłóg, kosmetyków, materiałów izolacyjnych.
Są bardzo rozpowszechnione w świecie roślinnym i zwierzęcym. Zależnie od pochodzenia rozróżnia się woski roślinne (np. wosk karnauba znajdujący się na pow. liści pewnych palm, albo wosk pokrywający pow. liści, łodyg i owoców - usztywniają je i chronią przed nadmierną utratą wody) i zwierzęce (np. olbrot, wosk pszczeli, wosk wydzielany przez skórę owiec, lanolina, woski powlekające skórę, włosy, sierść i pióra zwierząt - chronią przed wilgocią, działaniem czynników chem., usztywniają je
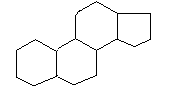
25. Sterole, steroidy i ich znaczenie w organizmach zwierzęcych i roślinnych.
STEROLE - hydroksylowe pochodne homologów cyklopentanoperhydrofenantrenu:
Są bardzo rozpowszechnione w świecie roślin i zwierząt, stanowiąc ich ważne składniki. W tł. występują w stanie wolnym, a częściowo pod postacią estrów z wyższymi kw. tł. czyli tzw. sterydów. Sterole są subst. stałymi, nie rozp. się w wodzie, łatwo rozp. się w rozpuszczalnikach tł. i tłuszczach. Rozróżniamy:
- sterole zwierzęce - zoosterole
- sterole roślinne - fitosterole
- sterole grzybów i pleśni - fungisterole i mykosterole
Sterole biarą udział w transportowaniu tł., w budowie błon kom. i w procesach detoksykacyjnych. Ponadto służą jako substrat do biosyntezy ważnych dla organizmu witamin i hormonów. Oprócz steroli w roślinach i u zwierząt występują także inne pochodne, zawierające ukł. cyklopentanoperhydrofenantrenowy - STEROIDY. Należą do nich m.in. witaminy, kw. żółciowe, hormony seksualne, hormony kory nadnercza.
Do najważniejszych steroli należą:
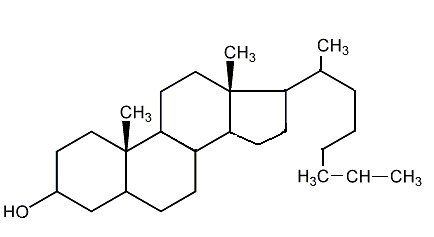
- cholesterol - występuje w stanie wolnym i pod postacią estrów kw. tł. we wszystkich tkankach zwierzęcych. Duże ilości cholesterolu znajdują się w żółtku jaj, tranie, w tkance mózgowej i nerwowej, jest głównym składnikiem kamieni żółciowych. Jest czynnikiem przeciwdziałającym niektórym truciznom i jadom hemolitycznym.
Nadmiar cholesterolu prowadzi do miażdżycy i choroby serca.
Do najważniejszych steroidów należą:
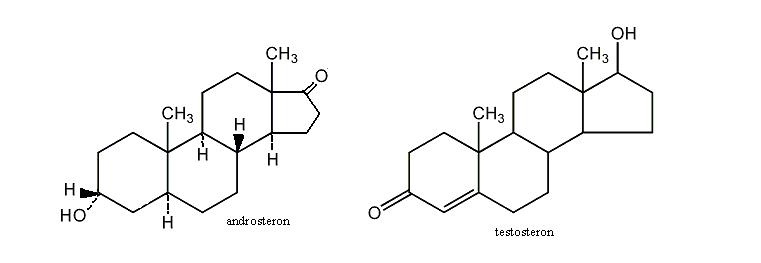
- męskie hormony płciowe (androgeny) - najważniejsze z nich to testosteron i androsteron. Odpowiadają za rozwój drugorzędnych cech płciowych podczas dojrzewania i za pobudzanie wzrostu tkanek i mięśni. Syntezowane są w jądrach z cholesterolu
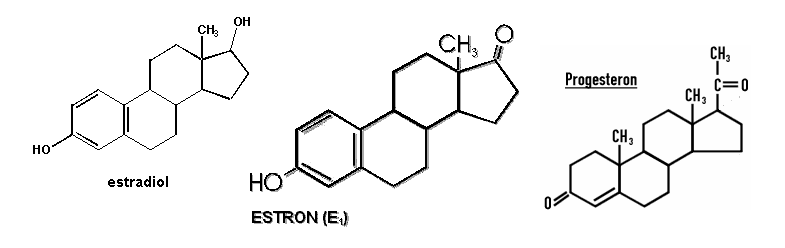
- żeńskie hormony płciowe (estrogeny) - najważniejsze to estron, estradiol oraz progesteron. Syntezowane są w jajnikach. Odpowiadają za rozwój 2-rzędowych cech płciowych i regulację cyklu miesiączkowego. Pierścień w nich jest aromatyczny.
- hormony kory nadnerczy - wydzielane są przez nadnercza, małe gruczoły umieszczane przy górnych końcach nerek. Nazywają się andrenokortykosteroidami. Odpowiadają ze nabrzmiewanie tkanek regulujących komórkowy bilans między Na+ i K+. Glukokortykoidy regulują metabolizm glukozy i kontrolują procesy zapalne. Maść hydrokortizonowa łagodzi opuchlizny.
26.Witaminy rozp. w tłuszczach - ich rola w organizmie .
regulują przebieg przemiany mat. są to A, D, E, F. A- wit. przeciw kserowftalmiczna (wzrostu) reg. funkcjonowanie skóry, błon śluzowych tw. purpury wzrokowe. Brak A pow. suchość, rogowacenie skóry, i błon śluzowych oczu (grozi utrata wzroku- kurza ślepota) obnirzenie odporności na choroby zakaźne, prowitaminy: karoten D- (D2, D3, D4,) wit. przeciwkrzywiczne, reguluje gosp. Ca, brak D naz. krzywicą E- wit. płodności brak E pow. zakłócenie w proc. utl. k. tłuszczowych, wyst w kiełkach pszenicy. K- przeciw krwotoczna, nie wyst. w przyrodzie, brak K obniż krzepliwość krwi. (liście sałaty, kapusta, szpinak, pomidor)
27.Witaminy rozp. w wodzie oraz ich znaczenie w przemianie materii.
służą do bud. enzymów, są to: B1;2;6;12 , PP, k. pantotenowy, foliowy, biotyna. B1- wit. przeciw neurotyczna, brak wywołuje beri-beri (porażenie mięśni), wyst. w zbożu. B2- brak objawia się zmniejszeniem apetytu, bólem oczu, drżenie kończyn, apatiom. wyst. mleko, jaja, wątroba, nerki i owoce. B1- u ludzi rzadko spotykana, objawia się schorzeniami skóry i ukł. nerwowego wyst. w drożdżach, kiełkach pszenicy, kukurydzy, rybach. B12- przeciwanemiczna brak-anemia złośliwa. PP- przeciwpelagryczna, jest to k. nikotynowy który w org. przekształca się w amid k. nikotynowego, brak powoduje zakłuceniea w syn. wielu enzymów, schorzeniami skóry, przewodu pokarmowego, ukł. nerwowego, wyst. w ziarnach zbóż, drożdżach, wątrobie, nerki, rybach, mleku, jajach i warzywach. C- przenośnik H w proc. oddychania tkankowego, niezbędna do wyt. kolagenu ścięgien, oseiny kości, zębny, nabłonka naczyniowego, brak powoduje szkorbut, krwawieniem, owrzodzeniem dziąseł, wypadaniem zębów, łamliwością kości, wyst: cytryna, pomarańcze, truskawki, papryka.
28.Mineralne składniki żywności.
Makroelementy- w dziennym zapotrzebowaniu powinny znajdować się w ilościach gramowych (NaCl, sole wapnia, potasu, fosforu i siarki). Mikroelementy- w ilościach miligramowych lub śladowych. Podział wg. roli w organizmie; 1) składnik środowiskowy procesów biochemicznych: Woda- stanowi ok 75% ciężaru ciała żywego. rola: wiąże koloidy białkowe, płyny ustrojowe (krew, soki), usuwa produkty przemiany materii, utrzymanie stałej temp., środowisko hydrolizy i syntezy białek, węglowodanów i tłuszczy. Zapotrzebowanie na wodę zależy od wieku, trybu życia i klimatu. Zapotrzebowanie organizmu na sole mineralne: okres wzrostu wymaga zwiększonych ilości soli mineralnych, okres dojrzałości stały ich poziom, istotna jest również zależność Ca i P. 2) składniki budowy tkanki podporowej i osłaniającej: Wapń: służy do budowy ukł. kostnego. w żywności występuje jako nie rozpuszczalne w wodzie sole(fosforany, węglany) rozpuszczają się w kw. żołądkowych, źródłem wapnia jest: mleko, sałata, marchew. Magnez: aktywator enzymów i regulator pracy mięśni, źródłem są produkty roślinne. Fosfor; występuje w organizmach zwierząt w postaci fosforanów nieorganicznych i organicznych , zawierają go kości i zęby, uczestniczy w metaboliźmie tłuszczów, białek i cukrów. Fluor: zawiera go tkanka kostna, zęby. brak go powoduje pruchnice zębów zaś nadmiar powoduje grubienie kości, źródłem jest głównie woda, Siarka: zawierają ją reszty aminokwasowe w białkach, źródłem są białka roślinne i zwierzęce. 3) składniki służące wytworzeniu hemoglobiny i przenoszeniu tlenu; Żelazo: jego rezerwa znajduje się w wątrobie, śledzionie i mózgu. niedobór powoduje anemię, źródłem jest mięso i produkty roślinne. Miedź: składnik enzymów utleniających, występuje w wątrobie zwierząt i mięsie ryb, Kobalt: stumuluje dojrzewanie krwinek, występuje w produktach roślinnych i zwierzęcych 4) składniki syntezy hormonów i enzymów: Jod: gromadzony jest w gruczole tarczycy, kościach, skórze, mięśniach, brak powoduje zahamowanie wzrostu, niedorozwój umysłu, źródłami są produkty roślinne i zwierzęce. Mangan: składnik enzymów. brak powoduje zahamowanie wzrostu i osłabienie funkcji rozrodczych. Cynk: składnik enzymów oddechowych. 5) składniki fizjologiczne: Potas: zawarty jest w ziemniakach, mleku, cebuli. reguluje kwaśność krwi, jest niezbędny dla roślin. Sód: występuje w krwi, sokach trawiennych
29.Budowa i funkcja DNA
(cukier 5-węglowy) reszta fosforanowa (P) wielocząsteczkowe biopolimery, zasady azotowe: purynowe (dwupierścieniowe, Adenina i Guanina) i pirymidynowe (jednopierścieniowe, Cytozyna i Tymina,) w których cukrem jest dezoksyryboza. Cząsteczka DNA jest złożona z 2 łańcuchów polinukleotydowych zwiazanych ze sobą wiązaniami wodorowymi i tworzących podwujną spiralę. W DNA zakodowana jest informacja o bud. cząsteczek białek syntetyzowanych przez dany organizm. Cechy DNA: trójkowy (3 kolejne nukleotydy kodują 1 aminokwas), niezachodzący, bezprzecinkowy, jednoznaczny, zdegenerowany (1 aminokwas kodowany na różne sposoby, 20 aminokwasów i 64 kombinacje trójek; 3 trójki nonsensowne - nic nie kodują), uniwersalny (wszystkie organizmy), kolinearny (kolejności trójek odpowiada kolejność aminokwasów w białku), pośredni charakter (białka nie są bezpośrednio wykorzystywane do prod. białek); Przekaz informacji odbywa się w trzech procesanch 1.REPLIKACJA (nowa nić zawiera połowę starej) - podwajanie materiału genet. (w mitozie); polimeraza DNA - rozdziela łańcuch od miejsca inicjacji replikacji; widełki replikacyjne - rozcięty DNA - powstają w czasie kopiowania DNA; podstawione w widełki nukleotydy (w formie trójfosforanów - energia grup fosforanowych zużyta na przyłączenie zasady) wiąże ligaza; polimeraza - zdolność wykrywania błędów, restryktaza - odcina błędny nukleotyd; nić rozcinana od 3. do 5. węgla potrzebuje starterów (krótkich odcinków komplementarnego DNA) na każdym odcinku (odcinki Okazaki) 2.TRANSKRYPCJA (ekspresja informacji genet. - przepisywanie odc. DNA na RNA i wykorzystanie jako matrycy do białek; badania nad pałeczką okrężnicy - Escherichia coli); 3TRANSLACJA (tworzenie białek), inicjacja: do mniejszej podjednostki rybosomu dołącza się mRNA (odc. zwany liderem; na rybosomie mieści się 6 nukleotydów, 1-3 - miejsce 'P', 4-6 - miejsce 'A') i tRNA z metioniną w m-cu 'P' do odc. startowego (AUG); podłącza się większa podjednostka rybosomu; elongacja: w miejsce 'A' na rybosomie przyłącza się odpowiedni tRNA z aminokwasem (X), metionina dołączona do aminokw. X i tRNA po metioninie odpada, łańcuch przesuwa się - miejsce dla kolejnego tRNA (z amin. Y) itd., powstaje łańcuch polipeptydowy; terminacja: gdy w miejsce 'A' podsunie się trójka nonsensowna (UAA, UAG lub UGA) - żaden tRNA nie rozpozna tej trójki uwalnia się białko, oddziela mRNA, rybosom rozdziela się.
30. Budowa i rola RNA. Rna jest polimerem złożonym z jednostek monomerycznych- rybonukleotydów- połączonych wiązaniami 3', 5' fosfodiestrowymi. Kowalencyjna struktura RNA jest bardzo podobna do struktury DNA, z wyjątkiem tego, że zamiast tyminy RNA zawiera uracyl, a zamiast deoksyrybozy- rybozę. (30. witaminy A , D, E K w tłuszcach), Funkcją RNA jest przenoszenie informacji, genetycznych od DNA do rybosomów, małych gralunarnych cząstek w cytoplazmie komórki, gdzie zachodzi biosynteza białek., Rybosmalny RNA- w formie kompleksu z białkami jest budulcem rybosomów. Transportujący- RNA- transportuje aminokwasy do rybosomów, gdzie są łączone z utworzeniem białek.
1
15
Wyszukiwarka
Podobne podstrony:
OPRACOWANE PYTANIA biochemia(1), pielęgniarstwo
opracowane pytania, Biochemia, Biochemia
Biochemia 4, opracowane pytania, 1
część 2 biochemii opracowane pytania
haran egzamin opracowane pytania
Opracowane pytania BiUD
Opracowane pojecia biochemiczne(1)
prawo opracowane pytania egzamin id 3
patomorfologia opracowane pytania opisowe egzamin
1.Rodzaje i geneza gruntów budowlanych, Opracowane pytania na egzamin
opracowane pytania MSI (1), Studia Zarządzanie PWR, Zarządzanie PWR I Stopień, V Semestr, Modelowani
Pytania biochemia OS 11
opracowane pytania od Kolonki II(2)
defekty enzymatyczne pytania biochem
POSTEPOWANIE EGZEKUCYJNE OPRACOWANE PYTANIA (1)
opracowane pytania metodologia III cz
opracowane pytania)
ściąga opracowane pytania z pierwszego koła
więcej podobnych podstron