Akademia Górniczo Hutnicza
w Krakowie
Wydział Górnictwa i Geoinżynierii
Laboratorium z chemii, sprawozdanie z ćwiczeń.
Wykonawcy: Konrad Goraj
Mikołaj Gzyl
Łukasz Gębusia
Ćwiczenie 1
Przygotować 50 mL roztworu o stężeniu 0,5 M diwodorofosforanu(V) sodu korzystając z monohydratu diwodorofosforanu(V) sodu. Jakich naczyń laboratoryjnych należy użyć do sporządzenia tego roztworu?
Opis wykonania ćwiczenia:
Obliczamy potrzebną ilość monohydratu diwodorofosforanu(V) sodu.
Obliczamy jaka ilość hydratu zawiera tyle g czystej substancji.
119,98g - 138g
2,9995g - x
x=3.45g
Obliczoną ilość substancji odmierzamy na wadze laboratoryjnej, a następnie wsypujemy do kolby miarowej o pojemności 50ml. Tryskawką zalewamy kolbę wodą do 50ml, po czym mieszamy. Aby doprowadzić do całkowitego rozpuszczenia substancji, stosujemy łaźnię ultradźwiękową.
Charakter chemiczny: sól
pH zmierzone: 3,33
Odczyn: kwaśny
Użyte naczynia laboratoryjne: łyżeczka, kolba miarowa o pojemności 50ml, zlewka, tryskawka.
Obserwacje:
Podczas mieszania roztworu kolba wyczuwalnie się oziębia. Substancja wymaga energicznego mieszania, a do rozpuszczenia całej ilości substancji potrzebne jest działanie ultradźwiękami.
Równania reakcji:
Wnioski:
Rozpuszczalność substancji według karty charakterystyki POCH wynosi ok. 850g/l, co oznacza, że maksymalna ilość jaką moglibyśmy roztworzyć otrzymując 50ml roztworu wynosi ok. 4g. Jest to ilość niewiele większa, niż ta potrzebna do wykonania ćwiczenia.
Rozpuszczaniu substancji towarzyszy pochłanianie ciepła, więc jest to reakcja endotermiczna.
Ćwiczenie 2
Do probówek wlać po około 3 mL:
6 M NaOH
6 M HCl
Do probówek wrzucić oczyszczone mechanicznie lub chemicznie metale i obserwować zachodzące zmiany.
Obserwacje:
Z pośród kawałków metali wrzuconych do roztworów zasadowych, tylko glin wykazuje objawy reakcji, poprzez widoczne pęcherzyki gazu ulatniające się z probówki. Natomiast w roztworach kwaśnych gaz wydziela się z probówki z próbką glinu oraz cynku.
Równania reakcji i wnioski:
Glin jest amfoteryczny, reaguje z kwasami i zasadami, a podczas reakcji zachodzi wydzielanie wodoru. Cynk i żelazo reagują z kwasami z wydzielaniem wodoru.
Zastosowania praktyczne reakcji:
Reakcje przedstawione powyżej stosuje się do otrzymywania wodoru.
Reakcja glinu z zasadą jest wykorzystywana do produkcji betonu komórkowego. Dodaje się do niego pasty lub proszki z aluminium, a po zmieszaniu beton pęcznieje.
Ćwiczenie 3
Badanie pH zaczynu cementowego.
Beleczkę ze stwardniałego zaczynu cementowego przełamać na pół. Miejsce przełamania spryskać 1% roztworem fenoloftaleiny. Obserwować zabarwienie przełomu. Zapisać wymiary beleczki. Narysować jak wygląda przełom po poddaniu go działaniu fenoloftaleiny. Wyjaśnić skąd biorą się różnice w barwie poszczególnych obszarów beleczki. Przedyskutować znaczenie praktyczne wykonanego doświadczenia.
Obserwacje:
Po spryskaniu przełamanej beleczki cementowej można zaobserwować zabarwienie na fioletowo części przekroju. Obszar ten położony jest blisko centrum beleczki.
Rysunek przekroju poprzecznego beleczki ze stwardniałego zaczynu cementowego, popryskanego fenoloftaleiną (zakreskowany prostokąt to miejsce, które zabarwiło się na fioletowo).
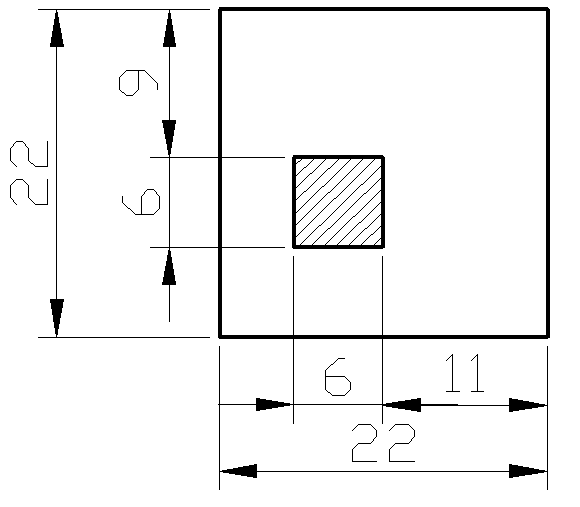
Wnioski:
W centralnej części beleczki beton ma odczyn zasadowy, przez obecny w nim wodorotlenek wapnia. Na obrzeżach nie wykazuje ona odczynu zasadowego, ponieważ nastąpiła tam karbonatyzacja, czyli reakcja wodorotlenku wapnia z tlenkiem węgla (IV). W odczynach zasadowych stal zbrojeniowa pasywuje się, tworząc warstwę tlenku, która chroni przed dalszą korozją. Obniżenie pH po niżej 9 może powodować rdzewienie zbrojeń w betonach, co znacznie zmniejsza żywotność konstrukcji budowlanych. Powinno się odpowiednio zabezpieczać żelbetony przed karbonatyzacją. Nie wykonanie zabezpieczeń jest błędem budowlanym i może być groźne dla użytkowników.
W zlewce o objętości 250 ml umieścić dwie łyżeczki cementu a następnie wlać 50 ml wody. Całość mieszać na mieszadle magnetycznym przez 10 min. Wyłączyć mieszadło, odczekać 5 minut, zdekantować roztwór do zlewki o pojemności 25 ml, zmierzyć pH uzyskanego roztworu.
pH otrzymanego roztworu wynosi 12.
Ćwiczenie 4
Badanie właściwości mechanicznych belek wykonanych z betonu komórkowego oraz zaczynu cementowego.
Spróbować zarysować powierzchnię badanego materiału przy pomocy ostrego przedmiotu. Zanotować obserwacje.
Beton komórkowy bardzo łatwo zarysować. Beton z zaczynu cementowego wykazuje większą odporność na zarysowania.
Spróbować przeciąć badane próbki przy pomocy brzeszczotu. Zanotować obserwacje.
Beton komórkowy bardzo łatwo przeciąć brzeszczotem, natomiast ten z zaczynu cementowego piłuje się bardzo opornie.
Zanurzyć kawałek badanego materiału w wodzie. Zanotować obserwacje.
Beton komórkowy unosi się na wodzie, nawet gdy zanurzymy go w niej na dłuższy czas, natomiast belka z zaczynu cementowego tonie.
Ćwiczenie 5
Pomiar pH słabych i mocnych elektrolitów. Roztwory kwasów i zasad
Lp. |
Substancja |
Stężenie / M |
Charakter chemiczny |
Rodzaj elektrolitu* |
pH zmierzone |
pH obliczone |
Odczyn |
1. |
NaOH |
0,5 |
zasada |
mocny |
14 |
13,70 |
zasadowy |
2. |
NaOH |
0,02 |
zasada |
mocny |
9,5 |
12,30 |
zasadowy |
3. |
Kwas octowy |
2 |
kwas |
słaby |
2,12 |
2,22 |
kwasowy |
4. |
Kwas cytrynowy |
0,5 |
kwas |
słaby |
1,7 |
1,69 |
kwasowy |
5. |
Kwas cytrynowy |
0,005 |
kwas |
słaby |
2,6 |
2,80 |
kwasowy |
* słaby, mocny
Obliczenia:
Kwas cytrynowy
Stałe dysocjacji:
K1=3,09
K2=4,75
K3=6,41
-sprzeczne (stopień dysocjacji musi być większy od 0)
Dla C0=0,5M
Nie uwzględniam w obliczeniach stałej dysocjacji drugiego i trzeciego stopnia, ponieważ nie mają one znaczącego wpływu na wynik.
pH=1,69
Dla C0=0,005M
M
Nie uwzględniam w obliczeniach stałej dysocjacji drugiego i trzeciego stopnia, ponieważ nie mają one znaczącego wpływu na wynik.
pH=2,80
Zapisz równania dysocjacji substancji użytych w ćwiczeniu.
Ćwiczenie 6
Hydroliza
Obserwacje i ich interpretacja
Lp. |
Substancja (stężenie molowe) |
Charakter chemiczny |
pH zmierzone (papierek uniwersalny / pH-metr) |
Odczyn |
1. |
Węglan sodu (0,005M) |
sól |
11/11,25 |
zasadowy |
2. |
Szczawian sodu (0,005M) |
sól |
8/8,72 |
zasadowy |
3. |
Octan sodu (0,005M) |
sól |
7/7,72 |
obojętny |
4. |
Węglan sodu (0,5M) |
sól |
11/11,77 |
zasadowy |
5. |
Diwodoroortofosforan sodu (0,005M) |
wodorosól |
4/3,33 |
kwasowy |
Zapisz równania reakcji wyjaśniające odczyn roztworów wodnych badanych w czasie ćwiczenia.
i 4.
Ćwiczenie 7
Pomiary pH produktów spożywczych.
Obserwacje i ich interpretacja
Lp. |
Substancja |
pH zmierzone (papierek uniwersalny/pH-metr) |
Odczyn |
Substancja odpowiedzialna za pH produktu spożywczego |
1. |
Sok z ogórka |
4/3,5 |
kwasowy |
Kwas mlekowy |
2. |
Cytryna |
2/2,3 |
kwasowy |
Kwas cytrynowy |
3. |
Woda morska |
6/5,8 |
obojętny |
NaCl |
4. |
Pomarańcza |
3/3,3 |
kwasowy |
Kwas cytrynowy |
5. |
Ocet |
2/2,2 |
kwasowy |
Kwas octowy |
6. |
Płyn do prania |
9/9,1 |
zasadowy |
Sole mocnych zasad i kwasów tłuszczowych |
7. |
Mydło |
10/10 |
zasadowy |
Sole mocnych zasad i kwasów tłuszczowych |
8. |
Proszek do prania |
11/11,3 |
zasadowy |
Sole mocnych zasad i kwasów tłuszczowych |
Wyszukiwarka
Podobne podstrony:
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
Chemia VI, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana, Chemia -
Chemia fizyczna - sprawozdanie (4-1), Chemia Fizyczna
analiza wody sprawozdanie chemia analityczna analiza wody teoria
Fizyczna27m, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
sprawozdanie chemia 3, Budownictwo UZ semestr I , II, Chemia budowlana, Sprawozdania od Seweryna
SPRAWOZ4, Chemia fizyczna AGH laborki, lab 12
Sprawozdanie damiana nr 1, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i
Moje sprawozdanie chemia nr 3, Studia budownictwo pierwszy rok, Chemia budowlana, Chemia budowlana,
sprawozdanie chemia michał, Budownictwo UZ semestr I , II, Chemia budowlana, Sprawozdania od Seweryn
poprawa II 25, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna
Sprawozdanie chemia 2
sprawozdanie chemia 7
sprawozdanie chemia 4
sprawozdanie chemia 5
Chfizyczna5, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczna i analityczna u
sprawozdanie chemia 10, sprawka z chemi utp rok I
więcej podobnych podstron