Wykład 7: Hydroliza, bufory Hydroliza soli
Bufory
Pojemność buforowa
Krzywe miareczkowania
Wskaźniki pH
Wydział Chemii UJ Podstawy chemii - wykład 7/1
dr hab. W. Makowski
Hydroliza soli
- reakcje protolityczne anionów lub kationów z cząsteczkami wody sole słabych kwasów i mocnych zasad
odczyn zasadowy
CH3COONa:
CH3COO-
+ H2O
CH3COOH
+ OH-
KCN:
CN-
+ H2O
HCN
+ OH-
NaNO
-
2:
NO2
+ H2O
HNO2
+ OH-
sole słabych zasad i mocnych kwasów
odczyn kwaśny
NH
+
4Cl:
NH4
+ H2O NH3
+ H3O+
AlCl3:
[Al(H2O)6]3+ + H2O [Al(H2O)5OH]2+ + H3O+
sole słabych kwasów i słabych zasad
odczyn ?
CH3COONH4: CH3COO-
+ H2O
CH3COOH
+ OH-
NH +
4
+ H2O NH3
+ H3O+
Wydział Chemii UJ Podstawy chemii - wykład 7/2
dr hab. W. Makowski
1
sól słabego kwasu HA (aniony A-) - zasada Brønsteda A-
+ H2O HA + OH-
[ HA] O
[ H − ]
[ HA][ H O+ ] O
[ H − ]
K
3
w
K − =
=
=
b A
[ A− ]
[ H O+ ][ A− ]
K
3
a HA
Kw
K =
=
pK
pK
a +
b =
b
K K
K
14
K
a
b
w
a
dla sprzężonej pary kwas-zasada
im słabszy kwas, tym mocniejsza sprzężona z nim zasada im mocniejszy kwas, tym słabsza sprzężona z nim zasada Wydział Chemii UJ Podstawy chemii - wykład 7/3
dr hab. W. Makowski
Stopień hydrolizy
sól słabego kwasu i mocnej zasady
A-
+
H2O
HA +
OH-
c (1-α )
c α
c α
o
h
o h
o h
[ H ]
A [
−
OH ]
Kb =
[ −
A ]
K
( c α )2
c α 2
K
w
o
h
o
h
w
=
=
α ≈
h
K
c 1
( −α )
1− α
K c
a
o
h
h
a o
−
K c
pK
log c
[ OH ]
w o
= α c ≈
pOH ≈ 7
a
o
−
−
h o
K
2
2
a
pK
log c
pH ≈ 7
a
o
+
+
2
2
Wydział Chemii UJ Podstawy chemii - wykład 7/4
dr hab. W. Makowski
2
jednocześnie ulegają dysocjacji kwasowej i hydrolizie zasadowej np. wodorowęglany
HCO -
2-
3
+ H2O H3O+ + CO3
HCO -
3
+ H2O H2CO3 + OH-
c
− K
K
+
a1
a 2
HA
[H O ] =
[H O+ ] ≈ K K
3
c
3
a1
a 2
− + K a1
HA
1
pH ≈
( pK + pK
1
a
a 2 )
2
Wydział Chemii UJ Podstawy chemii - wykład 7/5
dr hab. W. Makowski
Hydroliza - obliczenia
Przykład 7.1: Jakie powinno być stężenie roztworu NH4Cl, by wykazywał on pH = 5,5? (pKb NH3 = 4,75)
[H3O+] = 10-5,5 = 3,16·10-6
NH +
4
+ H2O
NH3 +
H3O+
co-3,16·10-6
3,16·10-6
3,16·10-6
[ NH ][
+
H O ]
3
3
−
−
−
K
14
4,75
10
K
K
K
a =
/
w
b = 10
/10
= 6
,
5 ⋅10
a =
[
+
NH ]
4
6
−
2
−
1
,
3
(
6 ⋅10 )
10
6
,
5 2 ⋅10
=
−6
co − 1
,
3 6 ⋅10
6
−
2
1
,
3
(
6 ⋅10 )
−6
−2
co =
+ 1
,
3 6 ⋅10
= 7
,
1 8 ⋅10
1
− 0
6
,
5 2 ⋅10
Wydział Chemii UJ Podstawy chemii - wykład 7/6
dr hab. W. Makowski
3
Przykład 7.2: Jak zmieni się stopień hydrolizy KCN w roztworze 0.05 M po dodaniu KOH (0,01 M) (pKa HCN = 9,31) Wydział Chemii UJ Podstawy chemii - wykład 7/7
dr hab. W. Makowski
Bufor kwasowy
Roztwór zawierający podobne stężenia słabego kwasu HA (ck) i jego soli z mocną zasadą (cs)
HA +
H2O
H3O+ + A-
ck-x
x
x
(tylko kwas)
ck-y
y
cs+y
(kwas i sól)
cofnięta dysocjacja
y << c
⇒
s i ck
[ H O+ ][ A− ]
[ H O+ ] c
(
+ y) [ H O+ c
]
3
3
s
3
s
K =
=
≈
a
[ HA]
c − y
c
k
k
cs
pH =
Równanie
pK + log
a
c
Hendersona-Hasselbacha
k
Wydział Chemii UJ Podstawy chemii - wykład 7/8
dr hab. W. Makowski
4
Roztwór zawierający podobne stężenia słabej zasady B (cz) i jej soli z mocnym kwasem (cs)
B +
H2O
BH+
+
OH-
cz-y
cs+y
y
cofnięta dysocjacja
y << c
⇒
s i cz
[ BH + ] O
[ H − ]
( c + y) O
[ H − ]
c O
[ H − ]
s
s
K =
=
≈
b
[ B]
c − y
c
z
z
c
c
s
z
pOH = pK + log
pH
b
=14 − pK + log
b
c
c
z
s
Wydział Chemii UJ Podstawy chemii - wykład 7/9
dr hab. W. Makowski
Właściwości roztworów buforowych
(na przykładzie buforów kwasowych)
c
n
s
s
pH = pK + log
= pK + log
a
a
c
n
k
k
• nie zmieniają pH w wyniku rozcieńczenia
• w niewielkim stopniu zmieniają pH po dodaniu małych ilości mocnego kwasu lub zasady
Rozwór buforowy można wytworzyć
• mieszając roztwór słabego kwasu z roztworem jego soli z mocną zasadą
• częściowo zobojętniając roztwór słabego kwasu mocną zasadą
• działając mocnym kwasem na roztwór soli słabego kwasu i mocnej zasady
Wydział Chemii UJ Podstawy chemii - wykład 7/10
dr hab. W. Makowski
5
Roztwory buforowe – obliczenia Przykład 7.3: Oblicz zmianę pH 1 dm3 buforu octanowego zawierającego 0,1 M CH3COOH (pKa = 4,75) i O,05 M CH3COONa po dodaniu: a) 0,02 mol NaOH, b) 0,05 mol HCl:
• roztwór wyjściowy
c
0
,
0 5
pH = pK + log s
a
= 7
,
4 5 + log
= ,
4 45
c
1
,
0
k
a) dodanie 0,02 mol NaOH:
OH- + CH3COOH
CH
→
3COO- + H2O
cs = 0,05 + 0,02 = 0,07 M
ck = 0,1 - 0,02 = 0,08 M
0
,
0 7
pH = 7
,
4 5 + log
= 6
,
4 9
0
,
0 8
Wydział Chemii UJ Podstawy chemii - wykład 7/11
dr hab. W. Makowski
Roztwory buforowe – obliczenia cd.
b) dodanie 0,05 mol HCl
H3O+ + CH3COO-
CH
→
3COOH + H2O
ck = 0,1 + 0,05 = 0,15 M
cs = 0,05 - 0,05 = 0,00 M
nie ma już roztworu buforowego!
nie można już stosować równania
cs
pH = pK + log
a
Hendersona-Hasselbacha
ck
powstał roztwór 0,15 M CH3COOH (+ 0.05 M NaCl) pK
log c
,
4 75
a
o
− 8
,
0 2
pH ≈
−
=
−
= ,
2 79
2
2
2
2
Wydział Chemii UJ Podstawy chemii - wykład 7/12
dr hab. W. Makowski
6
dn
n
∆
∆n –
liczba moli mocnego jednoprotonowego
β =
≈
kwasu (lub zasady) dodana do roztworu
dpH
p
∆ H
buforowego (w przeliczeniu na 1 dm3)
∆pH – zmiana pH wywołana tym dodatkiem
Obliczanie pojemność buforowej
Przykład 1: Bufor kwasowy (HA + NaA)
Dodajemy zasadę (NaOH)
cs
HA + NaOH
NaA + H
pH = pK + log
→
2O
a
c
• stężenie soli NaA rośnie
k
c + n
∆
• stężenie kwasu HA maleje
pH + p
∆ H = pK
s
+ log
a
• pH rośnie
c − n
∆
k
c + n
∆
c
s
s
p
∆ H = log
− log
trzeba wyliczyć ∆n
c − n
∆
c
k
k
Wydział Chemii UJ Podstawy chemii - wykład 7/13
dr hab. W. Makowski
Obliczanie pojemność buforowej cd.
c + n
∆
c
∆
c + n
∆ c
s
s
p
∆ H = log
− log
pH
s
k
10
=
⋅
c − n
∆
c
c − n
∆ c
k
k
k
s
p
∆ H
∆
c c 1
( 0
− )
1
pH
10
( c c − c n
∆ ) = c c + c n
∆
k
s
n
∆ =
k
s
s
k
s
k
( c +10 p
∆ H c )
k
s
Jeżeli ck = cs = 0.1 M
i ∆pH = 0.1
1
,
0 ⋅ 1
,
0 ⋅ ,
1
( 259 − )
1
∆
0
,
0 115
n =
= 0
,
0 115
β =
= 1
,
0 15
( 1
,
0 + ,
1 259 ⋅
)
1
,
0
1
,
0
Wydział Chemii UJ Podstawy chemii - wykład 7/14
dr hab. W. Makowski
7
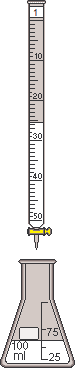
Zastosowanie pomiarów pH
- miareczkowanie kwasu zasadą (alkacymetria) Miareczkowanie (ang. titration)
- technika chemicznej analizy ilościowej polegająca na dodawaniu roztworu reagenta o znanym
stężeniu (titranta) z biurety do roztworu substancji, której stężenie jest oznaczane
- dla punktu końcowego miareczkowania objętość zużytego titranta odpowiada ilości oznaczanej substancji
- w reakcjach zobojętniania pomiar pH można wykorzystać do wykrycia punktu końcowego
miareczkowania
Wydział Chemii UJ Podstawy chemii - wykład 7/15
dr hab. W. Makowski
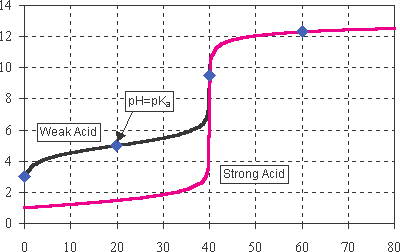
Krzywe miareczkowania
Zależności pH od objętości roztworu NaOH podczas zobojętniania 40 cm3 0,1 M roztworu słabego lub mocnego kwasu sól, hydroliza cofnięta
pH
hydrolizująca sól
CH3COOH + NaOH =
= CH3COONa + H2O
Słaby kwas
bufor
kwas
Mocny kwas
HCl + NaOH = NaCl + H2O
VNaOH (cm3)
Wydział Chemii UJ Podstawy chemii - wykład 7/16
dr hab. W. Makowski
8
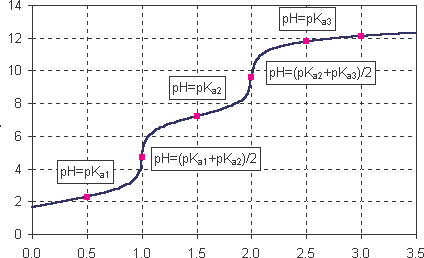
Krzywa miareczkowania kwasu trójprotonowego 1 mol H3PO4
Na2HPO4
+Na3PO4
pH
Na3PO4
NaH2PO4
+Na2HPO4
Na2HPO4
H3PO4+
NaH2PO4
NaH2PO4
H3PO4
n NaOH (mol)
Wydział Chemii UJ Podstawy chemii - wykład 7/17
dr hab. W. Makowski
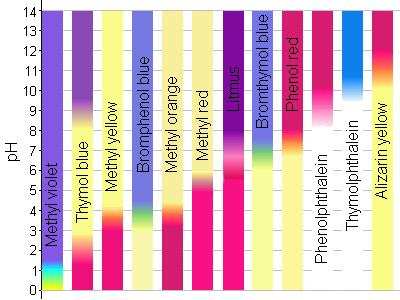
Wskaźniki pH
- barwne kwasy organiczne, których barwa zależy od pH, dodawane w niewielkich ilościach do badanego roztworu HInd + H2O H3O+ + Ind-barwa 1
barwa 2
[ Ind − ]
pH = pK
+ log
a HInd
[ HInd ]
[
−
Ind ] <
ó
1
,
0
a
b a
ro z t w
r
m
rw ę
1
Zmiana barwy zachodzi
[ H Ind ]
zwykle w zakresie 2
jednostek pH
[
−
Ind ] >
ó
10
a
b a
ro z t w
r
m
rw ę
2
(pKa ± 1)
[ H Ind ]
Wydział Chemii UJ Podstawy chemii - wykład 7/18
dr hab. W. Makowski
9
Kolory wskaźników pH
żółcień alizarynowa
tymoloftaleina
fenoloftaleina (8,2-10,0)
czerwień fenolowa
błękit bromotymolowy
lakmus
czerwień metylowa
oranż metylowy (3,1-4,4)
błękit bromofenolowy
żółcień metylowa
błękit tymolowy
fiolet metylowy
Wydział Chemii UJ Podstawy chemii - wykład 7/19
dr hab. W. Makowski
10
Wyszukiwarka
Podobne podstrony:
07 Hydroliza, bufory
14 Hydroliza, bufory, sole trudnorozpuszczalne
Wyklad 11b Elektrolity cd , hydroliza, bufory, iloczyn rozpuszczaln
HYDROLOGIA 07 id 207788 Nieznany
hydrologia wyklad 07
hydrologia wyklad 07
hydrologia wyklad 07
hydrologia wyklad 07
HYDROLOGIA 07 id 207788 Nieznany
hydrologia wyklad 07
więcej podobnych podstron