
Alkohole
Alkohole - są związkami o ogólnym wzorze R-OH, gdzie R jest
dowolną podstawioną lub nie podstawioną grupą alkilową.
Nazewnictwo alkoholi wg systemu IUPAC
1.Jako strukturę podstawową wybieramy najdłuższy łańcuch węglowy zawierający
grupę –OH. Nazwę tworzymy przez dodanie końcówki -ol do nazwy alkanu (np.:
metanol).
2.Położenie grupy –OH w łańcuchu podstawowym określamy jak najniższą liczbą.
3.Położenie każdej z pozostałych grup przyłączonych do łańcucha określamy
również odpowiednią liczbą.
4.Alkohole zawierające dwie lub trzy grupy wodorotlenowe nazywamy diolami lub
triolami.
Przykłady
CH
3
CH
CH
2
CH
2
Cl
OH
3-chloro-1-butanol
3-chlorobutan-1-ol
CH
3
CH
CH
3
OH
2-propanol
propan-2-ol
izopropanol
CH
2
CH
CH
2
OH
OH
O
H
1,2,3-propanotriol
propan-1,2,3-triol
gliceryna
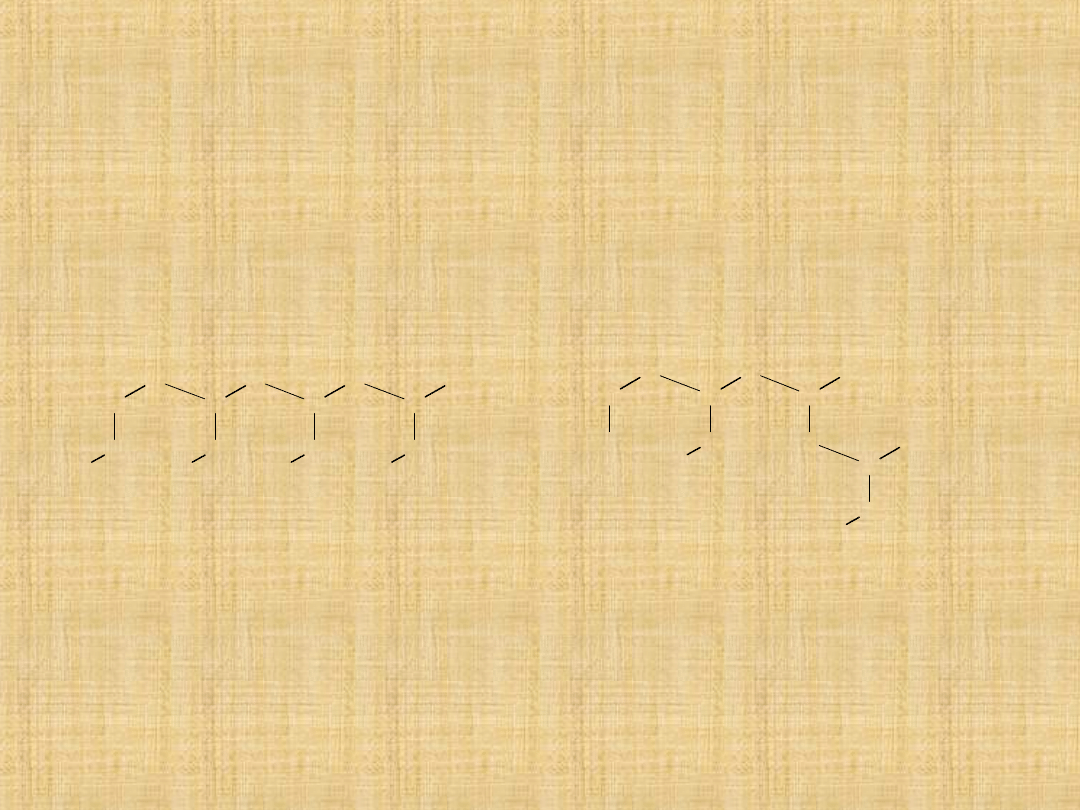
Własności fizyczne alkoholi
Własności alkoholi wynikają z ich budowy.
Węglowodory mają charakter niepolarny. Natomiast grupa hydroksylowa (–
OH) ma charakter silnie polarny. Stąd wysoka polarność alkoholi i zdolność
do tworzenia wiązania wodorowego.
Wiązanie wodorowe w alkoholach i roztworach wodnych
Proces odparowania takich asocjatów wymaga większej ilości energii do
rozerwania wiązań wodorowych. Stąd temperatury wrzenia alkoholi są
stosunkowo wysokie w porównaniu z alkanami o tej samej długości
łańcucha.
Niższe alkohole zawierające do trzech atomów węgla mieszają się z wodą
całkowicie.
Wzrost udziału grupy niepolarnej w alkoholach powoduje ich nie
rozpuszczalność w wodzie.
CH
3
CH
2
O
H
CH
3
CH
2
O
H
CH
3
CH
2
O
H
CH
3
CH
2
O
H
H
CH
3
CH
2
O
H
H
O
H
CH
3
CH
2
O
H
O
H
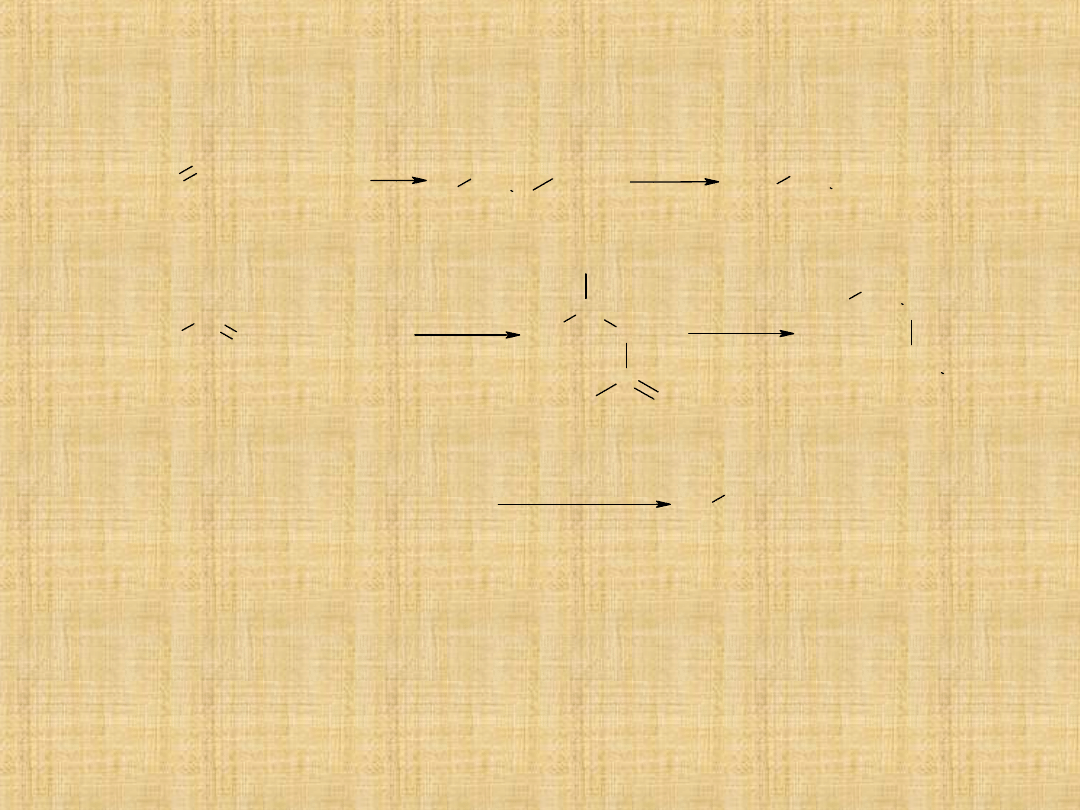
Przemysłowe metody otrzymywania
alkoholi
1. Hydratacja alkenów C
2
-C
4
uzyskanych z ropy naftowej w
procesie krakingu
2. Hydroformylowanie alkenów-proces okso
3. Synteza metanolu metodą Fischera –Tropscha
4. Synteza etanolu metodą fermentacyjną
2(C
6
H
10
O
5
)
n
+n H
2
O n C
12
H
22
O
11
( disacharyd)
C
12
H
22
O
11
+ H
2
O 2 C
6
H
12
O
6
(monosacharyd)
C
6
H
12
O
6
2 C
2
H
5
OH + 2 CO
2
CH
3
CH
CH
2
CH
3
CH
CH
2
H
C
O
H
CH
3
CH
2
CH
2
CH
2
OH
+
+
ciśnienie
[Co(CO)
4
]
2
H
2
CO
[H]
HCo(CO)
3
CH
3
OH
+
350-400°C, 200atm.
Cr
2
O
3
/ZnO
2H
2
CO
CH
2
CH
2
CH
3
CH
2
O
SO
3
H
CH
3
CH
2
OH
+
hydroliza
H
2
O
H
2
SO
4
drewno (1 tona) celuloza celobioza glukoza etanol
(200 litrów)
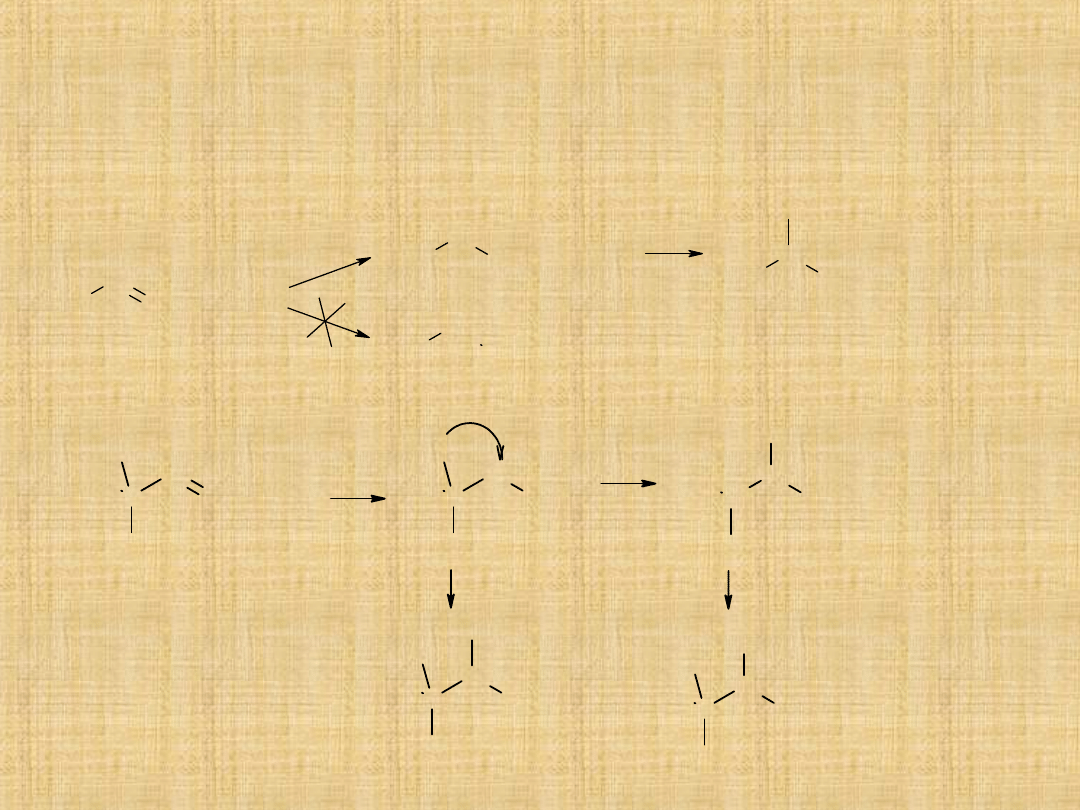
Otrzymywanie alkoholi
1. Addycja wody do wiązania podwójnego C = C
a) wobec katalizatora kwaśnego
CH
3
CH
CH
3
OH
+
H
2
O
+
H
+
CH
3
CH
CH
2
CH
3
CH
+
CH
3
CH
3
CH
2
CH
2
+
+
H
+
C
CH
CH
2
CH
3
CH
3
CH
3
C
CH
3
CH
+
CH
3
CH
3
CH
3
+
H
+
C
CH
3
CH
CH
3
CH
3
CH
3
OH
C
CH
3
CH
CH
3
CH
3
CH
3
OH
H
2
O
H
2
O
C
+
CH
3
CH
CH
3
CH
3
CH
3

Otrzymywanie alkoholi
2. Redukcja związków karbonylowych
1. Addycja wody do wiązania podwójnego C = C
b) borowodorowanie
CH
3
CH
CH
2
CH
3
CH
CH
2
H
B
CH
3
CH
2
CH
2
OH
B
2
H
6
H
2
O
2
/NaOH
Przyłączenie wody niezgodnie z regułą
Markownikowa!
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
2
OH
[H]
CH
3
CH
2
C
O
CH
3
CH
3
CH
2
CH OH
CH
3
[H]
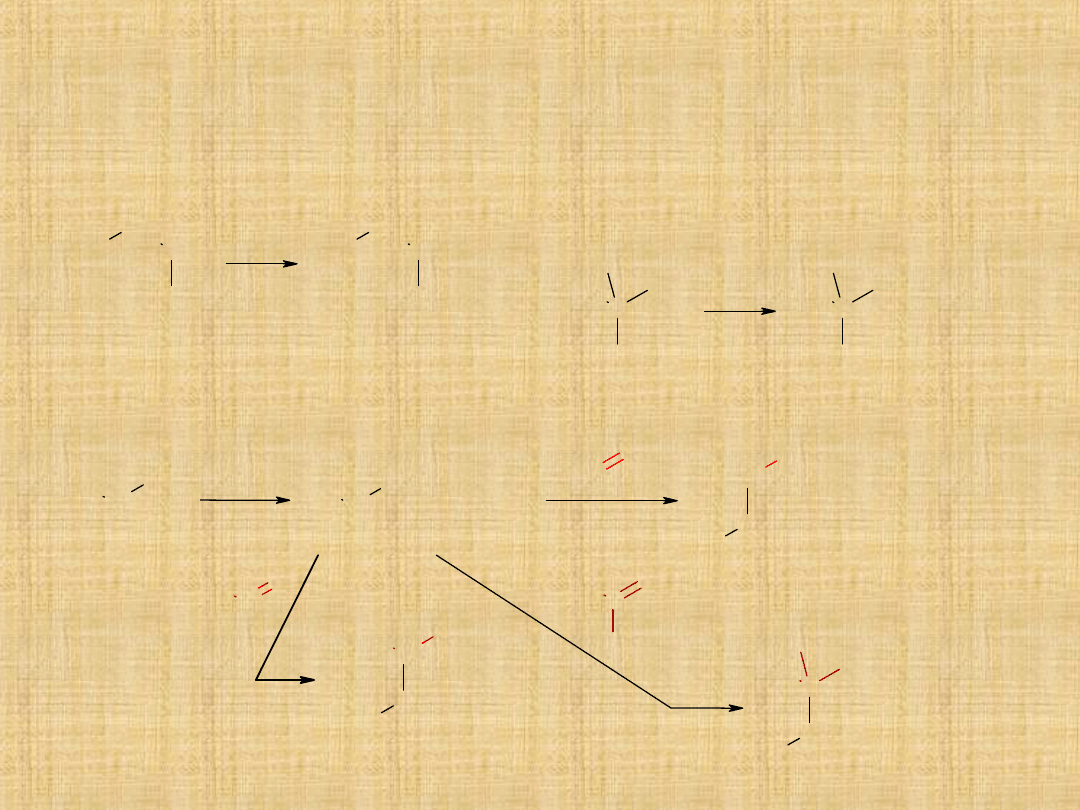
Otrzymywanie alkoholi
3. Hydroliza halogenków alkilowych
4. Synteza alkoholi o różnej rzędowości metodą Grignarda
CH
3
CH
2
CH
2
Cl
CH
3
CH
2
CH
2
OH
NaOH
CH
3
C
Cl
CH
3
CH
3
CH
3
C
OH
CH
3
CH
3
H
2
O
CH
3
CH
2
Cl
CH
3
CH
2
MgCl
Mg/eter
C
H
2
O
CH
2
OH
CH
2
CH
3
CH
3
CH
O
CH
3
CH
OH
CH
2
CH
3
CH
3
C
O
CH
3
CH
3
C
OH
CH
2
CH
3
CH
3
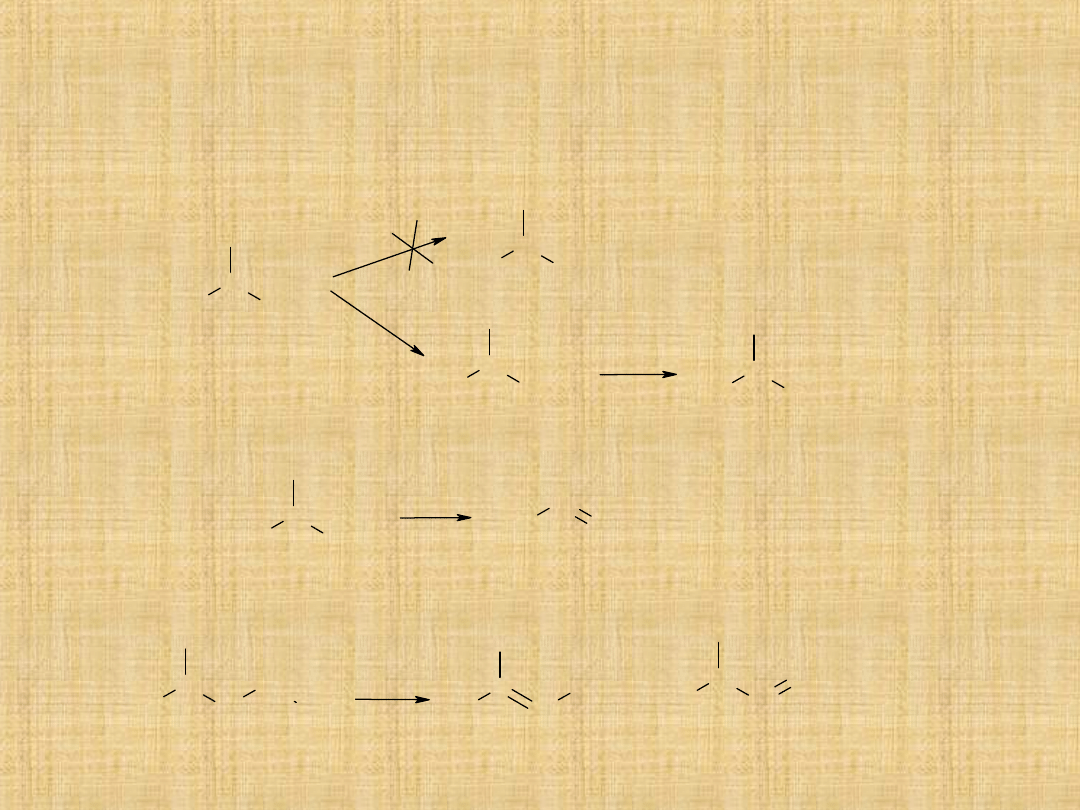
Podstawowe reakcje alkoholi
Rozerwanie wiązania C–OH
1. Reakcja z halogenowodorami
2. Reakcja dehydratacji
Powstający alken może ulec
przegrupowaniu
mechanizm
S
N
1 lub S
N
2
CH
3
CH
CH
3
OH
CH
3
CH
CH
3
Cl
Cl
–
CH
3
CH
CH
3
OH
2
+
CH
3
CH
CH
3
Cl
H
+
Cl
–
CH
3
CH
CH
3
OH
CH
3
CH
CH
2
H
+
+
H
2
O
CH
3
CH
CH
2
OH
CH
2
CH
3
CH
3
CH
CH
3
CH
3
C
CH
3
CH
CH
CH
2
CH
3
H
2
SO
4
produkt główny
produkt uboczny
+

Podstawowe reakcje alkoholi
Alkohole jako kwasy
Atom wodoru w grupie OH cząsteczki alkoholu związany jest
bezpośrednio z silnie elektroujemnym atomem tlenu i dzięki temu
wykazuje właściwości kwasowe.
Kwasowy charakter alkoholi powoduje łatwość ich reakcji z metalami np.:
Na, K, Mg, Ca, Al
CH
3
O–H + Na
Me
O
–
Na
+
+ 1/2 H
2
CH
3
CH
2
O–H + K
Et
O
–
K
+
+ 1/2 H
2
3
(CH
3
)
2
CH
–OH + Al Al(
i-Pr
O)
3
+ 3/2
H
2
W obecności wody alkoholany (z wyjątkiem metanolanów),
jako sole kwasow słabszych od wody, ulegają praktycznie
całkowitej hydrolizie
CH
3
CH
2
ONa + H
2
O CH
3
CH
2
OH + NaOH
Rozerwanie wiązania CO–H
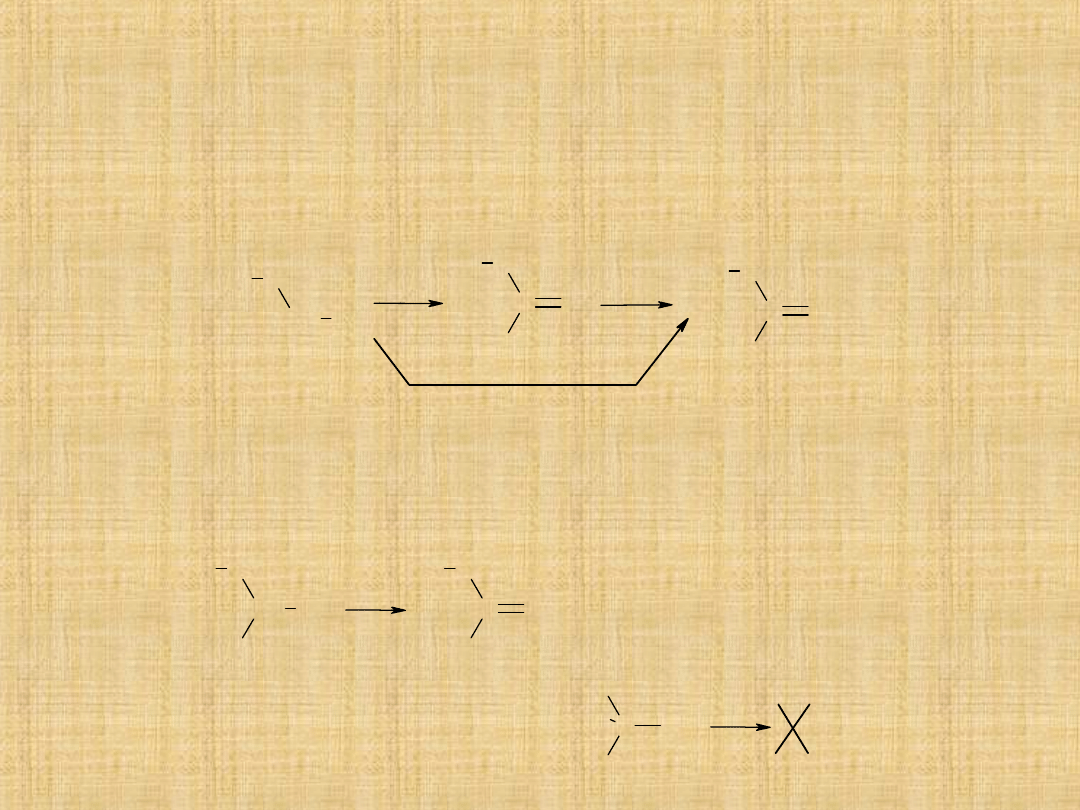
Utlenianie alkoholi
Utlenianie alkoholi 1°-rzędowych
Można utlenić do aldehydów, stosując mieszaninę K
2
Cr
2
O
7
i rozcieńczonego
kwasu siarkowego. Utlenianie do kwasu realizuje się przez ogrzewanie z
roztworem KMnO
4
.
Utlenianie alkoholi 2°-rzędowych
Drugorzędowe alkohole utleniają się na ketony za pomocą mieszaniny
K
2
Cr
2
O
7
i rozcieńczonego kwasu siarkowego lub za pomocą CrO
3
.
Utlenianie alkoholi 3°-rzędowych
Reakcja nie zachodzi.
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
2
OH
CH
3
CH
2
C
O
OH
[O]
[O]
KMnO
4
CH
3
CH
2
C
O
CH
3
CH
3
CH
2
CH OH
CH
3
[O]
CH
3
CH
3
C
OH
CH
3
[O]
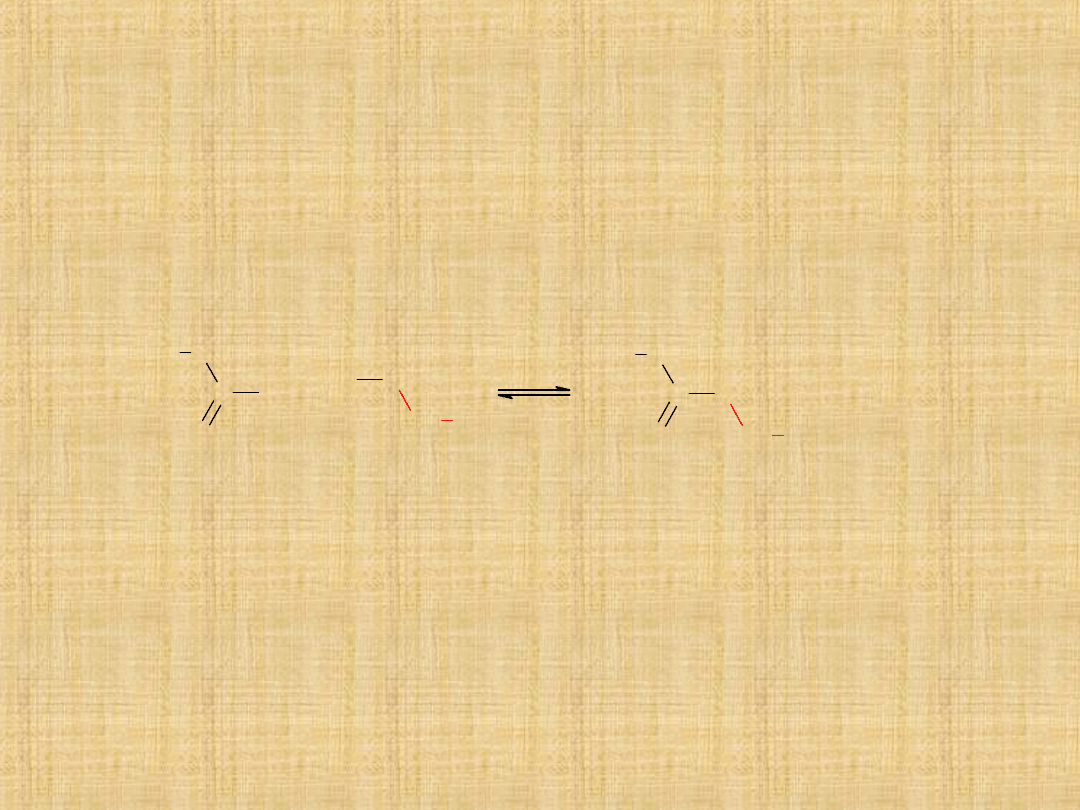
Tworzenie estrów
Estry można otrzymać przez ogrzewanie kwasu karboksylowego z
alkoholem.
Reakcja przebiega z udziałem katalizatora (np. kwasu
siarkowego).
Reakcja ta jest odwracalna i zwykle osiąga stan równowagi
między reagentami.
Ten sam katalizator - jon wodorowy, który katalizuje reakcję
estryfikacji,
jednocześnie
katalizuje
reakcję
odwrotną-
hydrolizę.
CH
3
CH
2
O
H
CH
3
CH
2
C
O
OH
O
H
2
CH
3
CH
2
O
CH
3
CH
2
C
O
H
+
+
+
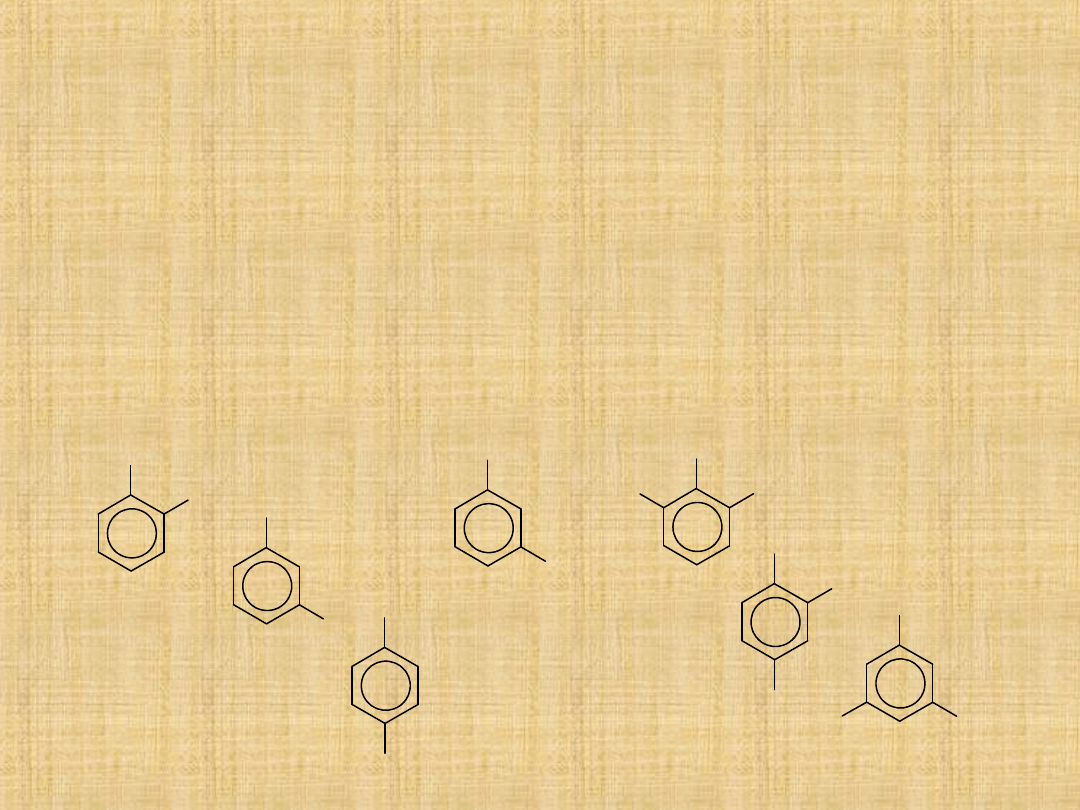
Fenole
Fenole sa związkami o ogólnym wzorze Ar-OH.
Grupa hydroksylowa jest bezpośrednio połączona z pierścieniem
aromatycznym.
Nazewnictwo –nazwy systematyczne powstają przez dodanie
do nazwy węglowodoru przyrostka –ol, -diol, -triol
Np.: 1,2,4-benzenotriol
Nazwy
zwyczajowe
są
powszechnie
stosowane
OH
OH
OH
OH
OH
OH
OH
OH
O
H
OH
OH
OH
OH
OH
O
H
OH
CH
3
pirokatechina
meta-krezol
hydrochinon
rezorcyna
pirogalol
hydroksyhydrochinon
floroglucyna
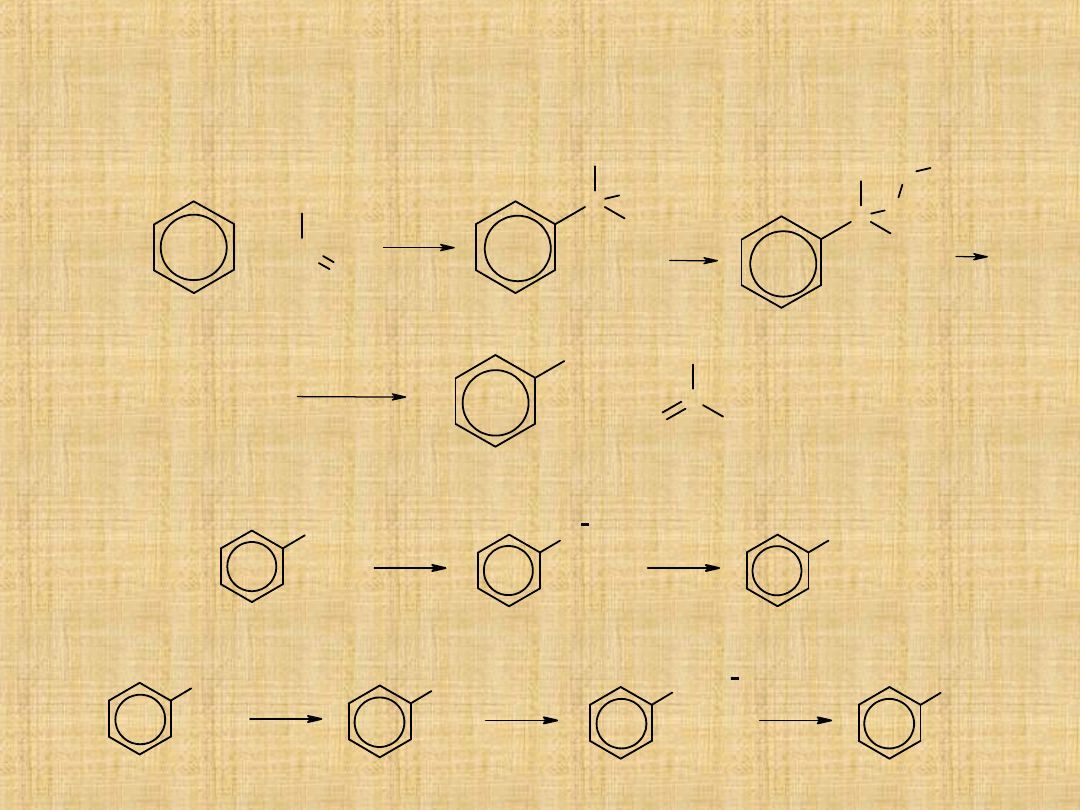
Metody otrzymywania fenoli
1. Synteza fenolu metodą kumenową
3. Hydroliza soli diazoniowych
NO
2
NH
2
N
2
Cl
OH
[H]
NaNO
2
HCl
+
H
2
O
C
CH
3
CH
3
H
C
CH
3
CH
3
O
O H
OH
C
CH
3
CH
3
O
CH
CH
2
CH
3
H
3
PO
4
T, p
O
2
10% H
2
SO
4
T
+
+
2. Stapianie kwasów sulfonowych z
NaOH
SO
3
H
O Na
+
OH
NaOH
T
DT
H
+
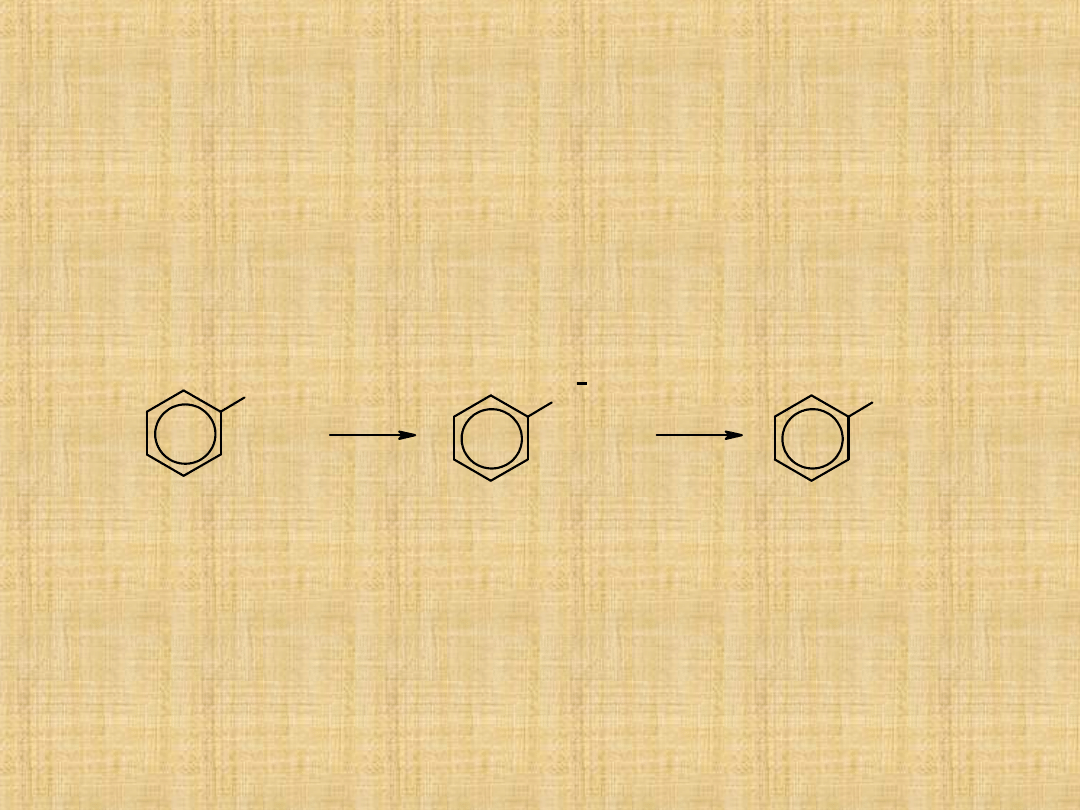
Właściwości fenoli
Fenole jako kwasy.
Fenole są kwasami znacznie silniejszymi od wody i alkoholi, ale
słabszymi od kwasu węglowego.
Rozpuszczają się w wodnych roztworach zasad tworząc fenolany.
Pod wpływem dwutlenku węgla można otrzymać wolny fenol.
Na
NaOH
Na
2
CO
3
Alkohole:
reagują
nie reagują
nie reagują
Fenole:
reagują
reagują
nie reagują
Kwasy:
reagują
reagują
reagują
OH
O Na
+
OH
NaOH
CO
2
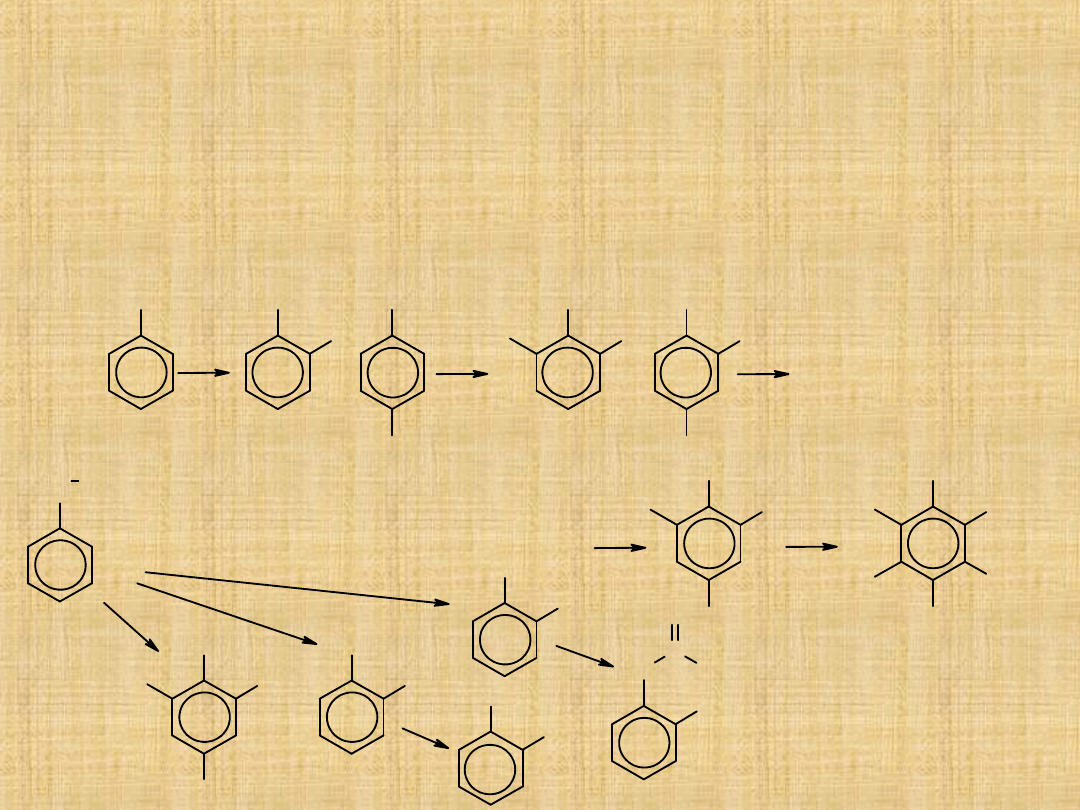
Reakcje fenoli
Reakcje substytucji w pierścieniu są jednymi z głównych reakcji fenoli.
Ze względu na silne aktywujące działanie grupy hydroksylowej, niską
energię aktywacji reakcje podstawienia elektrofilowego dla fenoli
przebiegają inaczej niż dla innych związków aromatycznych.
OH
Cl
Cl
Cl
OH
Cl
Cl
Cl
Cl
Cl
Cl
2
Cl
2
FeCl
3
pentachlorofenol
środek stosowany
do ochrony
drewna
O
OH
Br
Br
Br
OH
CHCl
2
OH
COOH
OH
CHO
CO
2
CHCl
3
Br
2
O
COOH
C
O
CH
3
aspiryna
OH
OH
Cl
OH
Cl
OH
Cl
Cl
OH
Cl
Cl
Cl
2
Cl
2
+
+
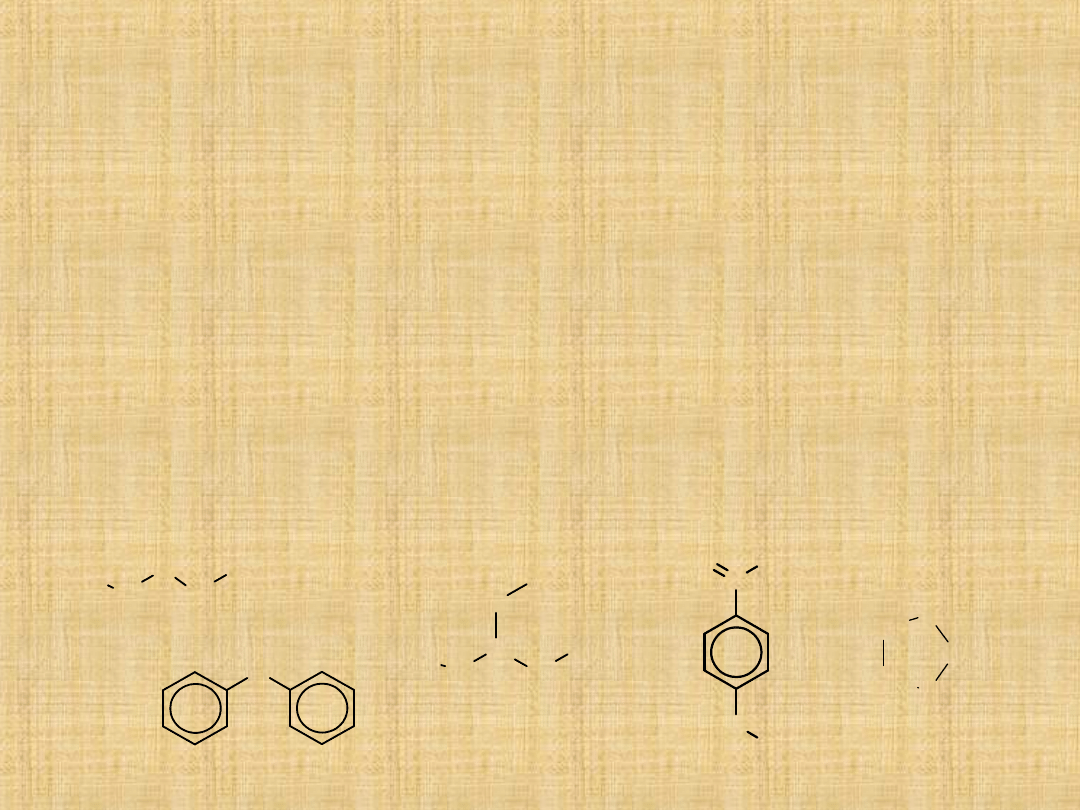
Etery
Etery są związkami o wzorze ogólnym R-O-R
‘
,gdzie symbole R i
R
‘
oznaczać mogą zarówno podstawnik alifatyczny jak i
aromatyczny.
Nazewnictwo
-Nazwę eteru tworzy się zwykle w ten sposób ,że po słowie eter
podaje się w kolejności alfabetycznej nazwy dwóch grup, które
są przyłączone do atomu tlenu.
-Jeżeli jedna z grup nie ma prostej nazwy,to związek można
traktować jako pochodną alkoksylową.
Wśród eterów łańcuchowych rozróżniamy etery proste
(symetryczne) oraz etery mieszane (niesymetryczne).
W eterach cyklicznych atom tlenu stanowi jeden z elementów
pierścienia.
CH
2
CH
2
O
CH
3
CH
3
eter
dietylowy
3-metoksy
pentan
CH
2
CH
2
CH
O
CH
3
CH
3
CH
3
eter
difenylowy
O
aldehyd p-
metoksybenzoesowy
O
C
CH
3
H
O
tetrahydrofu
ran
CH
2
O
CH
2
CH
2
CH
2

Właściwości eterów
Właściwości fizyczne
Etery są związkami polarnymi i
niezasocjowanymi (brak kwasowych
atomów wodoru) stąd etery
charakteryzują się niską temperatura
wrzenia
Mogą natomiast tworzyć wiązania
wodorowe z innymi posiadającymi
„kwaśne” atomy wodoru cząsteczkami.
Właściwości chemiczne
Etery należą do substancji biernych chemicznie. Wiązanie
eterowe jest odporne na działanie zasad oraz odczynników
utleniających i redukujących.
Obecność wolnych par elektronów na atomie tlenu
czyni
z
eterów
dogodnymi
rozpuszczalnikami
do wielu reakcji.
CH
3
CH
2
O
+
CH
3
CH
2
B
F
F
F
CH
2
CH
3
O
H
CH
3
CH
2
O
CH
2
CH
3
CH
3
CH
2
O
CH
3
CH
2
Mg
Br
CH
2
CH
2
CH
3
CH
3
CH
2
O
CH
3
CH
2
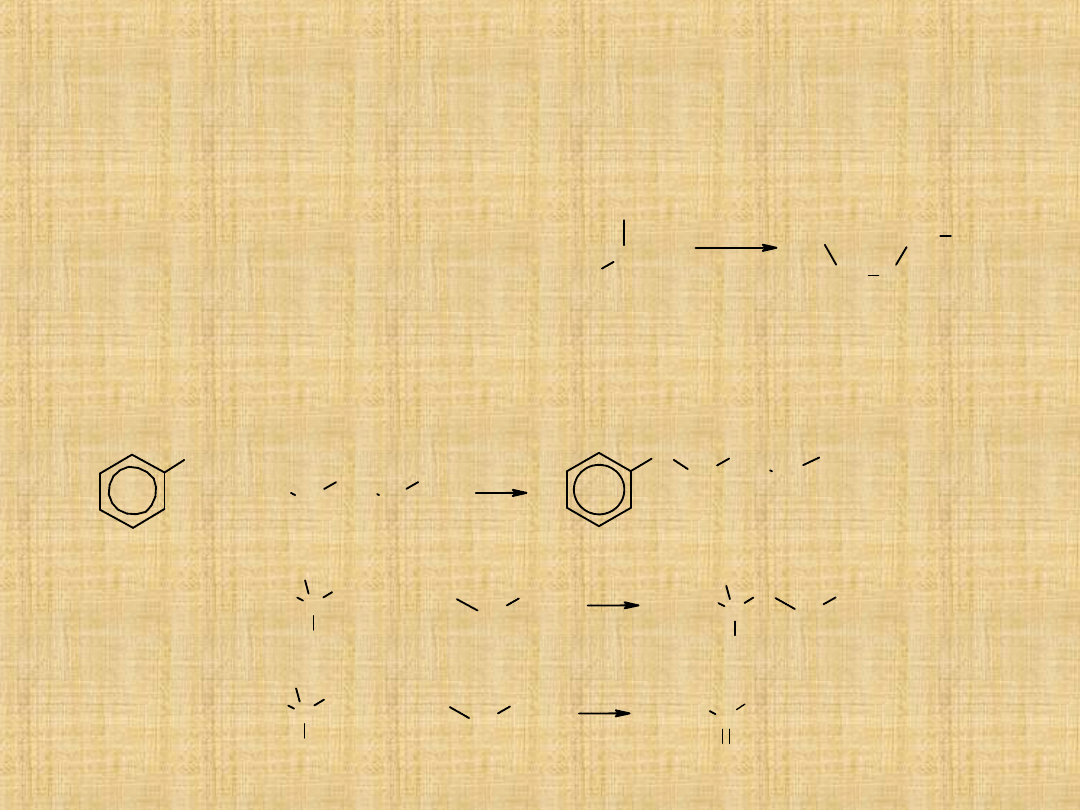
Otrzymywanie eterów
Międzycząsteczkowa dehydratacja alkoholi
Niższe etery symetryczne(głównie dimetylowy i dietylowy) otrzymuje
się w wyniku reakcji alkoholu z kwasem
(najczęściej siarkowym),
w podwyższonej temperaturze.
Synteza Williamsona
Jest to reakcja alkilowania alkoholanów lub fenolanów za pomocą
pierwszorzędowych odczynników alkilujących.
CH
3
CH
2
OH
CH
3
CH
2
O
CH
3
CH
2
2
H
2
SO
4
ONa
O
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
3
Br
+
CH
2
CH
3
Cl
CH
3
CH
3
ONa
C
CH
3
CH
2
CH
3
O
CH
3
CH
3
C
CH
3
+
CH
2
CH
3
NaO
CH
3
CH
3
Cl
C
CH
3
CH
3
CH
2
C
CH
3
+
!
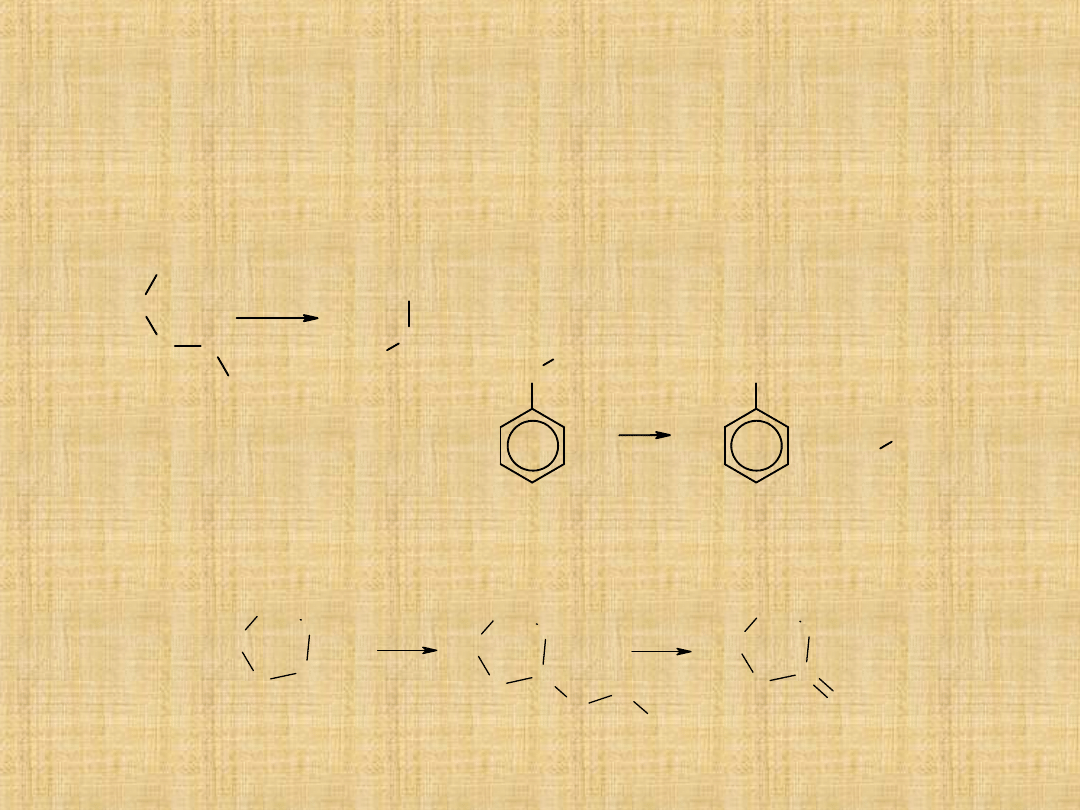
Główne reakcje eterów
Praktyczne znaczenie ma właściwie jedna reakcja:
-Rozszczepienie eterów pod wpływem silnych kwasów (np.:HI,
HBr) .
W wyniku reakcji powstaje alkohol i halogenek alkilowy .
-
Utlenianie eterów do nadtlenków (reakcja nie ma znaczenia
syntetycznego)
O
CH
3
OH
Br
C
H
3
+
HBr
CH
3
CH
2
I
CH
3
CH
2
O
CH
3
CH
2
2
HI
CH
2
CH
2
CH
2
CH
2
O
CH
2
CH
2
CH
CH
2
O
O
O
H
CH
2
CH
2
C
CH
2
O
O
O
2
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
5 Alkohole fenole etery materiały
Alkohole, fenole, etery
5 Alkohole fenole etery materiały
Alkohole, fenole i etery id 580 Nieznany (2)
Alkohole, tiole, fenole i etery wiadomosci ogolne id 58092
Alkohole i fenole 3 id 58102 Nieznany
instrukcja węglowodory, alkohole i fenole
test alkohole i fenole chem, chemia gimnazjum
alkohole i fenole 2 id 58101 Nieznany (2)
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
alkohole i fenole, Chemia- liceum
Alkohole i Fenole
Alkohole i fenole
Alkohole i fenole - teoria, ALKOHOLE MONOHYDROKSYLOWE
więcej podobnych podstron