
New trends in tissue engineering
Nowe trendy w inżynierii tkankowej
Anna Kaźnica
1
, Romana Joachimiak
1
, Tomasz Drewa
1
, Tomasz Rawo
2
,
Jarosław Deszczyński
2
1
Tissue Engineering Department, Chair of Medical Biology, Collegium Medicum, Nicolaus Copernicus University,
Toruń, Poland
2
Department of Orthopedic Surgery and Rehabilitation, 2
nd
Medical Faculty of Warsaw Medical University,
Warsaw, Poland
Summary
Tissue engineering is a new discipline of science which development is very intensive. Methods
used in tissue engineering enable regeneration or substitution of damaged tissues and organs with
new one, produced in vitro. The main issues concern combination of biomaterials, nanomaterials,
three-dimensional implants and microchips with stem cells.
key
words:
tissue engineering • biomaterials • stem cells • regenerative medicine
słowa
kluczowe:
inżynieria tkankowa • biomateriały • komórki macierzyste • medycyna regeneracyjna
Full-text
PDF:
http://www.artroskopia.org/fulltxt.php?ICID=630529
Word
count:
1291/1121
Tables:
—
Figures:
7
References:
18
Anna Kaźnica, Tissue Engineering Department, Chair of Medical Biology, Collegium Medicum, Nicolaus Copernicus
University, Toruń, Karłowicza 24, 85-092 Bydgoszcz, Poland, e-mail: a.kaznica@wp.pl
Received: 2007.07.16
Accepted: 2007.08.03
Published: 2007.09.28
Author’s address:
Adres autora:
11
© Artroskopia i Chirurgia Stawów, 2007; 3(3): 11-16
© Arthroscopy and Joint Surgery, 2007; 3(3): 11-16
www.artroskopia.org
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

W
STĘP
Inżynieria tkankowa to młoda, ale intensywnie rozwijająca się
dziedzina nauki. Nowe możliwości regeneracji chorych lub
uszkodzonych tkanek stworzone dzięki stosowaniu metod in-
żynieri tkankowej sprawiają, iż znajduje ona coraz szersze za-
stosowanie w medycynie, szczególnie w ortopedii. Inżynieria
tkankowa jest dyscypliną naukową, stwarzającą nowe alterna-
tywne rozwiązania zmieniające sposób podejścia do leczenia
przy pomocy przeszczepów oraz uzupełniania ubytków na-
rządów i tkanek. Jeszcze kilka lat temu sądzono, iż ludzkie
tkanki mogą być zastępowane tylko poprzez bezpośrednie
transplantacje allogeniczne lub całkowicie sztuczne implanty.
W ostatnich latach wiele uwagi poświęca się narządom biohy-
brydowym zbudowanym z komórek autologicznych.
Zastosowanie nowatorskich połączeń nanomateriałów, trój-
wymiarowych wszczepów, przepływowych mikroczipów czy
bioaktywnego szkła z wyhodowanymi na nich komórkami
macierzystymi daje szansę na przygotowanie odpowiedniej
tkanki w warunkach laboratoryjnych.
K
OMÓRKI
MACIERZYSTE
W inżynierii tkankowej wykorzystuje się wiele różnych typów
komórek, obecnie jednak najwięcej uwagi poświęca się ko-
mórkom macierzystym. Komórki macierzyste są to komór-
ki o dużym potencjale do różnicowania w inne typy komó-
rek, zdolne do samoodnowy [1,2].
Wyróżnia się następujące typy komórek macierzystych:
•
Totipotencjalne (embrionalne komórki macierzyste,
wyodrębnione z zarodka na etapie blastocysty) mogące
dać początek całemu organizmowi.
•
Pluripotencjalne (embrionalne komórki macierzyste),
które mogą różnicować się w każdy typ wyspecjalizowanej
komórki, za wyjątkiem komórek rozrodczych.
•
Multipotencjalne (somatyczne komórki macierzyste,
posiadające możliwość stałego wytwarzania nowych
komórek) mogące różnicować się w różne typy komórek,
z reguły o podobnych właściwościach.
•
Unipotencjalne (komórki prekursorowe będące bez-
pośrednim źródłem komórek odnawiających daną tkankę).
Mogą różnicować się tylko w jeden typ komórki.
W inżynierii tkankowej zastosowanie znalazły embrionalne
i somatyczne komórki macierzyste. Z wykorzystaniem em-
brionalnych komórek macierzystych wiąże się wiele dylema-
tów natury moralnej i etycznej i dlatego w ortopedii najwięk-
szym zainteresowaniem cieszą się mezenchymalne komórki
macierzyste – MSC (Mesenchymal Stem Cells) wyizolowane
ze szpiku kostnego osób dorosłych [1].
Mezenchymalne komórki macierzyste stosuje się do regene-
racji chrząstki, ścięgien, więzadeł i kości. Mezenchymalne
komórki macierzyste (Rycina 1) wykazują zdolność do różni-
cowania się w komórki pochodzenia mezodermalnego m.in.
w chondrocyty, osteocyty, miocyty i adipocyty [3–5].
Do rekonstrukcji uszkodzonych tkanek i narządów zwykle
stosuje się procedurę polegającą na namnożeniu wyizolo-
wanych komórek z tkanki biorcy w warunkach in vitro, „wy-
sianiu” ich na rusztowania z biodegradowalnych polimerów
i dalszej hodowli. W tym celu projektuje się trójwymiarowe
B
ACKGROUND
Tissue engineering is a new but intensively developing
discipline of science. Thanks to its possibilities to regen-
erate damaged tissues, tissue engineering is more often
used in medicine, especially in orthopedics. Tissue engi-
neering opens new alternative solutions which can change
the management of many diseases. Years ago, there was
a belief that human tissues can be replaced only by di-
rect allogenic transplantation or completely artifi cial im-
plants. In last years scientist attention is directed to bio-
hybrid organs.
Novel application of nanomaterials, three-dimensional im-
plants, fl ow-microchips or bioactive glass with stem cells
gives huge opportunity for creating new tissues.
S
TEM
C
ELLS
Many different types of cells are used in tissue engineering,
especially stem cells. Stem cells posses differentiation po-
tential and are capable to self-renew [1,2].
There are following types of stem cells:
•
Totipotential (embryonic stem cells from embryo blasto-
cyst) which can give rise to whole organism.
•
Pluripotential (embryonic stem cells) which can differ-
entiate into each cell type with the exception of germ
cells.
•
Multipotential (somatic stem cells, responsible for the re-
plenishment of cells throughout life) which can differen-
tiate into cells with similar properties.
•
Unipotential (progenitor cells) which can differentiate
into only one type of cell.
Embryonic and somatic stem cells are ideal candidates for
tissue engineering purposes. Unfortunately there are still
many ethical dilemmas due to use of embryonic stem cells.
In orthopedics attention is focused on mesenchymal stem
cells (MSC) from bone marrow [1].
Mesenchymal stem cells (Figure 1) can give rise to chondro-
cytes, osteocytes, myocytes and adipocytes [3–5].
Rycina 1. Mezenchymalne komórki macierzyste szpiku kostnego
wyizolowane od szczura rasy Wistar, pasaż 11 (pow. 100×,
mikroskop odwrócony, fot. R. Joachimiak).
Figure 1. Mesenchymal stem cells from male Wistar rat’s bone
marrow, passage 11
th
(magnifi c. 100×, inverted microscop,
phot. R. Joachimiak).
Artroskopia i Chirurgia Stawów, 2007; 3(3): 11-16
Kaźnica A i wsp. – Nowe trendy w inżynierii tkankowej
12
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
szkielety z biomateriałów wchłanialnych, odpowiednich dla
wzrostu komórek tworzących nowe tkanki i narządy [6].
Nadrzędnym zadaniem w inżynierii tkankowej stało się stwo-
rzenie rusztowania wraz z komórkami, takiego które mogło-
by odtworzyć nową tkankę, czynnościowo i strukturalnie, po-
równywalną z tkanką prawidłową.
R
USZTOWANIA
(
SKAFOLDY
)
Wykorzystywanie biomateriałów, jako biologicznych implan-
tów znane jest od czasów starożytnych. Sztuczne oczy, uszy,
zęby i nosy znaleziono przy mumiach egipskich. Chińczycy
i Indianie stosowali woski, kleje, drewno i różne metale celem
zastąpienia uszkodzonych lub brakujących części ciała [7].
Pod koniec XX wieku zmieniły się kryteria wyboru i wykorzy-
stania biomateriałów do przeszczepiania. Skafoldy stosowane
w inżynierii tkankowej mają naśladować biologiczne funkcje
macierzy zewnątrzkomórkowej, utrzymywać strukturę i funk-
cje tworzonych konstrukcji tkankowych oraz przyczyniać się
do wzrostu, adhezji i różnicowania się komórek. Rusztowania
przygotowuje się z odpowiednich biozgodnych materiałów,
które ulegają powolnej degradacji i resorpcji w organizmie.
Większość z nich zapewnia hodowli trójwymiarową przestrzeń,
w której komórki mogą rosnąć i dzielić się [6].
Wyróżnia się skafoldy naturalne i syntetyczne, które stosu-
je się w zależności od wskazań medycznych. Przyszłością są
„inteligentne” biomateriały, które będą modyfi kować swo-
je właściwości w odpowiedzi na zmiany warunków środowi-
ska zewnętrznego, np. zmiany pH, temperatury.
Rusztowania stosowane w inżynierii tkankowej zazwyczaj łączy
się z odpowiednimi komórkami. Coraz częściej jednak stosu-
je się skafoldy bez elementów komórkowych. Stosowanie ko-
mórek ma za zadanie wzmagać proces syntezy tkanek de novo.
W celu zapewnienia komórkom dostępu do składników od-
żywczych, jak i odpowiedniej powierzchni wzrostu projektu-
je się porowate konstrukcje. Do hodowli osteocytów stosuje
się skafoldy składające się z hydroksyapatytu lub bioaktywne-
go szkła, PLGA (poly(lactic-co-glycolic acid)) lub kolagenu,
które dzięki swojej strukturze aktywnie uczestniczą w rege-
neracji tkanki kostnej poprzez zwiększoną adsorpcję wielu
białek m.in. czynników wzrostu i białek receptorowych [8].
Nowe generacje skafoldów projektuje się z porowatych ma-
teriałów zawierających czynniki wzrostu tkanki kostnej, wol-
no uwalniającą się witaminę C i
b-glicerofosforan [6].
Popularną i wciąż modyfi kowaną techniką hodowli i przeszcze-
piania komórek jest enkapsulacja, która po raz pierwszy została
zastosowana w 1960 roku. Komórki „zamyka się” w kapsułkach
wykonanych z biomateriałów przepuszczających substancje od-
żywcze i tlen, pozwalając jednocześnie na wypływ substancji
wydzielanych przez przeszczepione komórki do krwiobiegu
lub sąsiadujących tkanek. Kapsułka taka chroni również przed
komórkami układu immunologicznego mogącymi zniszczyć
wszczep (Rycina 2). Tradycyjne materiały stosowane do pro-
dukcji kapsuł to m.in. chitozan, polisacharydowe hydrożele,
wapń i polilizyna, zaś nowe techniki pozwalają na produkcję
silikonowych kapsuł o nanometrowych porach [9].
Produkcja skafoldów powinna uwzględniać indywidualne
warunki anatomiczne pacjenta. Metoda „rapid prototyping”
Commonly applied procedure in damaged tissues and organs
reconstruction is donor cell isolation, seeding on biodegrad-
able scaffolds and further cultivation in vitro. For this purpose
3D absorbable biomaterials are being designed [6].
The main goal in tissue engineering is to create such cell
seeded scaffolds that are able to reconstruct functionally
and structurally new tissue.
S
CAFFOLDS
Biomaterials as biological implants are known from ancient
times. Artifi cial eyes, ears, teeth and noses were found with
Egyptian mummies. Chineese and Indians used waxes, glues,
wood and different metals to replace damaged or missing
parts of the body [7]. At the end of XX century selection
criteria of biomaterials were changed. Scaffolds used in tis-
sue enginnering are designed to mimic the biological func-
tion of extracellular matrix, maintain structure and func-
tion of created tissue constructs and contribute to growth,
adhesion and differentiation of cells. Scaffolds are made of
suitable biocompatible materials which are slowly degrad-
ed and resorbed. Most of them provide three-dimensional
space in which cells are able to grow and divide [6].
Natural and synthetic scaffolds are used depending on
therapeutic indications. Intelligent biomaterials capable
to change their own properties in response to external en-
vironment are the future of tissue engineering.
Scaffolds applied in tissue engineering can be seede with
different types of cells. Scaffolds without cell compartment
are also used very often. The main idea to use cell seede scaf-
folds is to enhance de novo tissue synthesis. To enable nutri-
ents and growth space access, porous constructions are de-
signed. Scaffolds made of hydroxyapatite or bioactive glass,
PLGA (poly(lactic-co-glycolic acid)) or collagen are used for
osteocytes culture. Thanks to their structure they participate
in bone tissue regeneration, enhancing proteins adsorption
(growth factors and receptor proteins) [8]. The new gener-
ation of biomaterials includes bone growth factors, slowly
released vitamin C and
b-glycerophosphate [6].
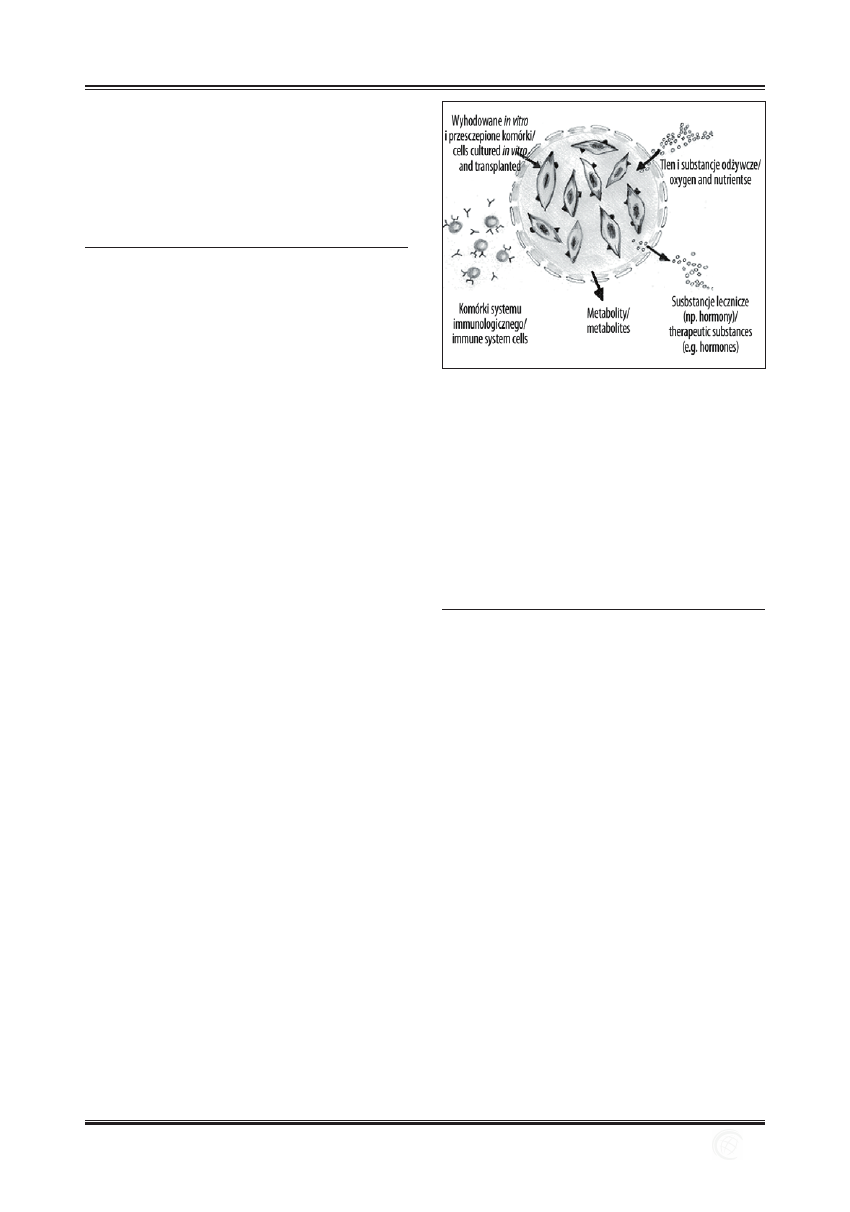
Rycina 2. Zasada działania wszczepu przygotowanego metodą
enkapsulacji (wg R. Joachimiak).
Figure 2. Encapsulation technique (according to R. Joachimiak).
Arthroscopy and Joint Surgery, 2007; 3(3): 11-16
Kaźnica A et al – New trends in tissue engineering
13
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
umożliwia komputerowe przygotowanie trójwymiarowego
modelu ubytku, który ma zostać wypełniony przez zapro-
jektowany implant (Rycina 3) [10].
Jedną z technik umożliwiającą wyprodukowanie tak zapro-
jektowanego implantu jest 3D printing (nadrukowanie prze-
strzenne), przy użyciu zmodyfi kowanych drukarek. Wybór
materiałów używanych w tej metodzie jest nieograniczony,
od materiałów ceramicznych w postaci pyłów do substancji
żelowych [10,11].
Skafoldy o małej średnicy porów umożliwiają lepszą interak-
cję komórek z czynnikami wzrostu i innymi ligandami, mają-
cymi wpływ na funkcje i różnicowanie się komórek [6].
N
ANOMATERIAŁY
STOSOWANE
W
INŻYNIERII
TKANKOWEJ
Nanomateriały składają się z elementów (włókna, ziarna,
cząstki), których wielkość nie przekracza 100 nm. Do pro-
dukcji nanomateriałów stosuje się dotąd powszechnie uży-
wane w produkcji skafoldów w skali mikro metale, cerami-
kę, polimery lub kompozyty powstałe z ich połączeń [12].
Nanomateriały posiadają unikalne właściwości powierzch-
niowe, które zwiększają adsorpcję białek i adhezję komó-
rek, poprawiają znacznie interakcje pomiędzy białkami
i komórkami [12,13]. Obserwuje się np. wzrost adsorpcji
fi bronektyny przy stosowaniu mniejszych cząsteczek PLGA
(Rycina 4).
Coraz częściej nanomateriały wykorzystuje się w ortopedii
w celu regeneracji tkanki mięśniowo-szkieletowej. Skafoldy
wykonane z nanomateriałów przypominają struktury żywego
organizmu, które są zbudowane z elementów o mikro i na-
norozmiarach, tak jak struktura kości (Rycina 5).
Do regeneracji kości stosuje się nanoceramikę, taką jak tle-
nek glinu, tytan i hydroksyapatyt, które w porównaniu z tra-
dycyjnie wykorzystywanymi rusztowaniami zwiększają adhe-
zję i proliferację osteoblastów, a także poprawiają czynność
osteoklastów [12,14]. Podobne korzystne zjawiska obserwu-
je się w przypadku stosowania nanometali, nanopolimerów
czy też nanokompozytów (Rycina 6).
Zastosowanie nanomateriałów w inżynierii tkankowej daje
duże nadzieje na regenerację tkanki chrzęstnej poprzez
„dopasowanie” składu, mikrostruktury i właściwości biolo-
gicznych do chondrocytów. Nanostruktura PLGA zwiększa
adhezję, wzrost, różnicowanie, żywotność i syntezę zewnątrz-
komórkowej macierzy chondrocytów [15]. Dzięki interakcji
pomiędzy nanomateriałami i białkami, a później komórkami
regeneracja uszkodzonych tkanek staje się możliwa.
Encapsulation, which was applied in 1960 for the fi rst time,
is still very popular and often modifi ed technique of culti-
vating and transplanting the cells. Cells are being closed in
capsules which are permeable for nutrients, oxygen and ther-
apeutic substances. Such capsule protects against host immu-
nological cells which may damage the implant (Figure 2).
Chitosan, polysaccharide hydrogels, calcium and polylysine
are traditionally used in capsule production. New methods
allow creating silicone capsules with nanosize pores [9].
Individual anatomical patient’s conditions should be taken
into consideration in scaffold creation. ‘Rapid prototyping’
method provides the possibility to produce three-dimen-
sional defect model which will be replaces by the implant
(Figure 3) [10].
3D printing is one of the method used in implant produc-
tion. The choice of material is highly fl exible, from powder
ceramic materials to gel substances [10,11].
Scaffolds with small pore size allow better cell interaction
with growth factors and other ligands which have infl uence
on cell function and differentiation [6].
N
ANOMATERIALS
USED
IN
T
ISSUE
E
NGINEERING
Nanomaterials are materials with very small components (fi -
bers, grains, particles) with dimension in the range of 1–100
nm. Nanomaterials can be conventionally used metals, ce-
ramics, polymers or composite materials which demonstrate
novel features due to their nanoscale [12]. Nanomaterials
possess unique surface features, which enhance protein ad-
sorption, cell adhesion and improve interaction between
cells and proteins. [12,13]. Better fi bronectin adsorption on
nanometer PLGA surface was observed (Figure 4).
Nanomaterials are more often used in orthopedics due to
their regeneration ability of sceletal-muscle tissue.
Scaffolds prepared from nanomaterials are designed and
assembled from micro- and nanoscale building elements
similar to natural tissues (for instance bone structure)
(Figure5).
Nanoceramics, alumina, titania and hyroxyapatite are used
in bone regeneration. They promote osteoblast adhesion
and proliferation, osteoclast function in comparison with
traditionally used microscale materials [12,14]. Similar ad-
vantageous effects are observed not only on nanophase ce-
ramics but also on nanometals, nanoplymers and nanocom-
posites (Figure 6).
Pył ceramiczny
(np. zmodyfikowany
proszek hydroksyapatytu)
+
Skafold
Pory: do 450 μm
Grubość ścianek: do 330 μm
Wytrzymałość mechaniczna: 22 MPa
Roztwór wiążący polimeru
Ceramic powder
(modified hydroxyapatitie
powder)
+
Scaffold
Pores: dimension down to 450 μm
Wall thickness: down to 330 μm
Mechanical strenght: up to 22 MPa
Polymer-based
Artroskopia i Chirurgia Stawów, 2007; 3(3): 11-16
Kaźnica A i wsp. – Nowe trendy w inżynierii tkankowej
14
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
S
KAFOLDY
I
KOMÓRKI
MACIERZYSTE
Komórki macierzyste aby przeżyć i zróżnicować się w okre-
ślony typ tkanki, wymagają odpowiedniego mikrośrodowiska
i obecności określonych czynników wzrostu. Połączenie ko-
mórek macierzystych z biomateriałami daje możliwości two-
rzenia nowych tkanek, a nawet narządów. Komórki macie-
According to the current trends it is suggested that nano-
materials used in tissue engineering may offer promising
opportunities for cartilage regeneration in a natural way.
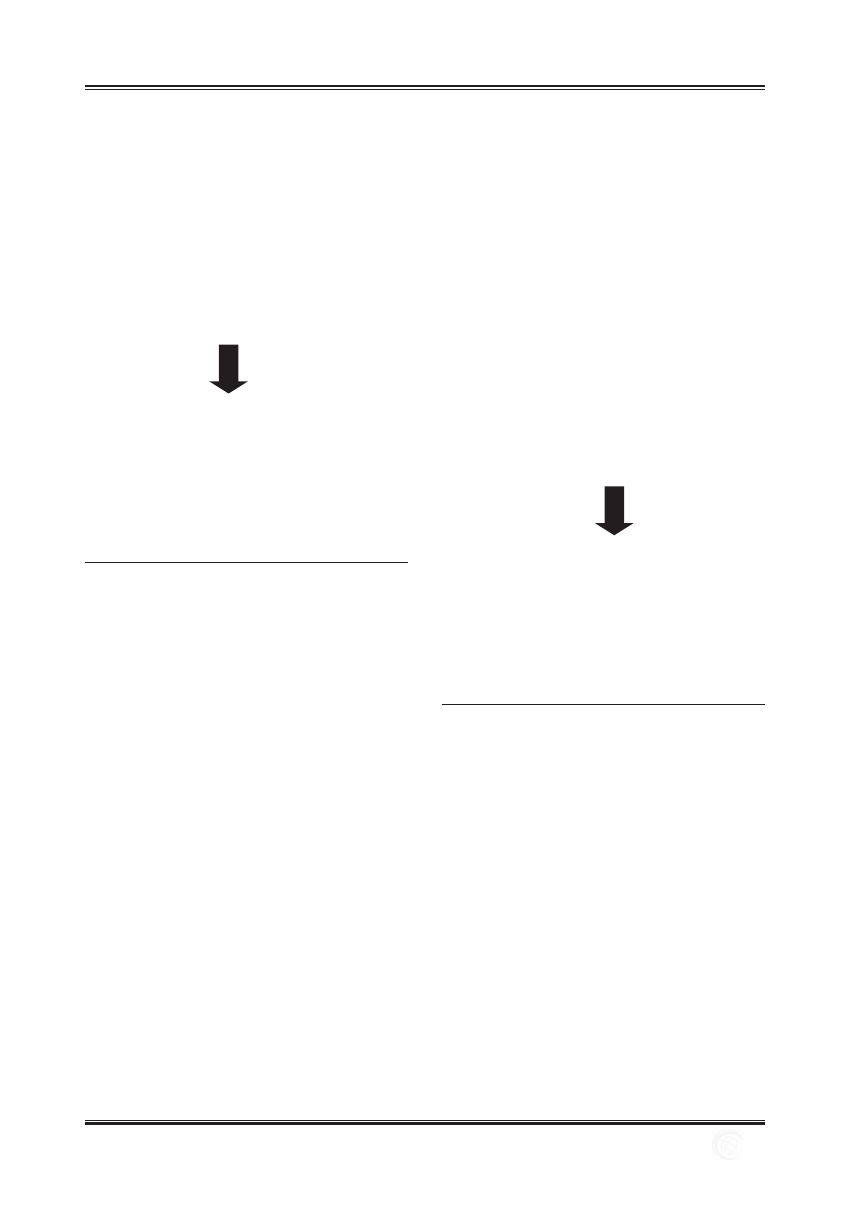
Rycina 3. Proces komputerowego projektowania implantu – „rapid
prototyping” wg Schieker i wsp. 2006 [10]. (A) Zebranie
danych klinicznych. Badanie tomografi i komputerowej
i rezonansu magnetycznego. (B) Zastosowanie programów
naśladujących naturalną budowę kości. (C) Projektowanie
rusztowania. (D) Wykonanie rusztowania metodą
nadrukowania przestrzennego.
Figure 3. A typical rapid prototyping process according to Schieker et
al. 2006 [10]. (A) Medical dataset (CT, MRI-scans). (B) Use
of computer programmes which mimic bone structure. (C)
Scaff old design. (D) Custom-made scaff olds by 3D printing.
A
B
C
D
Rycina 4. Adsorpcja fi bronektyny na cząsteczkach PLGA o różnej
średnicy wg Liu i Webster 2007 [12].
Figure 4. Images of fi bronectin adsorbed to PLGA surfaces with
various nanoscale surface features according to Liu and
Webster 2007 [12].
Rycina 5. Makro-, mikro- i nanostruktura kości (schemat wg M.
Schieker).
Figure 5. Macro-, micro- and nanostructure of bone according to M.
Schieker.
Rycina 6. Formowanie się kości na skafoldach pokrytych
nanofazowym (nano-hydroksyapatyt) i konwencjonalnym
hydroksyapatytem – HA wg Liu i Webster 2007 [12].
Figure 6. Bone formation on nanophase or conventional
hydroxyapatite (HA) scaff olds according to Liu and Webster
2007 [12].
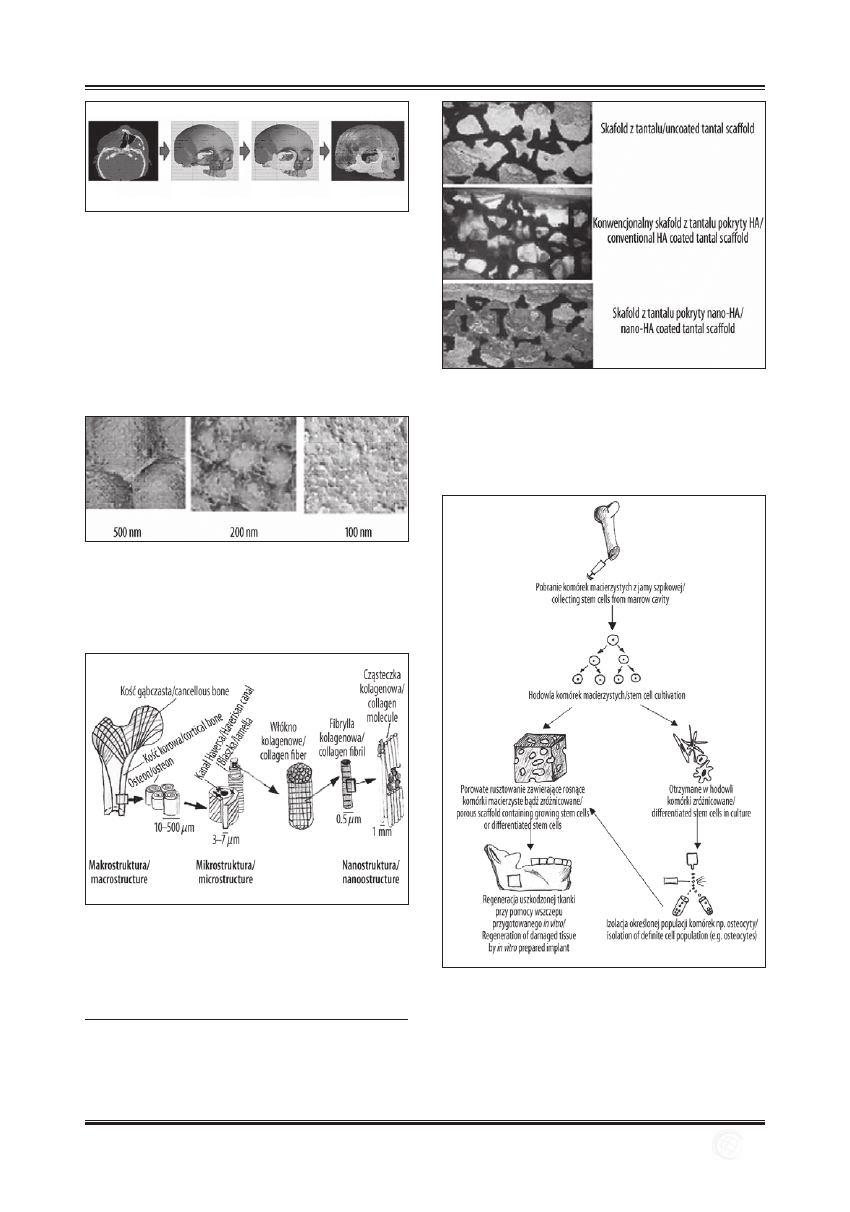
Rycina 7. Przygotowanie implantu z materiału biowchłanialnego
i wyhodowanych komórek in vitro (wg R. Joachimiak).
Figure 7. Bioabsorbable implant with stem cells prepared in vitro
(according to R. Joachimiak).
Arthroscopy and Joint Surgery, 2007; 3(3): 11-16
Kaźnica A et al – New trends in tissue engineering
15
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com

rzyste mogą być bezpośrednio umieszczone na powierzchni
macierzy, która tworzy szkielet przyszłej tkanki lub narządu.
Inną metodą jest osadzenie komórek macierzystych podda-
nych różnicowaniu w warunkach hodowli in vitro.
Utworzoną w ten sposób przestrzenną konstrukcję składa-
jącą się z biomateriałów wchłanialnych i wyhodowanych ko-
mórek wszczepia się w miejsce ubytku (Rycina 7), gdzie ko-
mórki dalej namnażają się i grupują budując tkankę. W tym
samym czasie biomateriał ulega stopniowej degradacji, a uby-
tek zostaje zastąpiony nową tkanką (neo-tkanka).
W ortopedii ze względu na ograniczaną liczbę dawców do
regeneracji tkanki kostnej i chrzęstnej coraz częściej wyko-
rzystuje się ludzkie mezenchymalne komórki macierzyste
szpiku kostnego poddane różnicowaniu w połączeniu z po-
rowatymi skafoldami i nanomateriałami. Proces różnicowa-
nia komórek macierzystych jest kontrolowany przez szereg
hormonów i czynników transkrypcyjnych [16–18].
W
NIOSKI
Rozwój inżynierii tkankowej stwarza nowe możliwości lecze-
nia wielu schorzeń. Największy postęp dotyczy modyfi kowa-
nia powierzchni i właściwości stosowanych biomateriałów.
W centrum zainteresowania są implanty, które zawierają
czynniki wzrostu charakterystyczne dla danej tkanki uwal-
niane sukcesywnie do wszczepu. Projektuje się mikroczipy
do hodowli komórek na trójwymiarowym podłożu, które
są niemal identycznej struktury, jak komórki w organizmie.
Przyszłość w rozwoju medycyny regeneracyjnej to również
wyspecjalizowane, w pełni zautomatyzowane bioreaktory,
w których wszystkie warunki fi zyko-chemiczne są ściśle zde-
fi niowane dla danej tkanki oraz nieinwazyjne techniki mo-
nitorowania zmian strukturalnych skafoldów i systemy ob-
serwowania fenotypu i żywotności komórek.
Inżynieria tkankowa korzystając z osiągnięć nauki o mate-
riałach biologicznych, biologii komórki, biochemii, inżynie-
rii biomedycznej i transplantologii stwarza nowe możliwo-
ści regeneracji tkanek.
PLGA nanostructure enhances chondrocyte function such
as adhesion, growth, differentiation and extracellular ma-
trix synthesis [15]. Regeneration of damaged tissues is pos-
sible due to interaction between nanomaterials, proteins
and cells.
S
CAFFOLDS
AND
S
TEM
C
ELLS
An adequate microenvironment and growth factors are nec-
essary for stem cells to live and differentiate into a special
type of tissue. Combination of stem cells and biomaterials
gives huge opportunity in creation of new tissue and whole
organs. Stem cells may be placed on matrix surface directly.
Another method is setting up stem cells which have been
preciously differentiated in in vitro conditions.
Such prepared three-dimensional implants consisting of
bioabsorbable materials and cultured cells are engrafted
into damaged place (Figure 7) where cells are proliferat-
ing and rebuilt new tissues. At the same time biomaterial
is slowly degraded.
In orthopedics, due to insuffi cient number of donors, hu-
man mesenchymal stem cells with porous scaffolds and
nanomaterials are used in bone and cartilage regeneration.
Stem cell differentiation process is strictly controlled by hor-
mones and transcriptional factors [16–18].
C
ONCLUSIONS
Development of tissue engineering gives new opportunities
in treatment of many diseases. The biggest progress con-
cerns modifi cation of biomaterials’ properties and their
surface. The most interesting are implants with slowly re-
leased growth factors characteristic for proper tissue. Three-
dimensional microchips with nearly identical structure as
natural cells are designed. Future of regenerative medicine
is automated bioreactors where every condition is defi ned,
equipped with noninvasive cell monitoring system.
1. Dai W, Hale S, Kloner A: Stem cell transplantation for the treatment of
myocardial infarction. Transpl Immunol, 2005; 15: 91–97
2. Amos T, Gordon M: Sources of human hematopoietic stem cells for
transplantation – a review. Cell Transplant, 1995; 4(6): 547–69
3. Martin D, Cox N, Hathcock T et al: Isolation and characterization of
multipotential mesenchymal stem cells from feline bone marrow. Exp
Hematol, 2002; 30: 879–86
4. Ulloa-Montoya F, Verfaillie C, Hu W: Culture system for pluripotent
stem cells. J Biosci Bioeng, 2005; 100(1); 12–27
5. Short B, Brouard N, Occhiodoro-Scott T et al: Mesenchymal stem cells.
Arch Med Res, 2003; 34: 565–71
6. Evans N, Gentelman E, Polak J: Scaffolds for stem cells. Materials Today,
2006; 9(12): 26–33
7. Ramakrishna S, Mayer J, Wintermantel E, Leong KW: Biomedical appli-
cations of polymer-composite materials: a review. Compos Sci Technol,
2001; 61: 1189–24
8. Padilla S, Sanchez-Salcedo S, Vallet-Regi M: Bioactive glass as precur-
sor of designed-architecture scaffolds for tissue engineering. J Biomed
Res Part A, 2006; 224–32
9. Pichonat T, Gauthier-Manuel B: Realization of porous silicon based
miniature fuel cells. J Power Sources, 2006; 154: 198–201
P
IŚMIENNICTWO
: R
EFERENCES
:
10. Schieker M, Seitz H, Drosse I et al: Biomaterials as scaffold for bone tis-
sue engineering. Eur J Trauma, 2006; 32: 114–24
11. Boland T, Tao X, Damon BJ et al: Drop-on-demand printing of cells and ma-
terials for designer tissue constructs. Mat Sci Eng C, 2007; 27: 372–76
12. Liu H, Webster T: Nanomedicine for implants: A review of studies and
necessary experimental tools. Biomaterials, 2007; 28: 354–69
13. Asuri P, Bale SS, Karajanagi SS, Kane RS: The protein – nanomaterial
interface. Curr Opin Biotechnol, 2006; 17: 562–68
14. Sato M, Webster T: Nanobiotechnology: implications for the future of
nanotechnology in orthopedic applications. Expert Rev Medical Devices,
2004; 1(1): 105–14
15. Park GE, Pattison MA, Park K: Accelerated chondrocyte functions on
NaOH treated PLGA scaffolds. Biomaterials, 2005; 26: 3075–82
16. Mygind T, Stiehler M, Baatrup A et al: Mesenchymal stem cell ingrowth
and differentiation on coralline hydroxyapatite scaffolds. Biomaterials,
2007; 28: 1036–47
17. Silva G, Coutinho O, Ducheyne P et al: The effect of starch and starch-bio-
active glass composite microparticles on adhesion and expression of the
osteoblastic phenotype of bone cell line. Biomaterials, 2007; 28: 326–34
18. Rezwan K, Chen Q, Blaker J, Boccaccini A: Biodegradable and bioac-
tive porous polymer/inorganic composite scaffolds for bone tissue en-
gineering. Biomaterials, 2006; 27: 3413–31
Artroskopia i Chirurgia Stawów, 2007; 3(3): 11-16
Kaźnica A i wsp. – Nowe trendy w inżynierii tkankowej
16
- - - - -
Electronic PDF security powered by www.IndexCopernicus.com
Wyszukiwarka
Podobne podstrony:
Maryniak Nowe trendy w opakowalnictwie
Nowe-Trendy-pytania-2012, UR Kraków Technologia Żywności
Zastosowanie metod inżynierii tkankowej w leczeniu oparzeń skóry
Psychologia ogólna Historia psychologii Sotwin wykład 8 Nowe trendy w nauce o umyśle
Wspolczesne trendy w nauce o zywnosci - inzynieria1, Współ.trendy - inżynieria
INŻYNIERIA TKANKOWA W CHIRURGII PRZEDIMPLANTOLOGICZNEJ
Nowe trendy w zachowaniach konsumentów na rynkach finansowych ebook demo
NOWE TRENDY W GIMNASTYCE KOREKCYJNEJ, wychowanie fizyczne, GIMNASTYKA korekcyjna
Trendy, NOWE trendy
23 nowe trendy w poradnictwie zawodowym u progu XXIw
Negocjacje 8 NOWE TRENDY
Maryniak Nowe trendy w opakowalnictwie
Opakowania w przemyśle spożywczym wymagania prawne i nowe trendy
199906 inzynieria tkankowa nadz
Hodowla komorek, inzynieria tkankowa i medycyna regeneracyjna
Nowe trendy w żywieniu zdrowych niemowląt karmionych naturalnie
więcej podobnych podstron