
Wydział Mechaniczny
Politechniki Białostockiej
Zakład Techniki Cieplnej i Chłodnictwa
Instrukcja do zajęć laboratoryjnych z przedmiotu:
POMIARY CIEPLNE
Ćwiczenie nr: 2
Oznaczanie kaloryczności paliw stałych
Kod przedmiotu:
MBM2N32006A
Instrukcję opracował: dr inż. M. Łukaszuk
Białystok 2016

1
CEL ĆWICZENIA
Celem ćwiczenia jest zapoznanie się z metodą wyznaczania ciepła spalania i
wartości opałowej paliw stałych za pomocą kalorymetru.
1. WPROWADZENIE
Własności paliwa zależą od jego składu chemicznego. Najważniejszymi danymi
technicznymi charakteryzującymi paliwa są: ciepło spalania i wartość opałowa,
zawartość części lotnych, wilgoci i popiołu. Ciepłem spalania Q
s
nazywa się ilość
ciepła wydzieloną przy pełnym spaleniu jednostki masy paliwa i schłodzeniu
produktów spalania do temperatury otoczenia. W wartości tej jest zawarte również
ciepło kondensacji pary wodnej, która powstała ze spalenia wodoru i odparowania
wilgoci paliwa. Temperatura spalin uchodzących z urządzeń przemysłowych jest z
zasady na tyle wysoka, że wilgoć w nich zawarta znajduje się w stanie gazowym.
Dlatego wprowadzono pojęcie wartości opałowej paliwa Qj, która jest mniejsza od
ciepła spalania o ciepło parowania wody zawartej w spalinach
Q
i
=Q
s
- rm
w
kJ/kg
gdzie: r -
ciepło parowania wody, kJ/kg (najczęściej przyjmuje się r =2500 kJ/kg),
m
w
-
masa wody powstałej ze spalenia wodoru i odparowania wilgoci paliwa,
kg/kg.
Ciepło spalania wyznacza się na stanowisku przedstawionym na rys. 1 i wyrażone
jest wzorem:
Q
i
= [ C · ( D
t
– k ) - c] / m,
gdzie: Q
i
-
ciepło spalania – J/g,
C -
pojemność cieplna kalorymetru – J/ºC,
D
t
-
ogólny przyrost temperatury okresu głównego - ºC,
k -
poprawka na wymianę ciepła kalorymetru z otoczeniem - ºC,
c - suma poprawek na dodatkowe efekty cieplne
– J,
m -
masa odważki paliwa stałego – g.
Pojemność cieplną kalorymetru C należy sprawdzać co 3 miesiące oraz w przypadku
wymiany lub naprawy którejkolwiek części układu kalorymetrycznego, a także przy
wystąpieniu większych wahań temperatury otoczenia. Obliczeń dokonuje się wg
poniższego wzoru:
C = (Q
s
m
2
+ c
1
) / ( D
t
- k ),
gdzie: C -
pojemność cieplna kalorymetru – J/ºC
Q
s
-
znane ciepło spalania substancji wzorcowej – J/g
m
2
-
masa odważki substancji wzorcowej – g
c
1
-
poprawka na ciepło wydzielone podczas spalania drutu oporowego i nitki
bawełnianej (w przypadku jej użycia) – J
D
t
-
ogólny przyrost temperatury okresu głównego - ºC
k -
poprawka na wymianę ciepła kalorymetru z otoczeniem - ºC
Poprawkę c
1
oblicza się wg wzoru:
c
1
= ( m
1
- m
2
) · q
1
+ m
3
q
3
,
2
gdzie: c
1
-
poprawka na ciepło wydzielone podczas spalania drutu oporowego i nitki
bawełnianej (w przypadku jej użycia) – J,
m
1
- masa drutu oporowego przed spaleniem
– g,
m
2
-
masa drutu oporowego pozostałego po spaleniu – g,
q
1
-
ciepło spalania drutu oporowego – J/g,
m
3
-
masa nitki bawełnianej ( w przypadku jej użycia ) – g,
q
3
-
ciepło spalania nitki bawełnianej ( w przypadku jej użycia ) – J/g.
Ogólny przyrost temperatury okresu głównego D
t
należy obliczyć wg wzoru:
D
t
= t
n
- t
o
,
gdzie: D
t
-
ogólny przyrost temperatury okresu głównego - ºC,
t
n
-
ostatni odczyt temperatury głównego okresu pomiarowego, tzn. T
3
-
ºC,
t
o
-
ostatni odczyt temperatury początkowej okresu pomiarowego
bezpośrednio przed włączeniem prądu, tzn. T
2
-
ºC.
Poprawkę k obliczyć wg wzoru:
k = 0,5 ( d
H
+ d
K
) + ( n- 1 ) d
K
,
gdzie: k -
poprawka na wymianę ciepła kalorymetru z otoczeniem - ºC,
d
H
-
średni przyrost temperatury na 1 minutę w okresie początkowym - ºC
/min.,
d
K
-
średni przyrost temperatury na 1 minutę w okresie końcowym - ºC /min.,
n -
czas trwania głównego okresu pomiarowego – min.
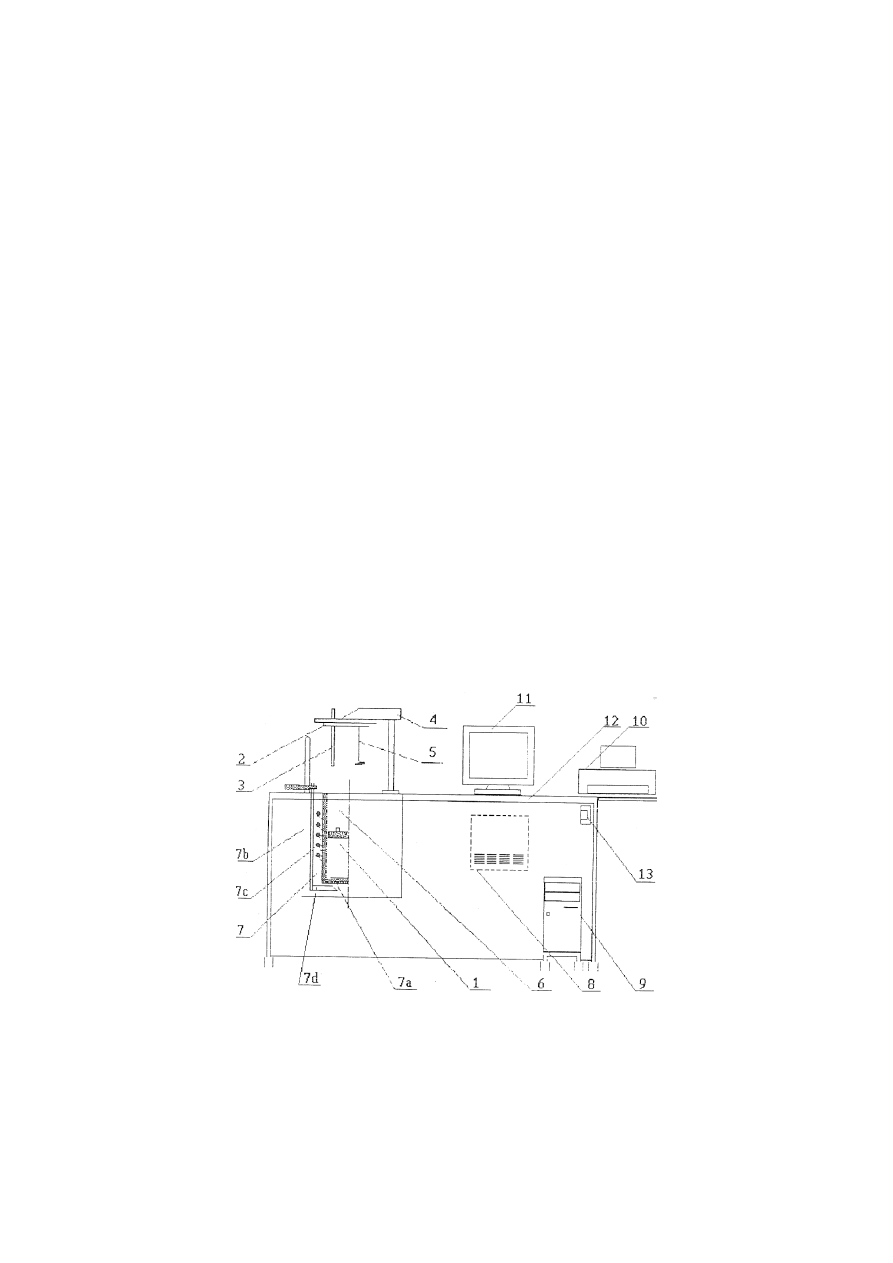
2. OPIS STANOWISKA POMIAROWEGO
Pomiary ciepła spalania i wartości opałowej paliw stałych są przeprowadzane za
pomocą kalorymetru, którego schemat przedstawiono na rys. 1.
Rys. 1. Podstawowe wyposażenie aparatury pomiarowej:1 - bomba kalorymetryczna, 2 -
pokrywa kalorymetru, 3 - czujnik temperatury, 4 - uchwyt pokrywy z umieszczonym w nim
napędem mieszadła mechanicznego, 5 - mieszadło mechaniczne, 6 - naczynie
kalorymetryczne, 7 - płaszcz kalorymetru składający się, 7a - ścianka wewnętrzna, 7b -
ścianka zewnętrzna, 7c – wężownica, 7d - mieszadło ręczne, 8 - zespół sterujący kalorymetru,
9 – komputer, 10 – drukarka, 11 - monitor komputera, 12 -stół kalorymetru, 13 - listwa
zasilająca z włącznikiem

3
3.
PREBIEG ĆWICZENIA
Płaszcz kalorymetru wypełnia się wodą przez otwór wlewowy. Wody tej w
zasadzie nie wymienia się. Reguluje się natomiast jej temperaturę do temperatury
otoczenia, korzystając w tym celu z wężownicy. Przed odczytem temperatury w
płaszczu należy kilkakrotnie poruszać mieszadłem ręcznym. Różnica pomiędzy
temperaturą wody w płaszczu a temperaturą otoczenia nie powinna przekraczać
0,5°C. Do naczynia kalorymetrycznego należy wlać wodę o niskiej twardości lub
wodę destylowaną o takiej temperaturze, aby po wykonaniu pomiaru temperatura
wody w naczyniu kalorymetrycznym była możliwie o tyle wyższa od temperatury w
płaszczu kalorymetrycznym, o ile przed pomiarem była od niej niższa. Warunek ten
jest na ogół spełniony, jeśli w naczyniu kalorymetrycznym przed pomiarem
temperatura wody jest o 1÷1,5°C niższa niż temperatura wody w płaszczu
kalorymetru. Ilość wody w naczyniu kalorymetrycznym powinna być tak dobrana, aby
zawory wystające z głowicy bomby były zanurzone do około 2/3 wysokości zaworu
wylotowego. Waru
nek ten jest spełniony przy użyciu 2,7dm³ (2700cm³) wody. Ilość
zużytej wody do pomiaru musi być taka sama przy oznaczaniu wartości cieplnej
kalorymetru. Dopuszczalna różnica wynosi 0,5g dla wody wraz z naczyniem. W
czasie ważenia naczynia kalorymetrycznego wraz z wodą ścianki wewnątrz naczynia
ponad powierzchnią wody oraz na zewnątrz powinny być suche. Do kolejnych
oznaczeń wystarczy tylko częściowa wymiana wody w naczyniu kalorymetrycznym w
celu uzyskania właściwej temperatury wody. Naczynie kalorymetryczne wraz z wodą
przenosi się za pomocą uchwytów i ustawia w płaszczu kalorymetru na znajdującej
się na dnie podstawce izolacyjnej. Naczynie kalorymetryczne należy ustawić w takiej
pozycji, aby wycięcie znajdowało się na wprost wyjścia przewodów zapłonowych ze
ściany wewnętrznej płaszcza. Głowicę bomby wraz z próbką należy przenieść
ostrożnie ze statywu, połączyć z korpusem i zamknąć szczelnie bombę przez
dokręcenie zakrętki samouszczelniającej. Przed wykonaniem pomiaru należy
napełnić bombę tlenem do ciśnienia 2,5 MPa ± 0,2 MPa. Następnie bombę przenieść
ostrożnie w pozycji pionowej do kalorymetru i wstawić do naczynia
kalorymetrycznego z przygotowaną wodą, trzymając przy wykonywaniu tej czynności
bombę za wystające zawory. Kołki kontaktowe połączyć z przewodem elektrycznym.
Jeżeli po wstawieniu bomby do naczynia kalorymetrycznego z wodą wydzielają się
pęcherzyki powietrza, świadczy to o nieszczelności bomby. W takim przypadku
należy bombę wyjąć z naczynia kalorymetrycznego, osuszyć czystą ścierką i
wypuścić tlen przez wkręcenie regulatora zaworu wylotowego. Następnie należy
otworzyć bombę przez odkręcenie zakrętki samouszczelniającej. Usunięcie
nieszczelności przeprowadza się zgodnie z opisem naprawy. Jeżeli nie widać
pęcherzyków powietrza to znaczy, że można przystąpić do rozpoczęcia pomiaru.
Naczynie kalorymetryczne przykrywamy
pokrywą, w której jest zamontowane
mieszadło i specjalny termometr kalorymetryczny. Następnie obliczałem masę
czystej próbki i wpisywałem ją do programu komputerowego. Po dokonaniu pomiaru
należy podnieść pokrywę zamykającą naczynie kalorymetryczne, odłączyć przewody
z elektrod bomby, a następnie wyjąć bombę z naczynia kalorymetrycznego trzymając
ją początkowo za zawory, a po zupełnym wynurzeniu z kalorymetru za korpus.
Bombę osusza się ściereczką i wypuszcza gazy spalinowe otwierając zawór
wylotowy przez wkręcenie radełkowanego regulatora zaworu wylotowego, zgodnie z
ruchem wskazówek zegara aż do oporu. Wypuszczanie gazów spalinowych z bomby
zaleca się dokonywać przed degestorium, szczególnie jeżeli w próbkach paliw
występują większe zawartości siarki.

4
Praca tego kalorymetru oparta jest na specjalistycznym układzie elektronicznym
podłączonym do komputera PC odpowiedzialnym za wszystkie realizowane funkcje.
Automatyczny cykl pomiar
owy zapewnia wygodę i łatwość obsługi tego urządzenia.
Kalorymetr działa na zasadzie pomiaru charakterystycznych temperatur bilansu
cieplnego. Wartości te są: przetwarzane na postać cyfrową, analizowane i
przeliczane przez komputer oraz zapamiętywane.
T1 T2 T3
m = [g]
T1 = [ºC]
T2 = [ºC]
T3 = [ºC]
T4 = [ºC]
n = min
Q = [J/g]
K = stała
26.421
o
C
Rys. 2. Przykładowy przebieg próby przy spalaniu
Podczas pomiaru na monitorze można obserwować przebieg pomiaru, a w
szczególności zapisywane przez program poszczególne fazy pomiaru. W pierwszej
fazie zostaje uruchomione mieszadło w celu wyrównania (stabilizacji) temperatury w
naczyniu kalorymetrycznym. Okres wstępny rozpoczynał się zapisem temperatury
T1, a został zakończony po upływie około pięciu minut i odczytem temperatury T2.
Następny krok pomiaru to uruchomienie zapłonu próbki i tym samym rozpoczęcie
okresu głównego. W tym czasie w minutowych odstępach czasu program określał
czy następował przyrost temperatury. Odczyt temperatury T3 nastąpił po osiągnięciu
maksymalnej temperatury. Od momentu określenia temperatury T3 rozpoczął się
okres końcowy. Okres końcowy trwa około pięciu minut i zostaje zakończony
odczytem T4. Jednocześnie z odczytem i wyświetleniem T4, zostaje obliczone i
wyświetlona wartość ciepła spalania i pojawi się komunikat o końcu próby.
4.
OPRACOWANIE WYNIKÓW
Po zak
ończeniu pracy programu należy zweryfikować poprawność procesu spalania
otwierając naczynie bomby. Następnie wprowadzić wartość ciepła wynikająca ze
spalenia drucika
– dodatkowe efekty cieplne oraz wartość wilgoci, wodoru oraz
popiołu w stanie analitycznym próbki. Odczytać i zapisać wartości ciepła spalania i
wartości opałowej próbki w stanie analitycznym oraz w stanie roboczym z okna
programu.

5
5. PYTANIA KONTROLNE
-
Co to jest stała kalorymetru?
-
Jak wyznacza się stałą kalorymetru?
-
Skąd wynikają poprawki na ciepło spalania?
- Budowa stanowiska pomiarowego.
-
Warunki przebiegu pomiaru ciepła spalania i wartości opałowej paliw stałych.
6. LITERATURA
1. Fodemski T. R.: Pomiary cieplne. Podstawowe pomiary cieplne cz.1.
Wydawnictwa Naukowo-Techniczne, Warszawa 2001.
2. Fodemski T. R.: Pomiary cieplne. Podstawowe pomiary cieplne cz.2.
Wydawnictwa Naukowo-Techniczne, Warszawa 2001.
3. Kortylewski W.: Spalanie i paliwa.Oficyna Wydawnicza Politechniki
Wrocławskiej. Wrocław 2008.
4. Szargut J.: Termodynamika techniczna.:
Wydaw. Politechniki Śląskiej, Gliwice
2013.
5.
Słupek S., Nocoń J., Buczek A.: Technika cieplna: ćwiczenia
obliczeniowe.
Akademia Górniczo-Hutnicza, Kraków 2002.
Wyszukiwarka
Podobne podstrony:
Oznaczanie kaloryczności paliw gazowych MBM2N32006A
Pracownia Paliw Stałych - KOLOKWIUM1, Energetyka AGH, semestr 4, IV Semestr, Technika Cieplna, LAB
D2 Kalorycznosc paliw id 130516 Nieznany
Ocena wydajności wytlewania naturalnych paliw stałych
Ciepło spalania i wartość opałowa paliw stałych
06 kalorymetria paliw gazowychi Nieznany (2)
Analiza elementarna paliw stałych
Sprawko 3 spalanie paliw stałych
5 Spalanie paliw stalych
Ciepło spalania i wartość opałowa paliw stałych
Pracownia Paliw Stałych KOLOKWIUM
3 Spalanie paliw stałych
Znaczenie dodatków paliwowych w procesach spalania paliw stałych Chyc
T 02 Ciepło spalania paliw stałych 2015
Pobieranie próbek paliw stałych sympozjum
PRAC PALIW STALYCH 2009
więcej podobnych podstron