
— 1 —
c
Grupa
Sole
W zadaniach 1–10 zaznacz jednà poprawnà odpowiedê.
Zaznacz zbiór, w którego skład wchodzà wyłàcznie wzory sumaryczne soli.
A.
NaCl, NaOH, Na
2
S
C.
NaCl, CaSO
4
, CaCl
2
B.
KCl, CaS, Na
2
O
D.
CuSO
4
, FeCl
3
, H
2
O
Zaznacz zbiór, w którym kolejno wymieniono nazwy soli o nast´pujàcych wzorach: NaCl, CuSO
4
, FeCO
3
.
A.
Chloran(VII) sodu, siarczan(VI) miedzi(II), w´glan ˝elaza(II).
B.
Sól kuchenna, siarczek miedzi(II), w´glan ˝elaza(II).
C.
Chlorek sodu, siarczan(IV) miedzi(II), w´glan ˝elaza(III).
D.
Chlorek sodu, siarczan(VI) miedzi(II), w´glan ˝elaza(II).
Oblicz i zaznacz zawartoÊç procentowà (procent masowy) wapnia w soli o wzorze CaCO
3
.
A.
20%
B.
33%
C.
40%
D.
68%
Zaznacz właÊciwe dokoƒczenie zdania.
Odczyn roztworów niektórych soli, np. chlorku potasu, jest oboj´tny, poniewa˝ w tych roztworach wyst´puje
A.
nadmiar kationów wodoru.
B.
nadmiar anionów wodorotlenkowych.
C.
tyle samo kationów wodoru i anionów wodorotlenkowych.
D.
tyle samo kationów metalu i anionów reszty kwasowej.
Zaznacz wzór soli, która dysocjuje na jony Fe
3+
i SO
4
2–
.
A.
Fe
3
SO
4
B.
Fe
2
(SO
4
)
3
C.
Fe
2
SO
4
D.
Fe
3
(SO
4
)
2
Zaznacz równanie reakcji dysocjacji jonowej w´glanu sodu.
A.
Na
2
CO
3
2 Na
+
+ CO
3
2–
C.
Na
2
CO
3
2 Na
+
+ CO
3
3–
B.
Na
2
CO
3
Na
2+
+ 3 CO
2–
D.
Na
2
CO
3
Na
2
+
+ CO
3
–
Zaznacz zbiór składajàcy si´ ze wzorów soli dobrze rozpuszczalnych w wodzie.
A.
BaSO
4
, PbSO
3
, SnS
B.
NaCl, MgCl
2
, AgCl
C.
Na
3
PO
4
, Fe(NO
3
)
3
, CaCl
2
D.
MgCl
2
, MgSO
4
, Mg
3
(PO
4
)
2
Zaznacz wzór kationu, który z jonem SO
4
2–
utworzy sól praktycznie nierozpuszczalnà w wodzie.
A.
Na
+
B.
Ba
2+
C.
Mg
2+
D.
Cu
2+
Sól fizjologiczna to 0,9-procentowy roztwór chlorku sodu. Oblicz i zaznacz, ile gramów chlorku sodu
znajduje si´ w 250 g takiego roztworu.
A.
1,8 g
B.
2,5 g
C.
0,9 g
D.
2,25 g
Zaznacz przykład zastosowania lapisu AgNO
3
.
A.
Składnik proszku do pieczenia.
B.
Nawóz sztuczny.
C.
Ârodek konserwujàcy produkty spo˝ywcze.
D.
Ârodek odka˝ajàcy.
I
2
3
4
5
6
7
8
9
10
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
imi´ i nazwisko ucznia
klasa suma punktów
data ocena
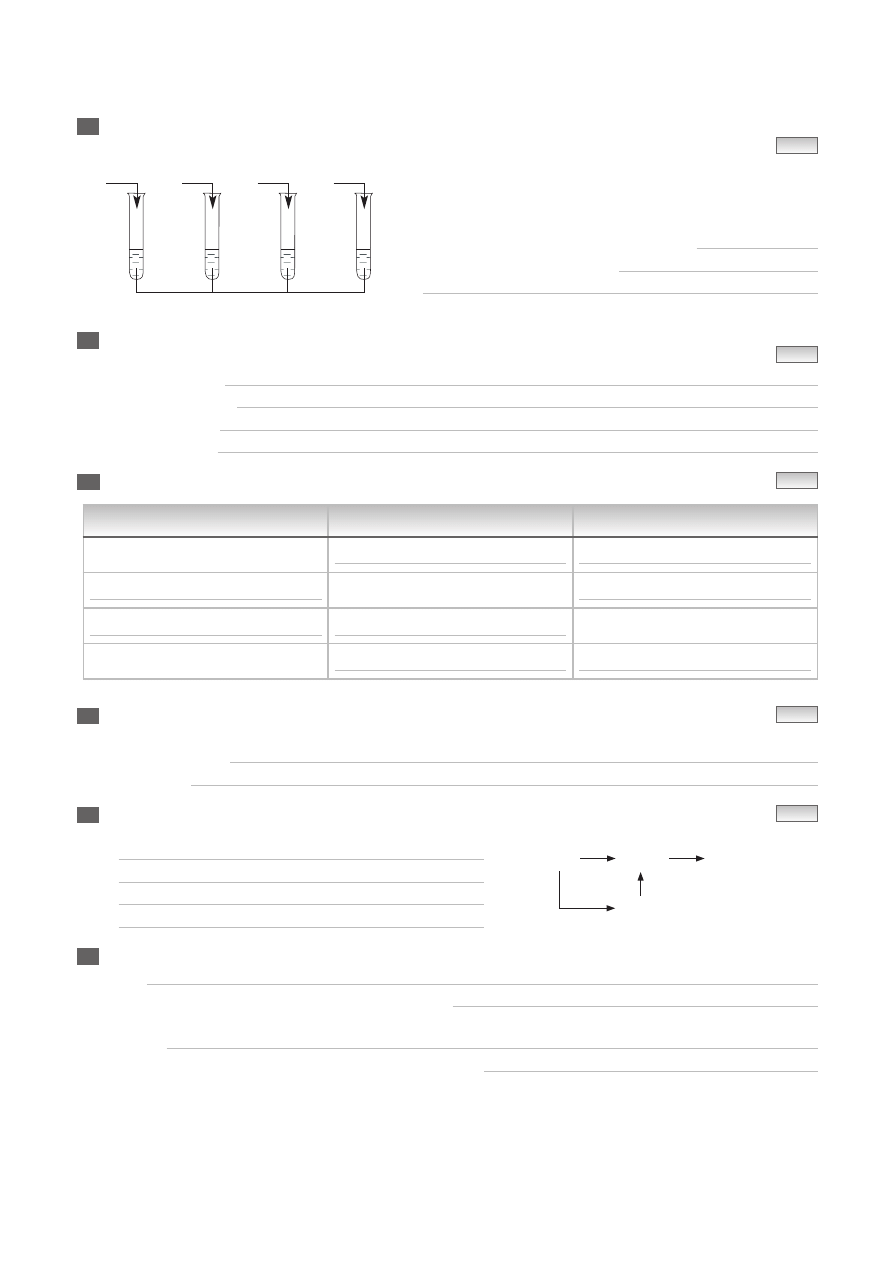
— 2 —
Zapisz numery probówek, w których w temperaturze pokojowej zaszły reakcje chemiczne
i napisz równania tych reakcji chemicznych.
Reakcje chemiczne zaszły w probówkach nr:
Równania reakcji chemicznych:
Przedstaw w zapisie jonowym równania reakcji chemicznych przebiegajàcych mi´dzy zwiàzkami chemicznymi
o podanych wzorach lub zapisz, ˝e reakcja chemiczna nie zachodzi.
A.
K
2
SO
4
, Ba(OH)
2
B.
Na
3
PO
4
, Fe(NO
3
)
3
C.
Na
2
CO
3
, K
2
SO
4
D.
Mg(NO
3
)
2
, KCl
Uzupełnij tabel´.
12
13
2 p.
2 p.
11
2 p.
*
Zn
Cu
1
rozcieƒczony roztwór kwasu siarkowego(VI)
2
3
Mg
4
Ag
Zapisz równania reakcji zoboj´tniania kwasu azotowego(V) zasadà sodowà.
Równanie reakcji chemicznej
Zapis czàsteczkowy:
Zapis jonowy:
Zapisz równania reakcji chemicznych przedstawionych na schemacie.
1.
2.
3.
4.
Napisz równania reakcji hydrolizy soli o podanych wzorach i okreÊl rodzaj odczynu roztworów tych soli.
K
2
SO
3
Roztwór otrzymany w wyniku hydrolizy K
2
SO
3
ma odczyn
Cu(NO
3
)
2
Roztwór otrzymany w wyniku hydrolizy Cu(NO
3
)
2
ma odczyn
15
16
2 p.
2 p.
14
Na
2
O Na
2
SO
4
BaSO
4
NaOH
1
2
3
4
Nazwa soli
Wzór soli
Wzory jonów tworzàcych sól
chlorek potasu
Fe(NO
3
)
2
Ca
2+
i CO
3
2–
siarczek glinu

— 1 —
Sole
W zadaniach 1–10 zaznacz jednà poprawnà odpowiedê.
Zaznacz zestaw, w którego skład wchodzà wyłàcznie wzory sumaryczne soli.
A. NaCl, CuSO
4
, Mg(NO
3
)
2
C. KNO
3
, KOH, K
2
SO
4
B. K
2
O, CaS, NaCl
D. CuSO
4
, Mg(NO
3
)
2
, H
2
O
Zaznacz zbiór, w którym nazwy soli wymieniono w nast´pujàcej kolejnoÊci: CuSO
4
, Fe
2
S
3
, KNO
3
.
A. Siarczan(IV) miedzi(II), siarczek ˝elaza(II), azotan(V) potasu.
B. Siarczan(VI) miedzi(II), siarczek ˝elaza(III), azotan(V) potasu.
C. Siarczan(IV) miedzi(II), siarczek ˝elaza(III), azotan(III) potasu.
D. Siarczan(VI) miedzi(II), siarczek ˝elaza(II), azotan(III) potasu.
Oblicz i zaznacz zawartoÊç procentowà (procent masowy) w´gla w soli o wzorze CaCO
3
.
A. 15,4%
B. 20,5%
C. 12%
D. 48%
Zaznacz wartoÊç pH roztworu chlorku sodu NaCl.
A. pH = 5,5
C. pH = 10
B. pH = 7
D. pH = 3
Zaznacz wzór soli, która dysocjuje na jony Mg
2+
i NO
3
–
.
A. MgNO
3
B. Mg
2
NO
3
C. MgNO
6
D. Mg(NO
3
)
2
Zaznacz równanie reakcji dysocjacji jonowej fosforanu(V) potasu.
A. K
3
PO
4
K
3
+
+ PO
4
–
C. K
3
PO
4
K
3+
+ 4 PO
–
B. K
3
PO
4
3 K
3+
+ PO
4–
D. K
3
PO
4
3 K
+
+ PO
4
3–
Zaznacz zbiór składajàcy si´ tylko ze wzorów soli praktycznie nierozpuszczalnych w wodzie.
A. CaCl
2
, BaSO
4
, FeCl
2
B. BaCO
3
, FePO
4
, CaSiO
3
C. FePO
4
, BaS, CaCl
2
D. CaCl
2
, Fe(NO
3
)
2
, BaCl
2
Zaznacz wzór kationu, który z jonem Cl
–
utworzy sól praktycznie nierozpuszczalnà w wodzie.
A. K
+
B. Na
+
C. Mg
2+
D. Ag
+
Zaprawa do kiszenia ogórków jest 8-procentowym roztworem soli kuchennej NaCl.
Oblicz i zaznacz, ile gramów soli kuchennej znajduje si´ w 300 g roztworu.
A. 37,5 g
C. 24 g
B. 32 g
D. 49 g
Zaznacz przykład zastosowania wapieni CaCO
3
.
A. Składnik napojów typu cola.
B. Lek na niedokwasot´.
C. Produkcja kredy szkolnej.
D. Posypywanie oblodzonych dróg.
I
10
9
2
3
4
5
6
7
8
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
1 p.
d
Grupa
imi´ i nazwisko ucznia
klasa suma punktów
data ocena
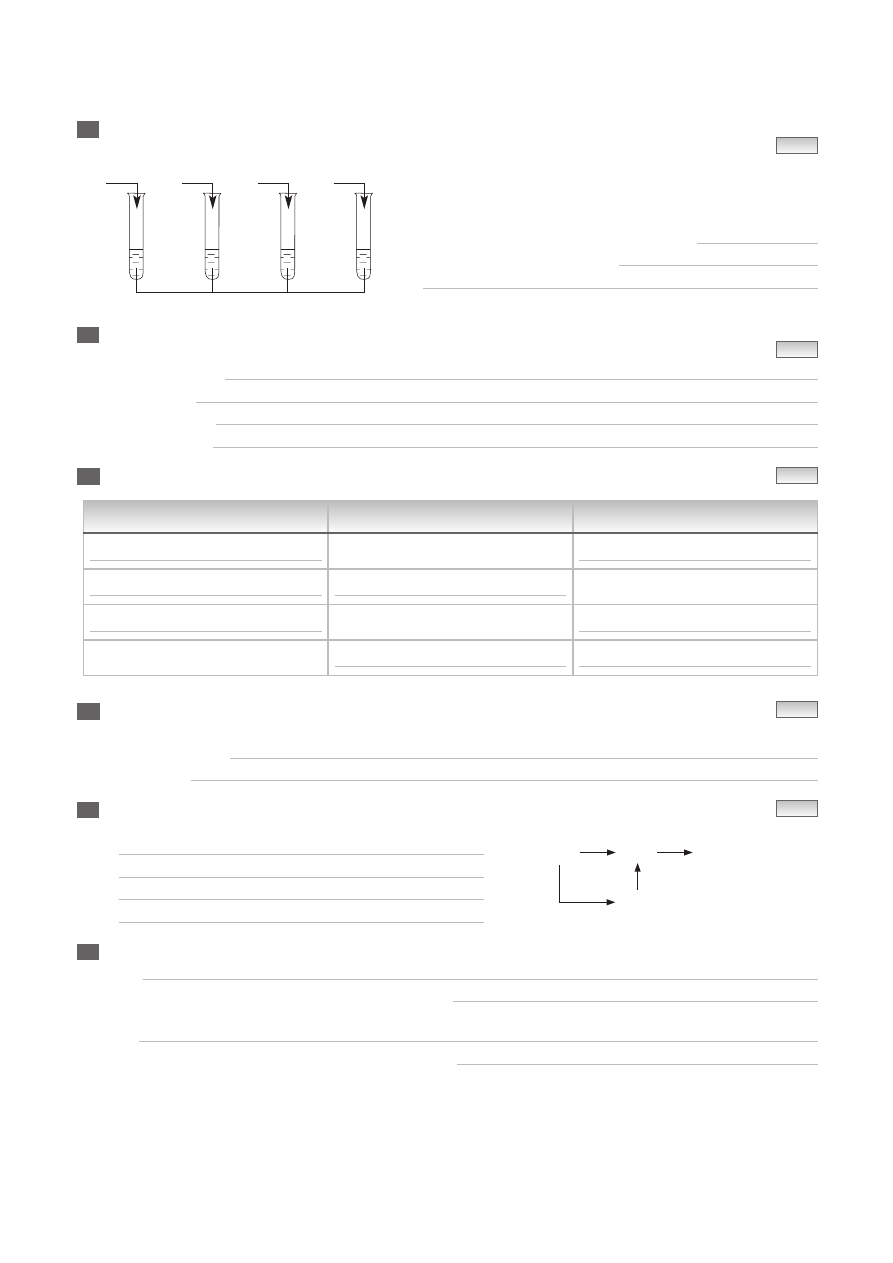
— 2 —
Zapisz numery probówek, w których w temperaturze pokojowej zaszły reakcje chemiczne
i napisz równania tych reakcji chemicznych.
Reakcje chemiczne zaszły w probówkach nr:
Równania reakcji chemicznych:
Przedstaw w zapisie jonowym równania reakcji chemicznych przebiegajàcych mi´dzy zwiàzkami chemicznymi
o podanych wzorach lub zapisz, ˝e reakcja chemiczna nie zachodzi.
A. K
2
SO
4
, Fe(NO
3
)
3
B. KOH, AlCl
3
C. Na
2
CO
3
, CaCl
2
D. BaCl
2
, NaNO
3
Uzupełnij tabel´.
12
13
2 p.
2 p.
2 p.
11
*
Au
Na
1
st´˝ony roztwór kwasu chlorowodorowego
2
3
Ca
4
Cu
Zapisz równania reakcji zoboj´tniania kwasu solnego zasadà potasowà.
Równanie reakcji chemicznej
Zapis czàsteczkowy:
Zapis jonowy:
Zapisz równania reakcji chemicznych przedstawionych na schemacie.
1.
2.
3.
4.
Napisz równania reakcji hydrolizy soli o podanych wzorach i okreÊl rodzaj odczynu roztworów tych soli.
NiCl
2
Roztwór otrzymany w wyniku hydrolizy NiCl
2
ma odczyn
Na
2
S
Roztwór otrzymany w wyniku hydrolizy Na
2
S ma odczyn
16
15
2 p.
2 p.
14
CaO CaCl
2
PbCl
2
Ca(OH)
2
1
2
3
4
Nazwa soli
Wzór soli
Wzory jonów tworzàcych sól
AlCl
3
K
+
i SO
4
2–
Cu
3
(PO
4
)
2
siarczek ˝elaza(III)
Wyszukiwarka
Podobne podstrony:
chemia nowa era 2 npp Sole A i B
chemia nowa era 2 npp Wodorotlenki Grupa C i D
chemia nowa era 2 npp Wodorotlenki Grupa A i B
sprawdzian chemia nowa era klasa 1 liceum
SOLE Chemia nowej ery 2 NPP gimnazjum Sprawdzian Sole. A i B. 1
chemia 2019 nowa era probna rozszerzona
sprawdzian chemia klasa 7 nowa era
chemia 2018 nowa era probna rozszerzona
chemia woda i roztwory wodne sprawdzian nowa era
więcej podobnych podstron