
1
LABORATORIUM
Fotodegradacja organicznych zanieczyszczeń wody
Utlenianie chemiczne jest jedną z metod oczyszczania wody stosowaną w celu utlenienia
związków organicznych i nieorganicznych pochodzenia antropogenicznego i naturalnego np.
prekursorów organicznych halogenopodobnych, utleniania jonów Fe(II), MN(II) i innych, oraz do
niszczenia patogennych drobnoustrojów (dezynfekcja). Istota tych procesów polega na
zastosowaniu związków chemicznych, które mogą utleniać związki organiczne i nieorganiczne
obecne w wodzie, a także powodować destrukcję komórek drobnoustrojów lub powodować
zakłócenia ich procesów metabolicznych.
Stosowane utleniacze powinny powodować mineralizację (całkowite utlenienie do CO
2
i
H
2
O) związków organicznych pochodzenia naturalnego i antropogenicznego. Jeśli zjawisko to nie
zachodzi w pełni mogą powstawać produkty uboczne utleniania/dezynfekcji, które zazwyczaj
charakteryzują się większą odpornością na utlenianie niż związki wyjściowe.
Coraz większą popularnością cieszą się procesy AOP (Advanced Oxidation Processes) do
których należą:
-gamma-radioliza – oparta na otrzymywaniu rodników hydroksylowych poprzez
poddanie wody działaniu promieniowania gamma lub wysokoenergetycznej wiązki
elektronów
-sonoliza – polega na propagacji fali ultradźwiękowej roztworze wodnym, prowadzi
ona do powstania pęcherzyków z rozpuszczonych w roztworze gazów. Pękanie
pęcherzyków powoduje powstawanie wysokich temperatur i ciśnienia, które prowadzi
do dysocjacji wody na rodniki typu: OH
•
, HOO
•
i inne. Określona częstotliwość
ultradźwięków powoduje powstawanie rodników określonego typu np. częstotliwość
ok. 400kHZ faworyzuje powstawanie rodników OH
•
.
-fotokataliza
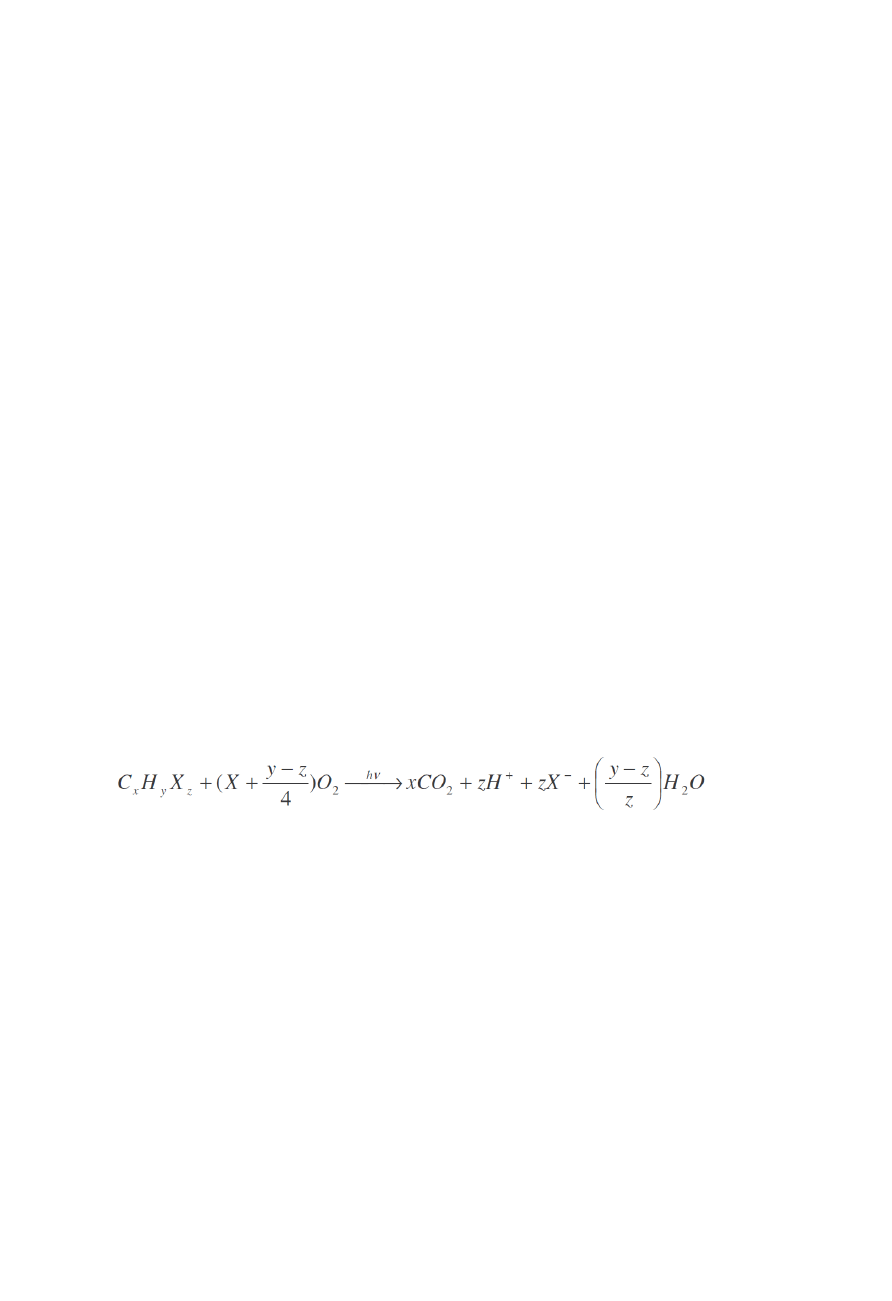
2
Według IUPAC fotokataliza to: reakcja katalityczna polegająca na absorpcji światła przez
katalizator lub substrat.
Obszarem zainteresowania fotokatalizy heterogenicznej jest obszar wzajemnego
oddziaływania pomiędzy ciałem stałym (fotokatalizatorem) i fazą ciekłą lub gazową zawierającą
reagenty i produkty reakcji. W wyniku działania wiązki promieniowania o odpowiedniej energii
może nastąpić fotowzbudzenie katalizatora z przeniesieniem ładunku w kierunku reagentów w
stanie podstawowym – sensybilizowana reakcja, lub wzbudzenie adsorbatu z przeniesieniem
ładunku do katalizatora – katalizowana fotoreakcja.
Degradacja fotokatalityczna jest procesem cieszącym się
coraz większym
zainteresowaniem, szczególnie w przypadku oczyszczania ścieków zawierających niewielkie ilości
substancji trudno usuwalnych.
W porównaniu z metodami konkurencyjnymi, zaletami tego procesu są:
-całkowita mineralizacja,
-niewielkie koszty,
-łagodne warunki (temperatura i ciśnienie).
W heterogenicznym układzie fotokatalitycznym, fotoindukowane przemiany cząsteczkowe
lub reakcje zachodzą na powierzchni katalizatora. Ogólna stechiometria heterogenicznego
utleniania fotokatalitycznego może być zapisana jako:
Fotokatalizatorami są ciała stałe, które mogą promować reakcje w obecności świtała
i nie są przy tym zużywane. Dobry fotokatalizator powinien być:
- fotoaktywny,
- zdolny do wykorzystania światła widzialnego i/lub bliskiego UV,
- biologicznie i chemicznie inertny,
- fotostabilny (nieulegający fotokorozji),
- niedrogi,
- nietoksyczny.
3
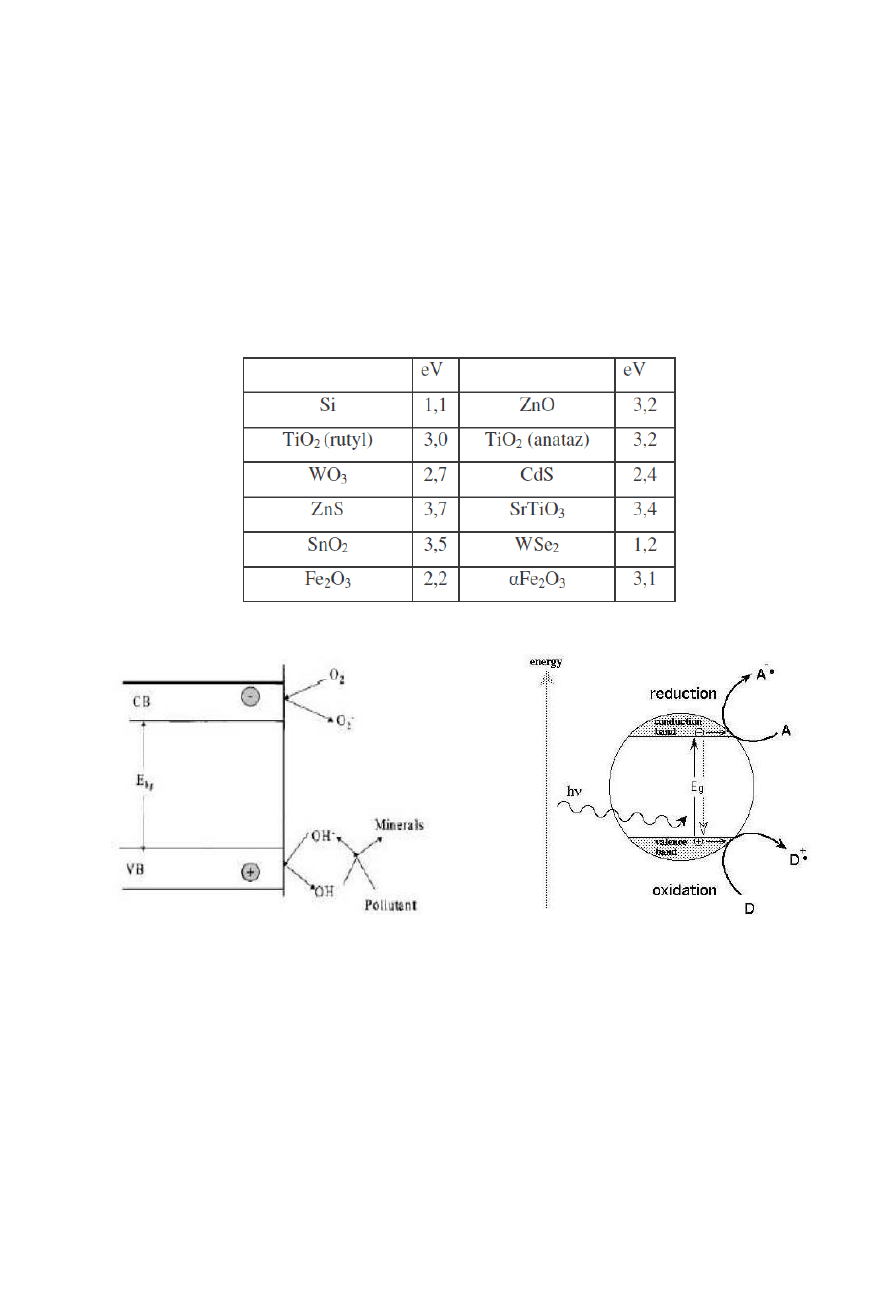
Jesli półprzewodnik ma być fotochemicznie aktywny jako sensybilizator w powyższej
reakcji, potencjał redox fotowytworzonej na powłoce walencyjnej dziury musi być wystarczająco
dodatni by wytworzyć rodniki HO
•
, które nastypnie utleniają zanieczyszczenia organiczne.
Potencjał redox wytworzonych na powłoce przewodzenia elektronów musi być wystarczająco
ujemny by były one w stanie redukować adsorbowany O
2
do O
3
-.
Tabela 1. Energie pasm wzbronionych różnych fotokatalizatorów
Rysunek 1. Procesy zachodzące na powierzchni fotokatalizatora
Utlenianie wielu zanieczyszczeń, szczególnie związków organicznych, wymaga wysokich
potencjałów, co skutkuje tym, że położenie pasma walencyjnego na powierzchni międzyfazowej
półprzewodnik-elektrolit powinno być raczej dodatnie, jak ma to miejsce np. w TiO
2
i CdS. W
takim przypadku, fotogenerowane dziury będą miały odpowiednią energię by utlenić związki
organiczne poprzez wytwarzanie rodników hydroksylowych.
Zakres zanieczyszczeń organicznych, które mogą być całkowicie fotomineralizowane przy
4
użyciu TiO
2
jako sensybilizatora, jest bardzo szeroki i zawiera wiele związków alifatycznych,
aromatycznych, detergentów, barwników, pesty- i herbicydów. W zastosowaniach środowiskowych
najbardziej efektywnym jest TiO
2
w formie anatazu EBG=3,23eV (384nm), jednak niewielkie
domieszki rutylu EBG=3,02eV (411nm) mogą mieć pozytywny wpływ na aktywność katalizatora.
Rutyl może być aktywny lub nieaktywny w zależności od stosowanej preparatyki. Stąd dużą wagę
przywiązuje się do stosowanych materiałów wyjściowych i metody preparatyki fotokatalizatorów.
Wielu badaczy stwierdza, że rutyl jest katalitycznie nieaktywny lub jest mniej aktywny niż anataz.
Fotony o odpowiedniej długości fali docierające do powierzchni fotokatalizatora powodują
przeskok elektronów z pasm walencyjnych (HOMO) do pasm przewodzenia (LUMO) (Rys. 1). W
wyniku przeskoku elektronu w paśmie walencyjnym pozostaje dodatnio naładowana dziura.
Reaguje ona ze zhydrolizowaną powierzchnią wytwarzając rodniki HO
•
, które są najsilniejszymi
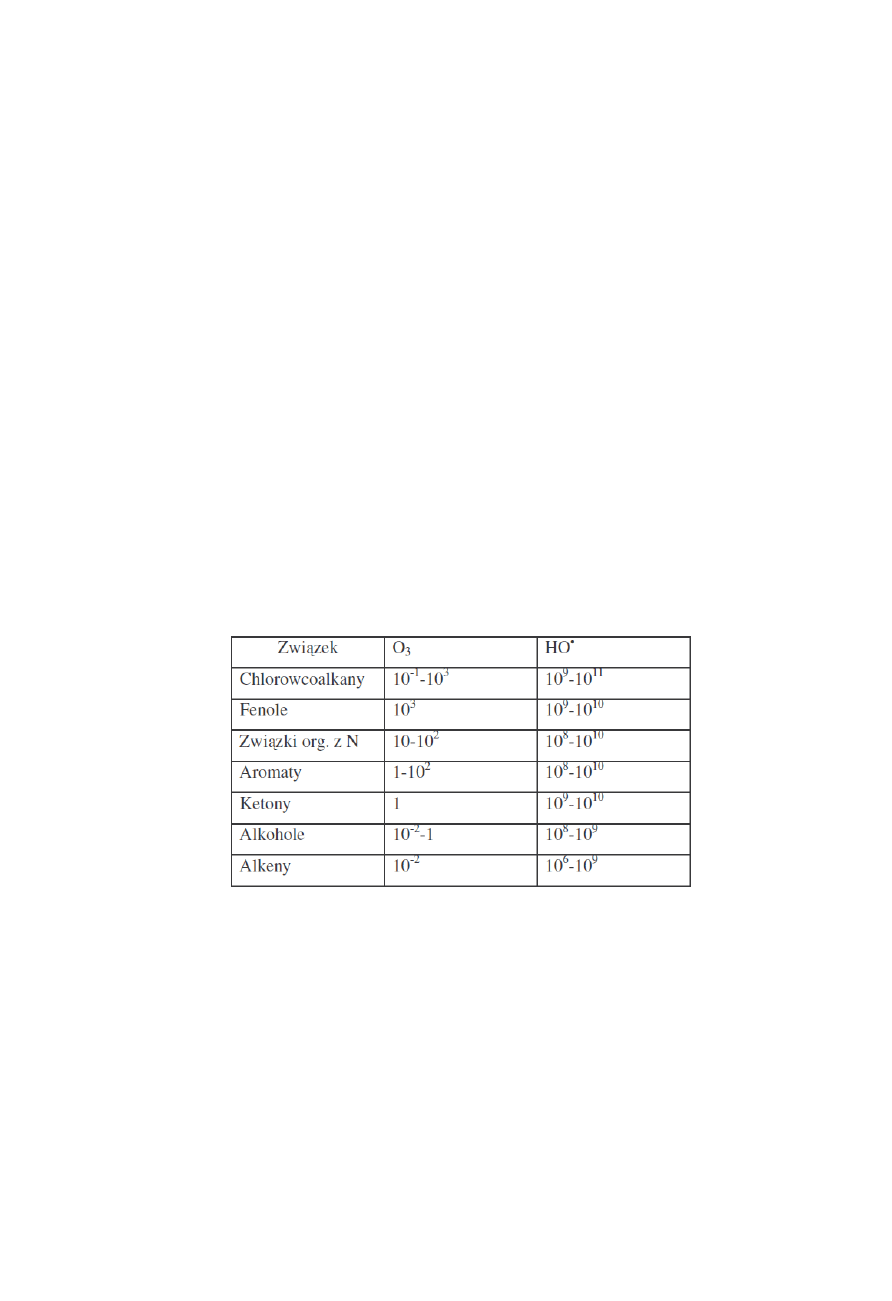
czynnikami utleniającymi. Względne szybkości reakcji utleniania z ozonem i rodnikami HO
•
przedstawiono w tabeli 2.
Tabela 2. Względne stałe szybkości (k, dm
3
/mol*s)
Minimalna długość fali potrzebna do wzbudzenia elektronu zależy od energii pasma wzbronionego
fotokatalizatora i wyraża się równaniem
E
bg
= 1240 /λ min
W wypadku braku obecności odpowiedniego elektronu i zmiataczy dziur magazynowana
energia jest rozpraszana w przeciągu kilku nanosekund w wyniku rekombinacji. Jeśli odpowiedni
zmiatacz dziur albo stan defektowy jest dostępny by uwięzić elektron lub dziury, zapobiega to ich

5
rekombinacji, i pozawala na zajście reakcji redox. W wypadku P25 Degussa elektrony pasma
przewodzenia anatazu przeskakują do mniej dodatniego rutylu, zmniejszając w ten sposób szybkość
rekombinacji elektronów i dodatnich dziur w anatazie. Jest to jeden z powodów dla których
występowanie obok anatazu niewielkich domieszek rutylu może mieć pozytywny wpływ na proces
fotodegradacji.
MECHANIZM
Jak zaznaczono wcześniej fotokataliza należy do procesów zaawansowanego utleniania
(Advanced Oxidation Processes – AOP). Przeprowadzono badania mające porównać dwie metody
AOP: fotochemiczne i fotokatalityczne utlenianie. W obu metodach badano degradację fenolu. W
wypadku degradacji fotochemicznej przy użyciu H
2
O
2
/UV zostały wykryte związki pośrednie jak
benzokwinon, hydrokwinon, katechol i rezorcyna. Główną różnicą pomiędzy degradacją
fotochemiczną i fotokatalityczną okazała się ilość produktów pośrednich. W przypadku
fotokatalitycznego rozkładu ilość ta była pomijalnie mała, gdy w drugim wypadku produkty
pośrednie były obecne w znacznych ilościach. Porównanie ekonomiki procesu fotochemicznego
(H
2
O
2
/światło widzialne) i fotokatalitycznego (TiO
2
/światło widzialne) wykazało, że ten drugi jest
bardziej ekonomiczny. Można wnioskować, że fotokataliza jest lepszym procesem, prowadzącym
do całkowitej mineralizacji z mniejszymi ilościami produktów pośrednich.
Etapem inicjującym w fotokatalizie jest wzbudzenie półprzewodnika przez promieniowanie
o odpowiedniej energii ( < min) w celu wytworzenia pary elektron-dziura. Reakcja fotokatalizy
półprzewodnikowej może być zapisana jako:
Wzbudzenie
Reakcja wtórna
Trapping
6
Adsorpcja zanieczyszczenia organicznego (S) i fotogenerowanych produktów pośrednich (Q)
centrum +↔ S ↔ S
ads
centrum+ Q ↔ Q
ads
Atak rodnika hydroksylowego na wyjściowy związek organiczny z wytworzeniem produktów
pośrednich
Atak rodnika hydroksylowego na produkty pośrednie z wytworzeniem innych produktów
pośrednich
Inne reakcje
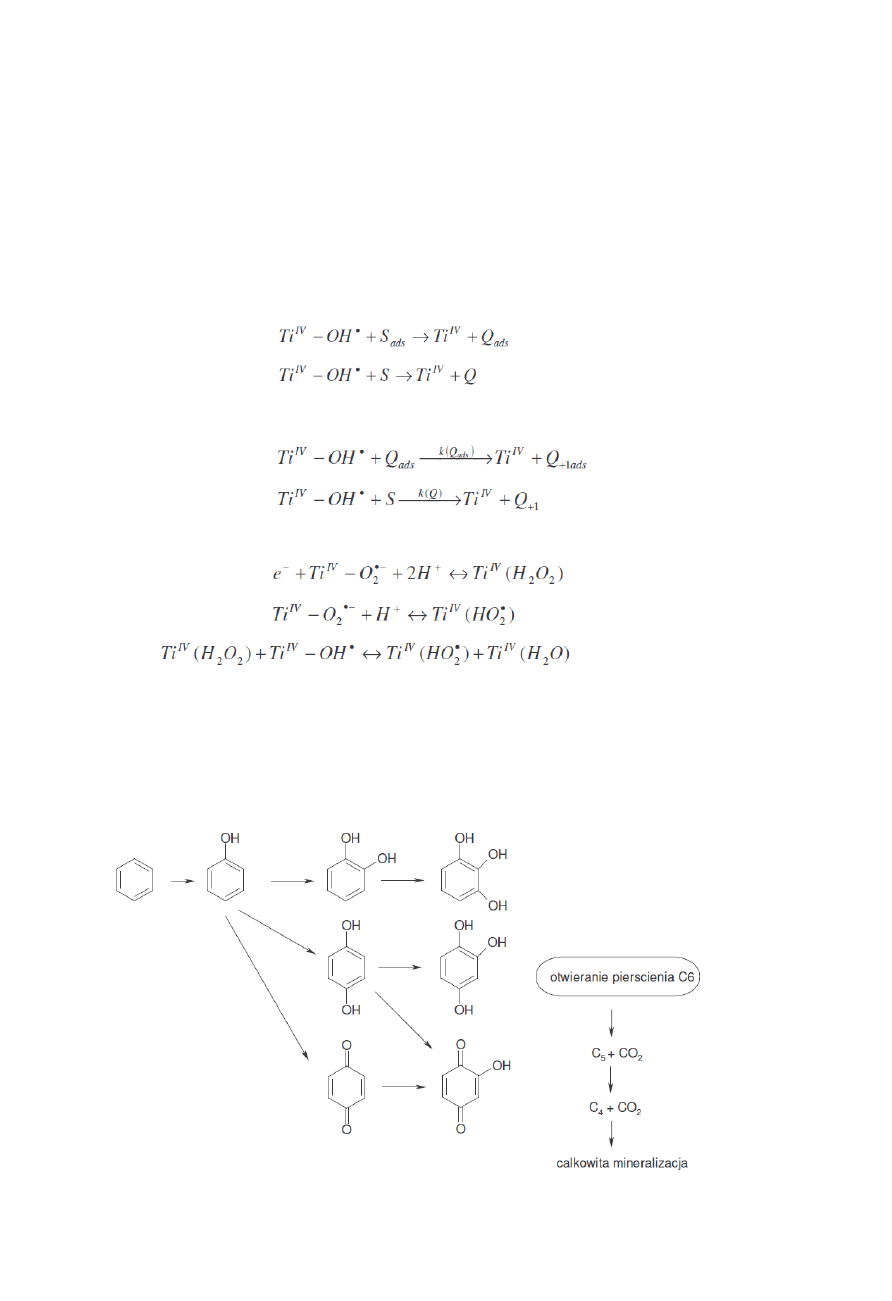
Fotodegradacja każdej substancji organicznej zachodzi z wytworzeniem związków
pośrednich powstających w wyniku ataku HO
•
. Poniżej przedstawiono schemat fotodegradacji
benzenu
7
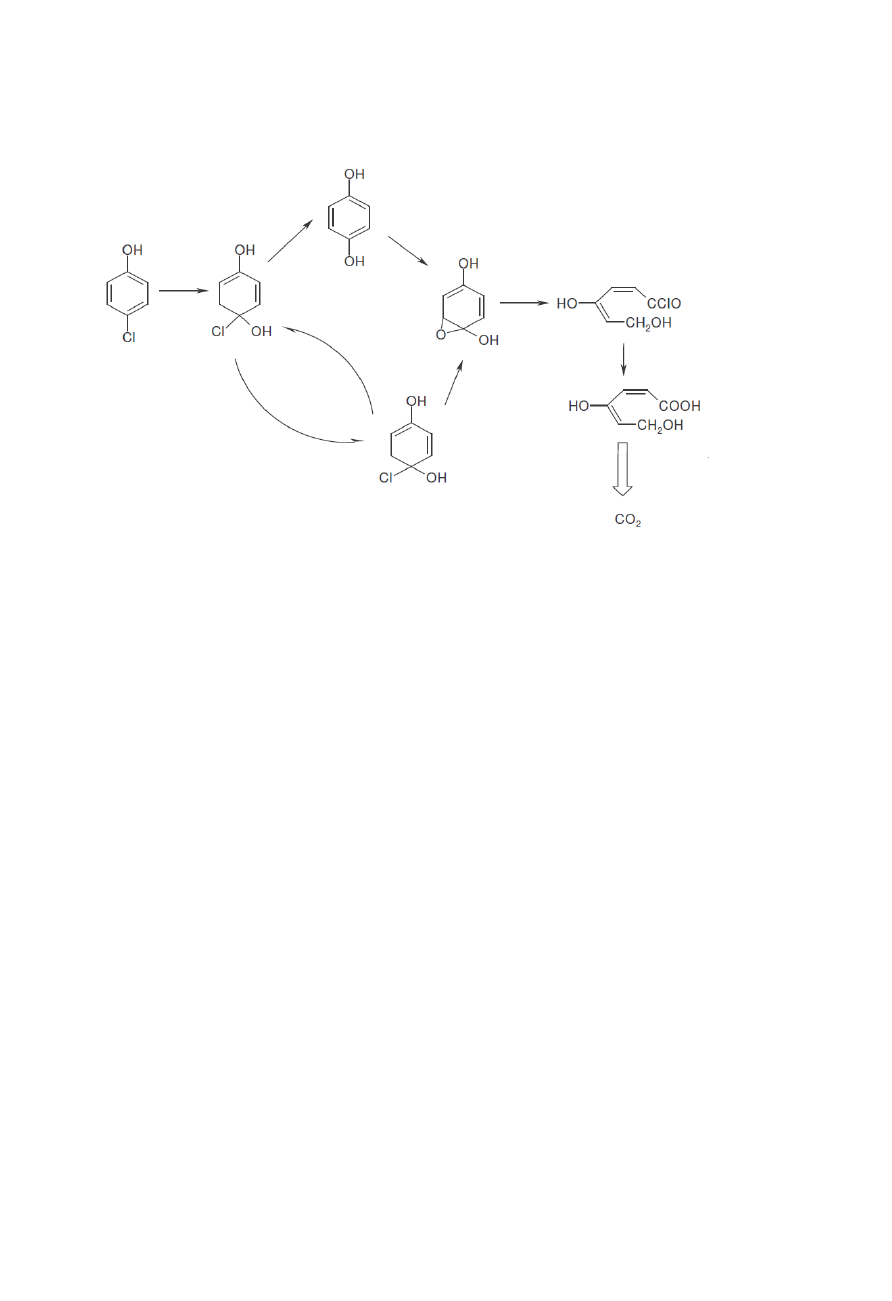
oraz chlorofenolu
W przypadku związków aromatycznych obserwuje się powstawanie produktów pośrednich
zawierających dwie/trzy grupy OH. Przyłączenie tych grup hydroksylowych nie powoduje jednak
rozerwania pierścienia. Badania wykazują brak obecności węglowodorów alifatycznych, co
oznacza że otwarty pierścień ulega bardzo szybkiej mineralizacji. Badania nad PCD rożnych
związków pozwalają na stwierdzenie że zarówno grupa NO
2
jak i COOH nie są podstawiane przez
grupy OH dopóki pierścień nie ulegnie rozerwaniu.
Reakcja zachodząca na powierzchni fotokatalizatora to reakcja redox. Ogólnie można
stwierdzić że utlenianie związku zachodzi w wyniku ataku rodnika
•
OH, w tym samym czasie
redukowany jest tlen pochodzący z powietrza. Badania wykazały że w przypadku związków
aromatycznych atak rodników
•
OH zachodzi w położeniach meta, orto i para w zależności od
istniejących grup funkcyjnych przyłączonych do pierścienia.
Wpływ intensywności światła i jego długości fali
Światło UV dostarcza fotony wymagane do przeskoku elektronu z pasma walencyjnego do
pasma przewodzenia fotokatalizatora. Energia fotonu zależy od jego długości fali, a całkowita
energia dostarczana procesowi fotokatalitycznemu zależy od jego natężenia. Wpływ zarówno
długości fali jak i natężenia światła są więc ważne w procesie fotokatalitycznym.

8
Liczne badania PCD przy użyciu różnych źródeł promieniowania doprowadziło do
określenia wpływu intensywności promieniowania na PCD. Przy niewielkich natężeniach światła
szybkość PCD rośnie liniowo wraz ze zwiększaniem natężenia. W zakresie środkowym natężeń
szybkość zależy od kwadratu natężenia. W przypadku dużych natężeń szybkość fotodegradacji jest
niezależna od natężenia padającego światła. Prowadzono również badania przy wykorzystaniu
skoncentrowanego światła słonecznego. Wyniki tych doświadczeń wykazały, że układ bez
koncentracji światła wykorzystuje je osiem razy bardziej efektywnie. Pomimo tego szybkość i
wydajność PCD w układzie wykorzystującym światło skoncentrowane były większe.
Ogólnie w przypadku długości fali światła, im mniejsza tym bardziej efektywne PCD, co
wynika z ilości transportowanej energii. Dodatkową zaletą jest fakt zmniejszenia ilości
powstających produktów pośrednich przy wykorzystaniu światła o krótszej fali. Jakkolwiek badania
nad otrzymywaniem fotokatalizatorów koncentrują się głównie na syntezie fotokatalizatorów o
zwiększonej aktywności w zakresie światła widzialnego. Wykorzystanie światła UV jest
kłopotliwe, jeśli weźmie się pod uwagę procesy prowadzone w dużej skali, poza tym nie można
pominąć dodatkowych kosztów, jakie są z takim źródłem promieniowania związane.
Wpływ adsorpcji
Skoro degradacja związku zachodzi na powierzchni katalizatora, szybkość degradacji
związku powinna być funkcją stężenia zaadsorbowanego substratu. Stopień zaadsorbowania
substratu powinien, więc być jednym z ważnych czynników wpływających na PCD. Dostępne
informacje pozwalają na stwierdzenie, że degradacja związku zależy od jego adsorpcji na
katalizatorze. Związki adsorbujące się mocniej ulegają szybszej degradacji. Jest to jeden z
dowodów na to, że reakcja fotodegradacji zachodzi na powierzchni katalizatora. Pozostałe to
między innymi zależność szybkości reakcji od powierzchni właściwej katalizatora, a także
odbarwianie się fotokatalizatora (np. żółte zabarwienie pochodzi od zaadsorbowanego kwasu
salicylowego po całkowitej degradacji kwasu salicylowego).
Wpływ pH
pH może mieć wpływ na ładunek powierzchniowy fotokatalizatora, a także na jonizację
substratu, a więc i na jego adsorpcję. Uwzględnienie pH jest konieczne szczególnie, jeśli
rozpatrujemy PCD ścieków przemysłowych, które mogą mieć charakter kwaśny lub zasadowy.

9
Zmiany pH powinny wpływać na szybkość adsorpcji jako, że adsorpcja zmienia się ze
zmianami pH. Maksimum adsorpcji obserwowane jest w pobliżu punktu pHPZC, w którym
również szybkość PCD jest największa. W przypadku substancji o charakterze słabo kwaśnym,
PCD wzrasta przy niskim pH ze względu na zwiększoną adsorpcję. Niektóre związki mogą ulegać
hydrolizie w środowisku zasadowym, co jest jedną z przyczyn zwiększenia się PCD w takich
środowiskach. W środowisku zasadowym zwiększa się również stężenie rodników OH co może być
kolejną przyczyną zwiększenia szybkości PCD W przypadku związków, które dysocjują lub tworzą
rodniki w określonym zakresie pH i są nastypnie adsorbowane, obserwuje się zwiększenie
szybkości specyficzne dla każdej substancji.
Wpływ anionów
Ścieki przemysłowe zawierają, oprócz zanieczyszczeń, różne sole w różnych stężeniach. W
warunkach PCD ulegają one jonizacji, a powstające aniony i kationy mogą mieć wpływ na
szybkość procesu. Obecność anionów takich jak chlorkowy, siarkowy czy węglanowy jest typowa
dla ścieków przemysłowych. Jony te wpływają na adsorpcję związków degradowanych, działając
jako hydroksylowe łapacze jonów i mogą również absorbować światło UV.
Stwierdzono ze siarczany, fosforany i azotany mają niewielki wpływ na szybkość PCD i
zmniejszają ją w tym samym stopniu, w jakim zmniejszają adsorpcje substratu. Wpływ chlorków
jest już większy, szczególnie, że jony chlorkowe absorbują światło UV. Największy wpływ na PCD
mają jony HCO
3
-
i CO
3
2-
za względu na zmniejszanie adsorpcji oraz reakcje z •OH przedstawione
poniżej.
Stwierdzono również, ze wpływ chlorków jest znaczący w przypadku związków, które adsorbują
się słabo, natomiast w wypadku silnie adsorbujących się substancji rośnie negatywny wpływ
węglanów.
Wpływ kationów
Kationy występujące w ściekach przemysłowych mogą mieć zarówno negatywny jak i
pozytywny wpływ na przebieg PCD. W przypadku Fe
3+
zauważono że ilość zdegradowanego
fenolu rośnie wraz ze stężeniem jonów. Okazało się jednak że przekroczenie stężenia ok. 4,8

10
mmol/dm
3
zmniejszało efekt katalityczny. Niewielkie ilości kationów Fe
2+
i Ag
+
również powodują
zwiększenie szybkości PCD. Oprócz pozytywnego wpływu kationów Fe, Ag i Cu – jeżeli obecne
były w roztworze w bardzo niewielkich ilościach, pozostałe badane kationy takie jak: Au, Cd, Cr,
Hg, Ni, miały negatywny wpływ na PCD. Ten negatywny wpływ może wynikać z łączenia się
kationów z anionami i wpływem powstających soli na adsorpcję związków organicznych na
fotokatalizatorze.
Wpływ temperatury reakcji
W przypadku procesu fotodegradacji prowadzonego w obecności światła widzialnego
temperatura strumienia może wzrastać, jako że światło widzialne zawiera znaczące ilości
promieniowania IR, dlatego też określenie wpływu temperatury na PCD jest ważne.
Badania wykazały, że zwiększenie temperatury procesu zwiększa szybkość wszystkich
reakcji zachodzących w układzie, za wyjątkiem fotogenerowania par elektron-dziura. Z drugiej
strony, zwiększanie temperatury reakcji zmniejsza rozpuszczalność tlenu w roztworze. Niższe
stężenie rozpuszczonego tlenu będzie powodować zmniejszenie się szybkości usuwania elektronów
z powierzchni fotokatalizatora.
Większość fotoreakcji i reakcji fotokatalitycznych nie jest w dramatyczny sposób zależna od
niewielkich różnic temperatury. Zanotowano liniowa zależność szybkości PCD ze wzrostem
temperatury w zakresie 10-60 ºC, brak jest jednak dokładnych danych dotyczących innych
katalizatorów i procesów rozkładu różnych związków. Jednak zmniejszanie stężenia
rozpuszczonego tlenu w roztworze a co za tym idzie ilości fotogenerowanych dziur ze
zwiększaniem temperatury powoduje konieczność ustalania optymalnej temperatury.
Wpływ powierzchni właściwej
Skoro na procesy PCD ma wpływ adsorpcja substratu na katalizatorze wpływ powierzchni
katalizatora na proces musi być brany pod uwagę. W przypadku, gdy szybkość PCD zależy od
adsorpcji będzie ona rosnąć również wraz ze zwiększaniem powierzchni właściwej.
Jednym ze sposobów zwiększenia aktywności ditlenku tytanu, który jest najbardziej
aktywnym i najbardziej popularnym fotokatalizatorem procesów PCD jest otrzymanie aerożeli
tytanowych.
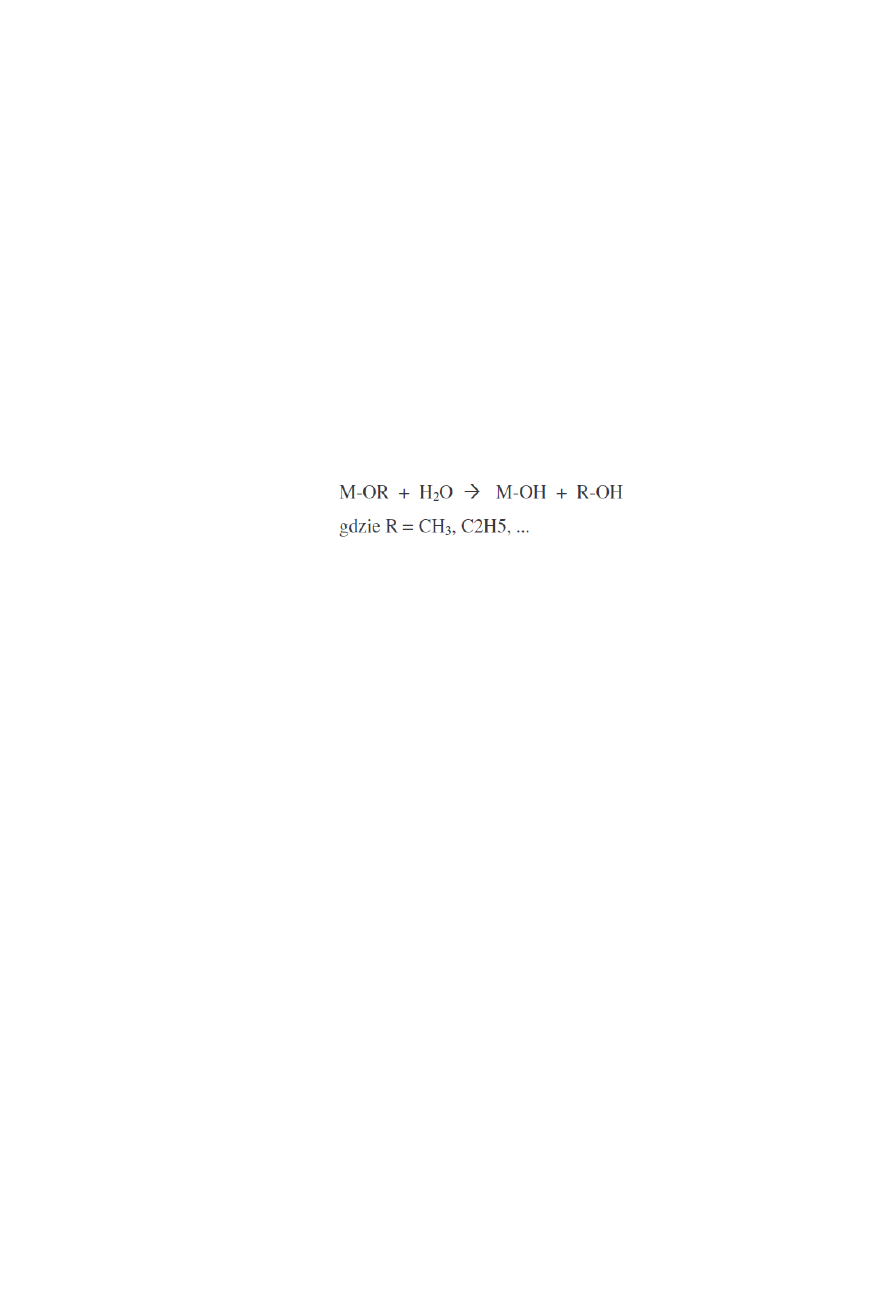
11
Otrzymywanie fotokatalizatorów TiO
2
Ditlenek tytanu otrzymuje się różnymi metodami. W skali przemysłowej uznanie zyskała
hydroliza płomieniowa TiCl
4
prowadzona w obecności wodoru i tlenu w temperaturze
przekraczającej 1200ºC (metoda opracowana przez firmę Degussa). TiCl
4
jest również, obok TiCl
3
prekursorem wykorzystywanym w tradycyjnych metodach strąceniowych. Bardzo dużą
popularnością cieszą się w ostatnich latach metody oparte na procesie zol-żel. Prekursorami
organicznymi ditlenku tytanu najczyściej stosowanymi w metodzie zol-żel są tetraizopropanolan
tytanu, tetrabutanolan tytanu i tetraetanolan tytanu.
Pierwszym etapem syntezy zol-zel jest hydroliza organicznego prekursora z wytworzeniem
reaktywnych grup M-OH
Kolejna reakcja to kondensacja prowadząca do powstania mostków tlenowych z wytworzeniem
cząsteczki alkoholu lub wody. Alkoholan metalu jest nierozpuszczalny w wodzie przez co przed
procesem hydrolizy powinien być rozpuszczony w alkoholu. Reaktywność alkoholanu w procesie
hydrolizy zależy głównie od elektroujemności atomu metalu i od jego zdolności do podwyższenia
liczby koordynacyjnej, a więc od jego wielkości. Końcowe produkty procesu zol-żel mogą
charakteryzować się różną strukturą chemiczną. Oprócz wiązań M-O-M obecne w produktach
mogą być również wiązania –OR a także grupy hydroksylowe i defekty sieci. Proces zol-żel
pozwala na sterowanie właściwościami otrzymywanych materiałów praktycznie na każdym etapie
syntezy. Produktami tego procesu mogą być zarówno cienkie powłoki, jak i ceramika, kserożele
czy aerożele.
Aerożele to ultralekkie materiały charakteryzujące się bardzo dużą porowatością (>5cm
3
/g) i
powierzchnią właściwą (do 1600m
2
/g). Otrzymywane są w procesie zol-żel przy wykorzystaniu
alkoholanów metali. Najbardziej popularnym fotokatalizatorem jest TiO
2
, dlatego też
wykorzystanie aerożeli w procesach fotokatalitycznych opiera się głównie na materiałach
zawierających ditlenek tytanu (gdzie zawartość TiO
2
waha się od 5 do 100%)
Najbardziej popularnym prekursorem tytanowym jest tetraizopropanolan tytanu, który w
pierwszym etapie syntezy zol-żel jest rozpuszczany w alkoholu (w wodzie nie rozpuszcza się,
błyskawicznie hydrolizując), a nastypnie dodawana jest niewielka ilość wody pozwalająca na jego
hydrolizę. Po etapie hydrolizy następuje kondensacja, kiedy to tworzy się zol. Zol w odpowiednich
warunkach przekształca się w żel, który w swojej strukturze ma uwieziony rozpuszczalnik

12
(alkohol). Jednym z najważniejszych etapów preparatyki aerożeli jest suszenie żelu. W wyniku
tradycyjnego suszenia rozpuszczalnik jest usuwany z żelu w wyniku parowania, powoduje to
powstawanie naprężeń w matrycy materiału, delikatna matryca ulega wtedy zniszczeniu lub
odkształceniu. W warunkach nadkrytycznych, jak wiadomo, zanika różnica pomiędzy fazą ciekłą i
gazową, pozwala to na usunięcie rozpuszczalnika z matrycy żelu bez jej zniszczenia. Otrzymany
aerożel poddaje się nastypnie obróbce termicznej w celu usunięcia resztek substancji organicznej,
ale przede wszystkim w celu uformowania kryształów ditlenku tytanu.
Przeprowadzone badania wskazują na zwiększoną aktywność aerożeli tytanowych
(zbudowanych z usieciowanego TiO
2
) w stosunku do klasycznie otrzymywanego ditlenku tytanu.
Możliwe jest dalsze zwiększenie aktywności fotokatalizatora tytanowego poprzez jego dyspersję na
materiale pozwalającym na swobodną propagację światła o pożądanej długości fali, w tym celu
otrzymuje się aerożele tytanowo-krzemowe (TiO
2
-SiO
2
).

13
Celem ćwiczenia jest określenie aktywności fotokatalitycznej katalizatora P25 (TiO
2
firmy
Degussa) w procesie fotodegradacji organicznego związku modelowego.
Ćwiczenie polega na naświetlaniu promieniowaniem UV wodnego roztworu błękitu
metylenowego w obecności katalizatorów zawierających ditlenek tytanu. W trakcie oznaczenia z
fotoreaktora wyposażonego w średniociśnieniową lampy rtęciową o mocy 450 W pobierane będą
próbki roztworu w 15 minutowych odstępach czasu. Po oddzieleniu katalizatora próbki będą
poddawane analizie na spektrofotometrze UV/Vis. Na podstawie otrzymanych widm UV/Vis
określony zostanie stopień konwersji związku modelowego
.
Przebieg ćwiczenia
1.
Odważyć 0,400 g katalizatora i przenieść do reaktora
2.
Reaktor napełnić 400 ml roztworu wodnego związku modelowego o znanym stężeniu
3.
Po włączeniu mieszadła magnetycznego umieścić układ reakcyjny w ciemni
4.
Pozwolić na ustalenie się równowagi adsorpcyjnej w układzie poprzez mieszanie roztworu
zawierającego katalizator w ciemni
5.
Po ustaleniu równowagi włączyć kriostat oraz umieścić w reaktorze lampę rtęciową
6.
Utrzymując stała temperatury w reaktorze pobierać próbki co 15 min
7.
Próbki po oddzieleniu katalizatora poddać analizie UV/Vis
8.
Z otrzymanych widm roztworów (w tym roztworu wyjściowego) określić stężenie błękitu
metylenowego oraz stopień jego konwersji
Aparatura
Fotorekator kwarcowy
Chłodnica kwarcowa
Średniociśnieniowa lampa rtęciowa o mocy 450W
Kriostat
Mieszadło magnetyczne
Analizy UV/Vis przeprowadzane będą na spektrofotometrze firmy Hitachi
Wyszukiwarka
Podobne podstrony:
Podstawowe procesy jednostkowe w technologii chemicznej
Estry metylowe podstawionych kwasów benzoesowych, technologia chemiczna, chemia organiczna 2003,2004
Procesy jednostkowe - egzamin 0, Technologia chemiczna PWR, SEMESTR V, Podstawowe procesy jednostkow
procesy 5lk, Technologia chemiczna, 5 semestr, Podstawowe procesy przemysłu chemicznego i aparatura,
18 Prowadzenie procesów jednostkowych w technologii
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
organiczna-koła, Technologia chemiczna, Chemia organiczna, 3 semestr, 1 kolokwium
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
Labolatoria (semestr III), Technologia chemiczna, Chemia organiczna, 4 semestr, ćwiczenia
dyd tech409 12a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organi
dyd tech407a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech407b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
pytania organiczna 1 termin 2011 sem 4, technologia chemiczna, chemia organiczna2010-2011, sem 4
ACETANILID, technologia chemiczna, chemia organiczna 2003,2004
NITROANILINY, technologia chemiczna, chemia organiczna 2003,2004
więcej podobnych podstron