
Metody wyznaczania masy molowej
Metody wyznaczania masy molowej
W
procesach
otrzymywania
polimerów
powstają
cząsteczki
różnej
wielkości.
Właściwości polimerów zależą od średniej
wielkości cząsteczek, którą można obliczać
różnymi
sposobami.
Najbardziej
bezpośrednim sposobem jest obliczanie
zwykłej średniej arytmetycznej, zwanej
liczbowo średnią masą molową M
n
M
i
oznacza masę molową indywiduum
cząsteczkowego i, a N
i
jest liczbą cząsteczek
i w próbce
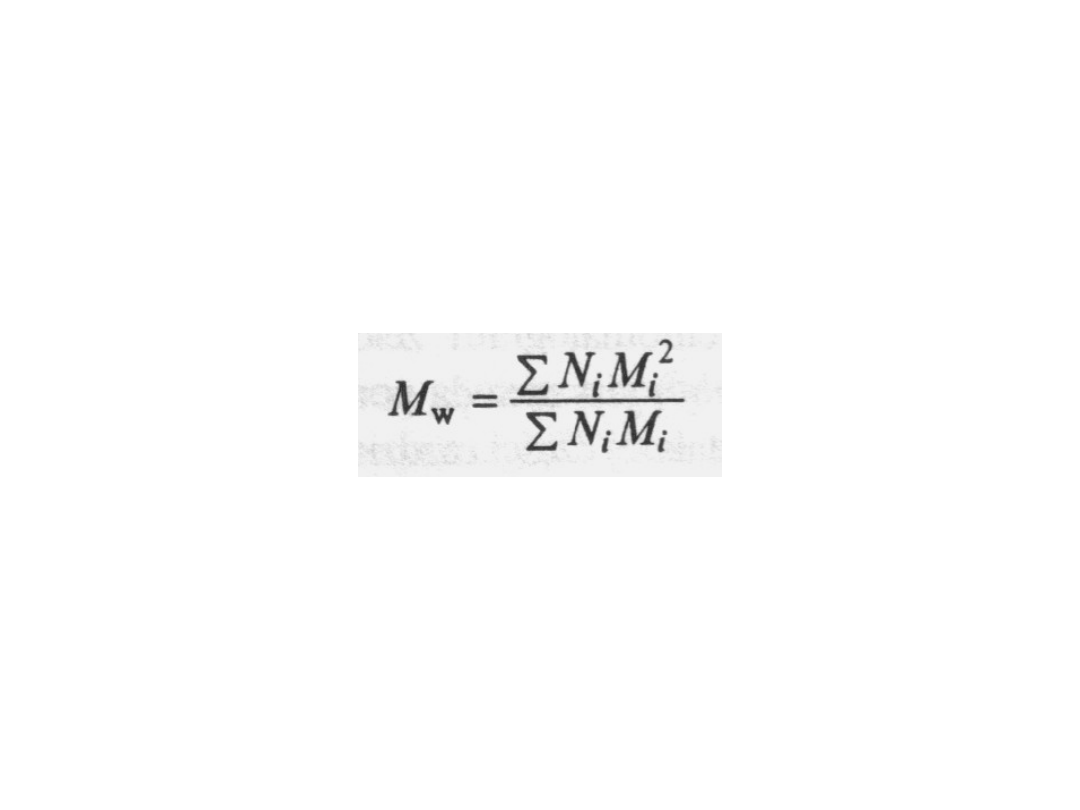
Metody wyznaczania masy molowej
Metody wyznaczania masy molowej
M
i
oznacza masę molową indywiduum
cząsteczkowego i, a N
i
jest liczbą cząsteczek
i w próbce
Podobnie można zdefiniować także
wagowo średnią masę molową M
w
, przy
czym do tego wyrażenia wchodzą
wartości M
i
2
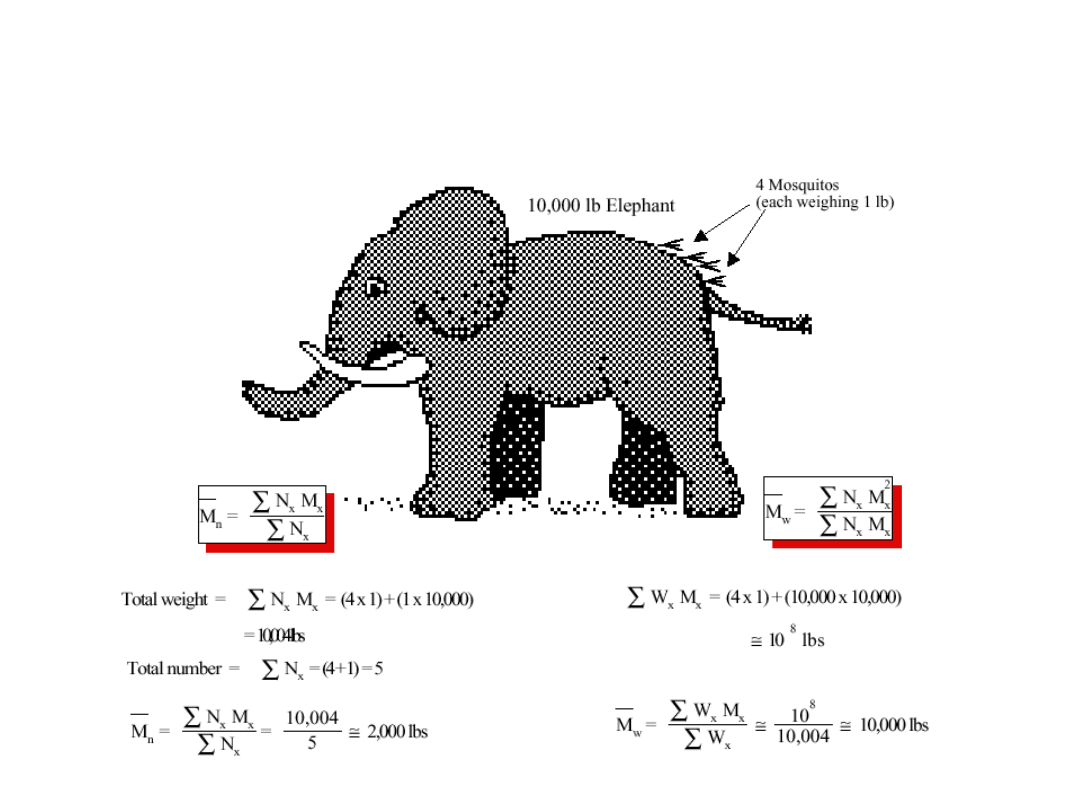
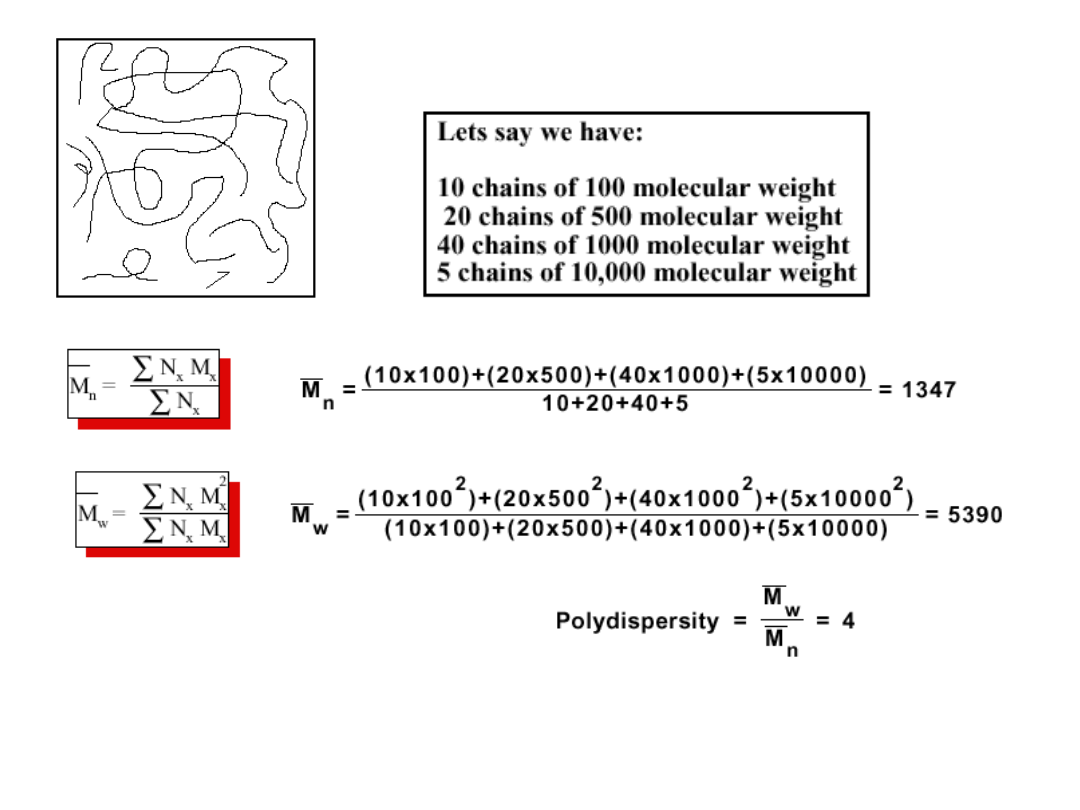
Znaczenie rodzaju uśrednienia jest ogromne!

Metody wyznaczania masy molowej
Metody wyznaczania masy molowej
Dla polimeru składającego się wyłącznie z
cząsteczek o takiej samej masie molowej M
n
= M
w
lecz w każdym innym przypadku M
w
>
M
n
.
Wynika stąd, że stosunek M
w
/M
n
może być
miarą niejednorodności mas molowych
próbki polimeru. Wartość tego stosunku
nazywamy polidyspersyjnością polimeru;
gdyM
w
/M
n
= l, polimer nosi nazwę polimeru
monodyspersyjnego.
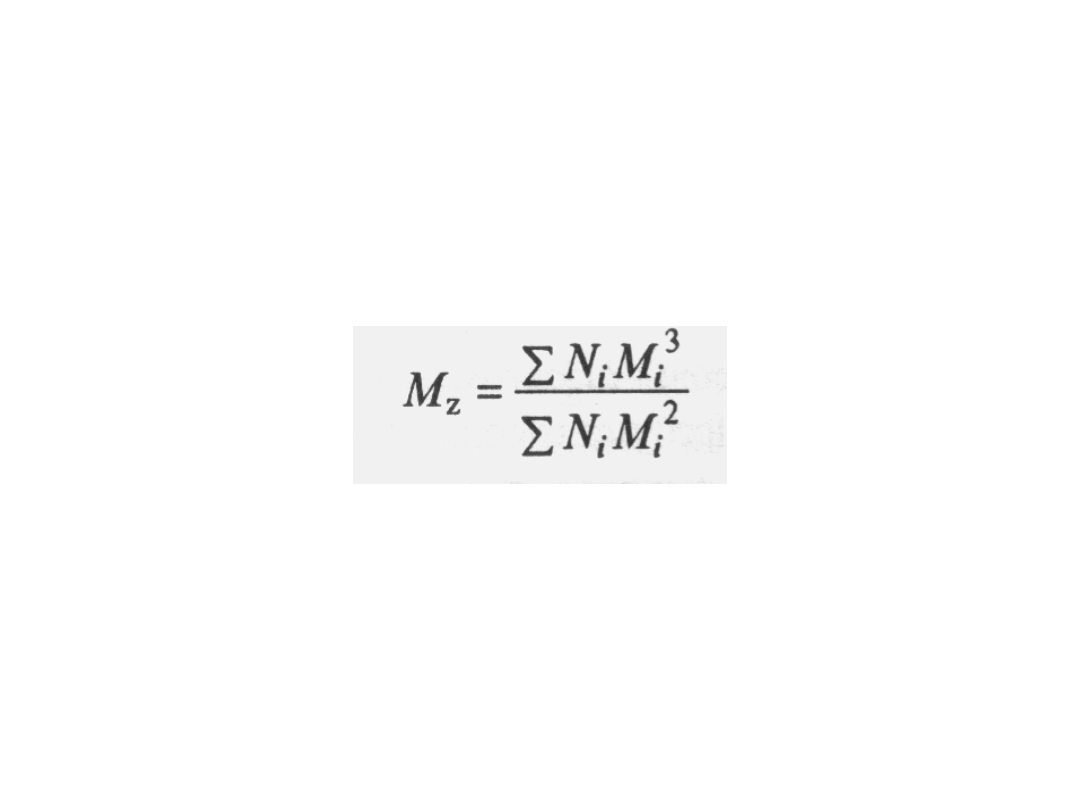
Metody wyznaczania masy molowej
Metody wyznaczania masy molowej
Inną, rzadziej stosowaną średnią jest z-
średnia masa molowa M
z
określona wzorem :
M
i
oznacza masę molową indywiduum
cząsteczkowego i, a N
i
jest liczbą cząsteczek
i w próbce

Metody wyznaczania masy molowej
Metody wyznaczania masy molowej
Do różnorodnych fizycznych i chemicznych
metod wyznaczania masy molowej
polimerów można zaliczyć:
•metodę analizy grup końcowych,
•pomiary właściwości koligatywnych,
• rozpraszanie światła,
•ultrawirowanie
• pomiar lepkości rozcieńczonych
roztworów.

Metody wyznaczania masy molowej
Metody wyznaczania masy molowej
Wszystkie odnoszą się do roztworów polimerów,
przy
czym
większość
metod
wymaga
ekstrapolacji wyników do nieskończonego
rozcieńczenia albo stosowania rozpuszczalnika
w temperaturze theta w celu uzyskania
idealnego zachowania roztworu. Różne techniki
pomiarowe dają w wyniku różne średnie masy
molowe
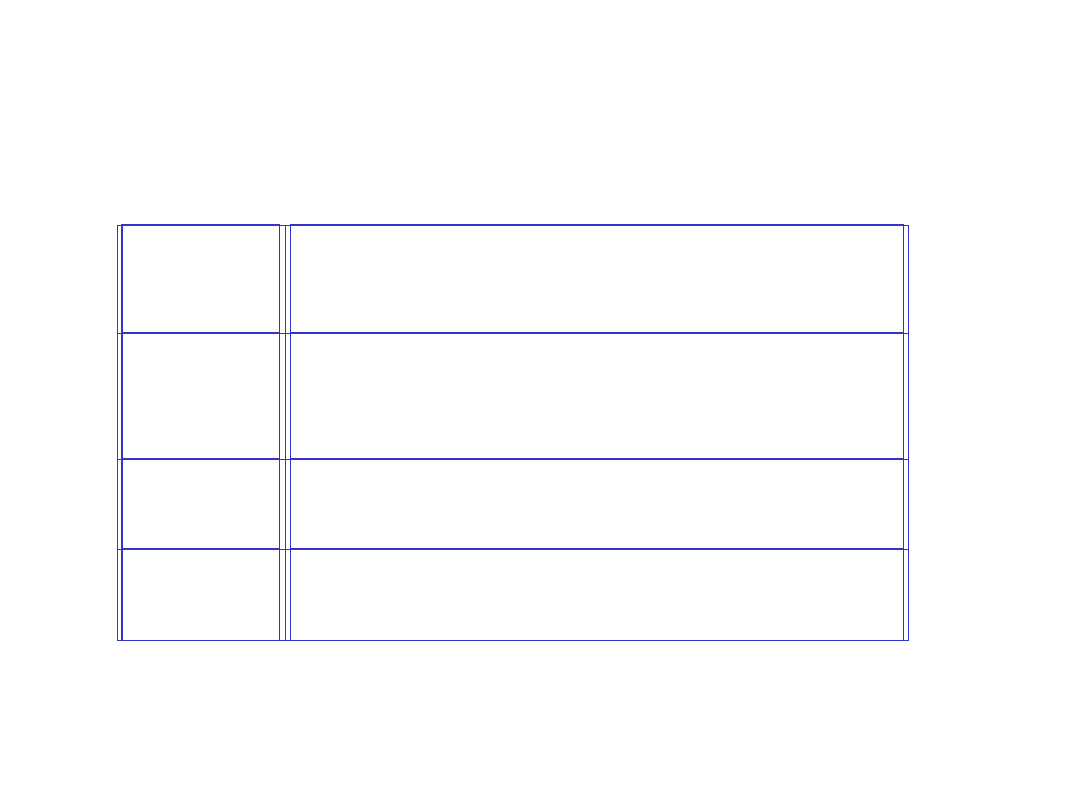
Metody doświadczalne wyznaczania różnych rodzajów
Metody doświadczalne wyznaczania różnych rodzajów
średniej masy molowe
średniej masy molowe
j
j
polimerów
polimerów
Rodzaj
średniej
Metoda doświadczalna
M
n
GPC (chromatografia żelowa), osmometria
membranowa, osmometria w fazie
parowej, analiza grup końcowych
M
w
rozpraszanie światła, GPC
M
z
ultrawirowanie

Masy molowe na podstawie właściwości
koligatywych
W chemii fizycznej określenie
właściwości koligatywne
odnosi się do tych właściwości, które zależą od liczby
cząsteczek.
Głównymi właściwościami koligatywnymi są:
• obniżenie temperatury zamarzania,
• podwyższenie temperatury wrzenia (roztworu),
• obniżenie ciśnienia pary
• ciśnienie osmotyczne.
Wszystkie
wymagają
ekstrapolacji
danych
doświadczalnych do nieskończonego rozcieńczenia.
Wynika to z faktu, że właściwości fizyczne dowolnej
substancji rozpuszczonej nie są określone przez ułamek
molowy tej substancji w roztworze, ale przez jej
aktywność
.
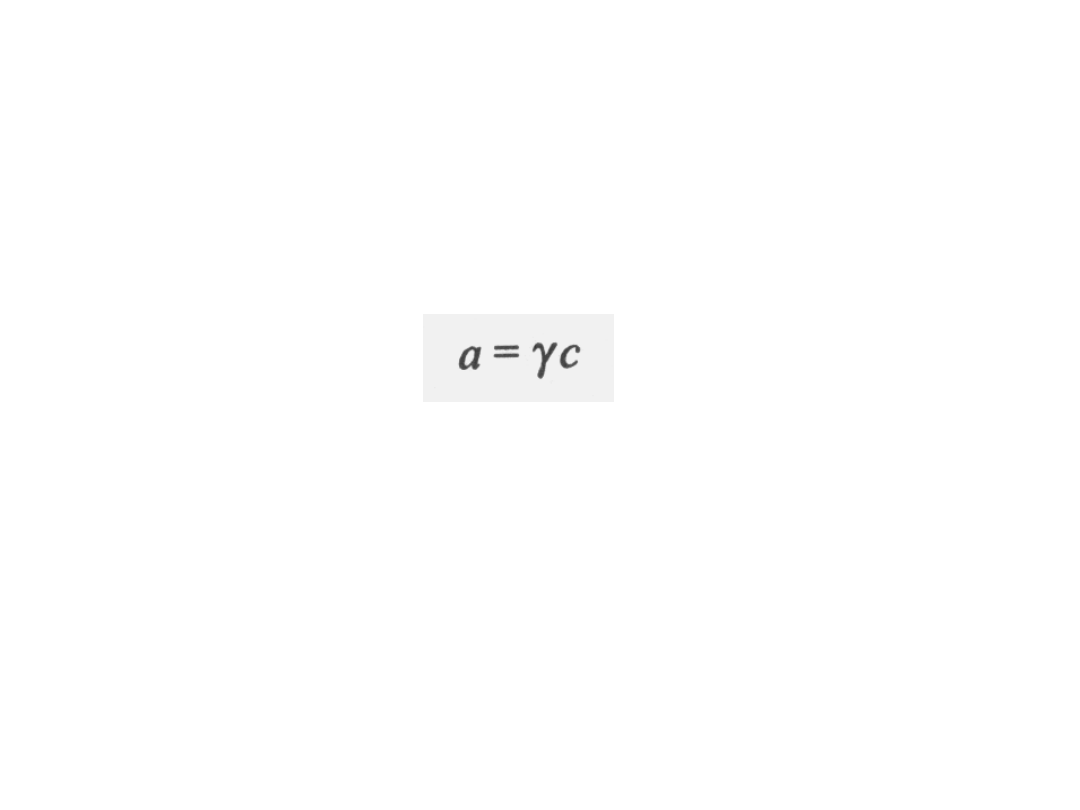
Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
Aktywność ma wartość mniejszą od
rzeczywistego ułamka molowego i jest
związana
z
nim
współczynnikiem
aktywności.
a - aktywność
c – stężenie
- współczynnik aktywności.
W nieskończonym rozcieńczeniu
W nieskończonym rozcieńczeniu
współczynnik aktywności jest równy
współczynnik aktywności jest równy
jedności i ułamek molowy staje się
jedności i ułamek molowy staje się
równy aktywności.
równy aktywności.

Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
Właściwości koligatywne roztworu
polimeru o masie molowej 20 000,
stężenie roztworu 0,01 g/cm
3
(F.W.
Billmeyer, „Textbook of Polymer Science",
John Wiley & Sons, Nowy Jork, 1962)
Właściwością
koligatywną
najbardziej
użyteczną do praktycznego pomiaru mas
molowych
polimerów
jest
ciśnienie
osmotyczne. Wszystkie inne właściwości mają
tak małe wartości, że ich pomiar jest bardzo
utrudniony.
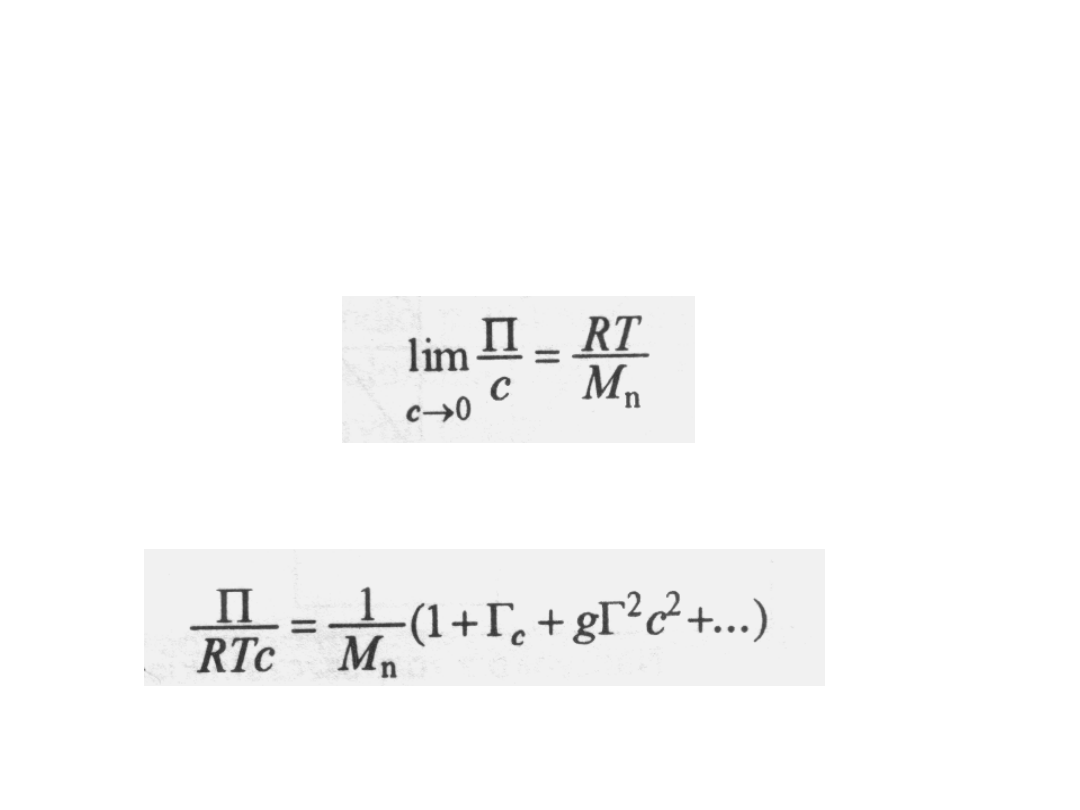
Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
Właściwości koligatywne są miarą
liczbowo średnich mas molowych M
n
. W
przypadku ciśnienia osmotycznego
obowiązuje zależność:
Na tej podstawie można wyprowadzić ogólne wyrażenie
na zależność tych parametrów od stężenia:
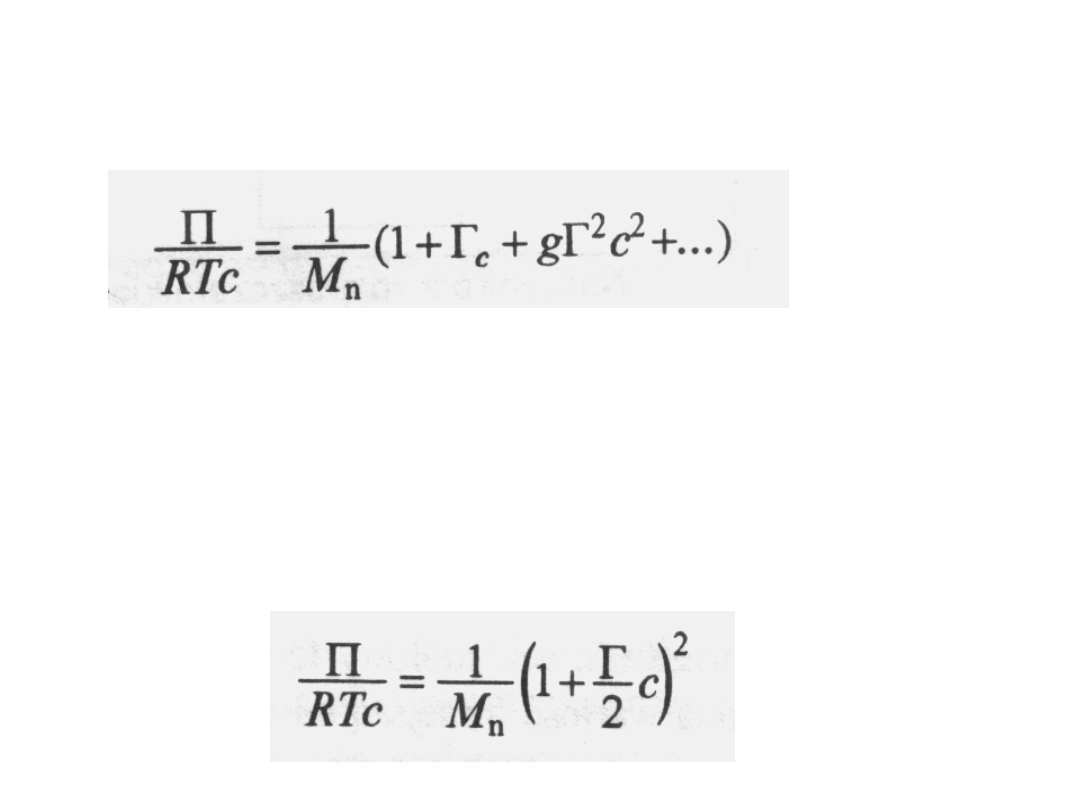
Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
jest stałą, a g - funkcją zależną od
oddziaływań
polimer-rozpuszczalnik;
funkcja ta ma wartości bliskie zeru w
złych rozpuszczalnikach i bliskie 0,25 w
dobrych. Najczęściej można pominąć
wyrazy z c
2
. Jeśli tego nie można zrobić,
to należy przyjąć wartość g = 0,25 i
napisać równanie w postaci:
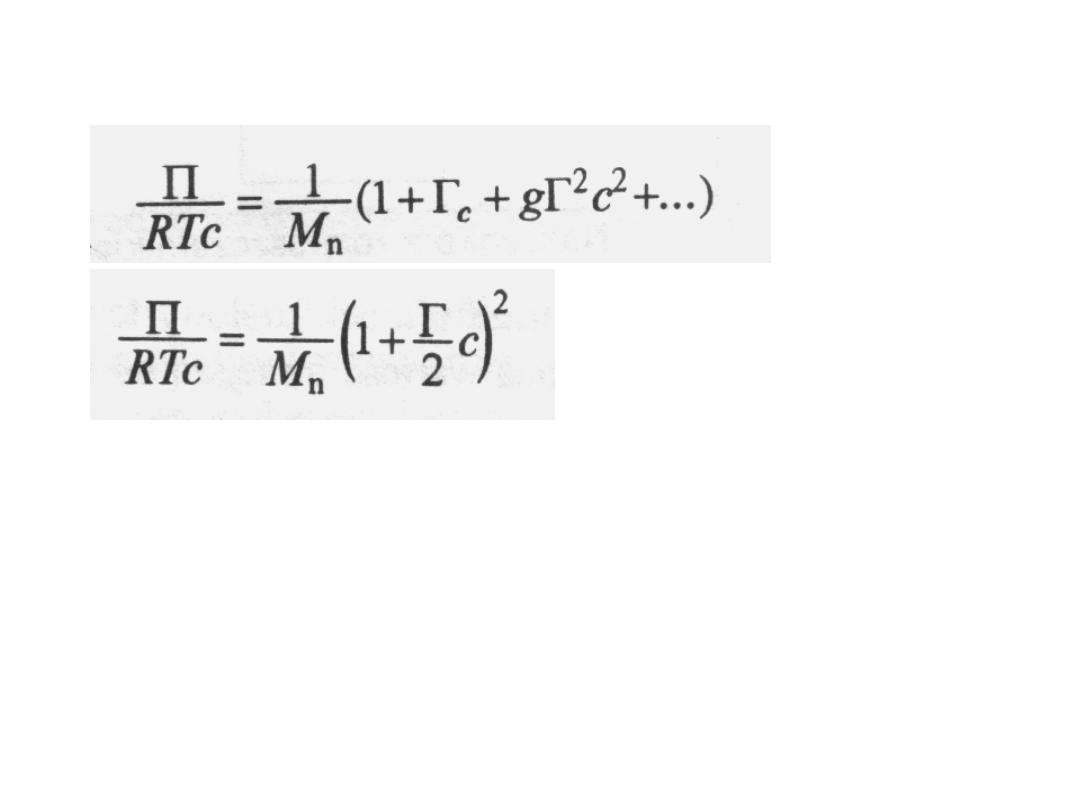
Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
Aby
ocenić
M
n
na
podstawie
właściwości
koligatywnych, należy sporządzić wykres
c względem
c. Otrzymuje się zwykle linię prostą z punktem
przecięcia przy c = O wyznaczającym wartość RT/M
n
.
Natomiast
w
dobrych
termodynamicznie
rozpuszczalnikach, gdy wyrazy z c
2
są znaczące,
właściwy jest wykres (/RTc)
1/2
, z którego można
ocenić samą wartość M
n
.

Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
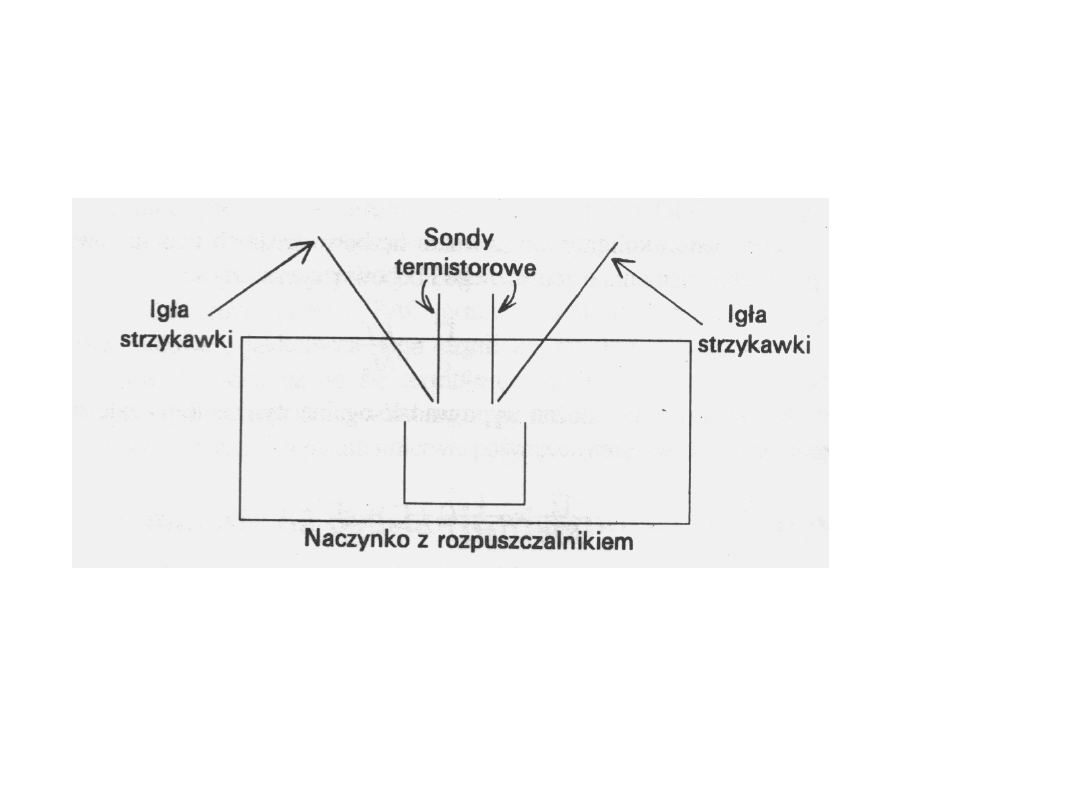
Osmometria w fazie parowej
Jest to powszechnie stosowana metoda polegająca
na wyznaczaniu właściwości koligatywnych. Wbrew
swej nazwie, nie jest to technika osmometryczna,
lecz pośrednia metoda pomiaru zmniejszenia
ciśnienia pary.
Parametrem mierzonym jest bardzo
mała
różnica
temperatury
wytworzona
w
atmosferze nasyconej pary rozpuszczalnika między
zawieszoną
na
igle
strzykawki
kroplą
rozpuszczalnika a zawieszoną na igle drugiej
strzykawki kroplą roztworu, przy czym występuje
zjawisko
parowania
i
skraplania
się
rozpuszczalnika.
Ta różnica temperatury jest
proporcjonalna do zmniejszenia ciśnienia pary
roztworu polimeru w warunkach równowagi, jest
więc także proporcjonalna do liczbowo średniej
masy molowej substancji rozpuszczonej.
Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
Osmometria w fazie parowej
Układ zasadniczych elementów
osmometru do pomiarów w
fazie parowej

Masy molowe na podstawie właściwości
Masy molowe na podstawie właściwości
koligatywych
koligatywych
Osmometria w fazie parowej
Pomiar polega na wyznaczeniu różnic
temperatury
dla
kilku
stężeń
i
ekstrapolowaniu wyników do c = 0.
Aparat kalibruje się za pomocą wzorców
o malej masie molowej.
M
M
etodę można stosować do polimerów
etodę można stosować do polimerów
o
o
M
M
n
n
do około 40 000.
do około 40 000.

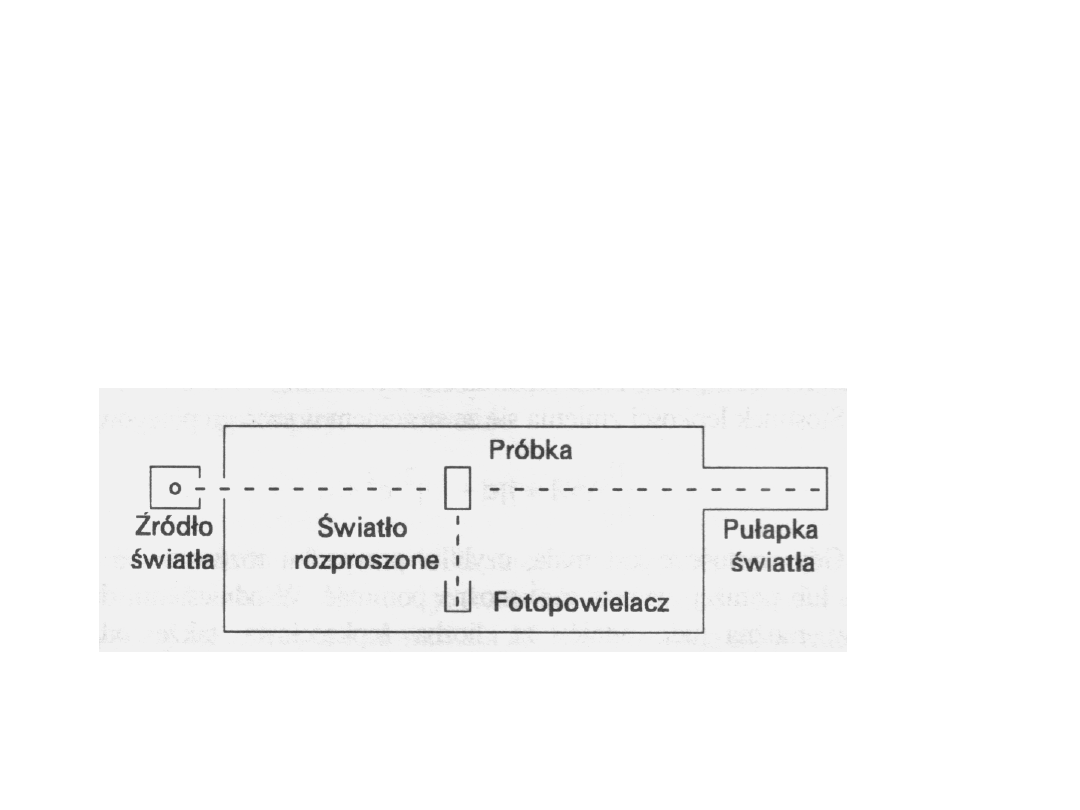
Rozpraszanie światła
Rozpraszanie światła jest zjawiskiem
powszechnym i występuje zawsze, gdy
światło pada na materię. Wiązka
padającego światła powoduje w materii
drgania jąder i pobudzenie elektronów.
Gdy te wzbudzone jądra i elektrony
wracają do stanów o mniejszej energii,
to ponownie emitują światło. Odmiennie
od
wiązki
początkowej,
światło
emitowane rozchodzi się we wszystkich
kierunkach,
jednak
długość
fali
świetlnej pozostaje taka sama, jak w
wiązce padającej.
Rozpraszanie światła
Metoda ta polega na pomiarze
intensywności światła rozproszonego pod
różnym kątem w stosunku do pierwotnej
wiązki światła.

Rozpraszanie światła
K* - stała optyczna
R’
–stosunek
Rayleiha
Gdy c=0 i =0
Oznacza to, że podwójna ekstrapolacja do zerowego kąta i do
zerowego stężenia umożliwia wyznaczenie wagowo średniej
masy molowej polimeru. Wykres na podstawie danych z
pomiarów rozproszenia światła nazywa się
wykresem Zimma
, a
samą technikę -
metodą podwójnej ekstrapolacji według
Zimma.
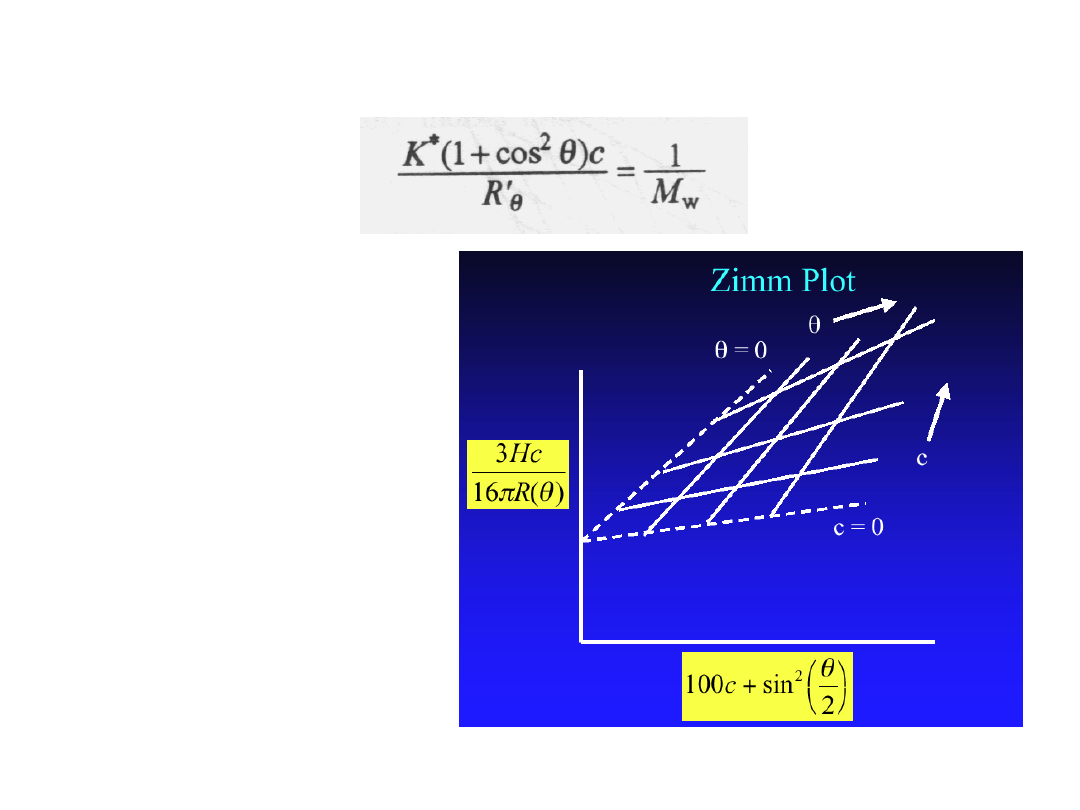
Rozpraszanie światła
K* - stała optyczna
R’
stosunek Rayleiha
Wykres Zimma

Lepkościowe metody wyznaczania
masy molowej
Do
wyznaczania
mas
molowych
polimerów
stosuje
się
bardzo
rozcieńczone roztwory o stężeniu około
1% masowego. W metodzie lepkościowej
stosuje się pewne zależności. Oto
niektóre z nich:
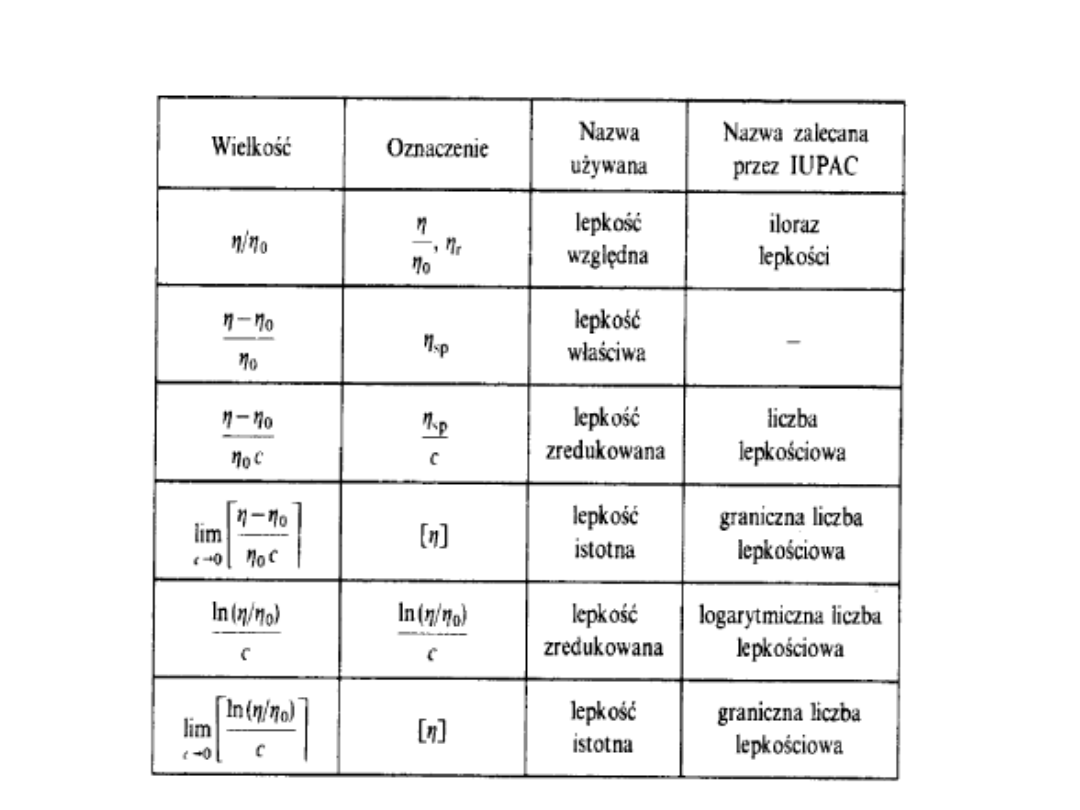
1) Stosunek lepkości lub lepkość
względna. Jest to stosunek lepkości
roztworu do lepkości czystego
rozpuszczalnika
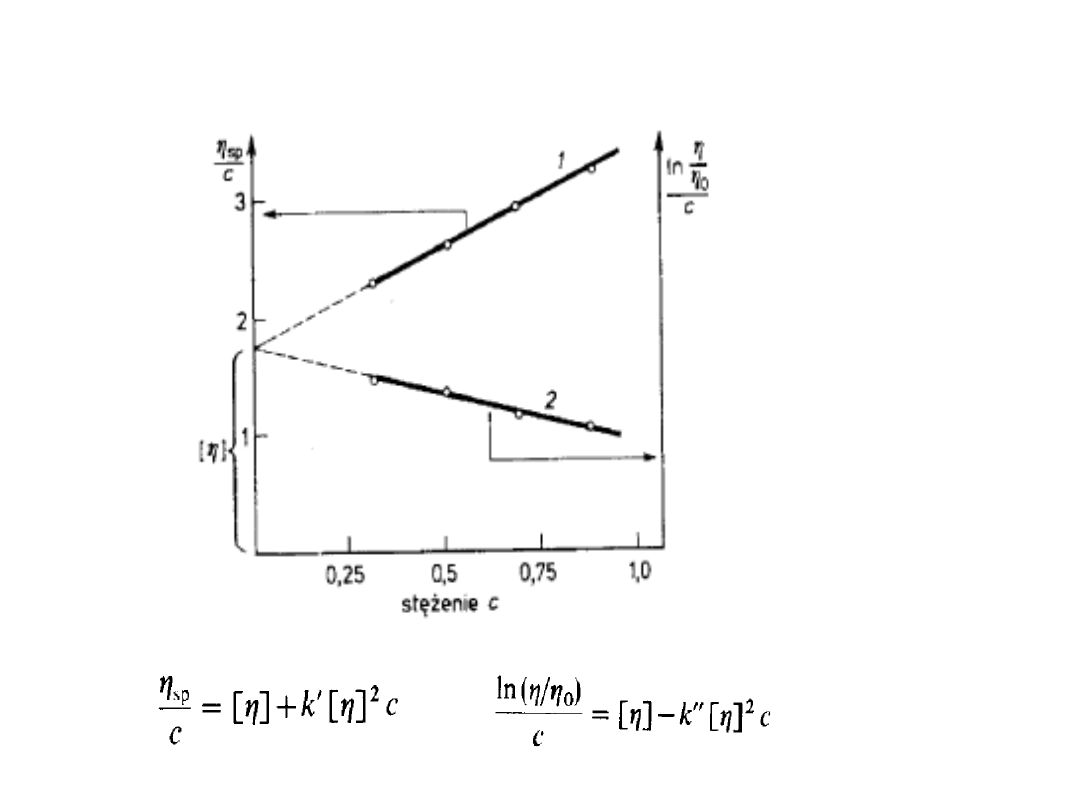
2) Liczba lepkościowa roztworu o
stężeniu c lub lepkość zredukowana
jest określona wyrażeniem:
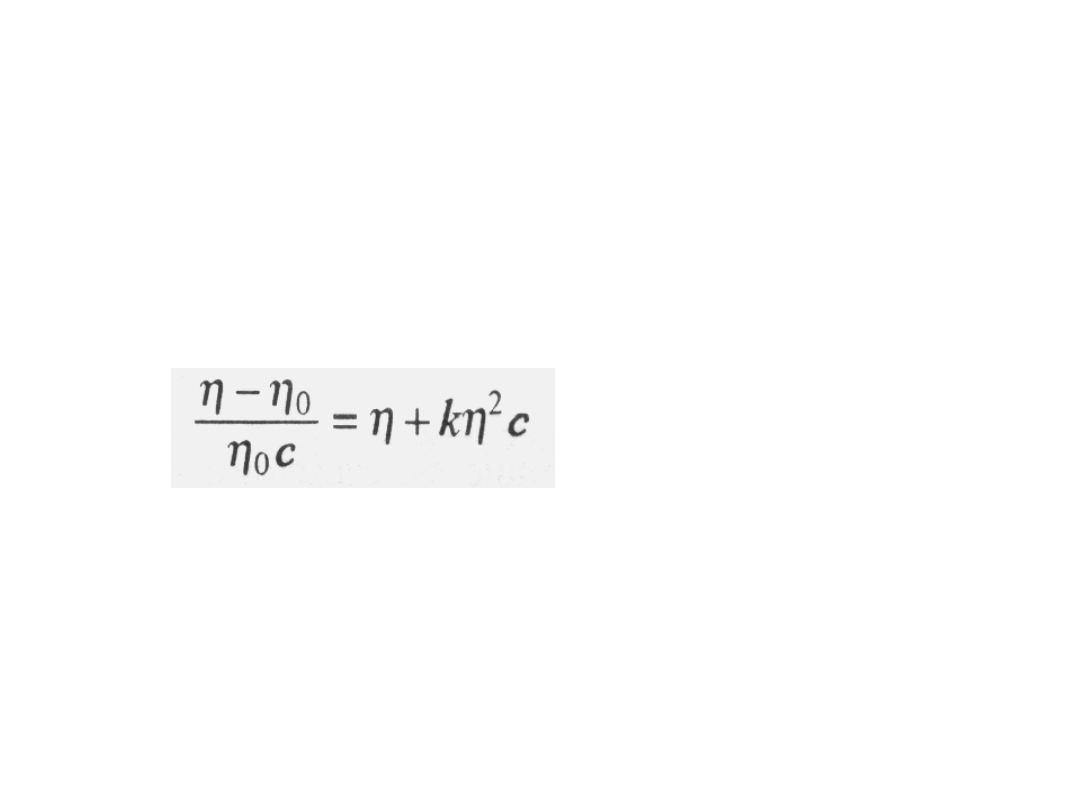
Lepkościowe metody wyznaczania
masy molowej
W
odniesieniu
do
roztworów
rozcieńczonych
liczba
lepkościowa
odpowiada
następującemu
szeregowi
potęgowemu:
Równanie
Hugginsa
gdy c dąży do zera, to wyraz (
0
)/
0
c
dąży do pewnej wartości granicznej. Nosi
ona nazwę granicznej liczby lepkościowej
[].
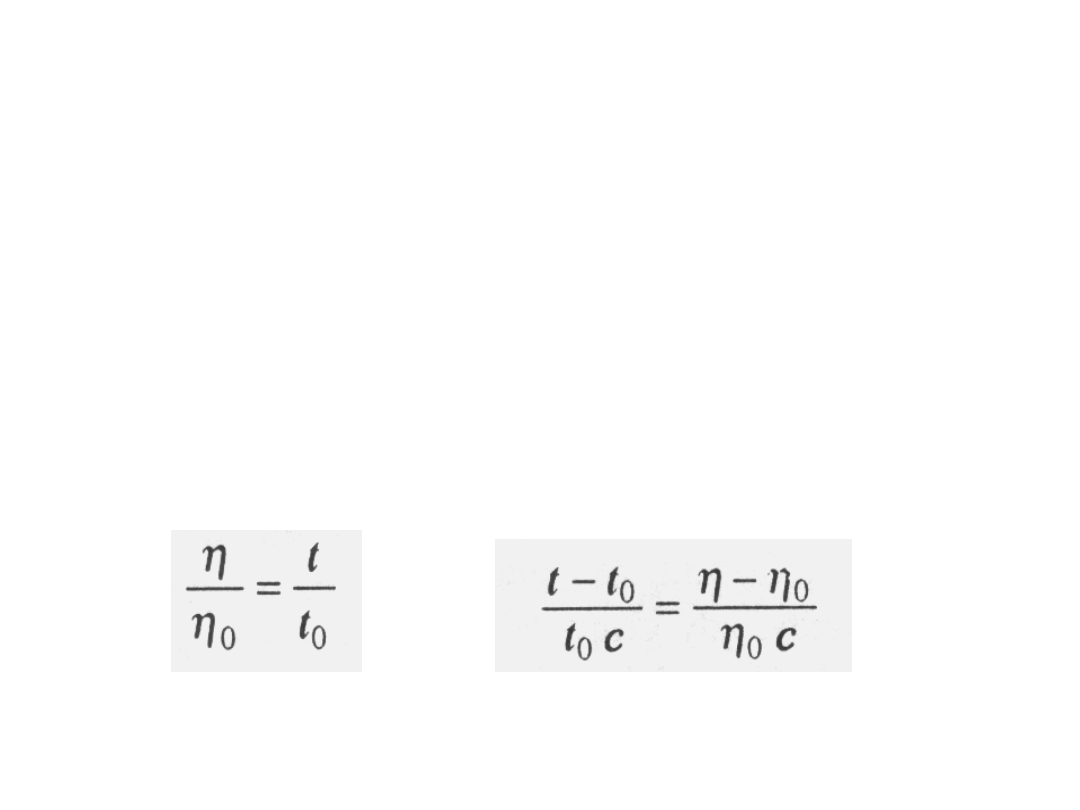
Lepkościowe metody wyznaczania
masy molowej
W praktyce nie mierzymy lepkości bezpośrednio, lecz
czasy przepływu roztworów i czystego rozpuszczalnika w
wiskozymetrze kapilarnym, czyli tzw. czasy wypływu.
Ponieważ stosuje się we wszystkich przypadkach to samo
ciśnienie hydrostatyczne słupka cieczy i różnice gęstości
bardzo rozcieńczonych roztworów o poszczególnych
stężeniach są pomijalne, to stosunek czasu wypływu
roztworu t do czasu wypływu czystego rozpuszczalnika t
0
można przyjąć za miarę stosunku lepkości, tj.
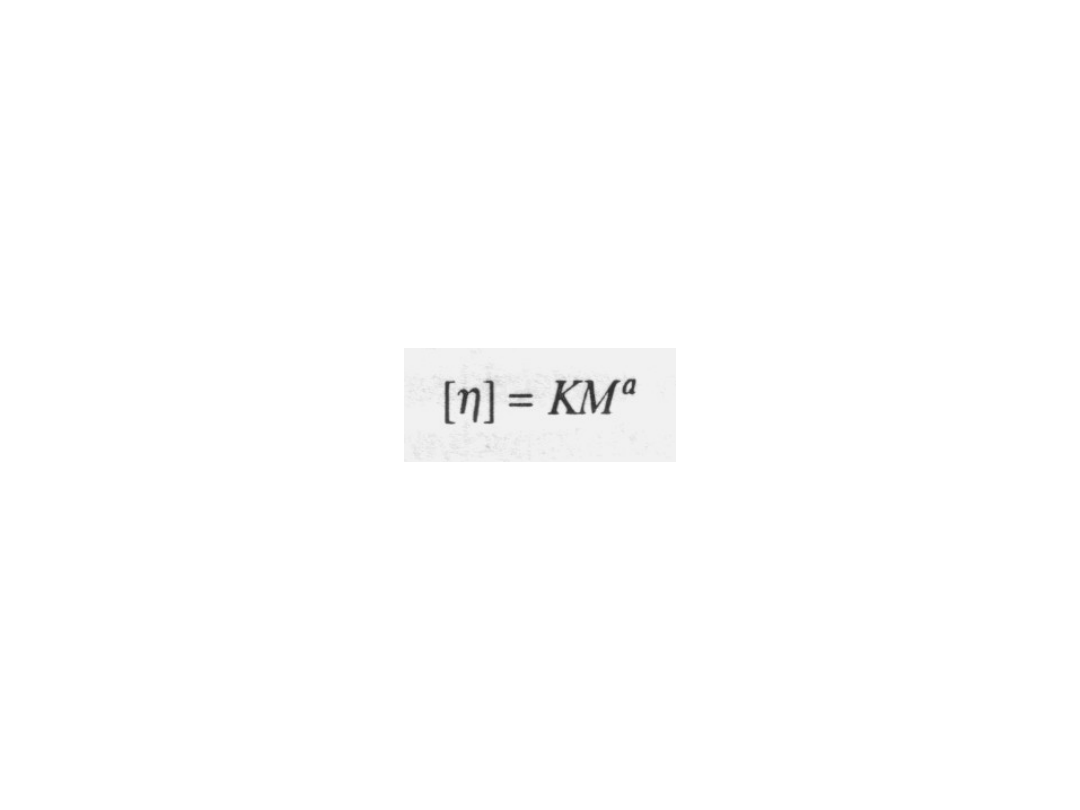
Lepkościowe metody wyznaczania
masy molowej
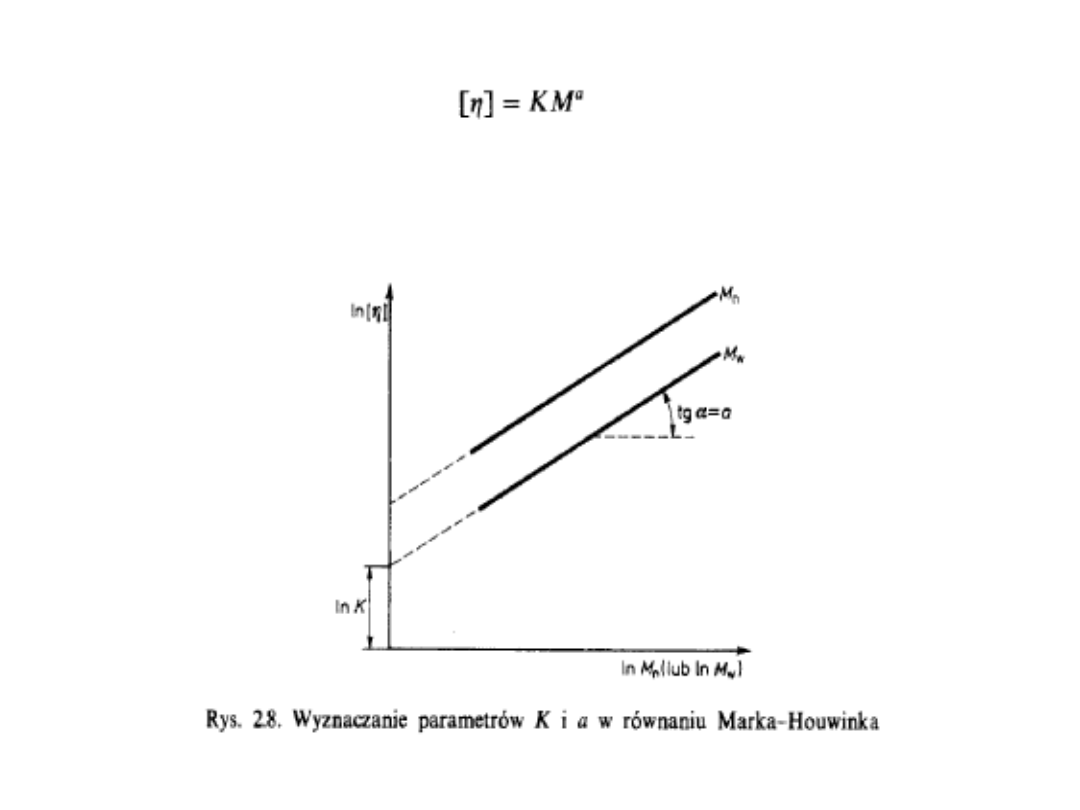
Z wartości granicznej liczby lepkościowej
możemy obliczyć masę molową, stosując
półempiryczne równanie:
Równanie to najczęściej nazywa się
równaniem Marka-
Houwinka
. Aby móc je stosować, trzeba znać wartości
stałych K i a. Zazwyczaj nie zależą one od wartości M,
lecz zmieniają się w zależności od rozpuszczalnika,
polimeru i temperatury układu. Na te wartości ma wpływ
także szerokość rozkładu mas molowych, a więc
polidyspersyjność badanego polimeru powinna być taka
sama,
jak
polidyspersyjność
próbek
stosowanych
pierwotnie na etapie kalibrowania w celu otrzymania
stałych równania Marka-Houwinka.

Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Co oznacza małżenstwo
Oznaczanie gazotworczosci z mas formierskich i rdzieniowych
Oznaczanie kariotypu
Oznaczanie kwasowości
Brymora Kaczyński Logistyka wytwórni mas bitumicznych ppt
Metody oznaczania ogólnej liczebności drobnoustrojów
rodzaje oznaczen i ich ochrooona
Spektrometria mas NMAZ
Calka oznaczona
co oznacza malzenstwo WWW ALEJAJA PL
Etanol skażony formaldehydem w nielegalnym obrocie napojami alkoholowymi wykrywanie i oznaczanie
www literka pl oznaczenia rezystorow,archiwum,2815,druku
Oznaczanie lipidów
więcej podobnych podstron