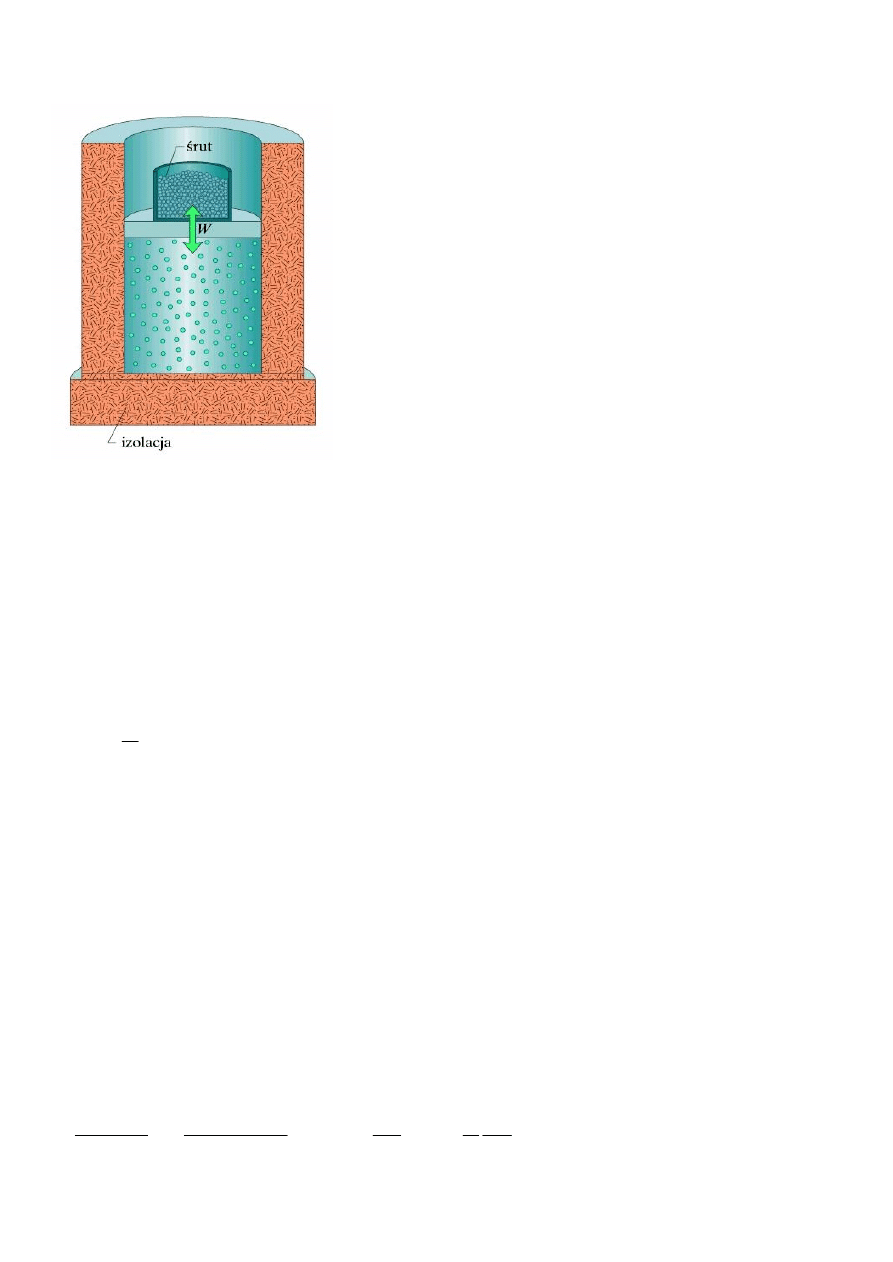
Przemiana adiabatyczna gazu doskonałego
Wyprowadzenie równania Poissona
I zasada termodynamiki w postaci różniczkowej
{
W
d
Q
d
d
w
+
=
=
0
ε
(1)
gdzie różniczkowa praca wykonana nad gazem
V
d
p
W
d
−
=
(2)
energia wewnętrzna gazu doskonałego
T
C
n
T
R
n
f
V
w
=
=
2
ε
stąd:
T
d
C
n
d
V
w
=
ε
(3)
podstawiamy (2) i (3) do (1):
V
d
p
T
d
C
n
V
−
=
(4)
obliczamy różniczkę równania stanu gazu doskonałego
T
R
n
V
p
=
(zmienne: p, V, T)
T
d
R
n
dp
V
V
d
p
=
+
podstawiamy
V
p
C
C
R
−
=
T
d
C
C
n
dp
V
V
d
p
V
p
)
(
−
=
+
(5)
dzielimy stronami (5) przez (4), a następnie zamieniamy stronę lewą z prawą:
V
d
p
dp
V
V
d
p
C
C
C
V
V
p
+
−
=
−
→
1
1
−
−
=
−
V
d
dp
p
V
C
C
V
p
przemiana
adiabatyczna
– bez
wymiany ciepła z otoczeniem

V
d
dp
p
V
C
C
V
p
−
=
/
⋅ dV, : V
p
dp
V
V
d
C
C
V
p
−
=
całkujemy obustronnie (czynniki stałe wyłączamy przed znak całki)
∫
∫
−
=
dp
p
V
d
V
C
C
V
p
1
1
α
+
−
=
p
V
C
C
V
p
ln
ln
korzystamy z własności logarytmu naturalnego (obowiązuje dla logarytmu o dowolnej
podstawie): a ln x = ln x
a
:
α
=
+
p
V
V
p
C
C
ln
ln
suma logarytmów jest równa logarytmowi iloczynu
α
=
V
p
C
C
V
p
ln
stosujemy obustronnie funkcję odwrotną do logarytmu naturalnego – funkcję wykładniczą e
x
const
e
=
=
=
β
α
V
p
C
C
V
p
stosujemy oznaczenie
κ
≡
V
p
C
C
κ –
współczynnik Poissona
ostatecznie równanie przyjmuje postać:
const
=
κ
V
p
(6)
jest to najczęściej używana forma równania Poissona
korzystając z równania stanu gazu doskonałego można zapisać równanie Poissona
korzystając z innej pary parametrów termodynamicznych (np. T i V lub T i p)
T
R
n
V
p
1
=
→
1
1
−
=
=
κ
κ
κ
V
T
R
n
V
T
R
n
V
V
p
const
=
=
β
κ
V
p
→
const
1
1
=
=
−
β
κ
R
n
V
T
stała całkowania

druga forma równania Poissona:
const
1
=
−
κ
V
T
(7)
T
R
n
p
V
1
=
→
)
1
(
)
(
1
−
−
=
=
κ
κ
κ
κ
p
T
R
n
T
R
n
p
p
V
p
const
=
=
β
κ
V
p
→
const
)
(
1
1
=
=
−
β
κ
κ
κ
R
n
p
T
→
const
)
(
1
1
1
1
=
=
−
−
κ
κ
β
κ
κ
R
n
pT
trzecia forma równania Poissona:
const
1
=
−
κ
κ
pT
(8)
Obliczenie całkowitej pracy wykonanej nad gazem
przy przejściu gazu doskonałego od stanu początkowego (objętość V
P
) do stanu końcowego
(objętość V
K
) nad gazem wykonywana jest praca
∫
−
=
K
P
V
V
V
d
p
W
(9)
z równania Poissona (6):
κ
κ
P
P
V
p
V
p
=
=
const
→
κ
κ
V
V
p
p
P
P
1
=
podstawiamy do (9):
−
−
=
=
−
−
=
−
−
=
=
+
−
−
=
−
=
−
=
−
−
−
−
−
−
+
−
∫
∫
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
1
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
κ
K
P
P
P
K
P
P
P
P
P
K
P
P
V
V
P
P
V
V
P
P
V
V
P
P
V
V
V
p
V
V
V
V
p
V
V
V
p
V
V
p
V
d
V
V
p
V
d
V
V
p
W
K
P
K
P
K
P
z równania stanu gazu doskonałego podstawiamy
P
P
P
T
R
n
V
p
=
i otrzymujemy
−
−
=
−
1
1
1
1
κ
κ
K
P
P
V
V
T
R
n
W
(10)
Wyszukiwarka
Podobne podstrony:
materialy 12b
Wykład 12b-Beton do wysłania dla studentów, STUDIA, Polibuda - semestr III, Materiały budowlane
geriatria p pokarmowy wyklad materialy
Materialy pomocnicze prezentacja maturalna
Problemy geriatryczne materiały
Wstęp do psychopatologii zaburzenia osobowosci materiały
material 7
Prez etyka materiały1
Prez etyka materialy7
Med Czyn Rat1 Ostre zatrucia Materialy
Cząsteczkowa budowa materii
Materiały dla studentów ENDOKRYNOLOGIA
Materiały organiczne
wyk1 09 materiał
materialy na diagnoze, Wyklad VI diagnoza
Materiały konstrukcyjne
więcej podobnych podstron