
WICZENIA Z CHEMII OGÓLNEJ
Tematy wicze :
I. Ogrzewanie, rodzaje osadów, metody izolacji osadów
II. Roztwory. Rodzaje st e .
III. Hydroliza soli. Okre lanie odczynu roztworów. Roztwory buforowe
IV. Procesy utleniania i redukcji (elektronacji i deelektronacji)
V. Roztwory koloidalne
VI. Zwi zki kompleksowe
Studenci I roku farmacji s zobowi zani do praktycznego wykonania i zaliczenia sze ciu
wicze z chemii ogólnej.
1

I. OGRZEWANIE I ODPAROWYWANIE CIECZY. RODZAJE OSADÓW.
ROZDZIELANIE OSADÓW
Obowi zuj ce zagadnienia
Ogrzewanie cieczy. Sposoby odparowywania. Ogrzewanie a pra enie. Rodzaje palników
gazowych. Rodzaje osadów. Zjawisko wspó str cania. Sposoby oddzielania osadu od
roztworu. Czynniki wp ywaj ce na szybko s czenia osadów.
1. Ogrzewanie cieczy, rodzaje a ni
Ogrzewanie substancji sta ej lub w roztworze mo e si odbywa przy u yciu palnika
gazowego, a ni wodnej, olejowej lub piaskowej. W zale no ci od rodzaju stosowanego
naczynia i wymaganej temperatury ogrzewa si substancj lub roztwór w okre lony sposób.
Ogrzewanie w probówkach, zape nionych do 1/3 obj to ci, przeprowadza si trzymaj c je w
drewnianych lub metalowych apach nad palnikiem gazowym. Próbówki ogrzewa si
poruszaj c nimi powolnym ruchem nad p omieniem palnika gazowego, przy czym wylot
probówki musi by zawsze skierowany od siebie. Ogrzewanie kwasów lub substancji
dymi cych nale y przeprowadza zawsze pod wyci giem. Naczynia takie jak, zlewki, kolbki,
kolby sto kowe ogrzewa si zwykle prze umieszczenie na siatce ceramicznej po o onej na
elaznym trójnogu, tak aby ogrzewanie by o równomierne. Parowniczki lub tygle
porcelanowe ogrzewa si równie na siatce ceramicznej, a do wypra enia po odparowaniu
cieczy, ustawia si na odpowiednim trójk cie porcelanowym nad p omieniem palnika.
Pra enie - ogrzewanie substancji sta ych w wysokiej temperaturze, ni szej od ich temperatury
topnienia w celu spowodowania przemian fizycznych i chemicznych
Rozró nia
si
pra enie:
- utleniaj ce, prowadzone w obecno ci utleniaczy, np. tlenu z powietrza,
- redukuj ce, prowadzone w obecno ci reduktorów, np. w gla, tlenku w gla,
- piroliz - prowadzon w atmosferze gazu oboj tnego bez obecno ci ani rodków
redukuj cych/utleniaj cych,
- kalcynacj — termiczny rozk ad substancji z wydzieleniem gazów.
Najcz ciej wykorzystywane rodzaje a ni:
a nia wodna – umo liwia ogrzewanie naczynia laboratoryjnego wod podgrzan w
sposób kontrolowany do odpowiedniej temperatury lub wrz c wod pod normalnym
2

ci nieniem, a wi c do stosunkowo niskiej temperatury ok. 100 °C. Po dodaniu do wody
pewnych substancji rozpuszczalnych w wodzie, mo ne uzyska podwy szenie lub
obni enie temperatury wrzenia wody destylowanej.
a nia olejowa – umo liwia ogrzewanie poni ej lub powy ej temperatury wrzenia wody
pod normalnym ci nieniem, a do temperatury wrzenia zastosowanego oleju. Najcz ciej
stosuje si oleje – mineralne (pochodne ropy naftowej), które umo liwiaj ogrzewanie do
ok. 160 °C (powy ej tej temperatury oleje mineralne zaczynaj si pali ) lub z silikonowe,
które umo liwiaj ogrzewanie nawet do 250 °C. Odmian a ni z olejem mineralnym jest
a nia parafinowa (parafiny topi si w ok. 60-70 °C).
a nia parowa – umo liwia ogrzewanie w naczyniu laboratoryjnym znajduj cym si
ponad wrz c ciecz .
a nia piaskowa – umo liwia równomierne ogrzewanie naczynia laboratoryjnego do
wysokich temperatur.
2. Rodzaje palników gazowych
W pracowniach analitycznych stosowane s palniki gazowe:
Palnik Bunsena jest najcz ciej stosowanym palnikiem w pracowniach analitycznych
Zbudowany jest z rurki metalowej, do której od do u wprowadza si gaz przez w sk dysz .
Gaz ulega zmieszaniu z powietrzem, które zostaje zassane poprzez dwa okr g e otwory. Ilo
dop ywaj cego powietrza mo na dowolnie regulowa za pomoc ruchomego pier cienia. Je li
dop yw powietrza jest wi kszy, p omie sk ada si z dwóch sto ków, z których wewn trzny
barwy niebieskiej jest stosunkowo ch odny, natomiast zewn trzny, jasnofioletowy wykazuje
temperatur ok. 1500 °C.
Palnik Bunsena
3

3. Osady
3.1. Rodzaje osadów
Osad (precypitat) – sta a, daj ca si oddzieli mechanicznie cz
niejednorodnej, nie tworz ca trwa ego uk adu koloidalnego. Proces celowego
generowania osadu z roztworu nazywa si wytr caniem albo str caniem.
Krystaliczne – z o one z cz stek o uporz dkowanej budowie sieciowej. Posta osadu
zale y od sposobu jego wytr cania:
- drobnokrystaliczne np. BaSO
4
- grubokrystaliczne np. MgNH
4
PO
4
.
Koloidalne – z o one z cz stek o nieuporz dkowanej budowie sieciowej S to osady
bezpostaciowe. W wodzie tworz roztwory koloidalne. Wyró nia si osady:
- serowate np. AgCl
- galaretowate np. Fe(OH)
3
Liofilowe (hydrofilowe), s to koloidy których cz stki na powierzchni tworz warstw
zaadsorbowanych cz steczek cieczy rozpraszaj cej, np. wody.
Liofobowe (hydrofobowe) – s to koloidy, których cz stki znajduj si w stanie wielkiego
rozdrobnienia, dzi ki utrzymuj cym si na ich powierzchni jednoimiennym adunkom
elektrycznym.
W praktyce wytr ca si osady najcz ciej na gor co. Bezpo rednio po wytr ceniu osad
krystaliczny zawiera zawsze obok wi kszych kryszta ów, pewn ilo kryszta ów bardzo
drobnych, które podczas s czenia przenikaj z atwo ci przez pory s czka. Wytr cony osad
pozostawiony przez pewien czas w zetkni ciu z ciecz macierzyst , tworzy wi ksze kryszta y,
atwiejsze do ods czenia i o wi kszym stopniu czysto ci. Jest to tak zwany proces starzenia
osadu (dojrzewania). Dla przyspieszenia dojrzewania osadu, roztwór mo na podgrza w a ni
wodnej; w podwy szonej temperaturze wszystkie procesy przebiegaj szybciej. Osady
bezpostaciowe na ogó nie wymagaj dojrzewania.
Podczas wytr cania osadu nale y:
- odczynnik str caj cy dodawa powoli, jednocze nie mieszaj c;
- proces powinien przebiega w podwy szonej temperaturze;
- roztwór i odczynnik str caj cy nie powinny by roztworami st onymi;
- pozostawi wytr cony osad w roztworze macierzystym w celu zwi kszenia cz stek.
4

3.2. Wspó str cenie
Jest procesem polegaj cym na wytr caniu wraz z osadem oznaczanego sk adnika. W
wyniku wspó str cania nast puje zanieczyszczenie str canego osadu dodatkowymi
substancjami. Proces ten mo e zachodzi na skutek:
- adsorpcji powierzchniowej jonów – w wyniku której zachodzi zatrzymanie atwo
rozpuszczalnych substancji znajduj cych si w roztworze. Adsorbentem jest cia o sta e
(osad), a adsorbatem substancja rozpuszczona w roztworze;
- okluzji – procesu w czania do osadu cz steczek innych substancji, zachodz cego w
czasie formowania si osadu. Polega na adsorpcji obcych cz steczek, które nast pnie na
skutek szybkiej krystalizacji zostaj zatrzymane we wn trzu kryszta u, w wyniku
szybkiego wzrostu kryszta u;
- tworzenia kryszta ów mieszanych – proces ten zachodzi w przypadku krystalizacji
substancji izomorficznych, czyli tworz cych kryszta y o identycznej budowie
przestrzennej. Kryszta y mieszane tworz si najcz ciej w przypadku krystalizacji
mieszaniny substancji, posiadaj cych zbli one wielko ci promieni jonowych lub
atomowych;
- wytr cania nast pczego – polegaj cego na wytr caniu na powierzchni osadu innej
substancji, zazwyczaj o wspólnym jonie z osadem, zachodz ce na ogó w czasie
powstawaniu osadu w kontakcie z roztworem macierzystym.
3.3. Sposoby oddzielania osadu od roztworu
Odwirowywanie – proces mo na przeprowadzi za pomoc wirówki r cznej lub
elektrycznej. Podczas odwirowywania nale y pami ta o równomiernym obci eniu
tulejek wirówkowych poprzez umieszczenie np. w przeciwleg ej tulejce probówki z wod .
Odwirowywanie osadu przyspiesza oddzielanie go od roztworu. Przemywanie osadu w
probówce wirówkowej prowadzi si przez zlanie supernatantu, dodanie czynnika
przemywaj cego do osadu znajduj cego si w probówce, dok adne wymieszanie i
powtórne wirowanie.
S czenie - proces s czenia jest zjawiskiem zachodz cym pod wp ywem si y ci ko ci,
polegaj cym na przepuszczaniu mieszaniny substancji sta ej i cieczy przez materia
porowaty, którego warstwa przepuszcza ciecz, a zatrzymuje substancj sta a, dzi ki temu,
e pory s mniejsze od cz stek cia a sta ego. Materia em tym najcz ciej s ró nego
5

rodzaju s czki. Ciecz któr nale y przes czy wlewa si na s czek po szklanej bagietce.
Osad nigdy nie powinien wype nia wi cej ni po ow pojemno ci u ywanego s czka.
Drobnoziarniste osady s czy si przez s czki „twarde”, cis e o jak najmniejszych porach
(najcz ciej oznaczone na opakowaniu niebieskim paskiem czy niebiesk etykietk ).
S czki rednie s przeznaczone dla osadów krystalicznych. Do s czenia osadów
bezpostaciowych i galaretowatych u ywa si s czków mi kkich.
S czki karbowane stosuje si do szybkiego s czenia, nie przylegaj one ca kowicie do
lejka, lecz jedynie na zgi ciach, dzi ki czemu s czenie odbywa si szybciej.
S czenie pod zmniejszonym ci nieniem. Metod stosuje si szczególnie cz sto w
przypadku s czenia substancji niszcz cych bibu .
Dekantacja – metoda przemywania osadu wytr conego w naczyniu, polegaj ca na
zadaniu go odpowiednim rozpuszczalnikiem, wymieszaniu i odczekaniu do ponownej
sedymentacji i zlaniu klarownej cieczy znad osadu. Najcz ciej czynno powtarzana jest
wielokrotnie.
Sedymentacja - proces opadania zawiesiny cia a sta ego w cieczy w wyniku dzia ania si y
grawitacji lub si bezw adno ci. Sedymentacji ulegaj zawiesiny o g sto ci wi kszej ni
g sto cieczy. Sedymentacja prowadzi do rozdzia u substancji niejednorodnych, a
kryterium rozdzia u jest zró nicowana g sto .
Odparowywanie – proces polegaj cy na zmniejszeniu ilo ci rozpuszczalnika w uk adzie
przez ogrzewanie na skutek czego nast puje wzrost st enia. Najcz ciej przeprowadzany
jest w parownicach porcelanowych lub zlewkach szklanych.
4. Przemywanie osadów
Osad na s czku powinien by dok adnie przemyty w celu usuni cia wszystkich
zanieczyszcze . Przemywanie osadu nale y rozpocz bezpo rednio po przeniesieniu go na
s czek. Do przemywania s u y tryskawka. Strumie cieczy przemywaj cej nale y skierowa
najpierw na cz
s czka woln od osadu, a nast pnie stopniowo na osad. Gdy s czek si ju
zape ni, przerwa czynno i poczeka , a ciecz cieknie ca kowicie. Czynno powtórzy
kilkakrotnie, ka dorazowo nape niaj c s czek i staraj c si zebra ciecz ze cianek s czka.
Nale y równie pami ta , e s czenie jest czynno ci , której nie powinno si przerywa .
Przerwy powoduj wysychanie, p kanie i twardnienie osadu.
6

Cz
praktyczna
Celem wiczenia jest zapoznanie si z obs ug palnika gazowego, ogrzewaniem i
odparowywaniem cieczy. Praktyczne zapoznanie si ze str caniem, s czeniem, wirowaniem
osadów. Zapoznanie si z procesem adsorpcji i sublimacji.
Sprz t i odczynniki
Palnik gazowy, siatka ceramiczna, trójnóg, a nia wodna, szczypce lub apa do probówek,
parowniczka porcelanowa, probówki, szkie ko zegarkowe, drucik platynowy, wirówka,
bagietka, lejek, zlewka, probówki, zlewka o poj. 250 cm
3
, kolba okr g odenna mi kkie s czki,
roztwory: 0,5 mol/dm
3
CuSO
4
, 0,5 mol/dm
3
NaCl, 0,5 mol/dm
3
KCl, 0,1 mol/dm
3
CaCl
2
, 0,1
mol/dm
3
BaCl
2
, 1,5 mol/dm
3
H
2
SO
4
, 6 mol/dm
3
NaOH, 0,1 mol/dm
3
Pb(NO
3
)
2
, 0,5 mol/dm
3
K
2
CrO
4,
0,1 mol/dm
3
Hg(NO
3
)
2
, 0,5 mol/dm
3
KI, jod in substantia, w giel aktywny, b kit
metylenowy (50 mg/100 cm
3
)
1. Odparowywanie cieczy
Sposób wykonania
Do porcelanowej parowniczki wla ok. 1 cm
3
roztworu 0,5 mol/dm
3
CuSO
4
, prób umie ci
na wrz cej a ni wodnej i ogrzewa do wydzielenia si kryszta ków.
Na szkie ku zegarkowym umie ci 2-3 krople roztworu 0,5 mol/dm
3
NaCl i odparowa na
a ni do sucha.
2. Obserwacja zabarwienia p omienia
Sole pierwiastków I i II grupy g ównej uk adu okresowego zabarwiaj p omie na
charakterystyczny kolor.
Sposób wykonania
Drucik platynowy zanurzy w probówce z odpowiedni sol , a nast pnie umie ci w
p omieniu palnika gazowego.
Przedstawi wyniki obserwacji barwy p omienia w postaci tabelki. Wyja ni zachodz ce
zjawiska.
7

3. Wytr canie osadów
Sposób wykonania
a.
wytr canie osadu BaSO
4
Do probówki doda ok. 1 cm
3
0,1 mol/dm
3
BaCl
2
a nast pnie ok. 1 cm
3
1,5 mol/dm
3
H
2
SO
4
b. wytr cenie osadu PbCrO
4
Do probówki doda ok. 1 cm
3
0,1 mol/dm
3
Pb(NO
3
)
2
a nast pnie ok. 1 cm
3
0,5 mol/dm
3
K
2
CrO
4
c. wytr canie osadu Cu(OH)
2
Do probówki doda ok. 1 cm
3
0,5 mol/dm
3
CuSO
4
a nast pnie ok. 1 cm
3
6 mol/dm
3
NaOH
d. wytr canie osadu HgI
2
Do probówki doda ok. 1 cm
3
0,1 mol/dm
3
Hg(NO
3
)
2
a nast pnie ok. 1 cm
3
0,5 mol/dm
3
KI
Zaobserwowa zmiany zachodz ce w próbkach. U o y odpowiednie równania reakcji
chemicznych w formie cz steczkowej i jonowej.
Wytr cone osady oddzieli od roztworu przez:
a) sedymentacj
b) odwirowanie
b) s czenie
c) dekantacj
4. Proces sublimacji
Sposób wykonania
Do zlewki wsypa niewielk ilo jodu, na zlewk po o y kolb z wod . Ogrza nad
palnikiem. Opisa wyniki obserwacji.
Uwaga! wiczenie wykona pod dygestorium.
5. Proces adsorpcji
Sposób wykonania
Do zlewki wla 100 cm
3
roztworu barwnika, nast pnie doda y eczk w gla aktywnego i
zamiesza . Opisa wyniki obserwacji.
8

II. ROZTWORY. RODZAJE ST
E
Obowi zuj ce zagadnienia
Definicja roztworów; rozpuszczalno . Definicja procesu roztwarzania. Rodzaje roztworów.
Poj cie iloczynu rozpuszczalno ci. Czynniki wp ywaj ce na proces rozpuszczania. Sposoby
okre lania st e roztworów.
1. Roztwory, rozpuszczalno , roztwarzanie
Roztwór - to jednorodny, uk ad dwu lub wielosk adnikowy, jednofazowy (ciek y, sta y lub
gazowy), którego sk adniki mo na oddzieli metodami fizycznymi, np. przez destylacj ,
krystalizacj lub uk ad niejednorodny wielofazowy sk adaj cy si z fazy rozpraszaj cej i
rozproszonej.
W procesie rozpuszczania ka dy ze sk adników roztworu mo e by uwa any za
rozpuszczalnik lub substancj rozpuszczon . Zwyczajowo jako rozpuszczalnik przyjmuje si
ten sk adnik, który przewa a ilo ciowo np. azot w powietrzu, b d ten który w trakcie
rozpuszczania nie zmienia swojego stanu skupienia.
Rozpuszczalno – wyra ana jest warto ci st enia substancji rozpuszczonej w roztworze
nasyconym w stanie równowagi. Ze wzgl du na zró nicowan rozpuszczalno substancji w
danym rozpuszczalniku, stosuje si okre lenia: jako dobrze, trudno i bardzo trudno
rozpuszczalne. Miar rozpuszczalno ci danej substancji jest zawarto w konkretnej ilo ci
rozpuszczalnika lub roztworu.
Najcz ciej jest wyra ana jako liczba gramów substancji rozpuszczonej w 100 g
rozpuszczalnika, przy ca kowitym nasyceniu roztworu w danej temperaturze.
Rozpuszczalno molowa jest to liczba moli substancji rozpuszczonych w 1dm
3
rozpuszczalnika.
Najpospolitszym rozpuszczalnikiem ciek ym jest woda i dlatego w analizie chemicznej
najcz ciej analizuje si z roztwory wodne, cho wykorzystuje si wiele innych
rozpuszczalników.
Roztwarzanie - proces przeprowadzania trudno rozpuszczalnej substancji do roztworu, w
wyniku nieodwracalnych reakcji chemicznych. Substancj roztwarzaj c s najcz ciej
9

roztwory wodne kwasów lub zasad, mo e by tak e woda. Po roztworzeniu nie mo na
metodami fizycznymi odzyska substancji roztworzonej, co jest mo liwe w przypadku
rozpuszczania.
Przyk ady reakcji roztwarzania:
- roztwarzanie cynku w kwasie solnym
2
2
2
2
H
Cl
Zn
HCl
Zn
- roztwarzanie siarczku miedzi(II) w kwasie azotowym(V)
O
H
S
NO
NO
Cu
HNO
CuS
2
2
3
3
4
3
2
)
(
3
8
3
- roztwarzanie krzemionki w kwasie fluorowodorowym
0
2
2
2
4
2
2
2
H
SiF
F
H
SiO
- roztwarzanie wodorotlenku glinu(III) w wodorotlenku sodu
4
3
)
(
)
(
OH
NaAl
NaOH
OH
Al
- roztwarzanie w glanu(IV) wapnia(II) w kwasie solnym
2
2
2
3
2
CO
O
H
CaCl
HCl
CaCO
- roztwarzanie tlenku cynku(II) w kwasie solnym
O
H
ZnCl
HCl
ZnO
2
2
2
2 .Rodzaje roztworów
Stosuje si zró nicowany podzia roztworów uwzgl dniaj c ró ne kryteria.
a) ze wzgl du na ilo substancji rozpuszczonej:
- roztwory nasycone
- roztwory nienasycone
- roztwory przesycone
b) ze wzgl du na stan skupienia rozpuszczalnika
- gazowe
- ciek e
- sta e
c) ze wzgl du na wielko cz stek substancji rozpuszczonej
- roztwory w a ciwe
10

- roztwory koloidalne
- zawiesiny
Roztwór nasycony – roztwór w którym w danej temperaturze st enie substancji
rozpuszczonej jest równe jej rozpuszczalno ci.
Roztwór nienasycony- roztwór, który w danej temperaturze st enie substancji rozpuszczonej
jest mniejsze od jej rozpuszczalno ci
Roztwór przesycony – roztwór, w którym st enie substancji rozpuszczonej jest wi ksze od
jej rozpuszczalno ci w danej temperaturze. Stanowi on uk ad atwo wracaj cy do równowagi,
wydzielaj c nadmiar substancji rozpuszczonej.
Roztwór w a ciwy - zwany te roztworem rzeczywistym to uk ad, w którym cz stki substancji
rozproszonej maj rozmiary mniejsze od 1 nm (nanometr- 10
-9
m).
Roztwór koloidalny – niejednorodna mieszanina, zwykle dwufazowa, tworz ca uk ad dwóch
substancji, w którym jedna z substancji jest rozproszona w drugiej. Cz stki substancji
rozproszonej maj rozmiary w granicach od 1-100 nm, wykazuj one zjawisko Tyndalla
charakterystyczne tylko dla roztworów koloidalnych, a odró niaj ce je od roztworów
w a ciwych.
Zawiesina - uk ad niejednorodny, dwufazowy, sk adaj cy si z fazy rozproszonej i
rozpraszaj cej), np. cz stek cia a sta ego w gazie lub cz stek cieczy w cieczy. G sto fazy
rozproszonej w zawiesinach jest na ogó wi ksza ni g sto fazy rozpraszaj cej ze wzgl du
na rozmiary cz stek substancji rozproszonej powy ej 100 nm. Dlatego te rozproszone
cz stki fazy sta ej maj tendencj do sedymentacji (opadania).
3. Iloczyn rozpuszczalno ci
St enie molowe elektrolitów trudno rozpuszczalnych w roztworach nasyconych w stanie
równowagi dynamicznej w okre lonej temperaturze, obliczamy stosuj c poj cie iloczynu
rozpuszczalno ci. Iloczyn rozpuszczalno ci oznacza si ró nymi symbolami np. K
s
(„s”- ang.
solubility – rozpuszczalno ), I
R.
.
Iloczyn rozpuszczalno ci trudno rozpuszczalnego zwi zku o wzorze BA mo na opisa
wzorem:
const
A
B
K
BA
S
]
][
[
11

W roztworze nasyconym cz steczki zwi zku [BA] znajduj si w osadzie, a jony [B
+
][A
-
] w
roztworze (w bardzo nieznacznym st eniu).
Iloczyn rozpuszczalno ci trudno rozpuszczalnego elektrolitu w roztworze nasyconym w danej
temperaturze jest wielko ci sta i równa si iloczynowi st e jonów tego elektrolitu w
roztworze.
4. Czynniki wp ywaj ce na rozpuszczalno substancji trudno rozpuszczalnych
- rodzaj substancji rozpuszczanej
- rodzaj rozpuszczalnika
- temperatura
- obecno innych jonów w roztworze
- pH roztworu
- proces hydrolizy
5. Sposoby okre lania st e roztworów
Ilo ciowy sk ad roztworu okre la st enie, wyra aj ce zawarto substancji rozpuszczonej w
okre lonej ilo ci rozpuszczalnika lub roztworu. W Farmakopei Polskiej
1
jako jednostki
obj to ci podano mililitry [ml] oraz litry [l]. Natomiast w chemicznym i farmaceutycznym
pi miennictwie anglosaskim, najcz ciej stosowane s skróty [mL] oraz [L]. W obliczeniach
chemicznych jako jednostki obj to ci stosuje si [cm
3
] lub [dm
3
].
5.1.St enia procentowe
- st enie procentowe masowe [% m/m] - okre la ilo gramów substancji zawartej w 100 g
roztworu
- st enie procentowe obj to ciowe – [ % v/v] wyra a ilo cm
3
(ml) substancji zawartej w
100 ml (cm
3
) roztworu. Ten rodzaj st enia stosuje si g ównie dla roztworów cieczy w
cieczach.
- st enie procentowe masowo-obj to ciowe [% m/v] - wyra a ilo gramów substancji
zawartej w 100 ml roztworu. Stosuje si je g ównie dla substancji sta ych rozpuszczonych w
1
Zbiór podstawowych wymaga jako ciowych oraz metod badania produktów leczniczych i ich opakowa oraz
surowców farmaceutycznych w Polsce.
12

cieczach i dotyczy zw aszcza roztworów, w których ilo substancji rozpuszczonej jest bardzo
ma a
- st enie procentowe obj to ciowo-masowe [% v/m] - oznacza ilo ml (cm
3
) substancji
zawartej w 100 g roztworu.
5.2. St enia wyra one liczb moli
- st enie molowe (molowo ) [Cm] -okre la liczb moli danej substancji znajduj cej si w
1 litrze (1 dm
3
) roztworu. Najcz ciej stosowane jednostki st enia molowego (mol/dm
3
,
mol/l, mol/L)
- st enie molarne (molarno ) wyra a liczb moli substancji rozpuszczonej w 1 kg
rozpuszczalnika.
5.3. Inne sposoby okre lania st enia roztworów
- ppm – cz
na milion (ppm- z ang. parts per million) – 1 ppm równa si 10
-4
%, poniewa
1% oznacza jedn cz
substancji na 100 cz ci roztworu.
- u amek molowy (procent molowy) okre la stosunek liczby moli sk adnika A roztworu do
ogólnej liczby moli wszystkich sk adników. Najcz ciej s to roztwory z o one z dwóch
sk adników; sk adnik A jest to substancja rozpuszczona, sk adnik B jest rozpuszczalnikiem.
U amek molowy sk adnika A definiuje si jako:
B
A
A
A
n
n
n
X
Natomiast sk adnika B
B
A
B
B
n
n
n
X
Suma u amków molowych wszystkich sk adników w roztworze jest zawsze równa jedno ci.
Aby wyrazi st enie danego sk adnika w u amku molowym nale y u amek molowy
pomno y przez 100. Ten sposób wyra ania st e stosuje si przede wszystkim do
roztworów gazowych.
13

Cz
praktyczna
Celem wiczenia jest zapoznanie si ze sposobami wyra ania st e roztworów i ich
praktycznym przygotowaniem, pomiar g sto ci roztworów oraz badanie rozpuszczalno ci
jodu w ró nych rozpuszczalnikach
Sprz t i odczynniki
Waga, cylinder miarowy, pipeta, kolbka miarowa, piknometr: 3 probówki z korkiem zlewka o
poj.100 cm
3
, bagietka, roztwory: st ony H
2
SO
4
(18 mol/dm
3
) i H
2
SO
4
(0,5 mol/dm
3
),
st ony CH
3
COOH, KI, etanol, chloroform, NaOH in substantia, KOH in substantia, NaCl in
substantia, , jod in substantia,
1. Przygotowywanie roztworów
A. Przygotowa 100 cm
3
roztworu H
2
SO
4
1,5 mol/dm
3
przez zmieszanie st onego H
2
SO
4
(18 mol/dm
3
) i H
2
SO
4
0,5 mol/dm
3
–zastosowa regu mieszania.
B. Przygotowa 100 cm
3
roztworu 6 mol/dm
3
CH
3
COOH korzystaj c ze st onego
CH
3
COOH (17 mol/dm
3
).
C. Przygotowa 100 cm
3
roztworu 30% CH
3
COOH korzystaj c ze st onego CH
3
COOH
(99,5%)
Uwaga! Rozcie czanie kwasu polega na dodawaniu go do wody
D. Przygotowa 100 cm
3
roztworu NaOH o st eniu 3 mol/dm
3
wykorzystuj c sta y
NaOH.
E. Przygotowa 100 cm
3
roztworu KOH o st eniu 3 mol/dm
3
wykorzystuj c sta y KOH.
2. Oznaczanie g sto ci roztworu
Sposób wykonania
14

Przygotowa 10 cm
3
25% roztworu NaCl. Nape ni piknometr wod destylowan ,
zamkn naczynie, osuszy bibu cianki boczne naczynia z nadmiaru cieczy i zwa y .
Czynno ci powtórzy z przygotowanym roztworem. Obliczy g sto badanego roztworu wg
wzoru:
d=[
w
m
· 0,9970 + 0,0012] g/cm
3
m = masa badanej substancji
w = masa wody
0,9970 = g sto wody w 20 ºC
0,0012 = poprawka na wa enie w powietrzu
3. Ocena rozpuszczalno ci jodu w ró nych rozpuszczalnikach
Sposób wykonania
Do 3 probówek wsypa po szczypcie jodu. Do pierwszej wla 2 cm
3
wody destylowanej, do
drugiej 2 cm
3
etanolu, a do trzeciej 2 cm
3
chloroformu. probówki zamkn korkiem i
wstrz sn . Oceni rozpuszczalno jodu w zastosowanych rozpuszczalnikach. Do probówki
z wod doda szczypt KI, zamiesza . Opisa wyniki obserwacji, zwróci uwag na barwy
roztworów.
15

III. HYDROLIZA SOLI, OKRE LANIE ODCZYNU ROZTWORÓW.
ROZTWORY BUFOROWE
Obowi zuj ce zagadnienia
Poj cie hydrolizy, hydrolizy kationowej i anionowej oraz kationowo-anionowej, przyk ady.
Definicje sta ej i stopnia hydrolizy. Czynniki wp ywaj ce na warto sta ej i stopnia hydrolizy.
Definicja pH oraz metody okre lania odczynu roztworu. Rodzaje wska ników i mechanizm
ich dzia ania. Poj cie buforów, przyk ady oraz mechanizm dzia ania buforów. Definicja
pojemno ci buforowej.
1. Hydroliza soli
Hydroliza soli jest reakcj pomi dzy jonami pochodz cymi z dysocjacji soli i cz steczkami
wody. Jest to reakcja jonowa (podwójnej wymiany), do zaj cia której wymagane jest, aby
przynajmniej jeden z produktów reakcji, by trudno rozpuszczalny lub s abo zdysocjowany.
Reakcjom hydrolizy ulegaj sole pochodz ce od s abych kwasów i mocnych zasad, sole
pochodz ce od s abych zasad i mocnych kwasów oraz sole pochodz ce od s abych kwasów i
s abych zasad.
2. Przyk ady hydrolizy kationowej i anionowej oraz kationowo-anionowej
Przyk ad 1.
Hydroliza octanu sodu – soli pochodz cej od s abego kwasu i mocnej zasady
C
OONa
CH
NaOH
COOH
CH
O
H
3
2
3
OH
Na
COOH
CH
O
H
Na
COO
CH
3
2
3
OH
COOH
CH
O
H
COO
CH
3
2
3
hydroliza anionowa
odczyn zasadowy
16

Przyk ad 2.
Hydroliza chlorku amonu - soli pochodz cej od s abej zasady i mocnego kwasu
HCl
O
H
NH
O
H
Cl
NH
2
3
2
4
Cl
H
O
H
NH
O
H
Cl
NH
3
3
2
4
H
O
H
NH
O
H
NH
2
3
2
4
hydroliza kationowa odczyn kwasowy
Przyk ad 3.
Hydroliza octanu amonu - soli pochodz cej od s abego kwasu i s abej zasady
O
H
NH
COOH
CH
O
H
COONH
CH
2
3
3
4
3
2
O
H
NH
COOH
CH
O
H
NH
COO
CH
2
3
3
2
4
3
hydroliza anionowo- kationowa
odczyn oboj tny
3. Sta a hydrolizy(K
h
), czynniki wp ywaj ce na warto sta ej hydrolizy
3.1. Sta a hydrolizy soli pochodz cej od s abego kwasu i mocnej zasady jest równa:
k
W
h
K
K
K
K
w
- iloczyn jonowy wody (K
w
= 10
-14
)
K
k
– sta a dysocjacji s abego kwasu
Sta a hydrolizy soli pochodz cej od s abego kwasu i mocnej zasady równa si stosunkowi
iloczynu jonowego wody K
w
, do sta ej dysocjacji s abego kwasu K
k
Sta a hydrolizy zale y od:
a) rodzaju soli: im s abszy kwas od którego pochodzi sól, tzn. im mniejsza warto K
k
tym wi ksza sta a hydrolizy i tym atwiej zachodzi hydroliza
b) temperatury poniewa iloczyn jonowy wody zale y od temperatury
Sta a hydrolizy nie zale y od st enia soli.
17

3.2. Sta a hydrolizy soli pochodz cej od s abej zasady i mocnego kwasu jest równa:
z
W
h
K
K
K
K
w
- iloczyn jonowy wody (K
w
= 10
-14
)
K
z
– sta a dysocjacji s abej zasady
Sta a hydrolizy soli pochodz cej od mocnego kwasu i s abej zasady równa jest stosunkowi
iloczynu jonowego wody K
w
do sta ej dysocjacji s abej zasady K
z
Sta a hydrolizy zale y od:
a) rodzaju soli: im s absza zasada od której pochodzi sól, tzn. im mniejsze K
z
,
tym wi ksza sta a hydrolizy i tym atwiej zachodzi hydroliza
b) temperatury, poniewa iloczyn jonowy wody zale y od temperatury.
Sta a hydrolizy nie zale y od st enia soli
3.3. Sta a hydrolizy soli pochodz cej od s abej zasady i s abego kwasu jest równa:
k
z
W
h
K
K
K
K
K
w
K
k
- sta a dysocjacji s abego kwasu
K
z
- sta a dysocjacji s abej zasady
Sta a hydrolizy soli pochodz cej od s abego kwasu i s abej zasady równa jest stosunkowi
iloczynu jonowego wody do i iloczynu sta ej dysocjacji s abego kwasu i s abej zasady.
Sta a hydrolizy jest tym wi ksza im mniejsze s warto ci sta ych dysocjacji s abej zasady i
s abego kwasu.
Sta a hydrolizy zale y od:
a) rodzaju soli: im s absza zasada od której pochodzi sól, tzn. im mniejsze K
z
i im
s abszy kwas od którego pochodzi sól K
k
tym wi ksza sta a hydrolizy i tym atwiej
zachodzi hydroliza
b) od temperatury, poniewa iloczyn jonowy wody zale y od temperatury.
Sta a hydrolizy nie zale y od st enia soli
18

4. Wyk adnik st enia jonów wodorowych, pH
4.1. Poj cie i skala pH
pH- ujemny logarytm ze st enia jonów wodorowych
pH
H
H
pH
10
]
[
]
lg[
Zale no miedzy st eniem jonów[ H
+
] i [ OH
-
] w temperaturze pokojowej - jest opisana
wzorem:
14
10
]
[
]
[
OH
H
i nosi nazw iloczynu jonowego wody.
Natomiast wyra ona za pomoc wyk adników pot gi przybiera posta :
pH
pOH
pOH
pH
pOH
pH
14
14
14
W roztworze oboj tnym pH = pOH = 7
W roztworze kwasowym pH 7
W roztworze zasadowym pH 7
Wyk adnik st enia jonów wodorowych pH przyjmuje warto ci pomi dzy 0 a 14.
Je eli ( [H
+
]=10
0
mol/dm
3
; wówczas warto pH =0
Je eli [H
+
]=10
-14
mol/dm
3
; pH=14
4.2. Metody okre lania odczynu roztworu
W celu okre lenia pH roztworu stosuje si dwie metody
a) metoda wizualna polegaj ca na okre leniu pH roztworu na podstawie zmiany barwy
odpowiedniego wska nika, którego zabarwienie jest zale ne od odczynu roztworu
b) pomiary pH metodami instrumentalnymi np. potencjometrycznie
4.3. Wska niki i ich mechanizm dzia ania
19

Wska niki kwasowo-zasadowe – s to zwi zki chemiczne, których barwa zmienia si
zale nie od pH rodowiska. Wska niki s to zwi zki organiczne o charakterze s abych
kwasów lub zasad. Dysocjacj wska nika o charakterze kwasu (HInd) lub zasady (IndOH),
zgodnie z teori Brönsteda-Lowry’ego wyra aj równania:
OH
Ind
IndOH
Ind
H
HInd
Zgodnie z prawem dzia ania mas, dla wska nika HInd
]
[
]
][
[
HInd
Ind
H
K
HInd
K
HInd
– sta a równowagi
Równowag ww. reakcji mo na przesuwa poprzez zmian st enia jonów wodorowych lub
wodorotlenowych i obserwacj zmiany barwy. Mechanizm zmiany barwy bywa ró ny dla
ró nych wska ników. Zmieniaj one barw na skutek:
a) przy czania jonów hydroniowych (H
3
O
+
) lub hydroksylowych (OH
-
)
b) przechodzenia w form jonow przy ci le okre lonym pH rodowiska
c) zmian konformacyjnych wywo anych przez zmian pH,
Przyk ady wska ników pH:
Wska nik
Zakres
zmiany barwy
Stosowany roztwór
0,1–2,3
0,1–2,7
1,2–2,8
wodny 0,05%
2,9–4,0
etanolowy 0,1%
3,1–4,4
wodny 0,1%
4,2–6,3
etanolowy 0,1%
4,5–8,3
czerwie bromokrezolowa 5,2–6,8
wodny 0,05%
6,2–7,6
wodny 0,05%
6,4–8,0
wodny 0,05%
7,2–8,8
wodny 0,1%
8,3–10,0
etanolowy 0,5%
20

10,0–12,0
etanolowy 0,1%
5. Bufory i mechanizm dzia ania, pojemno buforowa
Bufory s to roztwory, których warto pH po dodaniu niewielkich ilo ci mocnych kwasów
albo zasad, jak i po rozcie czeniu wod zmienia si tylko nieznacznie. Najcz ciej rol
buforów spe niaj mieszaniny s abych kwasów i ich soli z mocn zasad , s abych zasad i ich
soli z mocnym kwasem lub dwóch soli wieloprotonowych.
Przyk ady roztworów buforowych
- bufor octanowy: CH
3
COOH, CH
3
COONa; pH = 3,5 – 6,0
- bufor amonowy: NH
3
H
2
O, NH
4
Cl; pH = 8,0 – 11,0
- bufor fosforanowy: KH
2
PO
4
, K
2
HPO
4
; pH = 5,5 – 8,0
- bufor boranowy: H
3
BO
3
, Na
2
B
4
O
7
; pH = 7,0 – 9,0
5.1. Mechanizm dzia ania buforów
Dzia anie buforuj ce polega na wi zaniu przez jego sk adniki wprowadzanych jonów H
3
O
+
lub OH
-
W przypadku buforu octanowego kwas octowy pe ni rol donora protonów i wi
c
jony OH
-
powoduje, e pH praktycznie nie ulega zmianie podczas dodawania zasady.
O
H
COO
CH
OH
COOH
CH
2
3
3
Jon octanowy b d cy wed ug teorii Brönsteda zasad , jest akceptorem protonów i po
wprowadzeniu mocnego kwasu wi e jony H
3
O
+
, tworz c s abo zdysocjowany kwas octowy
O
H
COOH
CH
O
H
COO
CH
2
3
3
3
5.2. Pojemno buforowa
Pojemno buforowa jest to zdolno buforowa, wyra ona liczb moli mocnego kwasu lub
zasady, która wprowadzona do 1 dm
3
roztworu buforowego zmienia pH o jednostk .
Pojemno buforowa jest wprost proporcjonalna do st enia roztworu buforowego. W miar
21

zwi kszania ilo ci dodawanego kwasu lub zasady, pojemno buforowa zmniejsza si i staje
si równa zeru, gdy ca a zawarta w buforze sól zamieni si w s aby kwas, lub te ca y s aby
kwas zostanie przeprowadzony w sól. Najwi ksz pojemno buforow maj roztwory, w
których stosunek st e formy zdysocjowanej i niezdysocjowanej sk adników buforu jest
równy 1.
Pojemno buforowa wyra a si wzorem:
pH
BOH
pH
HA
lub
gdzie:
HA – ilo moli wprowadzonego mocnego kwasu
BOH- ilo moli mocnej zasady
pH – zmiana pH
Bufory odgrywaj wa n rol w chemii analitycznej, medycynie i farmacji. Wykorzystuje si
np. podczas wytr cania osadów w celu zapobiegania wytr caniu sk adników niepo danych,
przy przeprowadzaniu niektórych reakcji analitycznych. Bardzo wa n rol biologiczn pe ni
bufor w glanowy odpowiedzialny za utrzymanie pH krwi w granicach fizjologicznych 7,35-
7,45.
22

Cz
praktyczna
Celem wiczenia jest praktyczne zapoznanie si z hydroliz soli i sposobami oznaczania pH
roztworów, badanie wp ywu dodatku kwasu solnego oraz wodorotlenku sodu na pH roztworu
buforowego, przygotowanie roztworu buforu octanowego i pomiar pH
Sprz t i odczynniki
Probówki, bagietka, cylinder miarowy o poj. 10 cm
3
, a nia wodna, pehametr, biureta o poj.
25 cm
3
, zlewka o poj. 100 cm
3
, roztwory soli o st .1 mol/dm
3
: NaCl, CH
3
COONa, NH
4
Cl,
CH
3
COONH
4
, MgCl
2
, Na
2
CO
3
oraz roztwory soli Na
2
HPO
4
i NaH
2
PO
4
o st . 0,1 mol/dm
3
,
CH
3
COONa in substantia, uniwersalne papierki wska nikowe, roztwór fenoloftaleiny,
roztwór wzorcowy buforu o znanej warto ci pH, 0,1 mol/dm
3
HCl, 0,2 mol/cm
3
CH
3
COOH,
0,2 mol/dm
3
CH
3
COONa
1. Metody oznaczania pH roztworów
Sposób wykonania
Odmierzy kolejno po 5 cm
3
roztworu ka dej z podanych soli i wla do probówek. Dwie
krople roztworu z ka dej probówki przenie na uniwersalny papierek wska nikowy i okre li
warto pH. Wykalibrowa pH-metr stosuj c wzorcowy roztwór buforowy. Nast pnie
wyznaczy odczyn przygotowanych roztworów soli z wykorzystaniem pHmetru.
Wyniki do wiadczenia przedstawi w tabeli.
pH wyznaczone metod
Lp.
Roztwór soli
wska nikow pHmetryczn
1.
2.
3.
4.
1 mol/dm
3
NaCl
1 mol/dm
3
CH
3
COONa
1 mol/dm
3
NH
4
Cl
1 mol/dm
3
CH
3
COONH
4
23

5.
6.
7.
8.
1 mol/dm
3
MgCl
2
1 mol/dm
3
Na
2
CO
3
0,1 mol/dm
3
Na
2
HPO
4
0,1 mol/dm
3
NaH
2
PO
4
2. Wp yw temperatury na stopie hydrolizy
Sposób wykonania
Do probówki wsypa ok. 1 g (1/2 y eczki) octanu sodu, doda 5 cm
3
wody destylowanej, 2
krople fenoloftaleiny i okre li pH papierkiem uniwersalnym. Nast pnie tak przygotowany
roztwór, ogrzewa 10 min na a ni wodnej i obserwowa zmian zabarwienia wska nika w
roztworze. Zanotowa obserwacje, poda wyniki i wnioski.
3. Wp yw rozcie czenia roztworu na stopie hydrolizy
Sposób wykonania
Do dwóch probówek odmierzy odpowiednio po 1 i 2 cm
3
roztworu octanu sodu o st eniu 1
mol/dm
3
i uzupe ni wod destylowan do 10 cm
3
. Zmierzy pH otrzymanych roztworów
pehametrem. Zanotowa wyniki, poda wnioski.
4. Wp yw kwasu solnego na warto pH roztworu buforowego
Sposób wykonania
Do zlewki odmierzy pipet dok adnie 10,0 cm
3
roztworu buforowego o znanej warto ci pH.
Do odmierzonego roztworu buforowego, dodawa stopniowo za pomoc biurety 6 cm
3
kwasu
solnego o st eniu 0,1 mol/dm
3
, odmierzaj c ka dorazowo porcje po 0,5 cm
3
kwasu. Po
ka dorazowym dodaniu porcji kwasu solnego, roztwór dobrze wymiesza i okre li odczyn
roztworu pehametrem.
Obliczy pojemno buforow . Wyniki zanotowa w tabeli.
24

Obj to kwasu
V
HCl
[cm
3
]
pH
roztworu
buforowego
pH
k
n
pH
n
k
0,5
1,0
1,5
2.0
2,5
3,0
3,5
4,0
4,5
5,0
5,5
6,0
- pojemno buforowa
n
k
– liczba moli mocnego kwasu dodana do 1 cm
3
roztworu buforowego
pH- zmiana pH roztworu buforowego
5. Wp yw wodorotlenku sodu na warto pH roztworu buforowego
Sposób wykonania
Do zlewki odmierzy pipet dok adnie 10,0 cm
3
roztworu buforowego o znanej warto ci pH.
Do odmierzonego roztworu buforowego, dodawa stopniowo za pomoc biurety 12 cm
3
wodorotlenku sodu o st eniu 0,1 mol/dm
3
, odmierzaj c ka dorazowo porcje po 0,5 cm
3
zasady. Po ka dorazowym dodaniu porcji zasady, roztwór dobrze wymiesza i okre li
odczyn roztworu pehametrem.
Obliczy pojemno buforow . Wyniki zanotowa w tabeli.
Obj to zasady
V
NaOH
[cm
3
]
pH
roztworu
buforowego
pH
k
n
pH
n
k
25
0,5
1,0
1,5
2.0
2,5
3,0
3,5
4,0
4,5
5,0
5,5
6,0
6,5
7,0
7,5
8,0
8,5
9,0
9,5
10
10,5
11
11,5
12
- pojemno buforowa
nz – liczba moli mocnej zasady dodana do 1 cm
3
roztworu buforowego
pH- zmiana pH roztworu buforowego
26

6. Przygotowanie roztworu buforu octanowego i pomiar pH
Sposób wykonania
Przygotowa serie roztworów buforowych, odmierzaj c z biurety do ponumerowanych
probówek roztwory:
a) kwasu octowego i octanu sodu, w ilo ciach podanych w tabeli 1.
Zmierzy pH przygotowanych roztworów buforowych przy u yciu pehametru. Wyniki
zanotowa w tabeli
Tabela 1.
probówka nr
1
2
3
4
5
6
7
cm
3
CH
3
COOH 0,2 mol/cm
3
9,4
8,2
5,6
3,0
2,0
1,2
1,0
CH
3
COONa 0,2 mol/cm
3
0,6
1,8
4,4
7,0
8,0
8,8
9,0
pH obliczone
3,5
4,0
4,5
5,0
5,2
5,5
5,6
pH zmierzone
27

IV. REAKCJE UTLENIANIA I REDUKCJI
Obowi zuj ce zagadnienia
Definicja utleniania i redukcji (elektronacji i dezelektronacji). Regu y obliczania stopni
utlenienia. Poj cie reakcji dysproporcjonowania i synproporcjonowania, przyk ady. Podstawy
doboru wspó czynników w równaniach typu redoks. Definicja potencja u redoks. Poj cie
amoferów redoks, przyk ady.
1. Reakcje utlenienia i redukcji, utleniacz, reduktor
Reakcje utleniania i redukcji (dezelektronacji i elektronacji) s to reakcje, w których nast puje
wymiana elektronów pomi dzy sprz onymi reakcjami redukcji i utlenienia.
Redukcja
(elektronacja) - jest zwi zana z przyjmowaniem elektronów i prowadzi do
obni enia stopnia utlenienia.
Utlenianie
(dezelektronacja) – jest to proces oddawania elektronów wi e si wi c ze
zwi kszeniem stopnia utlenienia
Rol utleniaczy mog spe nia atomy, jony lub cz steczki, które s akceptorami elektronów,
s to elektronobiorcy np.
- niemetale np. Cl
2
, Br
2
I
2
,
- kationy metali na wy szym stopniu utlenienia np. Fe(III)
- jony wodorowe H
+
- aniony z o one zawieraj ce pierwiastek kwasotwórczy na wy szym stopniu utlenienia np.
MnO
4
-
, Cr
2
O
7
2-
- kwasy silnie utleniaj ce np. HNO
3
, H
2
SO
4
Reduktory s to atomy, jony lub cz steczki, które s donorami elektronów, s to
elektronodawcy np.
- kationy metali na ni szym stopniu utlenienia np. Fe(II)
- aniony proste I
-
, Br
-
, Cl
-
- wodór H
2
, a tak e jony wodorkowe H
1-
- w giel oraz CO
- aniony zawieraj ce pierwiastek kwasotwórczy na ni szym stopniu utlenienia np. NO
2
-
, SO
3
2-
28

- aniony niektórych kwasów organicznych np. HCOO
-
, C
2
O
4
2-
2. Stopnie utlenienia, regu y okre lania stopni utlenienia
Stopie utlenienia (liczba utlenienia) – oznacza liczb ujemnych lub dodatnich adunków
elementarnych, które nale a oby przypisa danemu atomowi gdyby cz steczki, w którym ten
atom wyst puje mia y budow jonow .
Regu y okre lania stopni utlenienia:
- stopie utlenienia pierwiastka w stanie wolnym jest równy 0, niezale nie od postaci w
której wyst puje np. Na, H
2
, O
3
,P
4
, S
8
- stopie utlenienia pierwiastka w postaci prostego jonu, równa si jego adunkowi
- tlen w zwi zkach z innymi pierwiastkami ma stopie utlenienia (-II), wyj tek stanowi
fluorek tlenu OF
2
gdzie stopie utleniania wynosi (II), nadtlenki H
2
O
2
, Na
2
O
2
, gdzie
stopie utlenienia wynosi (-I), oraz ponadtlenki np. KO
2
gdzie stopie utlenienia wynosi
1\2
- wodór najcz ciej wyst puje na (I) stopniu utlenienia, wyj tek stanowi wodorki metali, w
których stopie utlenienia wodoru wynosi (-I)
- suma stopni utlenienia we wszystkich cz steczkach elektrycznie oboj tnych jest równa
zeru
- suma stopni utlenienia w jonach jest równa adunkowi jonu
3. Reakcje dysproporcjonowania i synproporcjonowania
Reakcje dysproporcjonowania - s to reakcje, w których ten sam pierwiastek wyst puj cy w
danym zwi zku lub jonie na po rednim stopniu utlenienia, w wyniku reakcji cz ciowo ulega
utlenieniu, cz ciowo redukcji.
Przyk ad 1.
3
2
3
HClO
HCl
HClO
I
I
V
I
Cl
e
Cl
e
Cl
Cl
2
4
29

Przyk ad 2.
O
H
NO
HNO
HNO
2
3
2
2
3
II
III
V
III
N
e
N
e
N
N
2
Reakcje synproporcjonowania – zachodz wtedy, gdy atomy tego samego pierwiastka z
dwóch ró nych stopni utlenienia, w wyniku reakcji tworz substancje, w których wyst puj
na jednym, wspólnym.
Przyk ad 1.
CO
C
CO
2
2
II
IV
II
C
e
C
e
C
C
2
2
0
Przyk ad 2.
O
H
Cl
HCl
HClO
2
2
3
3
3
5
0
0
5
Cl
e
Cl
e
Cl
Cl
V
I
4. Jonowy zapis reakcji, dobór wspó czynników w równaniach erdoks
Wspó czynniki stechiometryczne w równaniach redoks mo na dobiera dwoma metodami:
- metoda uwzgl dniania stopni utlenienia, która mo e by stosowana do ka dej reakcji
zarówno w zapisie cz steczkowym jak i jonowym. W przypadku jonowego zapisu reakcji
oprócz bilansu atomów nale y uwzgl dni bilans adunków po obu stronach reakcji.
- metoda reakcji po ówkowych, która mo e by stosowana do doboru wspó czynników
jedynie w przypadku jonowego zapisu reakcji redoks. W metodzie tej ustala si jony które s
utleniaczami i reduktorami, uwzgl dnia rodowisko reakcji oraz jony b d ce produktami
reakcji.
Przyk ady jonowego zapisu reakcji redoks
Przyk ad 1
A. Wskazanie w równaniu po ówkowym atomów, które w wyniku reakcji zmieni y stopie
utlenienia
0
2
2
4
S
Mn
S
MnO
e
S
S
II
2
0
II
VII
Mn
e
Mn
5
30

B. Uwzgl dnienie udzia u pozosta ych atomów bior cych udzia w reakcji, zgodnie z prawem
zachowania masy i adunku, uzupe niaj c rozliczenie cz steczkami wody, jonami H
+
lub OH
-
w zale no ci od tego czy reakcja przebiega w rodowisku kwasowym, zasadowym czy
oboj tnym
O
H
Mn
MnO
H
2
2
4
4
8
C. Wyrównanie liczby dodanych i przyj tych elektronów
x5
e
S
S
2
0
2
x2
O
H
Mn
e
H
MnO
2
2
4
4
5
8
D. Dodanie reakcji po ówkowych stronami
H
O
H
e
S
Mn
e
S
MnO
2
0
2
2
4
8
5
2
5
2
16
10
10
O
H
S
Mn
S
MnO
H
2
0
2
2
4
8
5
2
5
2
16
Przyk ad 2.
3
2
2
4
Fe
Mn
Fe
MnO
e
Fe
Fe
III
II
II
VII
Mn
e
Mn
5
O
H
Mn
MnO
H
2
2
4
4
8
x5
e
Fe
Fe
3
2
O
H
Mn
e
MnO
H
2
2
4
4
5
8
x1
O
H
Fe
Mn
Fe
MnO
H
2
3
2
2
4
4
5
5
8
O
H
e
Fe
Mn
e
Fe
MnO
H
2
3
2
2
4
4
5
5
5
5
8
5. Potencja redoks
Zale no potencja u redoks dla okre lonego uk adu podaje wzór Nernsta:
]
[
]
[
ln
red
oks
nF
RT
E
E
gdzie:
E
0
- standardowy potencja redoks, mierzony wzgl dem standardowego pó ogniwa
wodorowego, w roztworze, w którym stosunek st enia (aktywno ci) formy utlenionej do
zredukowanej wynosi 1
R – sta a gazowa
31

T – temperatura [K]
n – liczba elektronów bior cych udzia w reakcji
F – sta a Faradaya
[oks][red] - st enia odpowiednio utlenionej i zredukowanej postaci zwi zku
W miar przebiegu reakcji zmienia si stosunek st e formy utlenionej do zredukowanej,
zmienia si tak e warto potencja u Istnieje tak e mo liwo zmiany potencja u gdy np.
jedn z form utlenion lub zredukowan , zwi e si w trwa y kompleks lub trudno
rozpuszczaln sól.
Warto potencja u pó ogniw metalicznych zale y od rodzaju metalu, st enia jego jonów w
roztworze i temperatury.
6. Amfotery redoks
Amfotery redoks to substancje, które wobec silnego utleniacza mog wyst powa w
charakterze reduktora, natomiast wobec odpowiednio silnego reduktora zachowywa si jak
utleniacz. S to jony lub cz steczki zawieraj ce atomy pierwiastka na po rednim stopniu
utlenienia.
Przyk ad 1.
Jony NO
2
-
w rodowisku kwasowym wykazuj w a ciwo ci redukuj ce wobec MnO
4
-
O
H
NO
Mn
H
NO
MnO
2
3
2
2
4
3
5
2
6
5
2
e
N
N
Mn
e
Mn
II
III
II
VII
5
Przyk ad 2.
Jony NO
2
-
w rodowisku kwasowym wykazuj w a ciwo ci redukuj ce wzgl dem jonów Fe
2+
.
O
H
Fe
NO
H
Fe
NO
2
3
2
2
2
e
Fe
Fe
N
e
N
III
II
II
III
32

Cz
praktyczna
Celem wiczenia jest wykazanie wp ywu rodowiska na przebieg procesu redukcji KMnO
4
,
ocena w a ciwo ci redukuj cych jonów prostych, obserwacja reakcji przemiany jonów
chromianowych(VI) w jony dichromianowe(VI), analiza reakcji potwierdzaj cych
w a ciwo ci utleniaj ce oraz redukuj ce jonów NO
2
-
Sprz t i odczynniki
Statyw do probówek, probówki, roztwory: 0,1 mol/dm
3
KMnO
4
, 1,5 mol/ dm
3
H
2
SO
4
,
6 mol/ dm
3
NaOH, 1,5 mol/ dm
3
Na
2
S
2
O
3
, 6 mol/dm
3
CH
3
COOH, 2 mol/dm
3
CH
3
COONa,
0,5 mol/dm
3
KI, CHCl
3
, 0,5 mol/dm
3
K
2
Cr
2
O
7
, 0,5 mol/dm
3
K
2
CrO
4
, 1,5 mol/ dm
3
H
2
SO
4
, 2
mol/ dm
3
NaOH, 1,5 mol/ dm
3
HNO
2
1. Wp yw rodowiska na przebieg reakcji redoks
Sposób wykonania
Do 3 probówek doda ok. 1 cm
3
0,1 mol/dm
3
roztworu KMnO
4
, nast pnie do jednej doda ok.
1 cm
3
1,5 mol/dm
3
H
2
SO
4
, do drugiej ok. 1 cm
3
6 mol/dm
3
NaOH, a do trzeciej ok. 1 cm
3
wody destylowanej i wymiesza .
Nast pnie do wszystkich prób doda ok. 1 cm
3
roztworu 1,5 mol/ dm
3
Na
2
S
2
O
3
i
zaobserwowa zmiany barwy.
Napisa równania wykonywanych reakcji. Zanotowa wnioski.
2. Jony proste jako reduktory
Sposób wykonania
Do probówki doda ok. 3 krople wody destylowanej, ok. 3 krople 6 mol/dm
3
CH
3
COOH, ok.
3 krople 2 mol/dm
3
CH
3
COONa, 1 kropl 0,5 mol/cm
3
KI oraz ok. 4-5 kropli CHCl
3
.
Wymiesza przez 10 sekund, zaobserwowa zmiany zabarwienia warstwy organicznej.
Napisa równanie wykonanej reakcji. Zanotowa wyniki poda wnioski.
3. Przekszta cenie jonów chromianowych(VI) w jony dichromianowe(VI)
33

Sposób wykonania
Do ok. 1 cm
3
0,5 mol/cm
3
roztworu K
2
CrO
4
, doda ok. 1 cm
3
1,5 mol/dm
3
H
2
SO
4
.
Zaobserwowa zmian zabarwienia. Do ok. 1 cm
3
0,5 mol/dm
3
K
2
Cr
2
O
7
doda ok. 1 cm
3
2
mol/dm
3
NaOH. Zaobserwowa zmiany zabarwienia. Napisa równania reakcji. Wyja ni
zachodz ce procesy.
4
.W a ciwo ci utleniaj co/redukuj ce jonów NO
2
-
Sposób wykonania
Do jednej z probówek wla ok. 1 cm
3
0,1 mol/ dm
3
KMnO
4
, doda ok. 1 cm
3
1,5 mol/dm
3
H
2
SO
4
, a nast pnie ok. 1 cm
3
1,5 mol/dm
3
HNO
2
. Zaobserwowa zmiany zabarwienia.
Napisa równanie reakcji oraz poda wnioski.
Do drugiej probówki wla ok. 1 cm
3
1,5 mol/dm
3
HNO
2
, doda ok. 1 cm
3
1,5 mol/dm
3
H
2
SO
4
,
a nast pnie ok. 1 cm
3
0,5 mol/cm
3
KI. Zaobserwowa zmiany. Napisa równanie reakcji oraz
poda wnioski.
34

V. ROZTWORY KOLOIDALNE
Obowi zuj ce zagadnienia
Definicja roztworów koloidalnych oraz ich w a ciwo ci. Podzia koloidów. Budowa miceli
hydrofobowych. Ró nice pomi dzy roztworami w a ciwymi i koloidalnymi. Czynniki
fizyczne i chemiczne wp ywaj ce na w a ciwo ci roztworów koloidalnych. Definicja
koagulacji.
1. Definicja koloidów
Koloidy s to uk ady o du ym stopniu rozdrobnienia. S stanem po rednim pomi dzy
roztworami rzeczywistymi, które s uk adami fizycznie jednorodnymi o rozdrobnieniu
cz steczkowym, a zawiesinami i mieszaninami niejednorodnymi. Poj cie koloidu do chemii
po raz pierwszy wprowadzi Graham, dla okre lenia substancji o w a ciwo ciach zbli onych
do kleju. Do koloidów nale zarówno:
- uk ady fizycznie jednorodne
- roztwory substancji wielkocz steczkowych
- uk ady fizycznie niejednorodne o du ym stopniu rozdrobnienia
- koloidy fazowe.
Ze wzgl du na dyspersyjno wyró nia si :
- monodyspersyjne, w których cz stki fazy rozproszonej maj jednakow wielko
- polidyspersyjne, w których cz stki maj ró ne wymiary.
W roztworach koloidowych, cz stki substancji zawieszonej maj wielko ci w zakresie 10
-9
–
10
-7
m (1-100 nm).
2. Podzia koloidów
W zale no ci od powinowactwa do rozpuszczalnika, wyró nia si :
- koloidy liofilowe (hydrofilowe) - wykazuj du e powinowactwo do rozpuszczalnika,
dzi ki czemu cz stki koloidalne otaczaj si cz steczkami rozpuszczalnika, co nadaje im
trwa o .
- koloidy liofobowe (hydrofobowe) posiadaj ma e powinowactwo do rozpuszczalnika.
Trwa o zapewnia im adunek elektryczny wynikaj cy z adsorpcji jonów z roztworu.
35
W zale no ci od stanu skupienia o rodka rozpraszaj cego i fazy rozproszonej (wg Ostwalda)
koloidy dzieli si na:
O rodek
dyspersyjny
Faza
rozproszona
Przyk ady
gaz
brak
ciecz
mg a, chmury, kondensuj ce pary
Gaz
cia o sta e
kurz, dym, cz stki w gla w p omieniu
gaz
piana mydlana, p cherzyki gazów w cieczy
ciecz
mleko, bia ka, emulsja t uszczów w wodzie
Ciecz
cia o sta e
zole (siarczków, wodorotlenków metali,
kleje krochmal)
gaz
pumeks, okluzje gazowe w minera ach
ciecz
kwarc mleczny
Cia o sta e
cia o sta e
szk o rubinowe, per y fosforowe
3. Budowa miceli koloidów hydrofobowych
Ka da cz stka koloidu hydrofobowego jest otoczona w pewnej odleg o ci warstw jonów
przeciwnego znaku, tzw. przeciwjonów. Taka cz stka wraz z jonami zaadsorbowanymi i
otaczaj cymi j przeciwjonami warstwy dyfuzyjnej oraz odpowiedni liczb cz stek
rozpuszczalnika nosi nazw miceli. Micela sk ada si z j dra, w sk ad którego wchodz
oboj tne cz steczki koloidu. Na powierzchni j dra najcz ciej adsorbowane s z roztworu
jony, które wchodz w sk ad j dra i znajduj ce si aktualnie w nadmiarze. Warstwa ta nosi
nazw warstwy adsorpcyjnej i wi e si ona lu no z warstw dyfuzyjn . J dro razem z
warstw adsorpcyjn nosi nazw granuli.
Schemat budowy miceli na przyk adzie zolu Fe(OH)
3
otrzymanego w wyniku hydrolizy
FeCl
3.
36
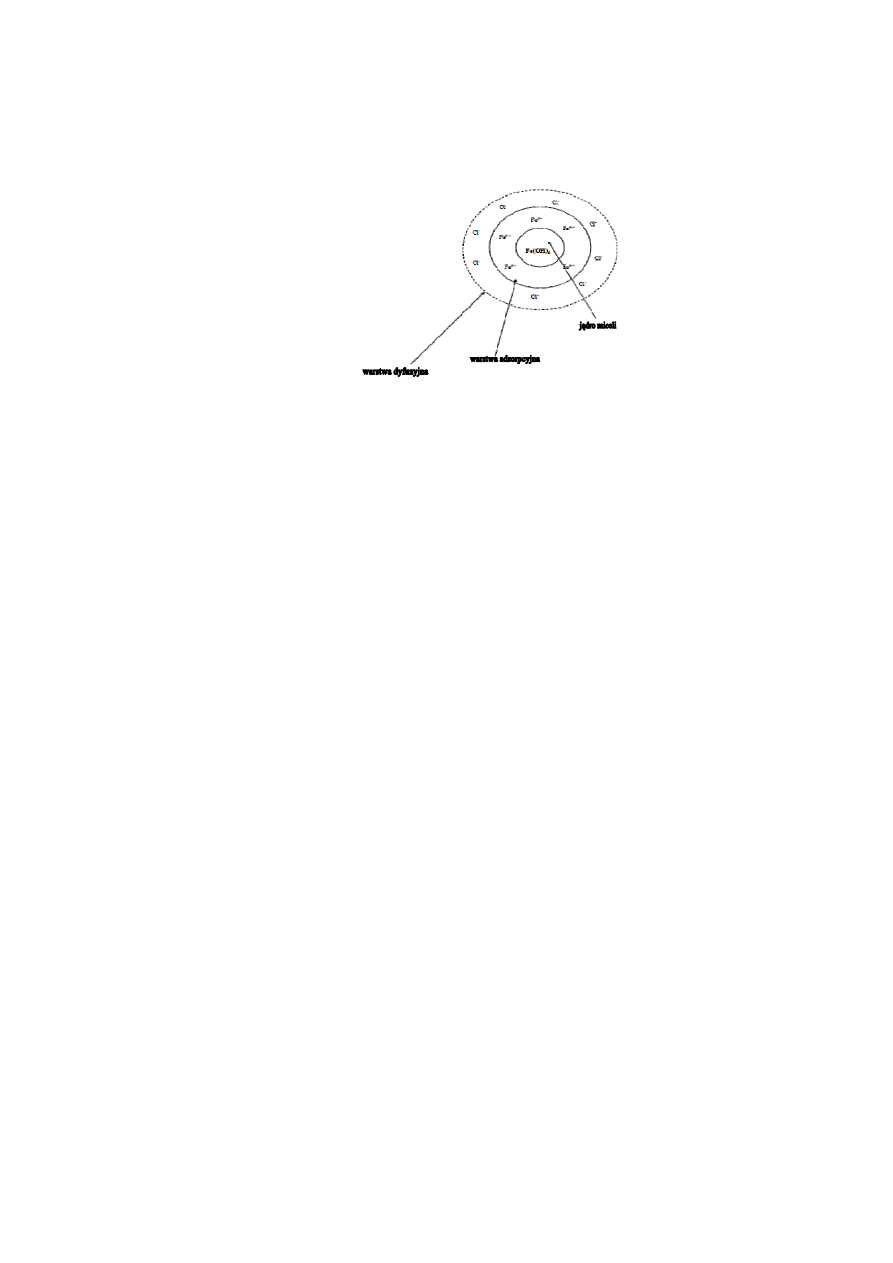
Na powierzchni j dra Fe(OH)
3
adsorbowane s z roztworu wspólne jony, w tym przypadku
jony elaza Fe
3+
.Warstwa ta nosi nazw warstwy adsorpcyjnej i wi e si ona lu no z
warstw dyfuzyjn zawieraj c jony Cl
-
4. W a ciwo ci optyczne, mechaniczne i elektryczne uk adów koloidalnych
a) Efekt Tyndalla - zjawisko fizyczne polegaj ce na rozpraszaniu wi zki wiat a
przechodz cej przez uk ad koloidalny, na cz stkach jego fazy rozproszonej z
wytworzeniem charakterystycznego sto ka wietlnego (smugi wietlnej). Intensywno
tego zjawiska jest tym wi ksza, im wi ksza jest ró nica mi dzy wspó czynnikiem
za amania fazy rozproszonej i o rodka rozpraszaj cego.
b) Ruchy Browna – nieustanne, chaotyczne ruchy (post powe, obrotowe i drgaj ce) cz stek
fazy rozproszonej w ciek ym lub gazowym o rodku dyspersyjnym.
c) adunek elektryczny koloidów liofobowych wynika z adsorpcji jonów z fazy
rozpraszaj cej, a adunek elektryczny koloidów liofilowych wynika z ich dysocjacji
elektrolitycznej.
Koagulacja to proces degradacji koloidów, polegaj cy na czeniu si ma ych cz stek zolu w
wi ksze skupiska – agregaty (koagulat, el).W przypadku koloidów liofobowych jest
wynikiem eliminacji adunku elektrycznego cz stek koloidalnych, a w przypadku koloidów
liofilowych jest wynikiem eliminacji otoczek solwatacyjnych. Rosn ce agregaty mog ulega
sedymentacji, a do ca kowitego rozdzielenia si fazy rozproszonej i o rodka dyspersyjnego.
Proces koagulacji mo e ujawnia si m.in. zm tnieniem, wydzieleniem osadu lub zmian
barwy. Koagulacj mo na wywo a nast puj cymi czynnikami:
- dodatkiem elektrolitu
- zmian temperatury
- dodatkiem nieelektrolitu (odwadniaj cego)
- przep ywem pr du
- dzia aniem wiat a
37

Najwi kszy wp yw na koagulacje wywiera dodanie elektrolitu. W takim przypadku st enie
jonów w roztworze znacznie si zwi ksza; wzrasta równie st enie przeciwjonów warstwy
dyfuzyjnej, które zbli aj c si do cz stek koloidowych, powoduj zoboj tnienie ich adunku.
Przy koagulacji koloidów liofobowych roztworami elektrolitów, obserwuje si nast puj ce
zale no ci:
- koagulacja pod wp ywem elektrolitów nast puje wówczas gdy st enie elektrolitu
przekroczy pewn warto , zwan progiem koagulacji. Najmniejsze st enie elektrolitu
niezb dne do skoagulowania koloidu nazywane jest st eniem koagulacyjnym
- koagulacj koloidu którego adunek elektryczny jest dodatni powoduj aniony, a koloidu,
posiadaj cego adunek ujemny powoduj kationy
- zdolno koagulacyjna ro nie wraz z warto ciowo ci jonu koaguluj cego. Najwi ksz
zdolno koagulacyjn wykazuj jony III warto ciowe, a najmniejsz I warto ciowe
Ilo elektrolitu u ytego do koagulacji nie powinna by zbyt wielka, poniewa mo e wtedy
nast pi nie tylko zoboj tnienie adunków cz stek koloidalnych, ale dalsza adsorpcja jonów
na powierzchni koagulatu, powoduj ca oddzielanie si cz stek zolu, które uzyskuj c
jednoimienny adunek elektryczny wzajemnie si odpychaj . Wskutek procesu odpychania
zachodzi proces odwrotny do procesu koagulacji, a mianowicie peptyzacja koagulatu
el
zol
peptyzacja
acja
koagu;
38

Cz
praktyczna
1. Otrzymywanie roztworu koloidalnego Fe(OH)
3
Sposób wykonania
Celem wiczenia jest praktyczne zapoznanie si z w a ciwo ciami fizykochemicznymi
koloidów.
Sprz t i odczynniki
Probówki, bagietka, zlewka o poj. 250 cm
3
zakraplacz, cylinder miarowy o poj. 10 cm
3
,
a nia wodna, zestaw do s czenia, mi kkie s czki, roztwory: 0,1 mol/dm
3
FeCl
3
, 0,5
mol/dm
3
NaCl, 0,5 mol/dm
3
Na
2
SO
4
, nasycony roztwór NaCl, skrobia, elatyna, aceton
Do zlewki odmierzy 25 cm
3
roztworu FeCl
3
, doda 5 cm
3
wody destylowanej i ogrzewa
do wrzenia. Obserwowa zmiany barwy w ogrzewanym roztworze.
2. Koagulacja roztworów koloidalnych
Sposób wykonania
Trzy probówki nape ni do po owy obj to ci zolem Fe(OH)
3
otrzymanym wed ug pkt. 1.
Do pierwszej probówki doda 1 - 2 krople 0,5 mol/dm
3
roztworu NaCl, do drugiej tak
sam obj to 0,5 mol/dm
3
roztworu Na
2
SO
4
, do trzeciej probówki doda 1-2 krople
nasyconego roztworu NaCl.
Wyja ni i zwi le opisa zachodz ce procesy.
3. S czenie roztworów koloidalnych
Sposób wykonania
Porówna zdolno filtracyjn roztworu koloidalnego Fe(OH)
3
przed koagulacj i po
koagulacji obserwuj c proces s czenia otrzymanych uk adów koloidalnych przez ró nego
rodzaju s czki.
4. Otrzymanie koloidów hydrofilowych (roztworu skrobi i elatyny)
39

Sposób wykonania
a. Do zlewki odwa y 0,5 g skrobi i doda 10 cm
3
wody destylowanej o temperaturze
50 °C, wymiesza bagietk i pozostawi 2-3 minuty do sp cznienia. Nast pnie doda
ponownie 15 cm
3
wody destylowanej i mieszaj c ogrzewa do ca kowitego
rozpuszczenia skrobi.
b. Do zlewki odwa y 0,5 g elatyny i doda 10 cm
3
wody destylowanej o
temperaturze 50 °C, wymiesza bagietk i pozostawi 2-3 minuty do
sp cznienia. Nast pnie doda ponownie 15 cm
3
wody destylowanej i mieszaj c
ogrzewa do ca kowitego rozpuszczenia elatyny .
5. Badanie koagulacji koloidów hydrofilowych
Sposób wykonania
Przygotowa dwie probówki, do jednej doda ok. 2 cm
3
roztworu skrobi a do drugiej
ok. 2 cm
3
roztworu elatyny. Nast pnie do ka dej probówki, ci gle mieszaj c dodawa
stopniowo kroplami aceton. Zanotowa zmiany zachodz ce w probówkach podczas
dodawania acetonu.
6. Badanie wzajemnego oddzia ywania koloidów hydrofilowych i hydrofobowych
Sposób wykonania
a. przygotowa dwie probówki i do ka dej doda 10 cm
3
zolu Fe(OH)
3
b. do jednej z probówek doda ok. 1 cm
3
wody destylowanej a do drugiej 1 cm
3
roztworu skrobi
c. do obu probówek doda po 2 cm
3
nasyconego roztworu NaCl i dok adnie
wymiesza . Porówna zawarto obu probówek po 10-15 minutach.
7. Badanie w a ciwo ci optycznych roztworów koloidalnych
40

Sposób wykonania
Przygotowa dwie zlewki i do jednej doda ok. 20 cm
3
roztworu skrobi a do drugiej ok.
20 cm
3
roztworu 0,5 mol/dm
3
NaCl. Zanotowa ró nic w wygl dzie wi zki wiat a
przechodz cej przez roztwór w a ciwy (NaCl ) i koloidalny (skrobia).
VI. ZWI ZKI KOMPLEKSOWE
41
Obowi zuj ce zagadnienia
Definicja kompleksów i ich budowa. Ró nice mi dzy zwi zkiem kompleksowym a
chelatowym. Poj cie liczby koordynacyjnej. Nomenklatura zwi zków kompleksowych.
Trwa o zwi zków kompleksowych. Definicje akwakompleksów i aminakompleksów.
1. Kompleksy i ich budowa
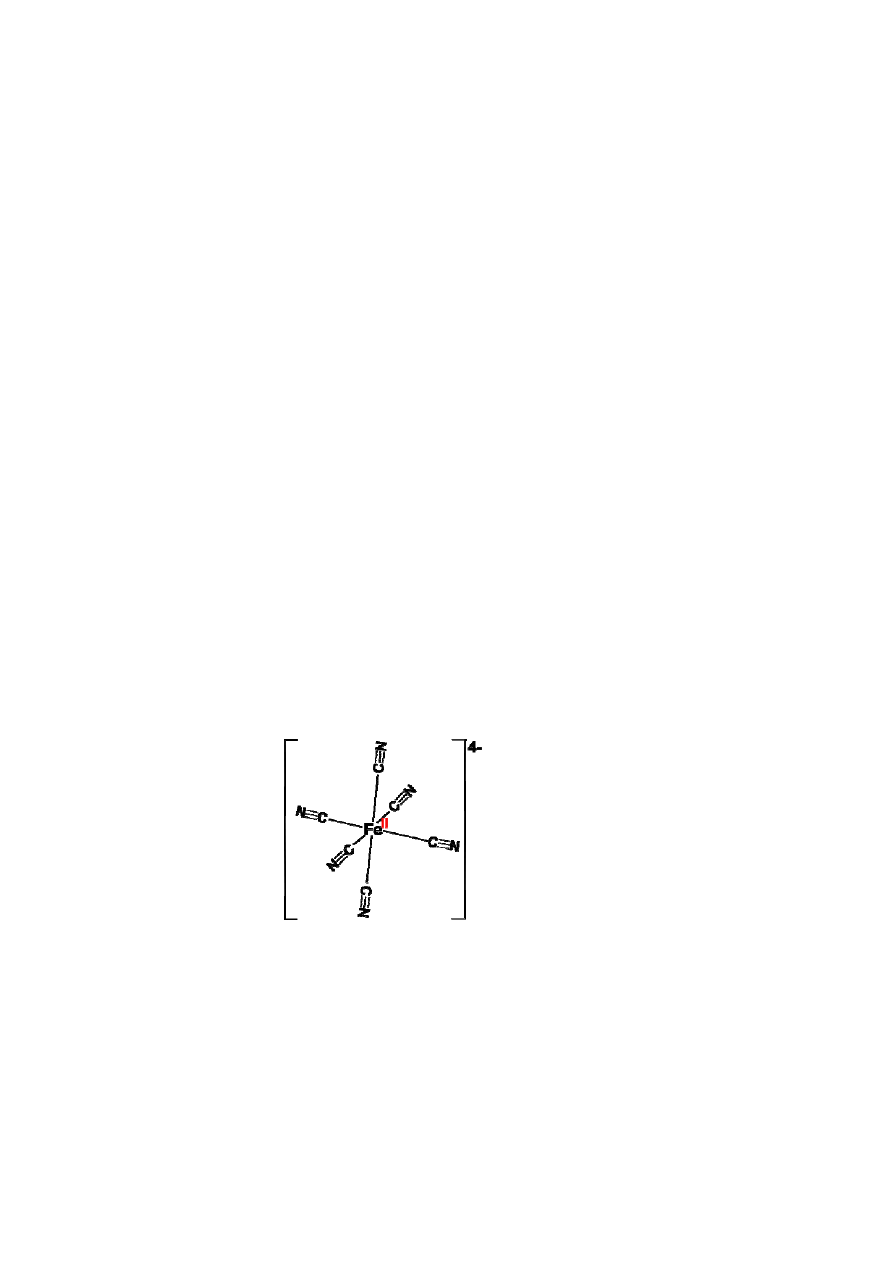
Zwi zkiem kompleksowym okre la si zwi zek, w sk ad którego wchodz jony
kompleksowe lub który jest cz steczk kompleksow . W jonie kompleksowym jeden z
atomów, przewa nie metal, w stosunku do pozosta ych zajmuje po o enie centralne i
wykazuje zdolno „koordynowania”, tzn. przy czania cz steczek lub jonów zwanych
ligandami za pomoc wolnych par elektronowych. Ligandy dysponuj ce wolnymi parami
elektronowymi cz si z kationem centralnym poprzez wi zania koordynacyjne. Liczba
par elektronowych przy czonych przez kation centralny, nosi nazw liczby koordynacyjnej.
Na przyk ad w jonie
jonem centralnym jest Fe
2+
, ligandami jony cyjankowe
CN
-
, a liczba koordynacyjna wynosi 6 (ryc. 1). Sumaryczny adunek jonu kompleksowego
zale y od charakteru i liczby ligandów oraz adunku jonu centralnego. W podanym
przyk adzie adunek jonu kompleksowego jest równy algebraicznej sumie adunków jonów
sk adowych: 2+( - 6)= -4.
4
6
]
(
[
CN
Fe
Ryc. 1. Wzór strukturalny jonu heksacyjano elazianowego
Je eli ligandami s cz steczki oboj tne jak np.
, wówczas adunek jonu
kompleksowego równa si adunkowi jonu centralnego. Wi kszo zwi zków
kompleksowych posiada parzyste liczby koordynacyjne 4 lub 6. Niektóre jony metali
przej ciowych jak np. Ag
+
, tworz kompleksy o liczbie koordynacyjnej 2. Znane s te
3
NH
42

kompleksy o nieparzystych liczbach koordynacyjnych 3 i 5. Niektóre kompleksy zw aszcza
metali ziem rzadkich (lantanowce), maj liczb koordynacyjn wi ksz ni 6.
W zale no ci od liczby koordynacyjnej, zwi zki kompleksowe maj ró ne struktury
przestrzenne np. liniow przy liczbie koordynacyjnej 2, struktur trójk tn przy liczbie
koordynacyjnej 3, czy tetraedryczn przy liczbie koordynacyjnej 4 – ryc. 2..
Przyk ady:
Ryc. 2. Struktura zwi zków kompleksowych a) liniowa
b) tetraedryczna
Utworzenie wi zania koordynacyjnego pomi dzy atomem centralnym a ligandami jest
mo liwe dzi ki temu, e ligandy posiadaj wolne pary elektronowe na orbitalach
niewi
cych, (s to orbitale, w których elektrony nie bior udzia u w tworzeniu wi za ), a
atom/jon centralny dysponuje pustymi orbitalami, które mog akceptowa pary
elektronowe ligandów.
•
•
•
•
•
•
•
•
2. Kompleksy chelatowe
Kompleksy chelatowe s szczególnym rodzajem kompleksów, w których ligandy zajmuj
wi cej ni jedno miejsce w sferze koordynacyjnej metalu, poniewa zawieraj wi cej ni
jeden atom donorowy. S to tzw. ligandy wielofunkcyjne. Ligandy wielofunkcyjne reaguj c
z kationami metali, tworz kompleksy, w których metal wchodzi w sk ad pier cienia
heterocyklicznego. Najcz ciej funkcj ligandów wielofunkcyjnych spe niaj zwi zki
organiczne, jak np. etylenodiamina, kwas winowy, kwas etylenodiaminotetraoctowy EDTA.
Najwi ksz trwa o wykazuj kompleksy chelatowe, w których w wyniku koordynacji
ligandów wytwarzaj si pier cienie pi ciocz onowe, mniejsz zawieraj ce pier cienie
sze ciocz onowe. Budow kompleksów chelatowych mog posiada jony dodatnie lub
ujemne, a tak e cz steczki oboj tne. Chelaty posiadaj ce adunek s rozpuszczalne w
wodzie, nie rozpuszczaj si natomiast w niepolarnych rozpuszczalnikach organicznych.
Bardzo wa n grup zwi zków stanowi kompleksy chelatowe, pozbawione adunku,
elektrycznie oboj tne. Nazywane s one kompleksami wewn trznymi lub wewn trznymi
43
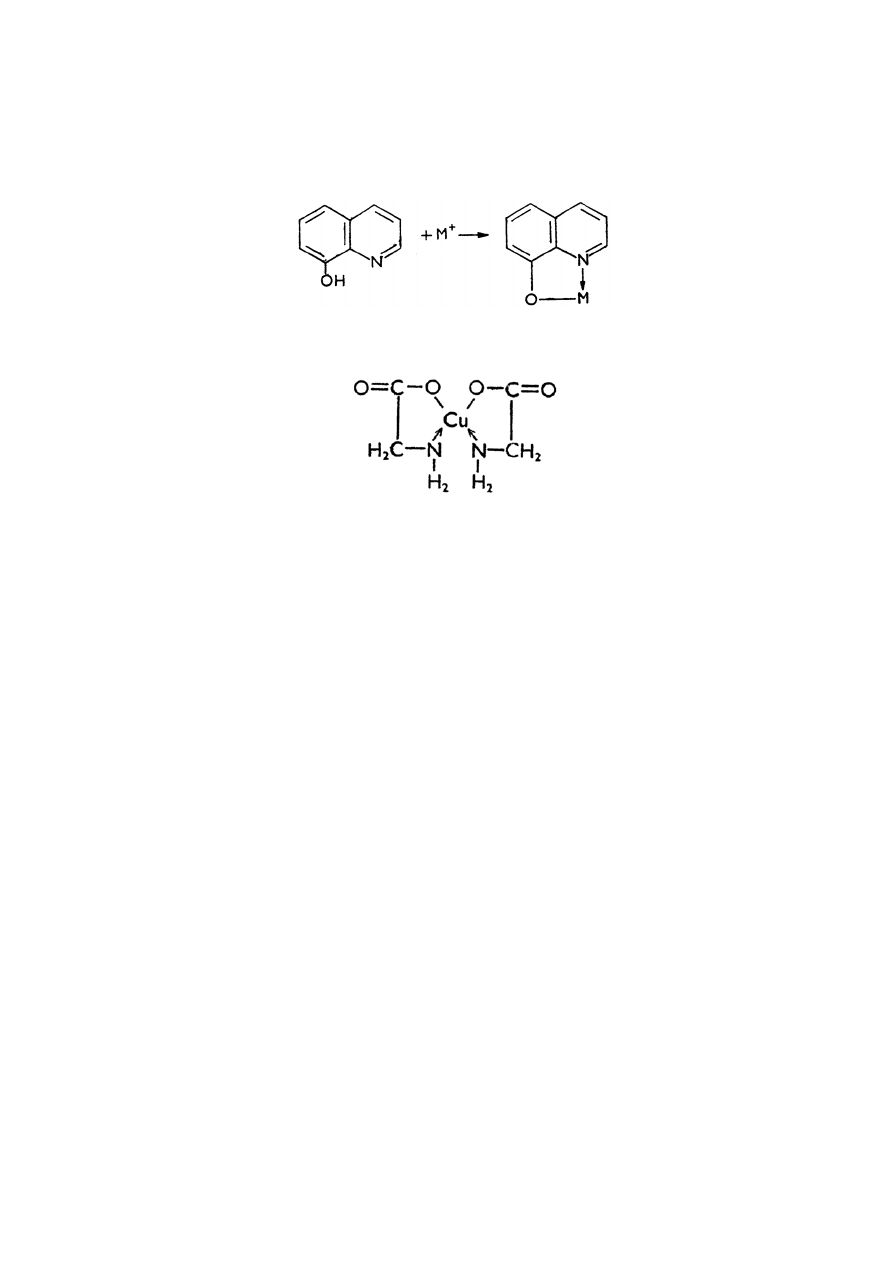
chelatami np. 8-hydroksychinolina, która z jonami wielu metali tworzy po czenia
wewn trzkompleksowe (ryc. 3) lub aniony kwasu aminooctowego tworz ce z jonami
miedzi(II) kompleksy typu chelatów wewn trznych (ryc. 4).
Ryc. 3 Kompleks 8-hydroksycholiny z jonami metali
Ryc. 4. Kompleks jonów miedzi(II) z anionami kwasu aminooctowego
3. Nomenklatura zwi zków kompleksowych
- Podaj c pe n nazw zwi zku kompleksowego, w pierwszej kolejno ci wymienia si
nazwy ligandów, a nast pnie nazw atomu/jonu centralnego. We wzorach zachowuje si
kolejno odwrotn ,
- stopie utlenienia atomu/jonu centralnego podaje si , umieszczaj c po nazwie kompleksu
cyfr rzymsk uj t w nawias okr g y np.
- jon tetraaminamiedzi(II),
2
4
3
]
)
(
[
NH
Cu
- w przypadku kompleksów posiadaj cych adunek ujemny (anionowych), do nazwy
atomu/jonu centralnego dodaje si ko cówk – an. W kompleksach kationowych podaje si
nie zmienion nazw atomu centralnego,
- ligandy wymienia si w porz dku alfabetycznym,
- dla cz steczki wody jako ligandu, przyjmuje si nazw akwa, amoniaku - amina, tlenku
w gla – karbony, tlenku azotu – nitrozy,
- do oznaczenia liczby ligandów u ywa si przedrostków greckich mono-, di, - tri, - tetra, -
penta i.td. W przypadku ligandów o bardziej skomplikowanej budowie nazw kompleksu
ujmuje si w nawias, przed którym stawia si okre lenie bis, - tris, - tetrakis – itd.
Przyk ady:
]
)
(
[
6
4
CN
Fe
K
heksacyjano elazian(II) potasu
44

]
)
(
[
6
3
CN
Fe
K
heksascyjano elazian(III) potasu
3
6
3
]
)
(
[
Cl
NH
Co
chlorek heksaaminakobaltu(III)
3
6
2
]
)
(
[
Cl
O
H
Cr
chlorek heksaakwachromu(III)
4. Trwa o zwi zków kompleksowych
Tworzenie zwi zków kompleksowych jest po czone bardzo cz sto ze zmian barwy i
w a ciwo ci chemicznych. Wi kszo reakcji prowadz cych do utworzenia zwi zków
kompleksowych, zachodzi w roztworach wodnych. Kationy w roztworze wodnym
wyst puj w postaci uwodnionej, tworz c akwakationy. Tworzenie kompleksów w
roztworach wodnych polega na wymianie ligandów, którymi s cz steczki wody, na inne
ligandy wprowadzone do roztworu. Proces podstawiania nowych ligandów odbywa si
stopniowo, a do uzyskania w danych warunkach, trwa ej liczby koordynacyjnej, Reakcje te
s reakcjami równowagowymi, podlegaj cymi prawu dzia ania mas.
Reakcje powstawania kompleksów w roztworach mo na zobrazowa równaniem:
n
ML
nL
M
gdzie M - jest atomem centralnym, a L-ligandem kompleksu.
Sta a równowagi (K) tworzenia kompleksu nosi nazw sta ej trwa o ci (
1
)
K =
n
n
L
M
ML
]
][
[
]
[
1
gdzie
1
- sta a trwa o ci kompleksu
Dla reakcji odwrotnej, zwi zanej z rozk adem jonu kompleksowego, sta równowagi
okre la si nazw sta ej nietrwa o ci
]
[
]
][
[
2
n
n
ML
L
M
Gdzie:
1
- sta a nietrwa o ci
Obie wielko ci s charakterystyczne dla okre lonych zwi zków kompleksowych. Sta a
nietrwa o ci okre la w jakim stopniu, dany jon kompleksowy ulega dysocjacji. Im mniejsza,
jest warto sta ej nietrwa o ci, tym trwalszy jest jon kompleksowy. I odwrotnie - wi ksza
warto sta ej nietrwa o ci, wskazuje mniejsz warto sta ej trwa o ci, tym s abiej
zwi zany jest metal w kompleksie.
Trwa o zwi zków kompleksowych zale y od wielu czynników:
45

- rodzaju atomu centralnego
- rodzaju ligandów
- osi gni cia przez atom centralny konfiguracji gazu szlachetnego
- pH rodowiska
- od wytworzonej struktury przestrzennej.
Kompleksy obdarzone du symetri np. tetraedryczne i oktaedryczne, s bardziej trwa e.
5. Akwakomplesy i aminakompleksy
Akwakomplelsami s wszystkie proste kationy metali, które ulegaj w roztworze wodnym
hydratacji, w cznie z protonem tworz cym jon hydronowy
a tak e jony, których
sole krystalizuj z okre lon liczb cz steczek wody np.
czy
.
O
H
3
2
6
2
)
(
O
H
Cr
2
4
2
)
(
O
H
Cu
Aminakompleksy - wyst puj zarówno w roztworze jak i w stanie sta ym. S bardziej
trwa e od akwakompleksów. Przyk ady jonów aminaokompleksowych:
,
,
. Niektóre wykazuj charakterystyczne zabarwienie i s
wykorzystywane w chemii analitycznej jako ciowej do izolacji i identyfikacji innych jonów.
2
3
)
(NH
Ag
2
4
3
)
(NH
Cd
2
4
3
)
(NH
Cu
46

Cz
praktyczna
Celem wiczenia jest poznanie rodzajów i budowy zwi zków kompleksowych,
reakcjami powstawania zwi zków kompleksowych, ocena w a ciwo ci zwi zków
kompleksowych, zapoznanie si z nomenklatur kompleksów.
Sprz t i odczynniki
probówki, cylinder miarowy o poj. 10 cm
3
,
roztwory: bezwodny CuSO
4
, bezwodny
CoSO
4
, uwodniony CuSO
4
, uwodniony CoSO
4
, 0.1 mol/dm
3
Cu(NO
3
)
2
, 0.1 mol/dm
3
Co(NO
3
)
2,
0.1 mol/dm
3
Fe(NO
3
)
3
, 0.1 mol/dm
3
Zn(NO
3
)
2,
0.1 mol/dm
3
Al(NO
3
)
3
, 0.1
mol/dm
3
Mg(NO
3
)
2
, 3 mol/dm
3
NH
3
.
H
2
O 3 mol/dm
3
i 6 mol/dm
3
NaOH, 3 mol/dm
3
i 6
mol/dm
3
HNO
3,
3 mol/dm
3
HCl, 0.1 mol/dm
3
KSCN, 0.1 mol/dm
3
, NaF, 0.1 mol/dm
3
FeCl
3
Sposób wykonania
1. Do jednej probówki wsypa szczypt bezwodnego siarczanu miedzi, a do drugiej
siarczanu kobaltu. Do ka dej doda 2 cm
3
wody i wymiesza . Porówna barwy
otrzymanych roztworów z barwami odpowiednich soli bezwodnych oraz hydratów.
2. Do dwóch oznaczonych probówek wla po 2 cm
3
0.1 mol/dm
3
Cu(NO
3
)
2
i 0.1
mol/dm
3
Mg(NO
3
)
2.
Dodawa kroplami 3 mol/dm
3
NaOH a do otrzymania s abo
alkalicznego odczynu. Obserwowa zachodz ce zmiany. Nast pnie dalej dodawa
6 mol/dm
3
NaOH i obserwowa proces rozpuszczania osadów. Ustali , które z
ocenianych jonów tworz rozpuszczalne hydroksokomplesy. Do otrzymanych
hydroksokompleksów dodawa kroplami 3 mol/dm
3
HNO
3
a do odczynu
oboj tnego, nast pnie kontynuowa dodawanie kroplami HNO
3
o st eniu
6
mol/dm
3
i obserwowa ponowne rozpuszczanie osadów.
3. Do dwóch oznaczonych probówek wla po 2 cm
3
0.1 mol/dm
3
(Cu(NO
3
)
2
, i 0.1
mol/dm
3
Mg(NO
3
)
2
). Dodawa kroplami 3 mol/dm
3
NH
3
.
H
2
O a do otrzymania
s abo alkalicznego odczynu. Nast pnie kontynuowa wkraplanie NH
3
.
H
2
O o
st eniu 3 mol/dm
3
i obserwowa proces rozpuszczania osadów. Ustali które z
47

ocenianych jonów tworz rozpuszczalne aminakompleksy. Do probówek, dodawa
powoli 3 mol/dm
3
HNO
3
a do uzyskania odczynu oboj tnego, nast pnie
kontynuowa dodawanie kropami 6 mol/dm
3
HNO
3
do odczynu kwasowego.
Zanotowa obserwacje, zapisa zachodz ce reakcje.
4. Do czterech oznaczonych probówek wla po 2 cm
3
0.1 mol/dm
3
Co(NO
3
)
2
,
Fe(NO
3
)
3
, Al(NO
3
)
3
i Zn(NO
3
)
2
). Dodawa kroplami 3 mol/dm
3
NaOH, a do
otrzymania s abo alkalicznego odczynu. Nast pnie kontynuowa wkraplanie 6
mol/dm
3
NaOH i obserwowa rozpuszczanie osadów Ustali które z ocenianych
jonów
tworz
rozpuszczalne
hydroksokompleksy.
Do
otrzymanych
hydroksokompleksów dodawa kroplami 3 mol/dm
3
HNO
3
a do odczynu
oboj tnego, nast pnie kontynuowa wkraplanie 6 mol/dm
3
HNO
3
i obserwowa
ponowne rozpuszczanie osadów.
5. Do czterech oznaczonych probówek wla po 2 cm
3
zwi zku 0.1 mol/dm
3
(Co(NO
3
)
2
,
Fe(NO
3
)
3
, Al(NO
3
)
3
, i Zn(NO
3
)
2
). Dodawa kroplami 3 mol/dm
3
NH
3
.
H
2
O a do
otrzymania s abo alkalicznego odczynu. Nast pnie kontynuowa wkraplanie
3 mol/dm
3
NH
3
.
H
2
O i obserwowa proces rozpuszczania osadów. Ustali które z
ocenianych jonów tworz rozpuszczalne aminakompleksy. Do probówek, dodawa
powoli 3 mol/dm
3
HNO
3
a do odczynu oboj tnego, nast pnie kontynuowa
wkraplanie 6 mol/dm
3
HNO
3
do odczynu kwasowego.
Zapisa obserwacje oraz wnioski.
6. Do probówki wla ok. 1,5 cm
3
roztworu 0.1 mol/dm
3
FeCl
3
, nast pnie kroplami
doda 3 mol/dm
3
HCl do uzyskania odczynu kwasowego, po czym doda ok. 1,5
cm
3
0.1 mol/dm
3
KSCN. Obserwowa zachodz ce zmiany. Do otrzymanego
roztworu doda nadmiaru roztwory NaF o st eniu 0.1 mol/dm
3
(ok. 1-2 cm
3
).
Zanotowa wyniki obserwacji i napisa odpowiednie reakcje chemiczne.
48
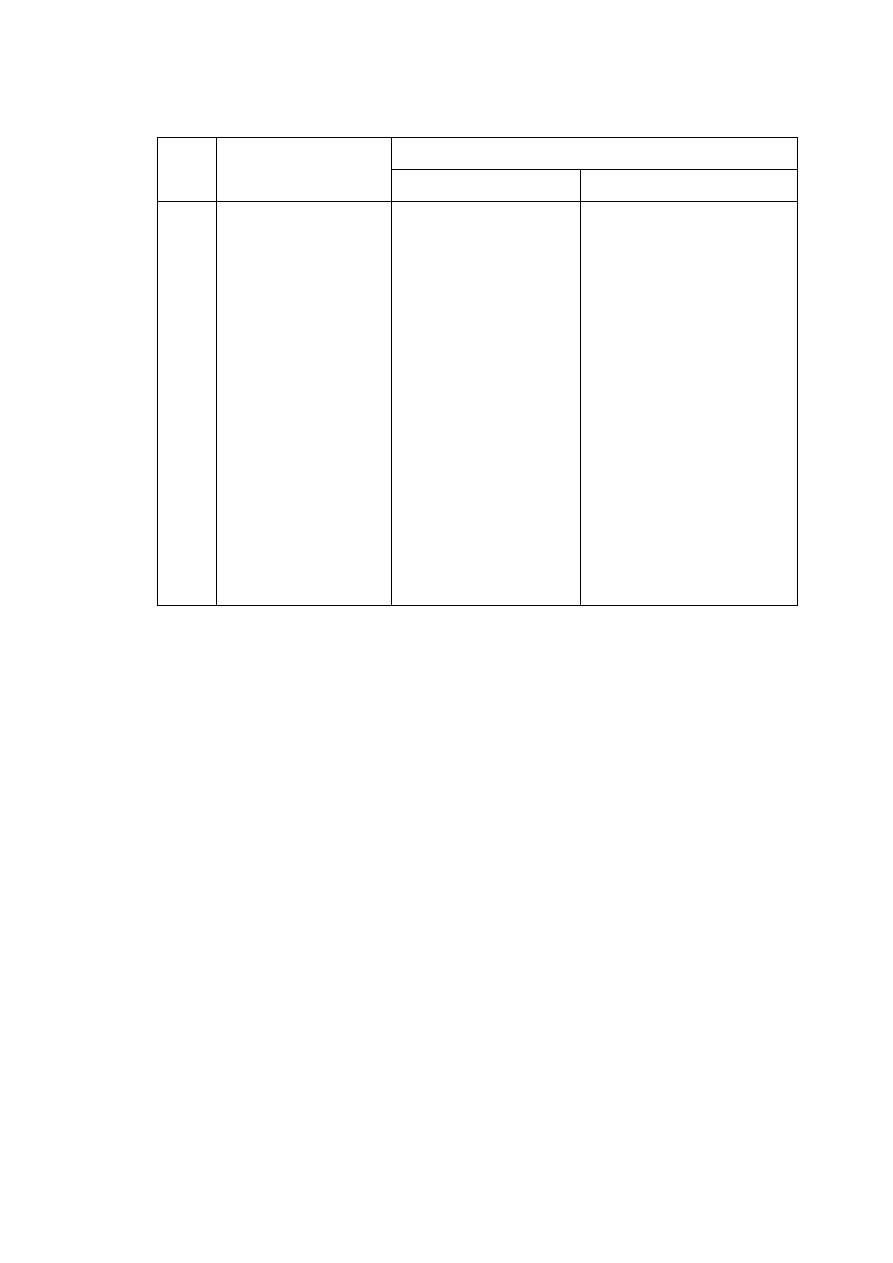
Rodzaj kompleksu
Lp.
Roztwór soli
hydroksokompleks
aminakompleks
1.
2.
3.
4
5.
6.
Cu(NO
3
)
2
Mg(NO
3
)
2
Co(NO
3
)
2
Fe(NO
3
)
3
Al(NO
3
)
3
Zn(NO
3
)
2
49
Document Outline
- Sprzęt i odczynniki
- Sprzęt i odczynniki
- Sposób wykonania
- Sposób wykonania
- Sposób wykonania
- 1. Wpływ środowiska na przebieg reakcji redoks
- Sposób wykonania
Wyszukiwarka
Podobne podstrony:
ćw.4 zadania pH, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
ćw.3 -alkacymetria, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I
ćw.1 kompleksy, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I sem
ćw.2 roztw.stęż, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I se
Plan zajęć 2010,2011, Ćwiczenia laboratoryjne z Chemii ogólnej dla I roku kierunku lekarskiego na r
PROGRAM CWICZEN Z CHEMII ORGANICZNEJ BIOLOGIA 2010 2011
2011Wykład1 chemii ogólnej 5fantastic pl
Ćw.1 Wybrane reakcje chemiczne przebiegające w roztworach wodnych ćwiczenie 1, Chemia ogólna i żywno
podstawy chemii ogolnej temat 5
Zasady zaliczania ćwiczeń z chemiii, chemia
TEMATY ĆWICZEŃ BUDOWNICTWO chemia, Tematy ćwiczeń z chemii
Rozkład ćwiczeń z chemii organicznej dla studentów I roku biotechnologii, chemia, organiczna
O egz z chemii ogolnej
Egzamin z chemii ogolnej id 153 Nieznany
Program ćwiczeń z chemii organicznej
podstawy chemii ogolnej temat 4
podstawy chemii ogolnej temat 3 Nieznany
więcej podobnych podstron