http://www.chemia.sos.pl
- 1 -
1.
Z zapisu
3
s
2
3p
2
(M
4
) wnioskujemy, że pierwiastek leży w
3
okresie w grupie
14
układu okresowego. Lub z policzenia
wszystkich elektronów (2+8+4) wynika, ze jego liczba atomowa wynosi 14. W układzie okresowym pierwiastków odnajudjemy,
że jest to krzem.
2.
Liczba atomowa berylu (odczytana z układu okresowego) wynosi 4, więc liczba atomowa pierwiastka wynosi 16 (jest to siarka).
Liczba atomowa selenu 34, więc liczba masowa izotopu siarki wynosi 34:
34
16
S
.
3.
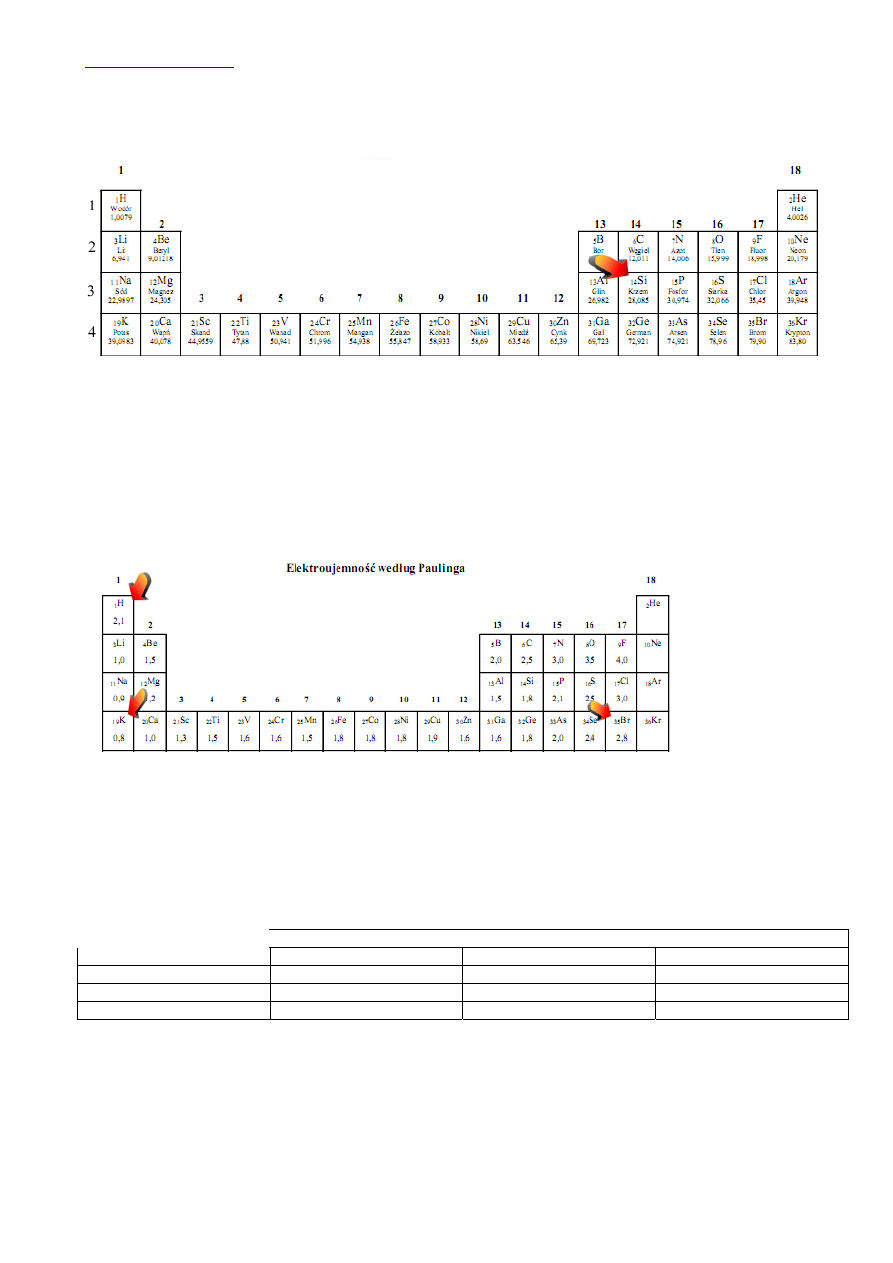
Jeżeli różnica elektroujemności pomiędzy pierwiastkami jest większa od 1,9 to pomiędzy nimi tworzy się wiązanie jonowe, w
przeciwnym przypadku pierwiastki związane są wiązaniem kowalencyjnym (bardziej lub mniej spolaryzowanym, a w przypadku
gdy nie ma różnicy elektroujemności to wiązanie takie nazywane jest wiązaniem atomowym.)
Z tablicy odczytujemy:
Pierwiastek Elektroujemność Różnica elektroujemności Typ
wiązania
K 0,8
KBr
Δ=2,8=0,8=2.
Wiązanie jonowe
H 2,1
HBr
Δ=2,8-2,1=0,7
Wiązanie kowalencyjne spolaryzowane
Br 2,8
4.
Przeczytanie równania reakcji w molach polega na dodaniu do współczynników stechiometrycznych słowa mol. W celu
przeczytaniu tego równania w gramach, wystarczy współczynniki stechiometryczne pomnożyć przez odpowiednie masy
molowe. Wiadomo, że 1mol gazu w warunkach normalnych zajmuje objętość 22,4dm
3
:
2
N
2
O
5(g)
→
4
NO
2(g)
+
1
O
2(g)
Ilość reagentów
Nazwa reagenta
tlenek azotu(V)
tlenek azotu(IV)
tlen
liczba moli
2 mole cząsteczek
4 mole cząsteczek
1 mol
cząsteczek
masa 216g 4
.
46g=
184g
32g
objętość
2
.
22,4=
44,8dm
3
89,6dm
3
22,4dm
3

http://www.chemia.sos.pl
- 2 -
5.
Charakter zasadowy (moc zasad, reaktywność) wśród metali wzrasta wraz z wzrostem nr okresu i wzrasta wraz ze
zmniejszeniem się nr grupy (zaznaczono strzałkami na układzie okresowym).
Zgodnie z tą dendencją charakter zasadowy tlenków wzrasta: MgO < CaO < Na
2
O
6.
Wystarczy tylko odpowiednio przeczytać równanie reakcji, by uzyskać odpowiedź:
4FeS
2
+ 11O
2
→ 2Fe
2
O
3
+ 8SO
2
z 480g (4mole) pirytu powstaje 8
.
22,4dm
3
(8moli) SO
2
, to
z30g pirytu powstanie x dm
3
SO
2
, czyli:
3
3
3
480g
8 22,4dm
30g 8 22,4dm
, x=
30g
x
480g
11,2dm
⋅
⋅ ⋅
=
=
7.
Za kwaśne deszcze odpowiedzialne są tlenki azotu i tlenek siarki(IV). Wszystkie czynniki odpowiedzialne za wydzielanie się
tych gazów są przyczyną kwaśnych deszczów: spalanie zasiarkowanego węgla (elektrownie, elektrociepłownie, gospodarstwa
domowe), erupcja wulkanów. Tlenki azotu wydzielają się podczas spalania paliwa w silnikach spalinowych.
8.
Sód: jest ciałem stałym, barwy srebrzystej, miękki, lżejszy od wody, kowalny, ciągliwy, przewodzi dobrze prąd elektryczny i
ciepło (sód jest metalem, wystarczy wymienić wszystkie właściwości fizyczne metalu)
Siarka: jest ciałem stałym, barwy żółtej, cięższa od wody, nierozpuszczalna w wodzie, krucha, nie przewodzi prądu
elektrycznego i ciepła (siarka jest niemetalem, tu również wystarczy wymienić właściwości niemetalu).
9.
Wodorotlenek sodu jest mocną zasadą (wodorotlenki z 1 grupy układu okresowego pierwiastków są mocnymi zasadami).
Rozpuszczaniu mocnych zasad w wodzie jest połączone z efektem egzotermicznym:
I
fałsz
Wszystkie mocne zasady działają parząco i żrąco na skórę
II
prawda
Jest higroskopijny i pochłania CO
2
z powietrza (2NaOH + CO
2
→ Na
2
CO
3
+ H
2
O )
III i V prawda
Wodorotlenek sodu jest mocną zasadą, co oznacza, że w wodzie jest zdysocjowany w 100%. Jest więc mocnym elektrolitem, a
to oznacza, że dobrze przewodzi prąd elektryczny
IV
fałsz
http://www.chemia.sos.pl
- 3 -
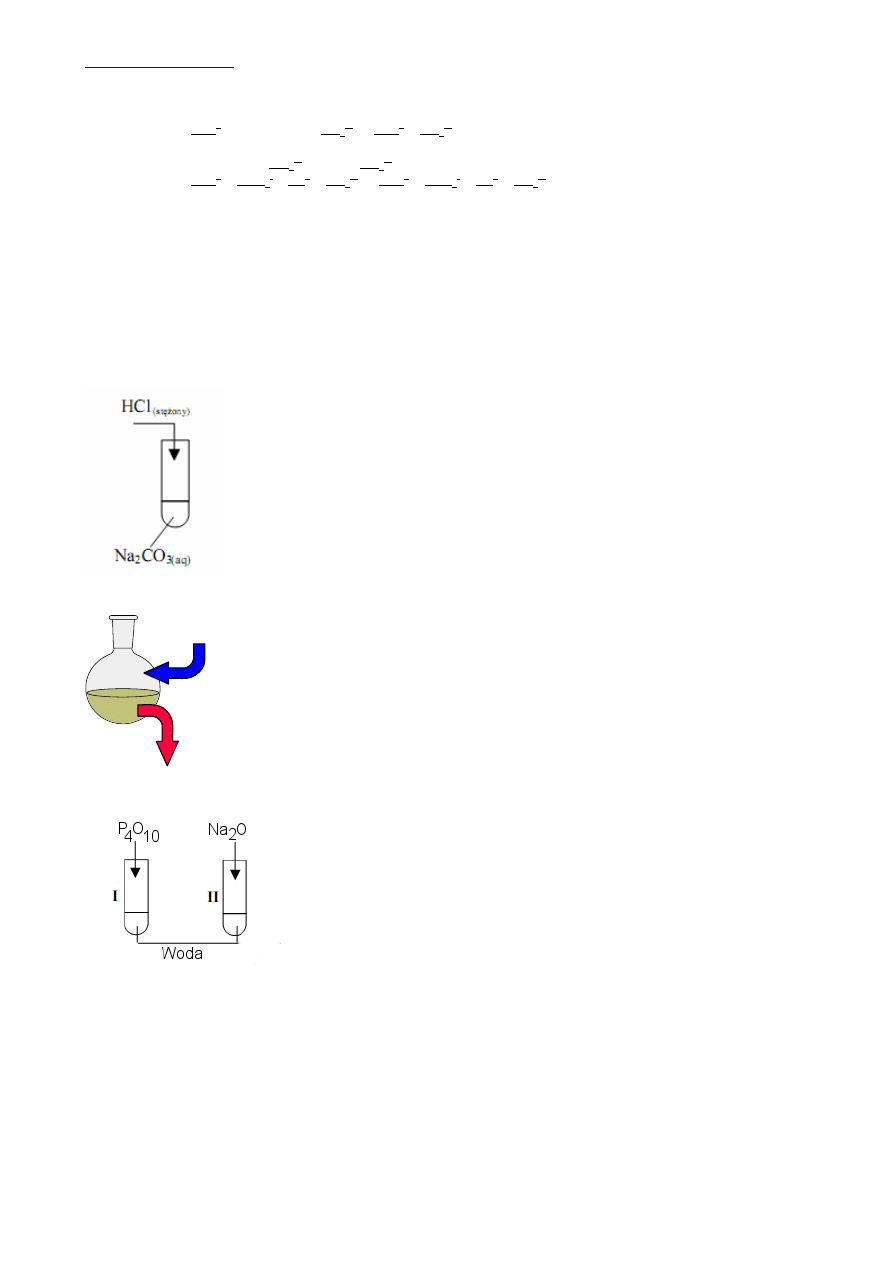
10.
W równaniach jonowych zapisujemy tylko te jony, które biorą udział w reakcji. Jony mogą tworzyć się z dysocjacji kwasów,
zasad i soli:
Probówka I:
2Na
+
+ 2OH
-
+ 2H
+
+ SO
4
2-
→ 2Na
+
+ SO
4
2-
+ 2H
2
O a po redukcji wyrazów podobnych i skróceniu
otrzymamy: H
+
+ OH
-
→ H
2
O
Probówka II:
K
2
O + 2H
+
+ SO
4
2-
→ 2K
+
+ SO
4
2-
+ H
2
O a po redukcji wyrazów podobnych: K
2
O + 2H
+
→ 2K
+
+ H
2
O
Probówka III
2Na
+
+ 2NO
3
-
+ 2H
+
+ SO
4
2-
→ 2Na
+
+ 2NO
3
-
+ 2H
+
+ SO
4
2-
widzimy, że wszystkie reagenty redukują się.
Reakcja nie zachodzi
.
11.
Z szeregu aktywności metali: K, Ca, Mg, Zn, Pb,
H
, Cu, Ag, Au, wynika, że metale znajdujące się w tym szeregu za wodorem
nie mogą reagować z kwasami z wydzieleniem wodoru. Oznacza to, że są bierne wobec kwasów beztlenowych. Kwas
chlorowodorowy (solny) jest kwasem beztlenowym, dlatego z kwasem tym nie może reagować miedź. Natomiast cynk i
magnez reagują z wydzieleniem wodoru ponieważ w szeregu aktywności metali znajdują się przed wodorem:
Zn + 2HCl → ZnCl
2
+ H
2
↑
Mg + 2HCl → MgCl
2
+ H
2
↑
12.
Kwas solny jest mocnym kwasem, natomiast węglan sodu jest solą słabego kwasu. Zawsze
mocny kwas wypiera słaby kwas z jego soli:
Na
2
CO
3
+ 2HCl → 2NaCl + [H
2
CO
3
]
H
2
CO
3
→ H
2
O + CO
2
↑
Powstały kwas węglowy jest nietrwały i rozkłada się na wodę i bezwodnik kwasowy (tlenek
węgla(IV).
Spostrzeżenia: Obserwujemy wydzielanie się bezbarwnego gazu
13.
reakcje egzo (egzotermiczna,
egzoenergetyczna)
reakcje endo (endotermiczna,
endoenergetyczna
Jeżeli nastąpiło przekazanie energii z otoczenia do układu (energia
została pochłonięta przez układ) to reakcja jest endoenergetyczną.
14.
Tlenek fosforu(V) jest tlenkiem niemetalu, czyli bezwodnikiem kwasowym. Reaguje z
wodą tworząc kwas. Natomiast tlenek sodu jest tlenkiem metalu 1 grupy układu
okresowego. Reaguje z wodą tworząc zasadę:
P
4
O
10
+ 6H
2
O → 4H
3
PO
4
Na
2
O + H
2
O → 2NaOH
Papierkiem wskaźnikowym możemy sprawdzić wodny roztwór tych związków: papierek
zabarwi się na czerwono w obecności kwasu i na niebiesko w obecności zasady.
Spostrzeżenia: Wodny roztwór tlenku fosforu(V) zabarwia papierek wskaźnikowy na
czerwono, a wodny roztwór tlenku sodu zabarwia papierek wskaźnikowy na niebiesko.
Wnioski: Tlenek fosforu ma właściwości kwasowe, a tlenek sodu właściwości zasadowe.

http://www.chemia.sos.pl
- 4 -
15.
Istnieje zasada, że pierwiastek bardziej reaktywny (w przypadku kwasów kwas mocniejszy, lub zasada mocniejsza) wypiera z
soli pierwiastek mniej reaktywny (słabszy kwas, słabszą zasadę). Reaktywność niemetali w układzie okresowym pierwiastków
wzrasta w następujący sposób:
Z układu okresowego pierwiastków widzimy, że chlor może wyprzeć jod i brom z
roztworów ich soli, ale brom jest w stanie wyprzeć tylko jod z jodków:
I
2KI + Cl
2
→ 2KCl + I
2
II
2KBr + Cl
2
→ 2KCl + Br
2
III
2KI + Br
2
→ 2KBr + I
2
IV
reakcja nie zachodzi
Wniosek: aktywność chlorowców wzrasta w szeregu I
2
> Br
2
> Cl
2
16.
Wzrost ilości fosforu w zbiornikach wodnych powoduje gwałtowny rozwój glonów i innych roślin w zbiorniku, które obumierając
zużywają tlen rozpuszczony w wodzie. Powoduje to zanik życia w zbiornikach wodnych. Zjawisko to nosi nazwę eutrofizacja.
17.
Stężenie procentowe liczone jest ze wzoru:
s
s
rozt
rozp
s
m
m
c% 100%
100%
m
m
m
=
=
+
.Jeżeli masa substancji wynosi 8g, a masa
rozpuszczalnika 72g, to masa roztworu m
rozt
=8g+72g=
80g
. Podstawiając dane do wzoru otrzymamy: c%=100%
.
8g/80g=
10%
.
18.
Aby przygotować 200g 10% roztworu glukozy (m
rozt
=200g, c%=10%), to masa glukozy m
s
=200g
.
10%/100%=
20g
, natomiast
masa rozpuszczalnika (wody) m
rozp
=200g-2-g=
180g
.
Prawidłowo roztwór przygotował uczeń IV.
19.
Kwasy o właściwościach silnie utleniających to kwasy tlenowe, w których atom centralny znajduje się na najwyższym stopniu
utlenienia. Warunki takie spełnia jedynie kwas siarkowy(VI) oraz kwas aztowy(V).
Do kwasów silnych zaliczamy z kwasów beztlenowych jedynie kwas solny, kwas bromowodorowy, oraz kwas jodowodorowy.
Jeżeli kwas tlenowy zapiszemy w postaci ogólnej H
n
EO
m
, to kwasami silnym są jedynie te w których m-n≥2. Z tych reguł
wynika, że kwasami słabymi są: kwas siarkowodorowy (H
2
S), kwas etanowy (kwas octowy)
20.
Kwas ortofosforowy(V), H
3
PO
4
jest kwasem trózasadowym (wskazuje na to indeks stechiometryczny 3), to znaczy, że reaguje
z 3 molami zasady z utworzeniem obojętnej soli:
H
3
PO
4
+ 3NaOH → Na
3
PO
4
+ 3H
2
O
Stosunek molowy wodorotlenku do kwasu odczytujemy z równania reakcji. Widzimy, że 3 mole zasady reagują z 1 molem
kwasu, czyli stosunek ten wynosi 3:1.
Stosunek masowy: 3 mole NaOH to 3.40g/mol=120g, 1.98g/mol=98g. Stosunek masowy wodorotlenku do kwasu to
120:98=60:49.
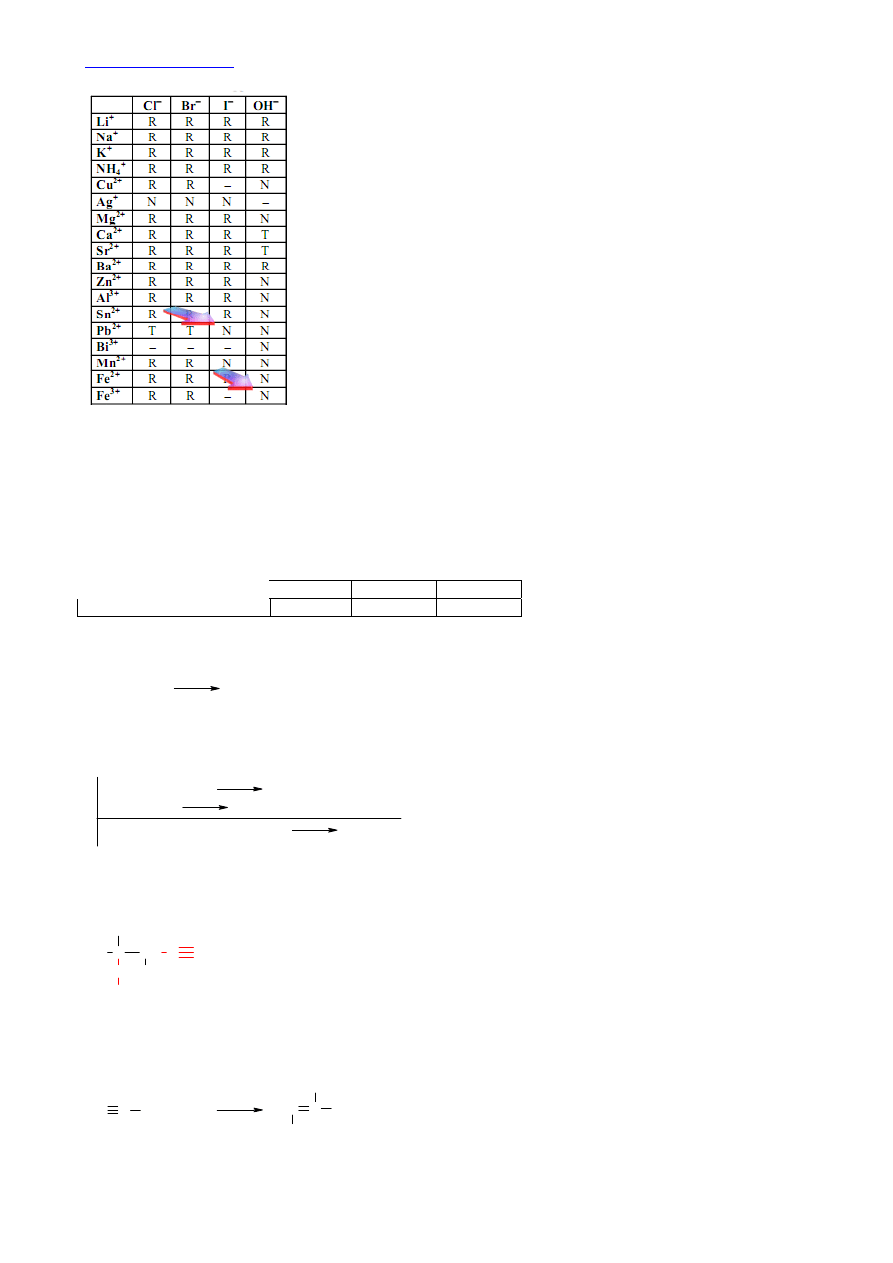
http://www.chemia.sos.pl
- 5 -
21.
W tablicy rozpuszczalności odnajdujemy, że jony Fe
3+
nie mogą istnieć w
obecności jonów OH
-
, a jony Pb
2+
w obecności jonów I
-
. Powstają
nierozpuszczalne osady wodorotlenku żelaza(III) oraz jodku ołowiu(II).
Natomiast siarczek sodu z kwasem solnym reaguje z wydzieleniem gazowego
siarkowodoru. Osad nie powstaje w probówce II.
22.
Stopnie utlenienia atomów oblicza się wychodząc z założenia:
- suma stopni utlenienia atomów równa jest 0 lub ładunkowi jonu
- atom tlenu jest zawsze na –II stopniu utlenienia, z wyjątkiem połączeń nadtlenkowych, w których jest na –I stopniu utlenienia
- atom wodoru jest zawsze na +I stopniu utlenienia, z wyjątkiem połączeń z metalami I, II i III grupy w których jest na –I stopniu
utlenienia.
NH
3
3
.
(+1)+x=0, x=-3.
NO
2
-
2
.
(-2)+x=-1, x=+3
N
2
O (-2)+2x=0, x=+1
NH
3
NO
2
-
N
2
O
Stopień utlenienia azotu
-III
+III
+I
23.
Przy dobieraniu współczynników reakcji metodą bilansu elektronowego musimy przede wszystkim znaleźć utleniacz i reduktor:
CuS + HNO
3
CuO + S + NO + H
2
O
-II
+V
0
+II
Siarka w siarczku miedzi utlenia się, jest
reduktorem
, natomiast azot w kwasie azotowym redukuje się, jest
utleniaczem
.
Kolejnym krokiem jest zapisanie równań połówkowych. Dobrym sposobem jest zapisywanie atomów w takiej postaci w jakiej
występują w rzeczywistości. Brakujące atomy tlenu, wodoru możemy pobrać z wody, lub z jonów wodorowych. Nadwyżki
atomów tlenu pozbywamy się z wodą:
HNO
3
+ 3e + 3H
+
NO + 2H
2
O
CuS + H
2
O
CuO + S + 2H
+
+ 2e
2
3
2HNO
3
+ 6H
+
+ 3CuS + 3H
2
O
2NO + 4H
2
O + 3CuO + 3S + 6H
+
Po redukcji wyrazów podobnych otrzymamy:
3CuS + 2HNO
3
→ 3CuO + 3S + 2NO + H
2
O
24.
CH
3
C
Br
CH
2
CH
3
CH
CH
3
C
CH
Aby nazwać ten związek musimy odnaleźć najdłuższy łańcuch zawierający wiązanie wielokrotne.
Grupy, które są przyłączone do tego łańcucha są podstawnikami. Numerację łańcucha prowadzimy
w taki sposób, by wiązanie wielokrotne znalazło się przy węglu o jak najniższym lokancie
4-bromo-3,3-dimetyloheks-1-yn
25.
Związek A należy do związków nienasyconych (wiązanie wielokrotne) i ulega reakcji addycji elektrofilowej (przyłączania).
Jeżeli 1 mol alkinu reaguje z 1 molem bromu, to cząsteczka bromu ulega addycji tylko do 1 wiązania
π:
C
H
C CH
3
C
H
C CH
3
Br
Br
+ Br
2
http://www.chemia.sos.pl
- 6 -
26.
Ketony najczęściej otrzymuje się utleniając 2-rzędowe alkohole. Odpowiedni alkohol można otrzymać w wyniku addycji wody
do alkenu (reakcja addycji wody do alkenu zachodzi zgodnie z regułą Markownikowa):
CH
2
CH CH
2
CH
3
CH
3
CH CH
2
CH
3
OH
CH
3
C CH
2
CH
3
O
+ H
2
O
H
+
Na
2
Cr
2
O
7
/H
+
Utlenianie alkoholu można prowadzić dowolnym, silnym utleniaczem.
27.
Amoniak, NH
3
, w wodnych roztworach zachowuje się jak zasada, reaguje jedynie z kwasami: NH
3
+ HCl → NH
4
Cl.
Alanina jest aminokwasem, to znaczy posiada grupę karboksylową, którą reaguje z zasadami jak kwas, oraz grupę aminową,
która z kwasami reaguje jak zasada:
CH
3
CH
NH
2
C
OH
O
CH
3
CH
NH
2
C
ONa
O
CH
3
CH
NH
3
Cl
C
OH
O
+ NaOH
+ HCl
-H
2
O
+ H
2
O
28.
Wszystkie tłuszcze ciekłe są tłuszczami nienasyconymi. Tłuszcze to estry wyższych kwasów karboksylowych i gliceryny.
Źródłem tłuszczy mononienasyconych jest oliwa z oliwek, olej słonecznikowy, rzepakowy
Źródłem tłuszczy wielonienasyconych, są ryby, tran.
Tłuszczem nienasyconym jest np. trioleinian gliceryny.
29.
Toluen jest związkiem aromatycznym. W obecności katalizatora ulega bromowaniu w pierścieniu, natomiast w obecności
światła bromowaniu ulega łańcuch węglowy. Grupa metylowa jest podstawnikiem I-rodzaju, uaktywnia pierścień na substytucję
elektrofilową i kieruje kolejny podstawnik w pozycję orto i para. Dlatego produktem bromowania w obecności katalizatora jest o-
bromotoluen i p-bromotoluen:
CH
3
CH
2
Br
CH
3
CH
3
Br
CH
3
Br
+ Br
2
h
ν
+ HBr
+ Br
2
+ HBr
FeBr
3
+
30.
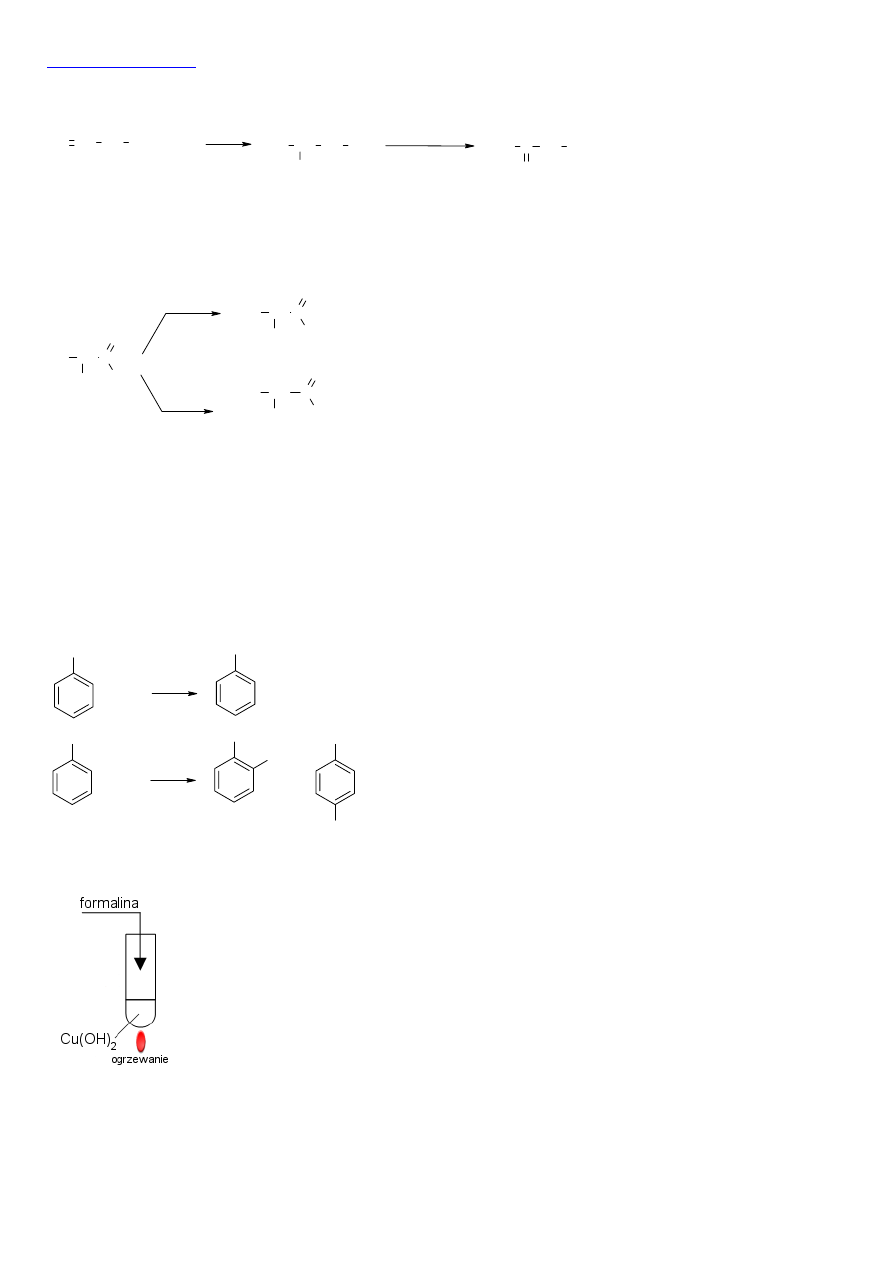
Formalina jest wodnym roztworem matanalu (aldehydu mrówkowego). Aby wykryć matanal w
formalinie musimy przeprowadzić reakcję charakterystyczną dla aldehydów. Może to być
reakcja Fehlinga (Trommera) lub Tollensa.
Obserwacje: ogrzewanie mieszaniny wodorotlenku miedzi(II) z formaliną powoduje
powstawanie ceglastoczerwonego osadu (w przypadku użycia amoniakalnego roztworu tlenku
srebra powstaje lustro srebrowe na ściankach probówki).
HCHO + 2Cu(OH)
2
→ HCOOH + Cu
2
O + H
2
O lub
HCHO + Ag
2
O → HCOOH + 2Ag
Wyszukiwarka
Podobne podstrony:
kom odp pr2006m(1)
kom odp pp2006m(1)
kom odp pr2007m(1)
kom odp pp2007m(1)
kom odp pr2008(1)
ch pp odp 2008 kom(1)
Narzady i kom u imm, antyg i Ab, mech odp swoistej i niesw
odp z bioli kom
wykaz odp egz kom
CW 7 odp swoista kom cz 1
Biol kom cz 1
więcej podobnych podstron