2010-01-22
1
CHEMIA VIII
Kinetyka reakcji
Typy reakcji
Reakcje
chemiczne
przebiegają
z
bardzo
różnymi
szybkościami.
po zmieszaniu roztworu
AgNO
3
+NaCl
AgCl + Na
+
+ NO
3
-
Reakcja ta przebiega do
końca tak szybko, że nie można
prześledzić jej stadiów.
natomiast w temperaturze pokojowej gazy
2H
2
+ O
2
2H
2
O,
reakcja
otrzymywania
wody
bez
udziału
katalizatorów
przebiega
wolno
i
nie
można doświadczalnie uchwycić
jakiejkolwiek zmiany w
układzie nawet po wielu latach.
Między tymi dwoma granicznymi przypadkami istnieje
wiele reakcji o
szybkościach pośrednich zarówno wśród
związków nieorganicznych jak i organicznych.
2010-01-22
2
Czynniki wpływające na szybkość
reakcji:
• rodzaj i stężenie reagujących substancji lub
ciśnienie gazów (jeżeli reakcja przebiega w
fazie gazowej)
• temperatura
• obecność katalizatorów
• wpływ promieniowania.
Szybkość reakcji
• to zmiana molowego stężenia substratu lub
produktu w jednostce czasu:
• v =(+/-)k dC/dt
k stała szybkości reakcji zależy od reagujących
substancji i od temperatury.
• Dla danej reakcji w stałej temperaturze stała k
może ulec zmianie pod wpływem katalizatora.
2010-01-22
3
Równanie Arrheniusa
-
Dla każdej reakcji k rośnie ze wzrostem temperatury:
wzrost T o 10K powoduje około dwukrotny wzrost
szybkości.
• - temperatura zależność k od t podaje wzór Arrheniusa
k = Ae
-E/RT
gdzie
• A - stała charakterystyczna dla danej reakcji
• e – podstawa ln
• E – stała zwana energią aktywacji
• R – stała gazowa w jednostkach energii 8.314 J/(mol x K)
• Małe zmiany T mogą powodować duże zmiany k
A ---> B + C + ....
• Jeżeli mamy równanie reakcji chemicznej to
szybkość reakcji opisuje równanie:
• v = dc
A
/dt = k*c
A
• lub
• v = dc
B
/dt = dc
C
/dt
• gdzie: c
A
, c
B
, c
C
-
stężenia molowe substancji A, B,
C,..., t - czas, dc
A
/dt -
ubytek stężenia substaratu w
jednostce czas,
dc
B
/dt, dc
C
/dt -
przyrost stężenia produktów w
jednostce czasu, k -
współczynnik proporcjonalności
(stała szybkości).
2010-01-22
4
P
rawo działania mas
• Szybkość reakcji jest wprost proporcjonalna
do iloczynu stężeń substratów
aA + bB + cC ---> dD,
• v = k[A]
a
x [B]
b
x [C]
c
Rząd reakcji
• Współczynniki potęgowe (a, b, c) przy stężeniach
poszczególnych substratów określają rząd reakcji,
który może być cząstkowy lub sumaryczny.
Cząstkowy rząd reakcji
Jeżeli a = 1, to reakcja jest pierwszego rzędu
względem A; jeżeli a = 2, to reakcja jest drugiego
rzędu względem A itp.
Sumaryczny rząd reakcji
Sumaryczny rząd reakcji chemicznej - jest to suma
wykładników potęgowych w równaniu szybkości
reakcji chemicznej
( rząd reakcji = a + b + c + .....).
2010-01-22
5
Cząsteczkowość reakcji
• liczba cząsteczek biorących udział w
najwolniejszym stadium reakcji.
• Cząsteczkowość jest zwykle równa rzędowości
reakcji, ale nie odwrotnie.
Cząsteczkowość i rząd reakcji wyznacza się
tylko eksperymentalnie
, nie można obliczyć ich
teoretycznie.
Sumaryczny rząd reakcji jest przeważnie liczbą
niecałkowitą, co oznacza, że reakcja przebiega
przez etapy pośrednie, z których nawolniejszy
decyduje o sumarycznym rzędzie reakcji.
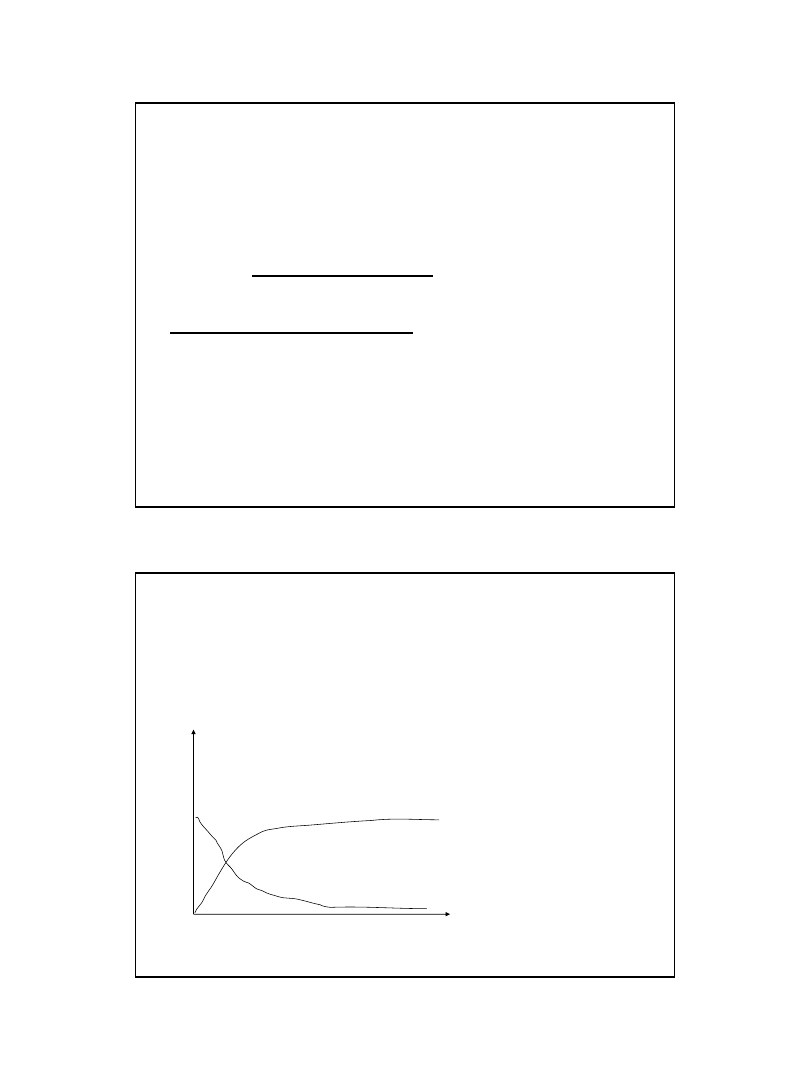
Dla reakcji I rzędy
Produkt
v= dC
P
/dt
Substrat
v= dC
S
/dt
2010-01-22
6
O
kres połowicznej przemiany.
• Wielkości, która charakteryzuje szybkość
reakcji
• Jest to czas potrzebny do tego, aby połowa
reagującej substancji uległa przemianie
Wpływ temperatury
• Wzrost temperatury zazwyczaj powoduje
wzrost szybkości reakcji.
• W wyjątkowych przypadkach – reakcje
wieloetapowe: dla jednego etapu szybkość
reakcji
odwrotnej
rośnie
szybciej
z
temperaturą
niż
szybkość
reakcji
następnego etapu.
2010-01-22
7
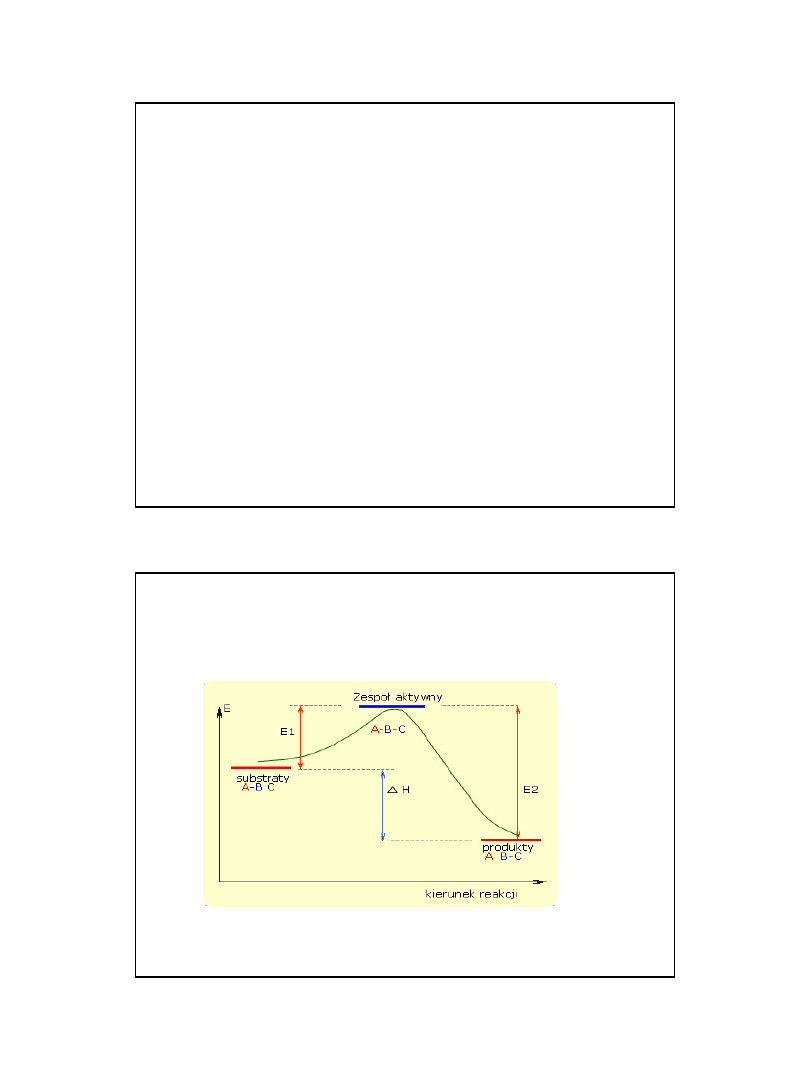
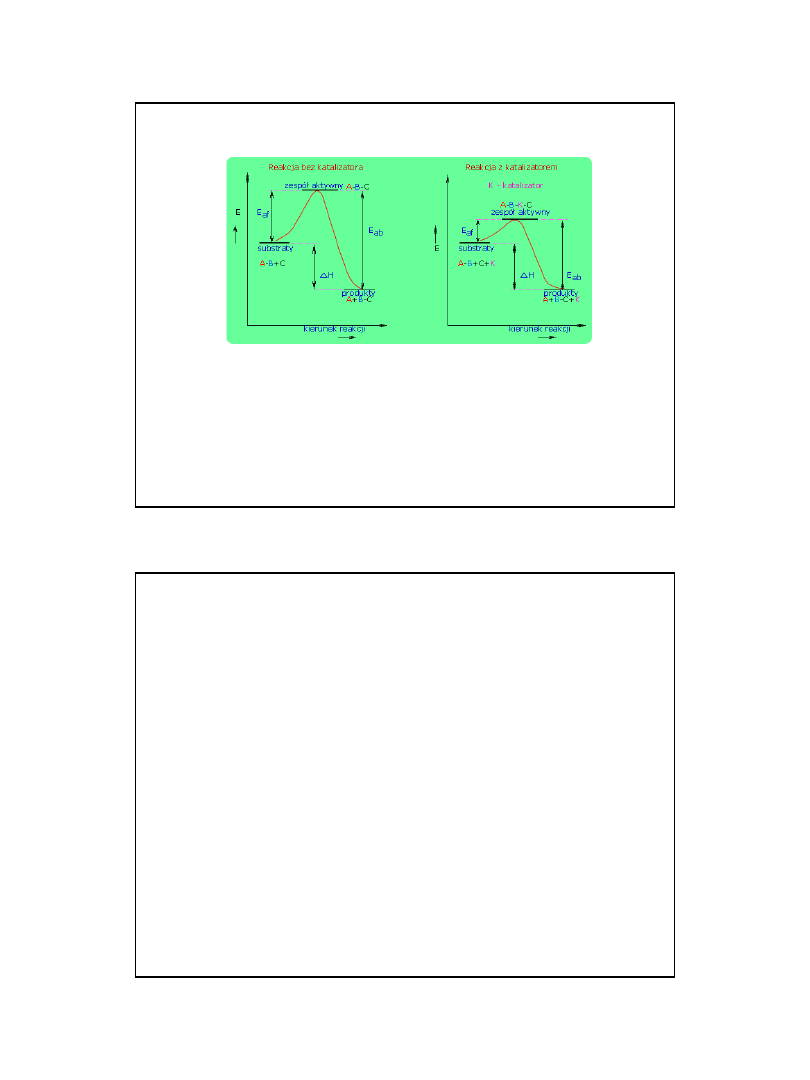
E
nergią aktywacji
• Stała E
a
nazywa się
energią aktywacji
i
charakteryzuje energię jaką muszą mieć
cząsteczki (atomy) aby zderzenia między nimi
były efektywne
Przebieg reakcji chemicznej można zilustrować
na przykładzie, gdzie substratami reakcji są
A
-
B
i
C
a produktami
A
i
B
-
C
• Przebieg reakcji
• A
-
B
+
C
-->
A
+
B
-
C
Przemiany energetyczne w
czasie reakcji chemicznej
Jeżeli w czasie zderzeń substraty mają za małą
energię reakcja nie zachodzi
.
2010-01-22
8
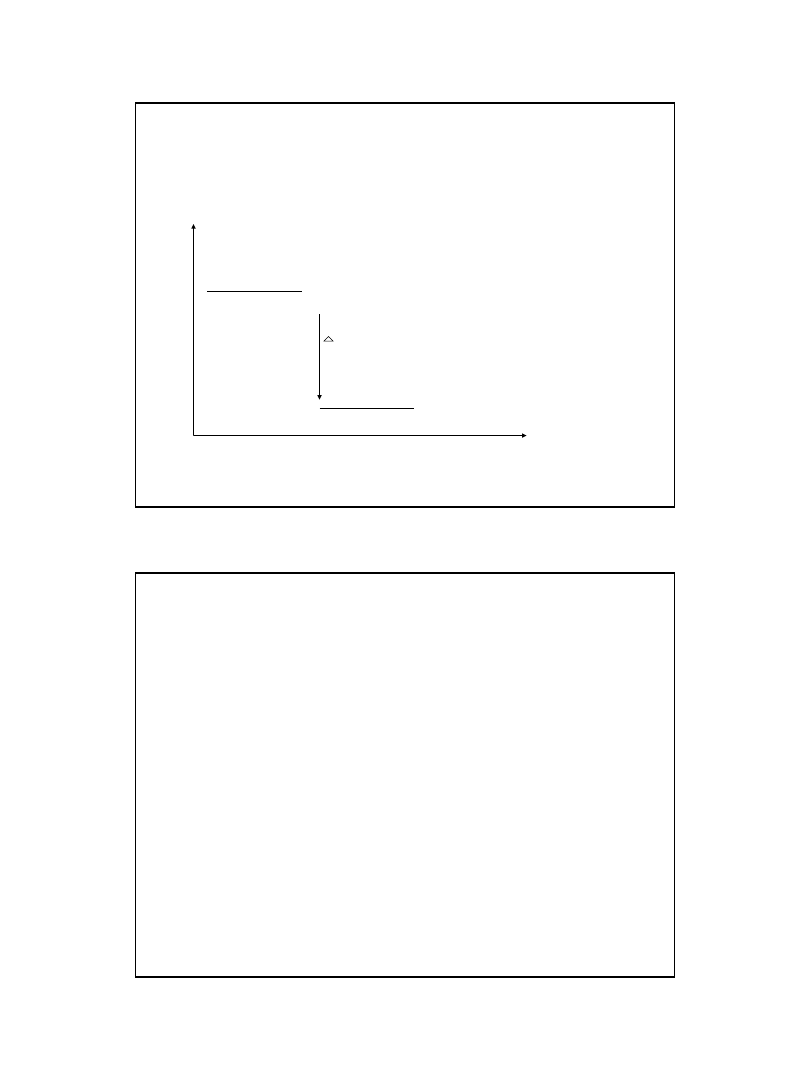
Jeżeli
energia produktów
jest mniejsza od
energii substratów
to
jest
reakcja egzotermiczna
(wydzielanie ciepła) E
ab
> E
af
jeżeli większa to z
reakcją endotermiczną (pochłanianie ciepła)
E
ab
< E
af
E
substraty
H = H produktów – Hsubstratów
produkty
kierunek reakcji
Wpływ środowiska
• Przebieg reakcji zależy od
-
stanu skupienia co związane jest z ruchliwością
molekuł.
W fazie gazowej -
dużą swobodę poruszania się,
częste zderzenia ciągłe przemieszczanie
cząsteczek - reakcja chemiczna zachodzi łatwiej
W roztworach od
- charakteru rozpuszczalnika - w rozpuszczalnikach
polarnych łatwiej reagują związki o budowie
polarnej, a związki o budowie niepolarnej łatwiej
reagują w rozpuszczalnikach niepolarnych
-
charakter budowy reagujących związków..
2010-01-22
9
Podczas reakcji chemicznej zachodzi rozrywanie
wiązań chemicznych i tworzenie nowych
Np. Mno
4
-
+ 5Fe
2+
+ H
+
= 5Fe
3+
+ Mn
2+
+ H
2
O - szybka
natychmiastowa
2MnO
4
-
+ 5C
2
O
4
2-
+ 16H
+
10 CO
2
+ 2Mn
2+
+ 8H
2
O -
powolna
Przykład:
[H
+
] maleje o 0.010M w czasie 1ns. Jaka jest średnia
szybkość reakcji?
Szybkość = Zmiana stężenia
/
czas
V = 0.010 M/1.00 x10
-9
s = 1 x10
7
M/s
Wpływ energii promienistej,
reakcje łańcuchowe
- energia promienista - reakcje łańcuchowe
i
fotochemiczne
H
2
+ Cl
2
= 2HCl
Cl
2
hν
2Cl
Cl + H
2
hν
HCl +H
H+ Cl
2
hν
HCl + Cl
2010-01-22
10
• - energia promienista - reakcje łańcuchowe
i
fotochemiczne
• H
2
+ Cl
2
= 2HCl
• H
2
--> 2H
*
• H
3
C-CH
3
--> 2H
3
C
*
• wolne rodniki -
swobodne atomy albo cząsteczki o
niesparowanych elektronach.
Reakcje przebiegające z wytworzeniem wolnych
rodników to
reakcji łańcuchowych
• Cl
2
hν
2Cl
• Cl + H
2
hν
HCl +H
• H+ Cl
2
hν
HCl + Cl
Wpływ katalizatorów
niektóre reakcje mogą przebiegać szybciej w
obecności substancji, które pozostają
niezmienione po zakończeniu reakcji.
Substancje nazywane
katalizatorami a
zjawisko przez nie wywołane katalizą

2010-01-22
11
Katalizatory
katalizator umożliwia:
osiągnięcie stanu równowagi w znacznie
krótszym czasie.
mogą występować w tej samej fazie lub w
dwóch różnych fazach (homogeniczna) albo
(heterogeniczna).
Katalizatory opóźniające reakcję – inhibitory.
Energia aktywacji - jest to najmniejsza
porcja energii niezbędna do
rozpoczęcia reakcji.
2010-01-22
12
Teoria stanów przejściowych
Zgodnie z
tą teorią aby zaszła reakcja chemiczna para cząstek musi przejść
przez
formę pośrednią między stanem początkowym i końcowym -
kompleks aktywny:
-
energia jest
większa od energii substratów o energię aktywacji E
a
- ulega natychmiast rozpadowi
przechodząc w trwalsze produkty reakcji.
kataliza jednofazowa
utlenianie tlenku siarki(IV) w obecności tlenku
azotu(II) (katalizator).
• SO
2
+ 1/2O
2
+ H
2
O --> H
2
SO
4
(wolno)
2SO
2
+ NO + O
2
+ O
2
+ H
2
O -->
2HSO
4
NO
(szybko)
2HSO
4
NO
+ H
2
O --> 2H
2
SO
4
+ NO + NO
2
(szybko)
2010-01-22
13
kataliza wielofazowa
zastosowanie tlenku wanadu(V) do utleniania
tlenku siarki(IV)
V
2
O
5
+ SO
2
--> V
2
O
4
+ SO
3
V
2
O
4
+ 2SO
2
+ O
2
--> 2 VOSO
4
2 VOSO
4
--> V
2
O
5
+ SO
3
+ SO
2
katalizator stanowi odrębną fazę – kontakt o powierzchni krystalicznej,
nieregularnej
Szybkość reakcji heterogenicznych i
homogenicznych
• wielofazowych
jest
proporcjonalna
do
powierzchni
zetknięcia między fazami
• np. rdzewienie żelaza – faza stała i faza gazowa - tlen
• -
powoli, jeżeli powierzchnia zetknięcia jest mała
• -
szybko przy dużych powierzchniach.
• jednofazowych zależy od stężenia reagentów:
• - dla fazy gazowej stężenia można zmieniać, zmieniając
ciśnienie
• - dla fazy ciekłej – stężenia poszczególnych reagentów lub
zmieniać objętość – Efekt (wzrost, spadek czy nie nastąpi
zmiana)można określić tylko doświadczalnie.
2010-01-22
14
Reakcję homogeniczną:
• 2H
2
+2NO
2
H
2
O +
N
2
• badamy mierząc ciśnienie:
• z 4 moli substratów powstają 3 mole produktów
• szybkość reakcji = k [H
2
] [NO]
2
• szybkość reakcji = k [A]
x
[B]
y
...
• gdzie k jest stałą szybkości reakcji.
• Wartość x i y określają tzw. rząd reakcji jeśli
np. x=1 to reakcja jest I rzędu względem A.
Utlenianie jodowodoru
nadtlenkiem wodoru.
Dla reakcji 2HI + H
2
O
2
= J
2
+ 2 H
2
O
• v = k [HI]
2
[H
2
O
2
]
• gdy C substratów są równe 1 to v = k.
•
• 1. Seria - Utrzymywano stałe stężenie H
2
O
2
i mierzono
szybkość w miarę zwiększania stężenia HI
• [H
2
O
2
] = const
• [HI]=1, 2, 3, ....razy większe od H
2
O
2
• Szybkość wzrastała proporcjonalnie do stężenia HI w
potędze pierwszej, a nie do kwadratu [HI].
2010-01-22
15
2. Seria- Utrzymywano stałe stężenie HI i
mierzono szybkość w miarę zwiększania
stężenia H
2
O
2
• [HI] = const
• [H
2
O
2
]=1, 2, 3, ....razy większe od HJ
• Szybkość wzrastała zgodnie z równaniem
• v = k [HI][H
2
O
2
]
• Reakcja dwuetapowa:
• I.
HI + H
2
O
2
powoli
HIO + H
2
O
II.
HIO + HI
szybko
J
2
+ 2 H
2
O
• Ponieważ spotkanie się więcej niż trzech
cząsteczek równocześnie jest bardzo mało
prawdopodobne, można z góry przewidzieć, że
w reakcjach gdzie bierze udział więcej niż trzy
substraty są reakcjami etapowymi:
2 Br
-
+ 2H
+
+ H
2
O
2
= Br
2
+ 2H
2
O
powoli
Br
-
+ H
+
+ H
2
O
2
HOBr + H
2
O
Br
-
+ H
+
+ HOBr
szybko
Br
2
+ H
2
O
Reakcja III rzędu v = k [Br
-
][ H
+
][ H
2
O
2
]
2010-01-22
16
• Dla reakcji jednocząsteczkowych
równanie kinetyczne to
pierwszorzędowe v=kc
• Dla reakcji dwucząsteczkowych
równanie kinetyczne to drugorzędowe
v=kc
1
c
2
• Dla reakcji trójcząsteczkowych
równanie kinetyczne to trzeciorzędowe
v = k c
1
c
2
c
3
Reakcja jednocząsteczkowa
– reakcja, gdzie udział bierze tylko jedna
cząsteczka.
Np. HCOOC
2
H
5
= HCOOH + C
2
H
4
a zarazem reakcja pierwszego rzędu
HCOOC
2
H
5
v = k c
HCOOC2H5
2010-01-22
17
Reakcja dwucząsteczkowa
• – to reakcja uwarunkowana zderzeniem
dwóch cząsteczek
• Np. H
2
+ I
2
2HI
• a zarazem reakcja drugiego rzędu
• v= k c
H2
c
I2
Reakcja trójcząsteczkowa
• – to reakcje bardzo rzadkie, warunkowe
udziałem trzech cząsteczek
• Np. 2NO + O
2
= 2NO
2
(a zarazem
reakcja trzeciego rzędu
• v = k c
2
NO
c
O2
2010-01-22
18
• Zmiana szybkości reakcji może spowodować
zmianę kierunku reakcji powodując otrzymywanie
innego produktu np. odwadniając alkohol etylowy
za pomocą H
2
SO
4
można, zależnie od temperatury,
otrzymać eter etylowy lub etylen:
-H
2
O
-H
2
O
C
2
H
4
160 C
C
2
H
5
OH
120 C
C
2
H
5
O C
2
H
5
• lub reakcja tlenku węgla z wodorem:
• wysokie ciśnienie / Fe - Zn
• - CO + H
2
CH
3
OH
wysokie ciśnienie/ Ni
• - CO + H
2
CH
4
+ H
2
O
Wyszukiwarka
Podobne podstrony:
4 Badanie kinetyki reakcji zmy Nieznany (2)
chemia kliniczna cw 1 2011 id Nieznany
Chemia wyklady 2007 2008(1) id Nieznany
Kinetyka reakcji enzymatycznych Nieznany
CHEMIA FIZYCZNA - kinetyka reakcji sc, Ochrona Środowiska pliki uczelniane, Chemia
Chemia ogolna wyklad 3 2012 id Nieznany
Chemia 20102011 Etap Szkolny id Nieznany
4 Badanie kinetyki reakcji zmy Nieznany (2)
chemia kliniczna cw 1 2011 id Nieznany
chemia 3 etap gim 2012 id 11187 Nieznany
CHEMIA SA,,DOWA WYKLAD 7 id 11 Nieznany
chemia 2006 maj rozsz id 111803 Nieznany
Kinetyka IX id 235076 Nieznany
więcej podobnych podstron