Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 7
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
1
Ćwiczenie 7
Temat: OTRZYMYWANIE KWASÓW NUKLEINOWYCH
I IDENTYFIKACJA ICH PODSTAWOWYCH SKŁADNIKÓW.
Część teoretyczna
Kwasy nukleinowe są, obok białek, podstawowymi składnikami komórek zwierzęcych,
roślinnych i drobnoustrojów a także wirusów. Występują one we wszystkich elementach
komórkowych oraz w rozpuszczalnych frakcjach komórek. Związki te biorą udział w
podstawowych procesach biologicznych: syntezie białka, podziale komórki, przenoszeniu cech
dziedzicznych, są wreszcie podstawowym materiałem genetycznym. Hydroliza kwasów
nukleinowych prowadzi do powstania pojedynczych nukleotydów - nukleotyd stanowi więc
podstawową cegiełkę w budowie kwasów nukleinowych. Nukleotydy składają się z zasady
organicznej (pochodnej puryny lub pirymidyny), pentozy (D-rybozy lub D-2-deoksyrybozy) oraz
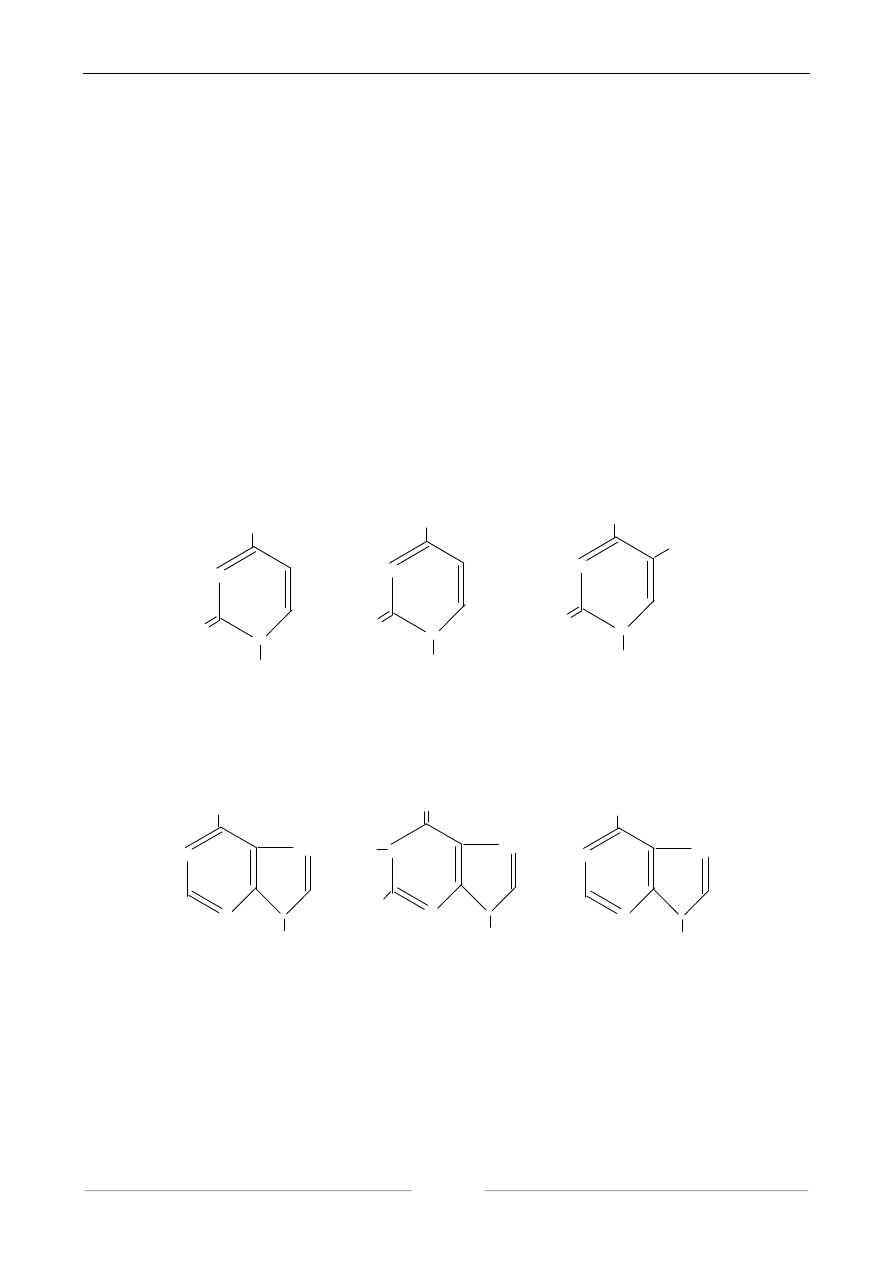
kwasu ortofosforowego. W skład kwasów nukleinowych wchodzą następujące zasady
pirymidynowe: cytozyna, uracyl, tymina.
N
N
O
NH
2
H
H
O
N
N
N
N
O
H
OH
OH
CH
3
cytozyna uracyl tymina
Z zasad purynowych w kwasach nukleinowych występują: adenina, guanina i hipoksantyna.
2
NH
N
N
N
N
H
H
N
N
N
N
H
N
N
N
N
H N
H
O
2
OH
adenina guanina hipoksantyna
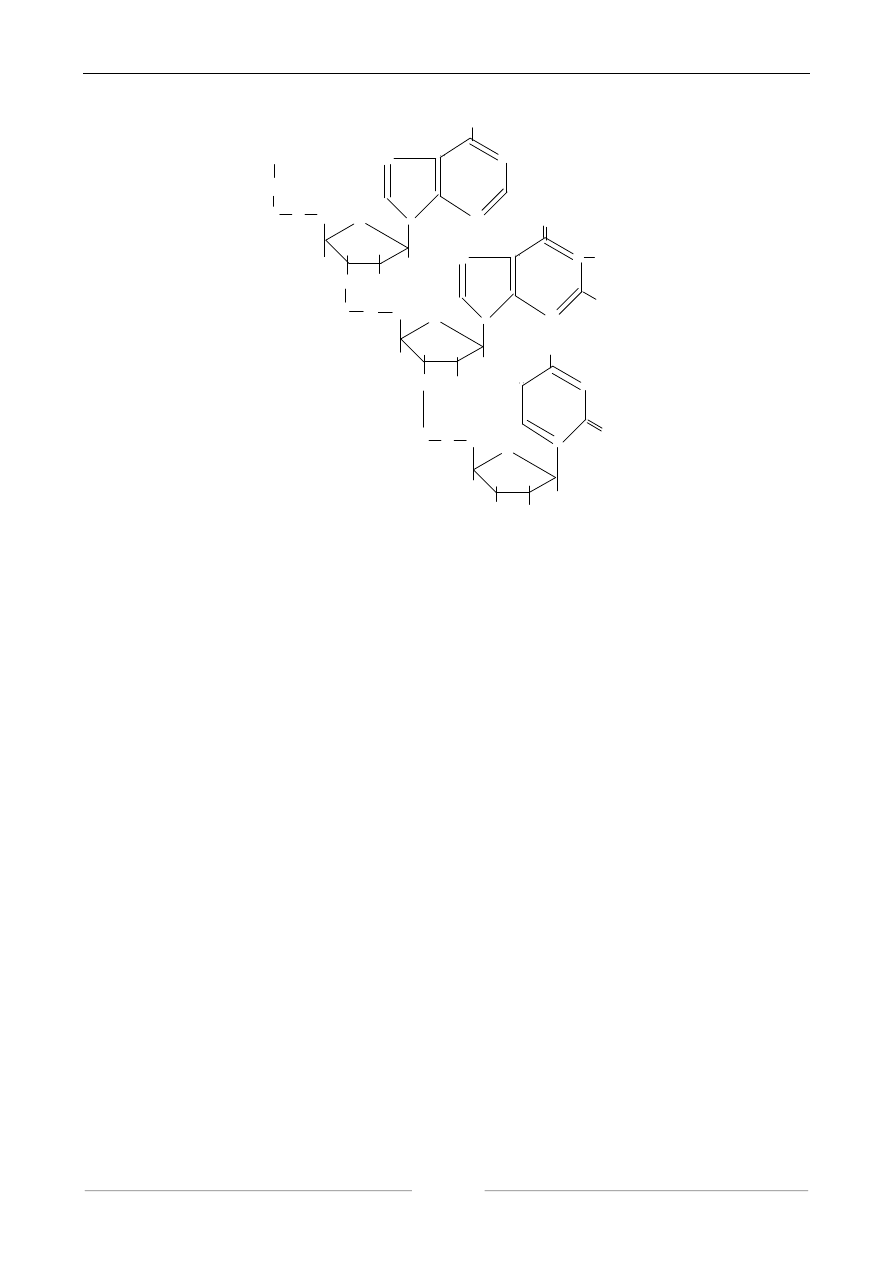
Zasada organiczna łączy się z rybozą lub deoksyrybozą wiązaniem N-glikozydowym tworząc
nukleozyd, a po przyłączeniu estrowo w pozycji C
5
kwasu ortofosforowego tworzy się nukleotyd.
Poszczególne nukleotydy łączą się ze sobą za pomocą cząsteczek kwasu fosforowego wiązaniem
dwuestrowym w cząsteczki kwasów nukleinowych. W zależności od tego czy w skład nukleotydu
wchodzi ryboza czy deoksyryboza, wyróżnia się kwasy rybonukleinowe (RNA) i kwasy
deoksyrybonukleinowe (DNA).
Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 7
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
2
N
N
O
P
O
CH
2
O
O
OH
O
O
2
CH
P
O
OH
N
N
NH
2
N
N
OH
O
O
2
CH
O
P
N
N
O
H
NH
2
2
NH
N
N
O
Ponadto DNA i RNA różnią się jeszcze składem zasad azotowych. W skład DNA wchodzą
zasady: adenina, tymina, guanina, cytozyna. Zaś w cząsteczce kwasów rybonukleinowych brak jest
tyminy a występuje uracyl.
Artykuły żywnościowe na ogół nie są bogatym źródłem kwasów nukleinowych. W mięśniach
ryb zawartość RNA mieści się w granicach od kilkudziesięciu do ponad 100 mg/100 g, a DNA
zaledwie kilka mg/100 g. Natomiast wątroba zwierząt rzeźnych oraz biomasa drobnoustrojów
zawiera od kilku do kilkunastu procent kwasów nukleinowych w suchej masie. Bogaty w kwasy
nukleinowe jest kawior. W artykułach żywnościowych występują również nukleotydy i produkty ich
przemian.
Cząsteczki DNA i RNA – silne polianiony - w komórkach są z reguły mocno związane z
kationowymi białkami. Połączenia kwasów nukleinowych i białek noszą nazwę nukleoprotein.
Białka związane z RNA to przede wszystkim białka rybosomowe. W deoksyrybonukleoproteinach
w charakterze komponentu białkowego występują głównie protaminy, histony i białka niehistonowe
(chromatynowe). Sposób połączenia komponenty białkowej i nukleinowej w nukleoproteinach nie
jest do końca jasny. Sugeruje się istnienie kilku typów tych połączeń. Największe uznanie zyskały:
1) elektrostatyczne oddziaływania (wiązania typu soli), gdzie rolę kwasu spełniają reszty
fosforowe kwasów nukleinowych lub grupy karboksylowe aminokwasów kwasowych, a rolę zasady
– grupy aminowe aminokwasów zasadowych lub grupy aminowe zasad purynowych i
pirymidynowych; 2) wiązania wodorowe między odpowiednimi atomami azotu i tlenu zasad
azotowych i aminokwasów; 3) wiązania chelatowe, w których jon dwuwartościowego metalu łączy
się ze związkiem organicznym dwoma wiązaniami, tj. jonowym, w którym zastępuje np. jon
wodoru i drugim – koordynacyjnym – z inną grupą związku organicznego. Nukleoproteiny bardzo
opornie rozpuszczają się w czystej wodzie, są niestabilne i bardzo wrażliwe na działanie różnych
czynników fizycznych i chemicznych powodujących ich degradację. Niewielki dodatek zasad, np.
NaHCO
3
, zwiększa rozpuszczalność nukleoprotein, powoduje jednak odszczepienie się kwasów
nukleinowych od białka, a nawet degradację kwasów rybonukleinowych bardziej wrażliwych na
hydrolizę zasadową.

Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 7
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
3
Część praktyczna
A) OTRZYMYWANIE KWASÓW NUKLEINOWYCH.
Znane są liczne metody wyodrębniania i oczyszczania kwasów nukleinowych. Najprostszą
metodą wydzielania nukleoprotein z tkanek zwierzęcych jest ich ekstrakcja z tkanki roztworami
chlorku sodu. Odpowiedni dobór stężeń roztworów chlorku sodu umożliwia oddzielne
wyodrębnianie z tkanek rybonuleoprotein i deoksyrybonukleoprotein. Tkankę należy ekstrahować
0,6% roztworem NaCl, w którym rozpuszczają się rybonukleoproteiny. Pozostałe w osadzie
deoksyrybonukleoproteiny ekstrahuje się 10% roztworem NaCl. Deoksyrybonukleoproteiny można
następnie wytrącić za pomocą alkoholu etylowego. Aby uniknąć depolimeryzcji nukleoprotein
wszystkie czynności należy wykonywać w temperaturze 0-2
o
C. Do homogenizacji tkanki stosuje się
roztwór chlorku sodu z dodatkiem cytrynianu sodu, który inaktywuje nukleazy.
1. OTRZYMYWANIE DNA Z WĄTROBY.
Wykonanie:
10 g zamrożonej wątroby pokroić na kawałki i homogenizować z 40 ml
oziębionego do
temperatury 4
o
C 0,6% NaCl w cytrynianie sodu przez 3 minuty. Homogenat wirować 10 minut.
Supernatant odrzucić. Otrzymany osad przenieść do zlewki na 250 ml, zalać 50 ml oziębionego
10% NaCl. Zlewkę umieścić w łaźni z lodem i osad ekstrahować przez 15 minut mieszając
energicznie. Po zakończeniu ekstrakcji zawiesinę odwirować. Płyn znad osadu zawierający
uwolnione cząsteczki DNA zlać do zlewki.
Wytrącanie DNA z roztworu:
W zlewce na 500 ml
przygotować 120 ml oziębionego alkoholu etylowego 96% i powoli
cienkim strumieniem wlewać otrzymany supernatant, w którym znajdują się kwasy DNA. Mieszać
ciągle bagietką, obserwować wytrącanie się włókien DNA. Wytrącające się włókna nawinąć na
bagietkę, wysuszyć na bibule i używać do dalszych prób jakościowych.
2. OTRZYMYWANIE RNA Z DROŻDŻY.
Wykonanie :
30 g drożdży piekarskich dokładnie rozetrzeć z 40 ml
0,4% NaOH. Osad odwirować,
supernatant przenieść do zlewki i zakwasić 15 ml 5% kwasu octowego. Roztwór wlać do naczynia
wirówkowego, do którego odmierza się uprzednio 40 ml etanolu zakwaszonego HCl. Po kilku
minutach wytrąca się osad RNA, który po odwirowaniu (3000 obr./min przez 10 minut) i zlaniu
supernatantu należy rozpuścić w małej ilości 0,4% NaOH (maksymalnie 8 ml) i zachować do prób
jakościowych.
B) IDENTYFIKACJA POSZCZEGÓLNYCH SKŁADNIKÓW NUKLEOPROTEIN
Wyróżnia się dwa sposoby badania składników kwasów nukleinowych. Pierwszy z nich
wymaga hydrolizy tych związków do składników podstawowych, tj. kwasu fosforowego, pentozy
oraz zasad azotowych, a następnie ich rozdziału. Drugi sposób badania składników kwasów
nukleinowych związany jest z wywoływaniem reakcji barwnych w preparatach niehydrolizowanych
lub po hydrolizie bez stosowania rozdziału składników podstawowych. Niehydrolizowane kwasy
nukleinowe (DNA i RNA) wykazują reakcję wspólną na obecność pentoz, tzw. reakcję Biala i
Tollensa. Natomiast reakcją odróżniającą oba typy kwasów w formie niehydrolizowanej jest reakcja
Dischego na obecność -D-2-deoksyrybozy (składnik DNA).

Biochemia
ŻYWIENIE CZŁOWIEKA
Ćwiczenie 7
Uniwersytet Rolniczy w Krakowie
Katedra Biotechnologii Żywności
4
1. WYKRYWANIE BIAŁKA - PRÓBA BIURETOWA
Wykonanie:
Do identyfikacji białka w badanej próbce kwasu nukleinowego można wykorzystać próbę
biuretową opisaną w ćwiczeniach nr 2 (1 ml próbki badanej + 2 ml 10% NaOH + 2-3 krople 1%
roztworu CuSO
4
).
2. WYKRYWANIE PENTOZ
a) PRÓBA TOLLENSA ( Z FLOROGLUCYNĄ)
Wykonanie:
Do 2 probówek pobrać otrzymane DNA i RNA, dodać po 1ml
stężonego HCl i po 1 ml
floroglucyny i ogrzewać we wrzącej łaźni wodnej. W obu przypadkach powstaje czerwony
produkt kondensacji.
b) PRÓBA BIALA
Wykonanie:
Do 2 probówek pobrać otrzymane DNA i RNA, dodać 2 ml
0,2% roztworu orcyny w 20%
roztworze HCl i dodać kroplę 1% roztworu FeCl
3
. Ogrzewać we wrzącej łaźni wodnej 5-10
minut. W obecności pentoz tworzy się barwa zielona.
3. ODRÓŻNIENIE DNA OD RNA – REAKCJA DISCHEGO
Wykonanie:
Do probówek z DNA i RNA dodać po 3 ml 0,4% NaOH i dokładnie rozgnieść bagietką
(szczególnie DNA), przesączyć. Do 1 ml przesączu wprowadzić 2 ml odczynnika dwufenyloaminy.
Zawartość probówek ogrzewać przez 10 minut we wrzącej łaźni wodnej. W przypadku DNA
powstaje barwa niebieska, w przypadku RNA reakcja jest negatywna.
4. WYKRYWANIE ZASAD PURYNOWYCH
Wynik dodatni dają tylko wolne zasady purynowe dlatego najpierw należy przeprowadzić
hydrolizę otrzymanych kwasów nukleinowych. W próbie z AgNO
3
czynnikiem hydrolizującym
łańcuchy DNA i RNA jest 5% H
2
SO
4
, zaś w reakcji mureksydowej stężony HNO
3
.
a) PRÓBA Z AgNO
3
Wykonanie:
Do probówek z DNA i RNA dodać po 5 ml
5% H
2
SO
4
i ogrzewać 30 minut na wrzącej
łaźni wodnej. Zobojętnić stężonym amoniakiem wobec czerwieni metylowej i odsączyć
przez bibułę do innej probówki. Do przesączu dodać kilka kropli 10% AgNO
3
. Tworzy się
biały osad kompleksu puryn ze srebrem.
b) PRÓBA MUREKSYDOWA
Wykonanie:
DNA i RNA umieścić w parowniczkach, zadać kilkoma kroplami stężonego HNO
3
i
odparować do sucha. Pozostałość zwilżyć kilkoma kroplami amoniaku w obecności zasad
purynowych pojawia się czerwone zabarwienie purpuranu amonu (mureksydu).
5. WYKRYWANIE KWASU ORTOFOSFOROWEGO
Dla wykazania obecności kwasu ortofosforowego w cząsteczkach nukleotydów tworzących
DNA i RNA niezbędnym jest przeprowadzenie uprzedniej hydrolizy tych makrocząsteczek. W
proponowanym doświadczeniu czynnikiem hydrolizującym jest 0,5 M roztwór HCl.
Wykonanie: Do probówek z DNA i RNA dodać po 0,3 ml 0,5 M HCl i po przykryciu probówek
korkami plastikowzmi ogrzewać we wrzącej łaźni wodnej przez 15 minut. Po oziębieniu dodać 1 ml
odczynnika molibdenowego i 1 ml reduktora. Probówki wstawić na chwilę do wrzącej łaźni
wodnej. Obserwować tworzenie się niebieskiego kompleksu fosforowo-molibdenowego.
Ostatnie zmiany: 13.02.2013
Wyszukiwarka
Podobne podstrony:
Biochemia(ZCz)Cw4 Klasyfikacja Nieznany (2)
Biochemia(ZCz)Cw5 Wlasciwosci f Nieznany
Biochemia(ZCz)Cw6 Oznaczanie za Nieznany (2)
Biochemia(ZCz)Cw6 Oznaczanie za Nieznany (2)
biochemia cukry instrukcja id 8 Nieznany (2)
biochemia kolo id 86264 Nieznany (2)
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
biochemia egzam1 id 86330 Nieznany
biochemia roślin, karoteny, OTRZYMYWANIE KAROTENÓW
2 Synteza acetonaftonu i otrzym Nieznany
Cw 2 Biochemia OS id 121642 Nieznany
Biochemia Wyklad 2 id 86540 Nieznany (2)
Biochemia II Wypasiony Egzamin Nieznany (2)
15 BIOCHEMIA 2008 Metabolizm we Nieznany
# Skrypt Biochemia czesc4 id 30 Nieznany
Biochemia 8K Fosforylacja oksyd Nieznany
BIOCHEMIA egzamin2 id 86591 Nieznany
Biochemia(ŻCz)Ćw2 Właściwości fizyko chemiczne białek
więcej podobnych podstron