1
ĆWICZENIE 1
Otrzymywanie proszków metali nieżelaznych: Cu i Ag, w wyniku
elektrolizy z roztworów wodnych.
1. Metody wytwarzania proszków.
Wytwarzanie proszków obejmuje zespól procesów mechanicznych i fizykochemicznych, które
mają na celu uzyskanie określonego materiału w postaci proszku. Proszek może być produktem
mechanicznego rozdrobnienia materiału bez zmiany jego składu chemicznego lub produktem
reakcji chemicznych z innych substancji. Obecnie z każdego metalu o znaczeniu technicznym
można uzyskać proszek.
Metody wytwarzania proszków:
mechaniczne
fizykomechaniczne
fizyczne
chemiczne
fizykochemiczne
- mielenie
- kruszenie
- rozbijanie
- obróbka
skrawaniem
- rozpylanie
- granulacja
- odparowanie
i
kondensacja
- redukcja tlenków
i innych związków
- dysocjacja
tlenków
i innych związków
korozja między-
krystaliczna
- samo rozpad
- hydrogenizacja -
dehydrogenizacja
- redukcja metalo-
termiczna soli
- redukcja roztworów
wodnych
soli wodorem
- redukcja roztworów
wodnych soli przez
wypieranie
- elektroliza
roztworów wodnych
soli
- elektroliza
stopionych soli
- synteza i dysocjacja
karbonylków
- zol - żel
2. Otrzymywanie proszku miedzi i srebra metodą elektrolizy.
Proszki miedzi i srebra otrzymuje się metodą elektrolizy, gdzie reduktorem (dostarczenie
elektronów) jest prąd elektryczny. Proszki miedzi otrzymuje się metodą elektrolizy kwaśnych
roztworów siarczanu miedzi, a proszki srebra metodą elektrolizy roztworu azotanu srebra.
Metal lub przewodnik elektronowy zanurzony w roztworze elektrolitu nazywa się elektrodą.
W każdym procesie elektrochemicznym bierze udział co najmniej jedna para elektrod.
Reakcję elektrodową, w której elektrony są substratami nazywamy reakcją katodową. W
reakcji katodowej zachodzi zawsze redukcja. Elektrodę, na której zachodzi reakcja anodowa
nazywamy anodą. Cechą reakcji anodowej jest utlenianie substancji.
Elektrolityczne otrzymywanie metali może odbywać się w roztworach wodnych lub solach
stopionych.

2
Proszki miedzi otrzymuje się metodą elektrolizy kwaśnych roztworów siarczanu miedzi, a proszki
srebra metodą elektrolizy roztworu azotanu srebra
Rozkład roztworów związków metali lub ich soli pod wpływem przepływu prądu stałego
zachodzi zgodnie z zależnością:
W przemysłowych procesach elektrolizy z roztworów wodnych rozróżnia się dwa sposoby
przeprowadzenia procesu:
z anodą nierozpuszczalną
Podczas wytwarzania proszków w metodzie elektrolitycznej z nierozpuszczalną anodą
źródłem jonów metalu jest elektrolit. W tej metodzie anoda wykonana jest np. z grafitu, stali
kwasoodpornych lub aluminium. W wyniku procesu elektrolizy, masa anody nie zmienia się
w czasie elektrolizy; zmianie ulega skład chemiczny elektrolitu.
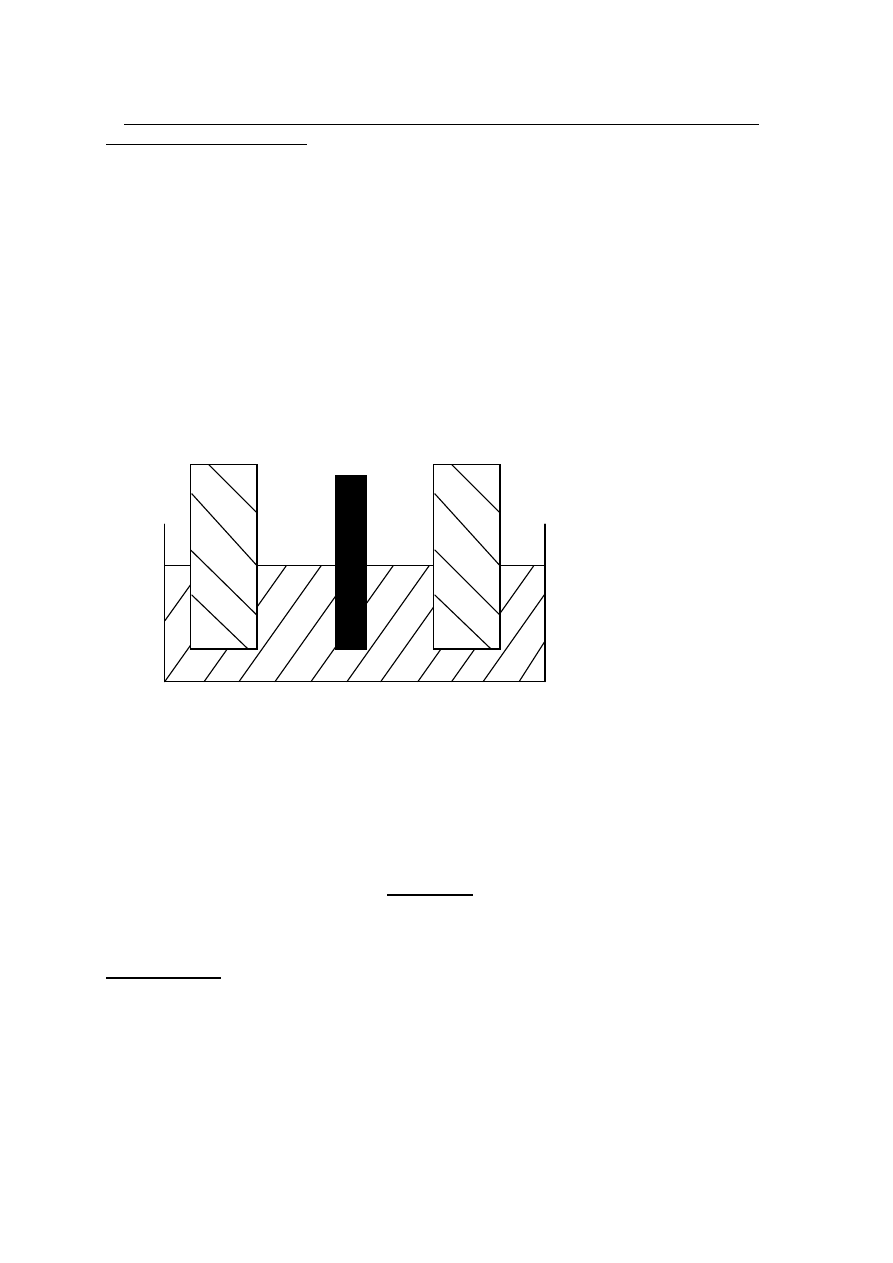
Elektrolizer z anodą nierozpuszczalną schematycznie można przedstawić następująco:
Pb, PbO
2
|(Cu
2+
, S0
4
-
, H
2
0)| Cu
Pb, PbO
2
przedstawiają tutaj nierozpuszczalną anodę ołowiową, na której wydziela
się podczas elektrolizy tlen.
Reakcje anodowe i katodowe przebiegają zgodnie z równaniami:
H
2
O = 2H
+
+ 0,5 O
2
+ 2e
Cu
2+
+ 2e = Cu
Sumaryczna reakcja chemiczna w elektrolizerze:
Cu
2+
+ H
2
O = Cu + 0,5 O
2
+ 2H
+
Zmiana entalpii swobodnej tak napisanej reakcji jest większa od zera (
G°>0), co oznacza,
że proces nie zachodzi samorzutnie w kierunku z lewej strony na prawą.
z anodą rozpuszczalną
Podczas wytwarzania proszków w metodzie elektrolitycznej z rozpuszczalną anodą źródłem
jonów metalu jest anoda wykonana z metalu poddawanego elektrolizie. W wyniku procesu
elektrolizy, masa anody zmniejsza się w wyniku jej rozpuszczania, a skład chemiczny
elektrolitu zmienia się nieznacznie.

3
2.1 Otrzymywanie proszku miedzi metodą elektrolizy (proces z rozpuszczalnymi anodami –
elektrorafinacja)
Przykładem elektrolizera z anodą rozpuszczalną jest wanna do elektrorafinacji miedzi.
Zachodzą tam reakcje:
Cu = Cu
2+
+ 2e (anoda)
Cu
2+
+ 2e = Cu (katoda)
Dodając do siebie obie reakcje elektrodowe otrzymamy:
Cu
A
= Cu
K
Czyli jedynym efektem obserwowanym jest przenoszenie miedzi z anody (A) na katodę (K).
W praktyce w procesie elektrolizy stosujemy napięcie 3 V, potrzebne do pokonania oporów
omowych i napięć na elektrodach. Pod wpływem przepływającego przez elektrody prądu
następuje roztwarzanie metalu z anody w elektrolicie, a następnie wydzielenie metalu na
katodzie. Metal z anody przechodzi do roztworu w postaci kationów, które ulegają
zobojętnieniu w przestrzeni katody i osadzają się na jej powierzchni. W zależności od
gęstości prądu oraz stężenia elektrolitu można uzyskać różny stopień granulacji proszku.
Elektrorafinacja miedzi:
Skład elektrolitu:
koncentracja miedzi Cu:
10-18 g/l
koncentracja H
2
SO
4:
130-200 g/l
Temperatura: 35-50
◦
C
Gęstość prądu:
- gęstość katody:
4026 A/m
2
- gęstość anody:
420 A/m
2
Powstający osad na katodzie strąca, a następnie poddaje się go płukaniu, suszy w suszarkach
próżniowych i w kolejnym etapie redukuje wodorem. W rezultacie uzyskuje się proszek o
kształcie dendrytycznym i wielkości poniżej 45 μm i zawartości Cu powyżej 99,9%.
2.2 Otrzymywanie proszków srebra metodą elektrolizy (proces z rozpuszczalnymi anodami –
elektrorafinacja)
Analogiczne reakcje zachodzą w przypadku srebra:
Ag = Ag
+
+ e (anoda)
Ag
+
+ e = Ag (katoda)
Dodając do siebie obie reakcje elektrodowe otrzymamy:
Ag
A
= Ag
K
Także w tym przypadku stosuje się napięcie 1 do 1,3 V potrzebne do pokonania oporów i
napięć na elektrodach.
4
3. Otrzymywanie proszków miedzi i srebra metodą elektrolizy (proces z rozpuszczalnymi
anodami – elektrorafinacja):
Elektrorafinacja srebra:
Skład elektrolitu:
koncentracja Ag - 60 g/l
koncentracja HNO
3
- 130 g/l
temperatura: 35 – 45
◦
C
Gęstość prądu:
- gęstość katody: 1000 – 2000 A/m
2
Metodą elektrolizy możliwe jest wytworzenie proszków większości metali, a otrzymany
materiał charakteryzuje się bardzo wysoką czystością i dobrymi własnościami (dobrą
formowalnością i aktywnie się spiekają).
Schemat procesu:
Teoretyczna masa miedzi (I Prawo Faraday’a):
m = k · I · t
m – teoretyczna masa miedzi [g], k – równoważnik chemiczny, I – natężenie prądu [A], t – czas procesu[s]
Wydajność procesu elektrorafinacji metali określa współczynnik wydajności prądowej:
Przy prawidłowo dobranych parametrach, sprawność metody jest większa od 70%.
Sprawozdanie:
Opisać proces otrzymywania proszków srebra i miedzi metodą elektrolizy.
Przedstawić schemat procesu (elektrolizera).
Obliczyć teoretyczną ilość srebra / miedzi, jaka powinna wydzielić się na katodzie.
Obliczyć wydajność elektrolizy w oparciu pomiar masy wydzielonego osadu katodowego lub
ubytku masy anody.
ANODA (+) KATODA (-) ANODA (+)
Wyszukiwarka
Podobne podstrony:
Algorytmy Genetyczne AG 3 id 61 Nieznany (2)
Antologia wstep by AG id 18051 Nieznany (2)
AG 04 id 52754 Nieznany
Licencja na logo Cu id 267791 Nieznany
AG 03 id 52753 Nieznany
AG 04 id 52754 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
więcej podobnych podstron