2009-11-24
1
Chemia III
Powłoki
elektronowe
Powłoki elektronowe
• Elektrony tworzące chmurę elektronową
poruszają się wokół jądra w pewnych ściśle
określonych obszarach tzw. orbitalach
(powłokach) elektronowych.
• Elektrony wchodzące w skład powłoki posiadają
zbliżone wartości energii (kinetycznej ruchu
wokół jądra i potencjalnej w stosunku do jądra).
• Obszary poza powłokami są dla elektronów
niedozwolone.
• Im powłoka leży w większej odległości od jądra
tym energia elektronów należących do tej
powłoki jest większa.
2009-11-24
2
• Na każdej powłoce elektronowej może
znajdować się ściśle określona ilość
elektronów, które nie może przekroczyć
liczby równej:
2xn
2
n jest numerem powłoki licząc od jądra.
• Elektrony znajdujące się na ostatniej powłoce
elektronowej nazywają się elektronami
walencyjnymi.
• Ich ilość i rozmieszczenie ma decydujący wpływ
na własności chemiczne danego pierwiastka.
Równanie Schrodingera
(funkcja falowa ψ,):
Jeśli układ ma stałą w czasie energię E (stan
stacjonarny), to funkcję falową takiego stanu możemy
przedstawić następująco:
Ψ(x,y,z,t) = ψ(x,y,z) exp(-iEt/ħ)
Funkcja falowa, w najogólniejszej postaci funkcja
zespolona, nie ma bezpośredniego sensu
fizycznego. Dopiero jej kwadrat interpretujemy jako
gęstość prawdopodobieństwa znalezienia cząstki.
2009-11-24
3
• Właściwie wszystkie wielkości fizyczne mierzone w
mikroświecie atomów i cząsteczek podlegają zjawisku
kwantowania, tzn. mogą przyjmować tylko pewne
ściśle określone wartości.
• Np. elektrony w atomie znajdują się na ściśle
określonych orbitach i mogą znajdować się tylko tam,
z dokładnością określoną przez
. Z kolei każdej orbicie odpowiada
pewna energia.
• W podobny sposób zachowują się także inne
wielkości np.
.
• Wobec takiego stanu rzeczy naturalnym pomysłem
było po prostu ponumerowanie wszystkich możliwych
wartości np. energii czy momentu pędu. Te numery to
właśnie liczby kwantowe.
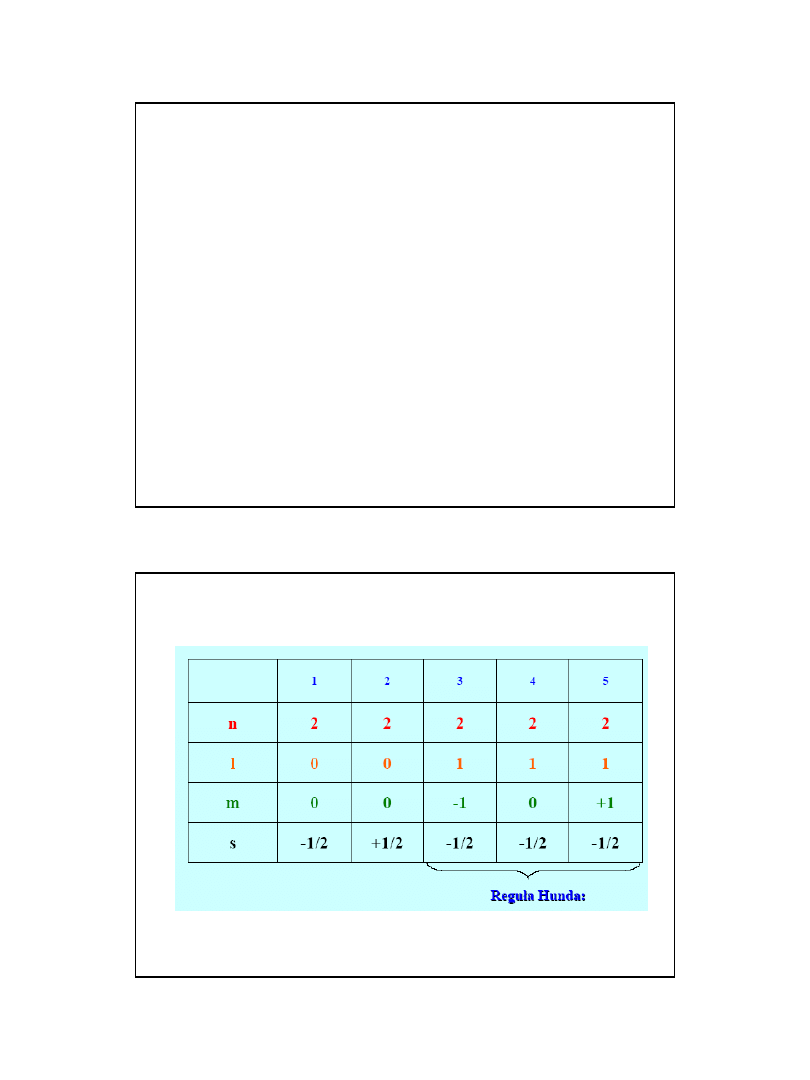
Równanie Schrodingera
(funkcja falowa ψ,):
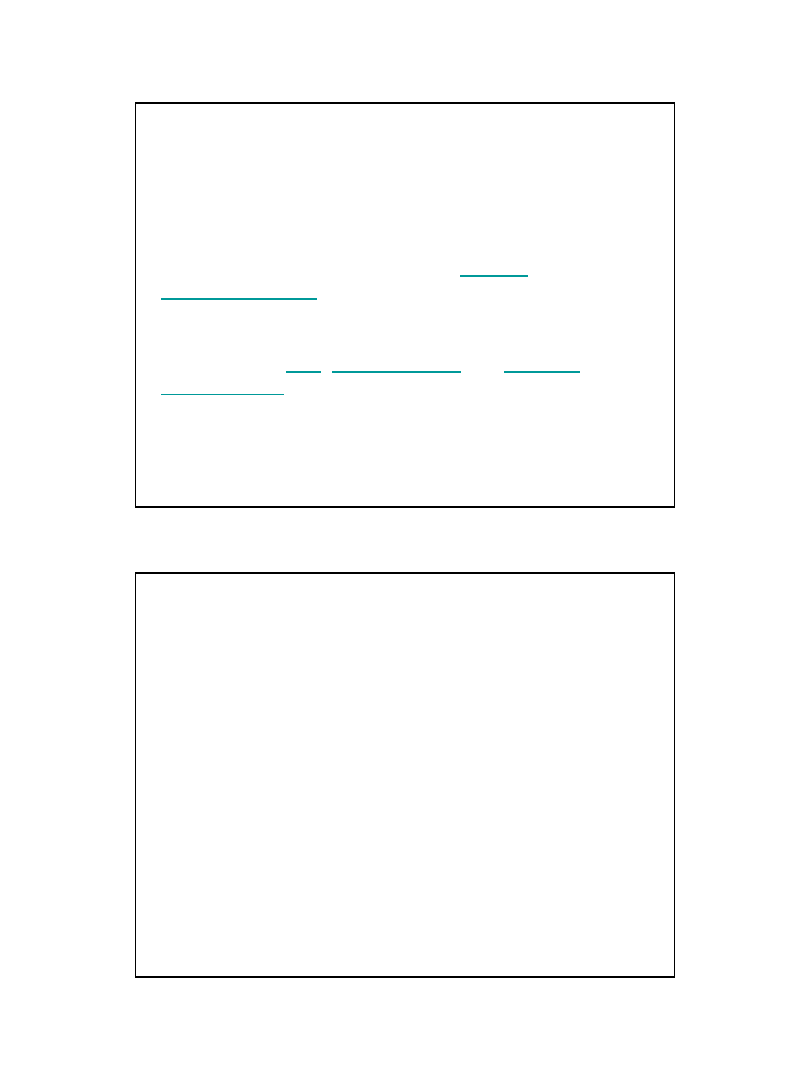
• Liczby kwantowe:
Główna (n): 1, 2, 3, 4, 5, 6, 7
Poboczna (
l ≤ n-l): 0, 1, 2, 3, 4, …, n-1
Magnetyczna (m = -l
÷ +l): -l, 0, l
Spinowa(s): -1/2, +1/2
n -
nr okresu (powłoki)
l
–typ podpowłoki
m
–typ orbitala
2009-11-24
4
Liczby kwantowe
• Główna liczba kwantowa (n)
-
przyjmuje wartości kolejnych liczb naturalnych
1, 2, 3, ... (wg Bhora K, L, M, ...);
-
od niej zależy energia danego elektronu;
- decyduje o rozmiarach orbitali -
im większa
wartość n, tym większy jest orbital;
-
maksymalna ilośc elektronów w powłoce
wynosi 2m2 (kwadrat)
Poboczna
• Poboczna liczba kwantowa (l)
-
przyjmuje wartości liczb całkowitych od 0
do n-
1 włącznie;
-
precyzuje dokładniej stan energetyczny
danej powłoki;
-
liczba stanów kwantowych wyraża się
wzorem 4l + 2
2009-11-24
5
Magnetyczna
Magnetyczna liczba kwantowa (m)
-
przyjmuje wartości liczb całkowitych takich, że -
1 jest mniejsze bądź równe n, które jest
mniejsze bądź równe +1
-1< n >+1;
-
określa rzut momentu pędu na wyróżniony
kierunek;
-
decyduje o wzajemnych ułożeniu orbitali w
przestrzeni
Magnetyczna spinowa
Magnetyczna spinowa liczba kwantowa
(ms)
-
charakteryzuje rut spinu na wyróżniony
kierunek w przestrzeni;
-
może przyjmować tylko dwie wartości
+1/2 lub -1/2
2009-11-24
6
Poziomy i orbitale
•
n
l
1 = K
2 = L
3 = M
4 = N
5 = O
6 = P
7 = Q
0 = s
1 = p
2 = d
3 = f
4 = g
5 = h
6 = i
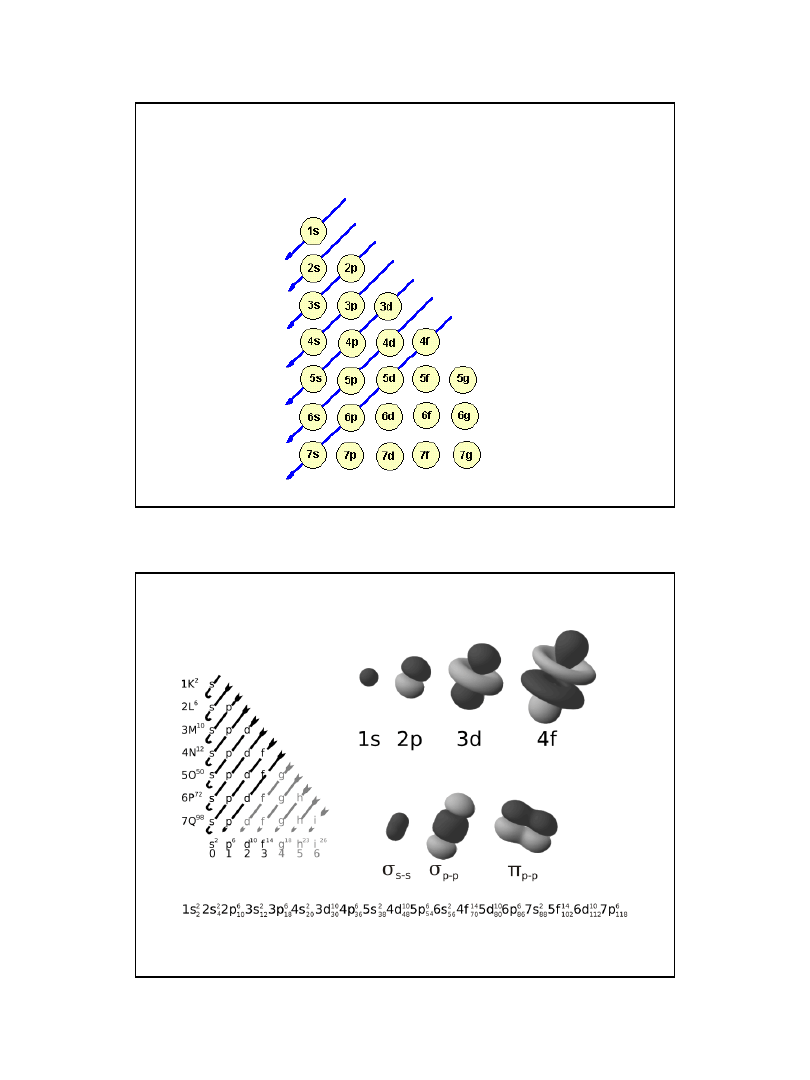
Elektron zajmuje ten spośród wolnych stanów (orbitali), który ma
mniejszą wartość sumy głównej i pobocznej liczby kwantowej
n+l, a jeżeli wolne są dwa stany o takiej samej wartości n+l, to
elektron zajmuje stan o niższej wartości n.
W myśl tej reguły orbital 4s (4+0) obsadzany
jest przed 3d (4+0 < 3+2), natomiast orbital
3d przed 4p (3+2 = 4+1).
n
l
s
p
d
f
1
2
3
4
5
0
0
0
0
0
1
1
1
1
2
2
2
3
3
2009-11-24
7
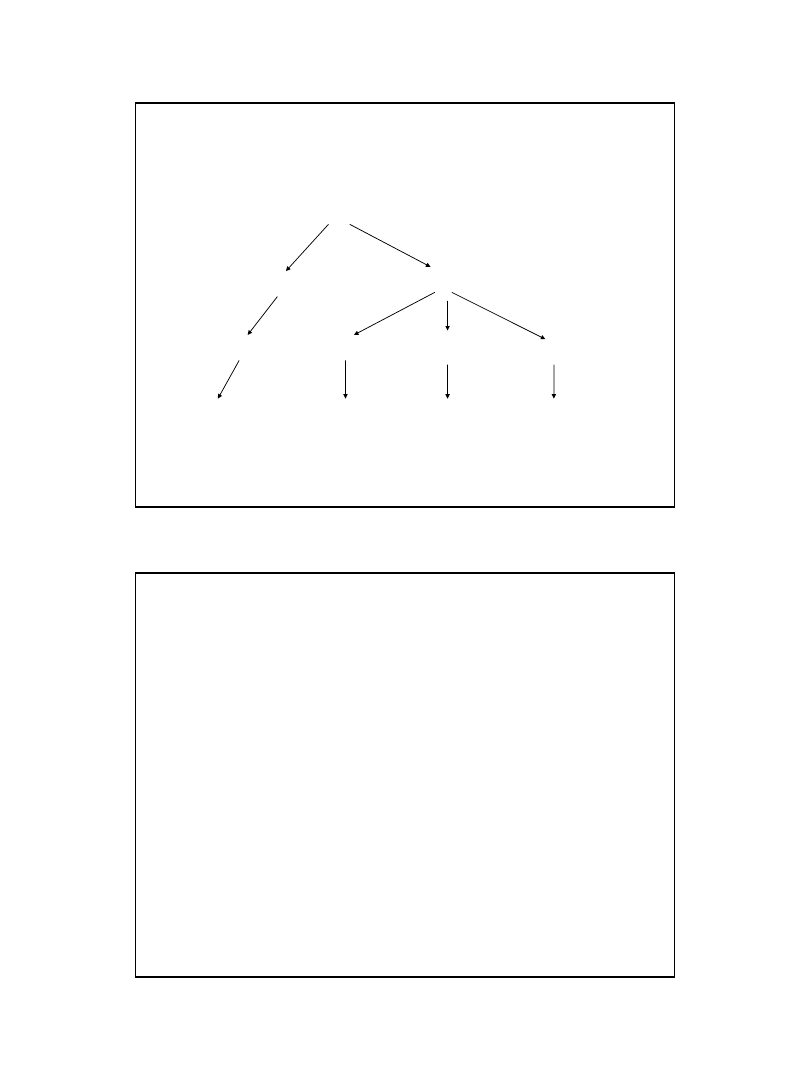
Sposób zapełniania orbitali w
atomie
Kształty orbitali
2009-11-24
8
• n =
2
• l=
0
1
•
m = 0
-1
0
1
•
• ± ½
±1/2
±1/2
±1/2
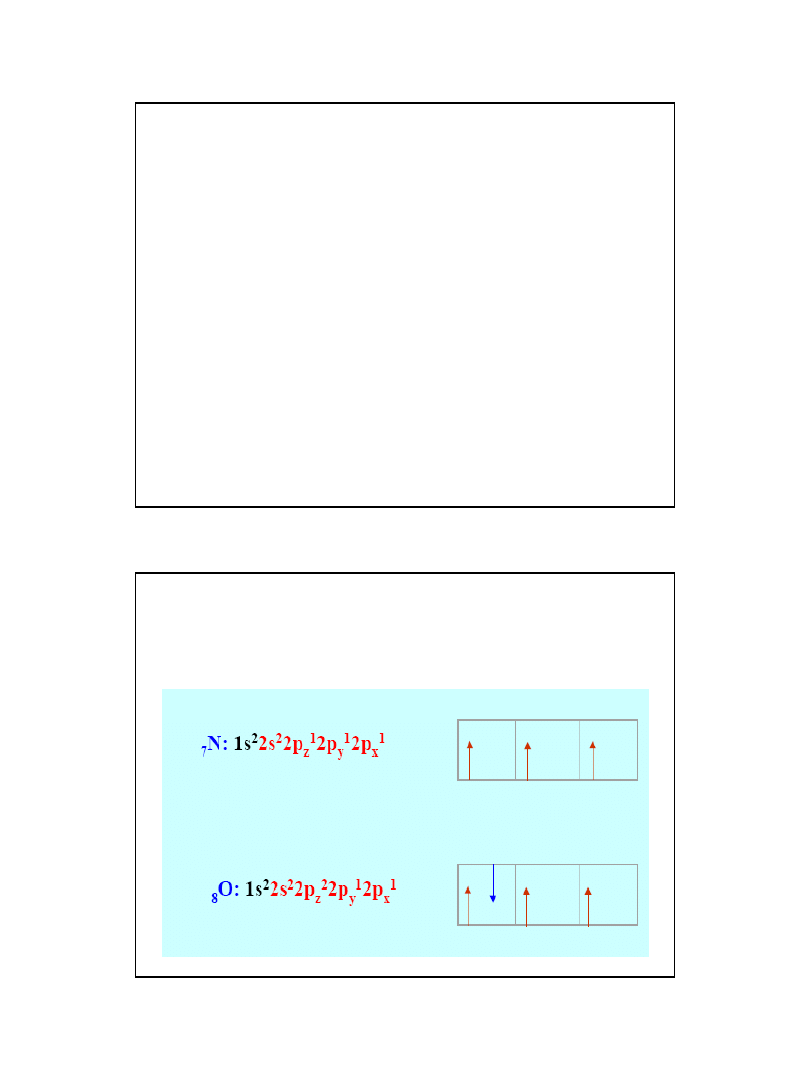
Konfiguracja elektronowa
• Konfiguracja elektronowa (struktura elektronowa)
pierwiastka
– uproszczony opis atomu polegający na
rozmieszczeniu
elektronów
należących do atomów
danego pierwiastka na poszczególnych powłokach,
podpowłokach i orbitalach. Każdy
elektron
znajdujący się w atomie opisywany jest przy pomocy
zbioru
liczb kwantowych
.
• Na podstawie konfiguracji elektronowej atomu
można określić położenie pierwiastka w układzie
okresowym i opisać jego właściwości chemiczne.
2009-11-24
9
Reguła Hunda:
1. W danej podpowłoce powinna być możliwie
największa liczba niesparowanych elektronów;
2. Niesparowane elektrony zajmujące poziomy
orbitalne danej podpowłoki mają identyczny
spin;
3. Pary elektronów tworzą się dopiero po
zapełnieniu wszystkich poziomów orbitalnych
danej podpowłoki przez niesparowane
elektrony.
Regu Hunda:
Elektrony w atomie obsadzają najniższe dostępne
poziomy energetyczne
2009-11-24
10
Zakaz Pauliego
Określony poziom energetyczny atomu
obsadzony może być tylko przez jeden
elektron o takich samych 4 liczbach
kwantowych,
w jednym atomie dwa elektrony muszą
różnić się wartością przynajmniej
jednej liczby kwantowej (np. w
jednym poziomie orbitalnym muszą
mieć przeciwną orientację spinu).
•
7
X: [He]2s
2
2p
x
1
2p
y
1
2p
z
1
Zakaz Pauliego
2009-11-24
11
Rdzeń i elektrony walencyjne
• Rdzeń, czyli zrąb atomu, stanowi tę
część atomu, która uczestnicząc w reakcji
chemicznej
lub
w
wielu
kolejnych
reakcjach,
zachowuje
ilość
i
rodzaj
składników
• rdzeń
to
jądro
wraz
z
elektronami
niewalencyjnymi.
• Elektrony walencyjne to te elektrony,
które podczas reakcji chemicznej biorą
udział w tworzeniu wiązań chemicznych.
2
1
jądro
4
3
35
Br 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
5
Elektrony
elektrony
rdzenia
walencyjne
2009-11-24
12
Konfiguracja walencyjna
jest
to
fragment
konfiguracji
elektronowej dotyczący elektronów
walencyjnych,
np.
35
Br 1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
5
Elektrony rdzenia
elektrony
walencyjne
35
Br [Ar] 3d
10
4s
2
4p
5
Elektrony
elektrony
rdzenia
walencyjne
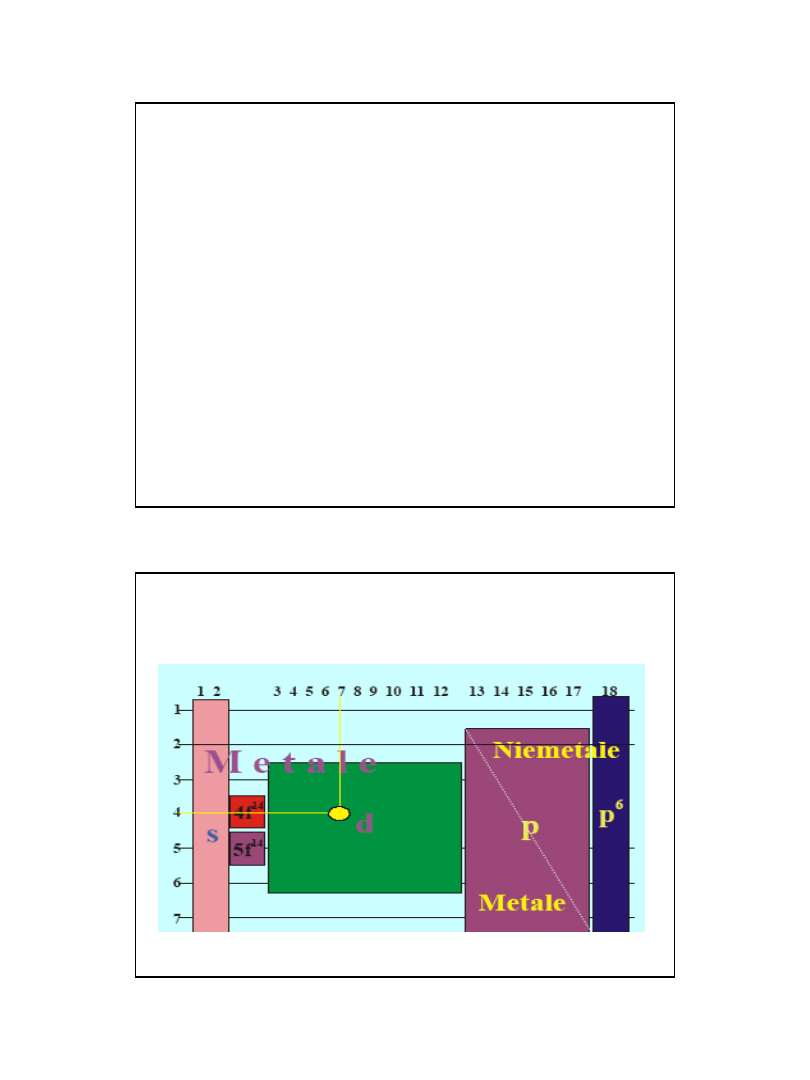
Bloki w ukł. okresowym
2009-11-24
13
Podaj konfigurację elektronową atomu
pierwiastka o liczbie atomowej Z = 15.
•
15
X:1s
2
2s
2
2p
6
3s
2
3p
3
;
15
X:[Ne]3s
2
3p
3
• Pierwiastek
• bloku p,
niemetal
• 3 okres,
15 grupa,
• Stopień utlenienia: od -III do V
Podaj konfigurację elektronową atomu
pierwiastka o liczbie atomowej Z = 25.
•
25
X:1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
5
•
25
X:[Ar]4s
2
3d
5
Pierwiastek
• bloku d,
metal,
• 4 okres,
7 grupa
• Stopień utlenienia: od 0 do VII
2009-11-24
14
Ogólne zasady ustalania
konfiguracji
Elektrony zajmują kolejne orbitale na kolejnych
powłokach tak aby atom jako całość posiadał jak
najniższą energię.
W przypadku pierwiastków z grup głównych
teoretyczne obliczenie energii
elektronów na poszczególnych orbitalach jest
stosunkowo proste.
Dlatego można tu podać ogólne reguły zapełniania
kolejnych orbitali, dzięki której znając
danego pierwiastka można łatwo
samemu ustalić jego konfigurację
Reguły te to:
• 1. Zapełniene są orbitale w kolejności: "s", "p",
"d" i "f"
• 2. Orbitale z wyższych poziomów są
zapełniania dopiero po całkowitym zapełnieniu
niższych.
• 3. Maksymalna liczba elektronów na orbitalach
to: s - 2, p - 6, d – 10, f - 14
• 4. Pierwsza powłoka zawieta tylko orbital s,
druga orbitale s i p, trzecia i czwarta są a w
piąta i szósta orbitale s, p, d i f.
2009-11-24
15
Warunki pisania konfiguracji
elektronowej:
- reguła Hunda
- elektrony w stanie
stacjonarnym rozmieszczane są w
podpowłokach i powłokach, zaczynając od
najniżej energetycznych.
- W przypadku ciężkich metali z grup
pobocznych oraz lantanowców reguły te
zawodzą. Np. przed pełnym obsadzeniem
orbitali z powłoki drugiej, zaczynają już się
zapełnianiać orbitale s i p powłoki trzeciej
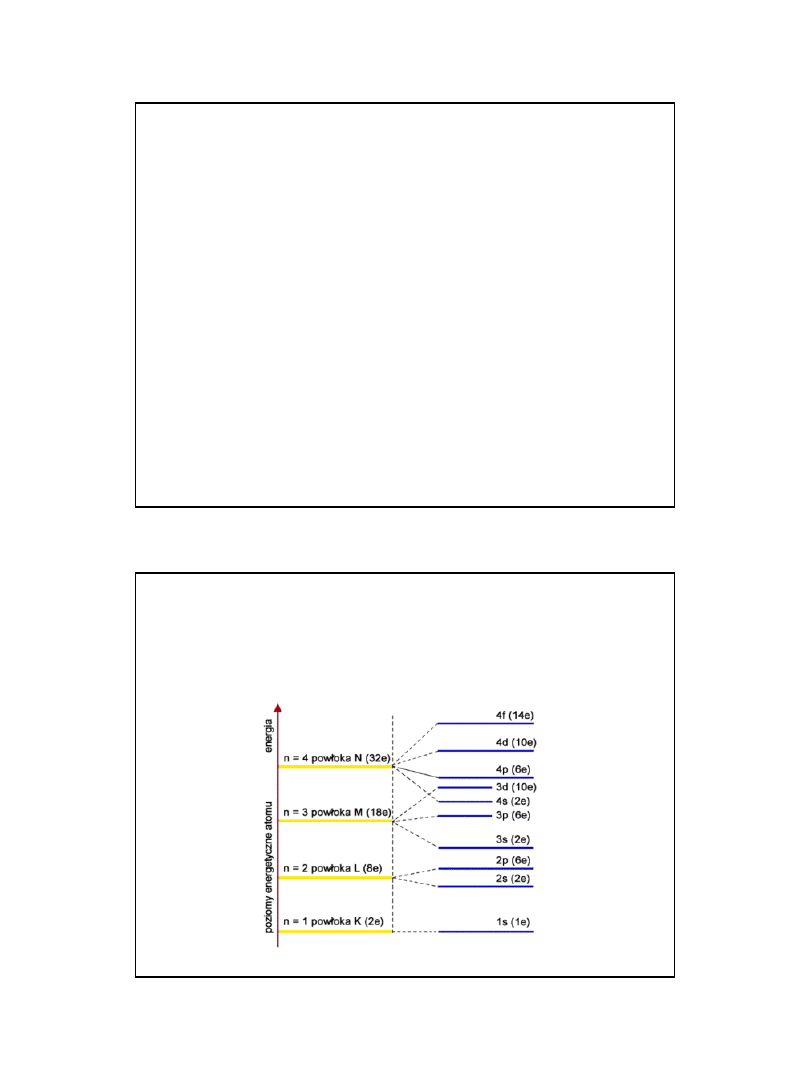
Rozkład poziomów
energetycznych powłok
elektronowych w atomie
2009-11-24
16
Konfiguracja elektronowa
pierwiastków
[
1
H] = 1s
1
[
2
He]
= 1s
2
[
3
Li] = 1s
2
2s
1
= [
2
He] 2s
1
[
4
Be] = 1s
2
2s
2
= [
2
He] 2s
2
[
5
B] = 1s
2
2s
2
2p
1
= [
2
He] 2s
2
2p
1
[
6
C] = 1s
2
2s
2
2p
2
= [
2
He] 2s
2
2p
2
[
7
N] = 1s
2
2s
2
2p
3
= [
2
He] 2s
2
2p
3
[
8
O] = 1s
2
2s
2
2p
4
= [
2
He] 2s
2
2p
4
[
9
F] = 1s
2
2s
2
2p
5
= [2He] 2s
2
2p
5
[
10
Ne]
= 1s
2
2s
2
2p
6
Okres IV
[
19
K] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
= [
18
Ar] 4s
1
[
20
Ca] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
= [
18
Ar] 4s
2
[
21
Sc] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
1
= [
18
Ar] 3d
1
4s
2
[
22
Ti] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
2
= [
18
Ar] 3d
2
4s
2
[
23
V] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
3
= [
18
Ar] 3d
3
4s
2
[
24
Cr] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
5
= [
18
Ar] 3d
5
4s
1
(!
promocja elektronu)
[
25
Mn] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
5
= [
18
Ar] 3d
5
4s
2
[
26
Fe] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
6
= [
18
Ar] 3d
6
4s
2
[
27
Co] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
7
= [
18
Ar] 3d
7
4s
2
[
28
Ni] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
8
= [
18
Ar] 3d
8
4s
2
[
29
Cu] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
1
3d
10
= [
18
Ar] 3d
10
4s
1
(!promocja elektronu)
[
30
Zn] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
= [
18
Ar] 3d
10
4s
2
[
31
Ga] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
1
= [
18
Ar] 3d
10
4s
2
4p
1
[
32
Ge] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
2
= [
18
Ar] 3d
10
4s
2
4p
2

2009-11-24
17
Lantanowce
[
54
Xe] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
[
57
La] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
6s
2
5d
1
= [
54
Xe] 5d
1
6s
2
[
58
Ce] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
6s
2
4f
2
= [
54
Xe] 4f
2
6s
2
[
59
Pr] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
6s
2
4f
3
= [
54
Xe] 4f
3
6s
2
[
60
Nd] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
6s
2
4f
4
= [
54
Xe] 4f
4
6s
2
[
61
Pm] = 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
6s
2
4f
5
= [
54
Xe] 4f
5
6s
2
Wyszukiwarka
Podobne podstrony:
Chemia III sem
wzory laborek I część, Polibuda (MiBM), Semestr III, III semestr, od Arniego, 3 semester, sebastiano
bioorganiczna, uj chemia III, III rok
CHEMIA III
chemia pod powloka
mock-exam-chemia-B2-2013, uj chemia III, III rok
klucz do biochemii, uj chemia III, III rok
CHEMIA III, Technika Rolnicza i Leśna, Semestr 1, Chemia i Materiałoznawstwo, Sprawozdania (chemia)
Bioorganiczna pytania, uj chemia III, III rok
Chemia III, Semestr 1, Chemia laboratorium, chemia budowlana sprawozdania, Chemia Budowlana, Chemia
elektra-sciaga maku-1, Polibuda (MiBM), Semestr III, III semestr, od Arniego, 3 semester, sebastiano
Chemia III sem
wzory laborek I część, Polibuda (MiBM), Semestr III, III semestr, od Arniego, 3 semester, sebastiano
SPRAWOZDANIE Z CWICZENIA NR 4, Technologia zywnosci, semestr III, chemia zywnosci
pytania leki, Płyta farmacja Poznań, III rok, Chemia leków, egzamin
Zadania treningowe do ćwiczeń rachunkowych z chemii - kolokwium III, Studia, Moje, Chemia
Narkotyczne leki przeciwbólowe, Farmacja, III rok farmacji, Chemia leków
więcej podobnych podstron