Chemia
Woda bromowa
Nasycony roztwór wodny bromu; ma kolor jasnobrązowy (ze względu na barwę bromu - brązowobrunatnej cieczy). Wytrząsana z ciekłym węglowodorem nienasyconym odbarwia się, gdyż brom zostaje przyłączony (reakcja addycji) do wiązań wielokrotnych, a że jego stężenie w wodzie jest niewielkie, najczęściej następuje całkowite odbarwienie warstwy wodnej.
Zostaje odbarwiona również przez aldozy, służy do odróżnienia ketoz (nie ulegają reakcji z woda bromową) od aldoz.
Woda chlorowa
Wodny roztwór gazowego chloru Cl2, dodana do roztworu bromków lub jodków powoduje wyparcie ich z soli i przeprowadzenie jonów w postać pierwiastkową (reakcje redoks):
Cl2 + 2KBr = 2KCl + Br2 aq
Powstające żółte (Br) lub brunatne (I) zabarwienie pozwala przy pomocy tej reakcji wykrywać w roztworach obecność jonów tych fluorowców
Woda wapienna
Jest to nasycony roztwór wodorotlenku wapnia Ca(OH)2, który stosunkowo słabo rozpuszcza się w wodzie, mimo że jest silnym elektrolitem; (wapień → wapno palone → wapno gaszone: woda wapienna)
Jodyna
3% roztwór jodu w alkoholu etylowym. Brunatna ciecz o silnych właściwościach odkażających, ze względu na połączenie odkażających właściwości etanolu i silnie utleniających właściwości jodu.
Płyn Lugola
Roztwór jodu (1%) w wodnym roztworze jodku potasu (2% KI). Jodek potasu tworzy z jodem kompleksowe powiązanie rozpuszczalne w wodzie. KI + I2 = KI3 aq. ("wodny" roztwór jodu)
Reakcja ksantoproteinowa
Reakcja białka ze stężonym kwasem azotowym (V). Powstaje trwałe żółte (ksanto..) zabarwienie. Reakcja charakterystyczna dla białek (...proteinowa ) zawierających w swojej strukturze ugrupowania aromatyczne (powstaje pochodna nitrowa o żółtej barwie).
Reakcja dysproporcjonowania
Często występuje w grupie aldehydów (R—CHO). Dwie cząsteczki aldehydu reagują między sobą, przy czym jedna utlenia się do kwasu kosztem drugiej, która redukuje się do alkoholu:
R-CHO + R-CHO + H2O = R-CH2OH + R-COOH
Ogólnie reakcja, w której dwie cząsteczki tego samego związku, będąc na pośrednim stopniu utlenienia, reagują ze sobą w reakcji redoks, przy czym jedna utlenia się kosztem drugiej (która rzecz jasna ulega redukcji), np.:
4S0 = 3S2- + S6+
Reakcja Würtza
Chlorowcopochodne węglowodorów alifatycznych w reakcji z metalicznym sodem odłączają dwa atomy chloru, które z sodem tworzą 2NaCl, zaś łańcuchy węglowodorowe łączą się w miejscach odłączenia chloru, dając węglowodory o dłuższym łańcuchu. Gdy reakcja Würtza przebiega w mieszaninie kilku węglowodorów o różnej długości łańcucha otrzymujemy mieszaninę produktów powstałych przez przebieg reakcji elementarnych we wszystkich możliwych kombinacjach.
Podobny efekt można otrzymać przez elektrolizę kwasów karboksylowych bądź ich soli.
Reakcja biuretowa
W obecności wiązania peptydowego niebieskie zabarwienie zasadowego roztworu soli miedzi przechodzi w barwę fioletową. Reakcja głównie stosowana do wykrywania białka. Nazwa jej bierze się stąd, że reakcji tej ulega również biuret, w którym występuje wiązanie peptydowe.
Mocznik
Diamid kwasu węglowego CO(NH2)2 ; z kwasem azotowym daje trudno rozpuszczalny biały osad. Występuje w moczu; poprzez kondensację z wydzieleniem cząsteczki amoniaku otrzymuje się biuret (dimocznik)
Biuret
dimocznik, produkt kondensacji dwóch cząsteczek mocznika. Ze względu na wiązanie peptydowe (NH2-CO-NH-CO-NH2) ulega reakcji biuretowej
Silny elektrolit
elektrolit, którego stopień dysocjacji α = 1 (w odróżnieniu od elektrolitów słabych praktycznie całkowicie zdysocjowany, nawet w roztworach o dużym stężeniu).
Słaby elektrolit
to taki, który jedynie w roztworach bardzo silnie rozcieńczonych (o stężeniu nieskończenie małym) jest całkowicie zdysocjowany. W roztworach praktycznie stosowanych stopień dysocjacji jest mniejszy od jedności. Jego roztwory można charakteryzować stałą dysocjacji (stałą równowagi odwracalnej reakcji dysocjacji)
Stała dysocjacji
wartość stała dla danej reakcji dysocjacji (dotyczy elektrolitów słabych!), nie zależy od stężenia a jedynie od temperatury roztworu. Wiąże stężenia produktów reakcji (jonów; w liczniku) i substratów (cząsteczek niezdysocjowanych; w mianowniku). Poprzez prawo rozcieńczeń wiąże się ze stopniem dysocjacji.
dla reakcji
Dysocjacja
Zjawisko rozpadu cząsteczki zawierającej wiązanie jonowe na poszczególne jony pod wpływem polarnego rozpuszczalnika, który wnikając pomiędzy atomy powiązane elektrostatycznym wiązaniem jonowym i solwatując powstałe jony utrzymuje elektrolit w roztworze w postaci jonowej. Silne elektrolity są zdysocjowane całkowicie, słabe tylko w pewnym stopniu (dynamiczna równowaga form jonowych i niezdysocjowanych cząsteczek - stała dysocjacji)
Prawo rozcieńczeń Ostwalda
wstawiając we wzorze na stałą dysocjacji K w miejsce stężeń produktów (jonów) i substratów wartości, które wynikają z uwzględnienia stopnia dysocjacji α, otrzymujemy wzór wiążący stopień dysocjacji α ze stałą dysocjacji K.
Stała równowagi reakcji odwracalnych
stała, charakteryzująca reakcję odwracalną; ułamek zawiera w liczniku iloczyn stężeń produktów (w potęgach zgodnych ze współczynnikami stechiometrycznymi reakcji), a w mianowniku iloczyn stężeń substratów (też w odpowiednich potęgach) występujących w stanie równowagi reakcji
Szybkość reakcji
Wielkość przyrost stężenia produktów (lub ubytku stężenia substratów) odbywająca się w czasie nieskończenie krótkim.
Ponieważ chwilowa szybkość reakcji jest proporcjonalna do stężeń (lub ciśnień dla reakcji w stanie gazowym), a te zmieniają się w sposób ciągły w czasie trwania reakcji, nie wyznacza się dla reakcji wartości szybkości (bo ta jest zmienna) lecz wartość zwaną stałą szybkości reakcji. Szybkość reakcji definiuje się zatem jako różniczkę dc/dt (zmianę stężenia produktów w nieskończenie krótkim czasie).
Dla reakcji odwracalnych szybkość reakcji substratów w kierunku produktów z upływem czasu maleje, zaś rosnące stężenia produktów powodują wzrost szybkości reakcji przeciwnej. W stanie równowagi szybkość reakcji w kierunku produktów jest równa szybkości reakcji biegnącej od produktów do substratów (reakcji odwrotnej)
Stała szybkości reakcji
Stała charakterystyczna dla danej reakcji i danych warunków, określa "bezwzględną" szybkość reakcji.
Sens fizyczny: wartość szybkości danej reakcji, gdy molowe stężenia każdego z substratów jest równe 1 mol/l.
V= k [A]a[B]b...[X]x
Punkt izoelektryczny
Wartość pH roztworu, w którym dany aminokwas (lub białko) ma wypadkowy ładunek elektryczny równy zero (tworzy jon obojnaczy)
Aminokwasy (białka) w swojej strukturze zawierają zarówno grupę kwasową jak i aminową (zasadową). Mogą zatem wykazywać charakter kwaśny (odłączać proton grupy karboksylowej) jak i zasadowy (przyłączać proton do grupy aminowej). Przy pewnym pH roztworu (zwanym punktem izoelektrycznym i charakterystycznym dla danego związku) cząsteczka związku jest elektrycznie obojętna, bowiem ujemny ładunek zdysocjowanej grupy karboksylowej jest zrównoważony dodatnim ładunkiem protonowanej grupy aminowej - powstaje jon obojnaczy, elektrycznie obojętny.
Przy pH o wyższej wartości niż punkt izoelektryczny danego związku (roztwór bardziej zasadowy) cząsteczki będą anionami (dysocjacja kwasowa będzie przeważać nad protonowaniem grupy aminowej); dla pH o niższej wartości (roztwór bardziej kwaśny) cząsteczki będą kationami.
We wszystkich przypadkach w roztworze będą także obecne cząsteczki obojętne niezdysocjowane, bowiem aminokwasy są słabymi elektrolitami.
Reakcja zmydlania
Reakcja zasadowej hydrolizy estrów. Nazwę bierze z technologii otrzymywania mydła kosmetycznego - gotowania tłuszczu zwierzęcego z ługiem. Ponieważ głównym składnikiem tłuszczu są glicerydy kwasów tłuszczowych (estry) a otrzymany produkt zwany mydłem to głównie sole sodowe bądź potasowe kwasów tłuszczowych, nazwę zmydlanie rozciągnięto na wszystkie reakcje zasadowej hydrolizy estrów, a nazwę mydła na wszystkie sole wyższych kwasów tłuszczowych.
Mutarotacja
Zjawisko zmiany w czasie (muta..) wielkości kąta skręcenia (..rotacja) płaszczyzny światła spolaryzowanego przez roztwór α-glukozy bądź β-glukozy.
Cząsteczka glukozy (cukier gronowy) w formie pierścieniowej może występować w dwóch konfiguracjach (zwanych α i β, formy anomeryczne). W roztworach wodnych następuje przejście części cząsteczek o konfiguracji α w cząsteczki o konfiguracji β. Podobnie po rozpuszczeniu formy β przechodzi ona częściowo w formę α. Tak więc, bez względu na to czy stworzymy roztwór α-glukozy (skręcalność właściwa +111°) czy β-glukozy (skręcalność właściwa +19°) po pewnym czasie w roztworze ustali się równowaga między tymi formami i roztwór będzie wykazywał skręcalność pośrednią między skręcalnością α-glukozy a β-glukozy. Nastąpi więc zmiana skręcalności (mutarotacja ) roztworu.
Inwersja sacharozy
Zjawisko zmiany znaku kąta skręcalności płaszczyzny drgań światła spolaryzowanego roztworu sacharozy, spowodowane kwaśną hydrolizą sacharozy.
Sacharoza (skręcalność dodatnia, +66°) pod wpływem ogrzewania z kwasami hydrolizuje, dając w wyniku hydrolizy równomolową mieszaninę glukozy (+) i fruktozy(-) (cukier inwertowany). Ponieważ wartość bezwzględna skręcalności właściwej fruktozy jest większa niż glukozy, cały roztwór skręca płaszczyznę polaryzacji światła w lewo, czyli odwrotnie (inwersja ) niż wyjściowy roztwór sacharozy.
Chiralność
Zjawisko występowania izomerii geometrycznej, polegającej na istnieniu odmian, które mają się do siebie jak odbicia lustrzane (lewa i prawa ręka) i nie da się ich nałożyć na siebie. Cząsteczki chiralne zawierające asymetryczny atom węgla (atom połączony z czterema różnymi podstawnikami) są najczęściej związkami optycznie czynnymi, tzn. powodują skręcenia płaszczyzny światła spolaryzowanego.
Racemat
Otrzymując poprzez syntezę związki, dla których istnieje izomeria optyczna, najczęściej otrzymujemy równomolową mieszaninę enancjomerów (odmian D i L), czyli optycznie nieczynny racemat. Dzieje się tak skutkiem statystycznej identyczności każdego z czterech wiązań węgla asymetrycznego. W naturze związki optycznie czynne syntezowane są poprzez specyficzne reakcje enzymatyczne co powoduje precyzyjne określenie produktu reakcji. Reakcje zachodzące w przyrodzie często są wykorzystywane do przemysłowego otrzymywania odpowiednich odmian (leki!) związków optycznie czynnych (biotechnologia). Rozdzielenie racematu na optycznie czynne składniki jest bardzo trudne, ze względu na praktyczną identyczność chemicznych, fizycznych i fizykochemicznych właściwości poszczególnych odmian izomerycznych
Forma mezo-
Optycznie nieczynna cząsteczka substancji o symetrycznej budowie i zawierająca dwa (ogólniej - parzystą liczbę) węgle asymetryczne, o takiej konfiguracji, że jedna z symetrycznych połówek ma przeciwną konfiguracje niż druga, wobec czego ich skręcalności się nawzajem znoszą
izomeria optyczna kwasu winowego
Diastereoizomery
Izomery optyczne nie będące enancjomerami (dla związków zawierających parę węgli asymetrycznych), np. przy np. trzech węglach asymetrycznych cząsteczki izomeryczne mają konfigurację:
L,L,L; L,D,L; L,L,D; L,D,D; D,D,D; D,L,D; D,D,L; D,L,L (ogólnie 2n; gdzie n-ilość węgli asymetrycznych).
Pary L,L,L i D,D,D L,D,L i D,L,D L,L,D i D,D,L oraz L,D,D i D,L,L to enencjomery (lustrzane odbicia), natomiast wszelkie inne zestawienia należą do diastereoizomerów - czyli izomerów o różnej wartości skręcalności, nie będących jednocześnie enancjomerami
Skręcalność
Zjawisko skręcania przez roztwór substancji optycznie czynnej (zawierającej węgiel asymetryczny) płaszczyzny drgań światła spolaryzowanego.
Wiązka światło niespolaryzowanego drga we wszystkich kierunkach prostopadłych do kierunku rozchodzenia się tej wiązki. Po przejściu przez ośrodek o odpowiedniej budowie (np. kryształ dwójłomny - kryształ szpatu islandzkiego CaCO3) drgania te zostają uporządkowane w jednym kierunku zwanym płaszczyzną polaryzacji
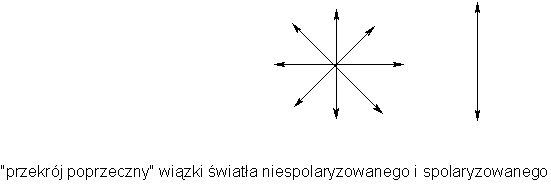
Światło spolaryzowane (pryzmat Nicola) przebiegając koło atomu cząsteczki, oddziałuje z polem elektrycznym i magnetycznym tego atomu (jest przecież falą elektromagnetyczną), co powoduje skręcenie jego płaszczyzny polaryzacji. W roztworach substancji nie podlegających izomerii optycznej, ze względu na symetrie poszczególnych elementów cząsteczki światło na swojej drodze spotka praktycznie taką samą ilość elementów skręcających płaszczyznę polaryzacji w prawo co i skręcających ją w lewo. W sumie światło po przejściu przez roztwór będzie drgać w tej samej płaszczyźnie.
W roztworze izomerycznej odmiany o określonej konfiguracji światło na swojej drodze spotyka tylko jeden układ przestrzenny (biorąc pod uwagę tylko węgiel asymetryczny) powodujący skręcenie płaszczyzny w jedną konkretną stronę.
Wiązanie jonowe
Wiązanie między atomami o dużej różnicy elektroujemności (>1,4). Jego nietrwałość prowadzi do zjawiska dysocjacji w roztworach polarnych. Różni się od wiązań atomowych tym, że siła wiążąca atomy nie pochodzi ze wspólnoty pary elektronów (jak w wiązaniach atomowych, kowalencyjnych), lecz wyłącznie oddziaływania elektrostatycznego między atomem akceptora elektronów (bardziej elektroujemny atom wiązania) a donorem (atom o ładunku dodatnim).
Wiązanie wodorowe
Forma łączenia się cząsteczek (także w roztworach), pośrednia między oddziaływaniem dipolowym a słabym wiązaniem atomowym. Występuje w przypadku cząsteczek posiadających wodór związany z silnie elektroujemnym pierwiastkiem, w atomie którego występują wolne pary elektronowe (N, O, S,..). Spolaryzowany dodatnio wodór jednej cząsteczki oddziałuje z ujemno naładowanym atomem, donorem pary elektronowej, tworząc wiązania wodorowe. Siły wiązań wodorowych są na tyle słabe, że w roztworach rozpadają się pod wpływem rozcieńczania, są jednak na tyle silne, że wyraźnie manifestują swoją obecność poprzez zmianę właściwości fizykochemicznych i fizycznych substancji.
Izomeria cis-trans
Izomeria cząsteczek, w których można określić jakąś płaszczyznę, w stosunku do której podstawniki tej cząsteczki leżą po dwóch stronach, a brak symetrii uniemożliwia nałożenie obu form na siebie poprzez proste przemieszczenia w przestrzeni. Taką płaszczyzną może być płaszczyzna podwójnego wiązania (płaszczyzna orbitali p tworzących wiązanie π) lub pierścień. 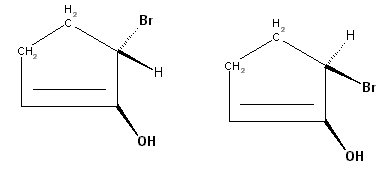
Karbid
Węglik wapnia można otrzymać przez prażenie tlenku wapnia z koksem 2CaO + 5C = 2CaC2 + CO2
Wiązania peptydowe
Wiązanie między grupą karboksylowa jednego aminokwasu a grupą aminową drugiego. Występuje w peptydach i białkach. Wykrywamy go reakcją biuretową, która stanowi podstawowa reakcję wykrywania białek i peptydów.
Mydła
Sole wyższych kwasów tłuszczowych (m.in. produkt zmydlania tłuszczu). Mydła sodowe i potasowe należą do mydeł rozpuszczalnych; ich właściwości czyszczące polegają na emulgowaniu nierozpuszczalnego w wodzie brudu (szczególnie tłustego) i tym sposobem pozwalają usunąć go przy pomocy wody.
Mydła wapniowe i magnezowe są w wodzie nierozpuszczalne. Stosuje się je m.in. w farmacji jako substancje pomocnicze. Wypadający, w czasie używania mydeł rozpuszczalnych w twardej wodzie, osad to właśnie mydła wapniowe i magnezowe powstające na skutek reakcji łączenia się anionów kwasu tłuszczowych (z mydeł rozpuszczalnych) z jonami Mg2+ i Ca2+, które są obecne w wodzie głównie w postaci soli kwasu węglowego.
Elektroforeza
Zjawisko migracji białek (ogólnie - cząstek koloidalnych obdarzonych ładunkiem) pod wpływem pola elektrycznego Może służyć do rozdzielania mieszaniny białek, np. pochodzenia naturalnego (białka surowicy krwi) w celach diagnostycznych i badawczych. Roztwór białek w buforze o odpowiednim pH (patrz punkt izoelektryczny!) nanosi się na pasek bibuły, na końcach którego przykłada się określone napięcie stałe. Poszczególne białka wędrują do anody lub katody z różnymi szybkościami, co jest spowodowane głównie różnymi wartościami mas molowych (cięższe białka wędrują wolniej). Po pewnym czasie trwania zjawiska mieszanina białek zostaje rozfrakcjonowana wzdłuż paska bibuły i poszczególne składniki mogą być identyfikowane i badane.
Technika elektroforezy może być stosowana do rozdzielania wszelkich cząsteczek i cząstek koloidalnych posiadających ładunek elektryczny.
Cukier inwertowany
Sacharoza jest dwucukrem zbudowanym z cząsteczki glukozy i fruktozy. Wiązanie łączące glukozę z fruktozą ulega pod wpływem silnych kwasów (np. H2SO4) hydrolizie, i przyłączając cząsteczkę wody odtwarza wolne monocukry. Związane z tą reakcją jest zjawisko zwane inwersją sacharozy, a polegające na zmianie znaku skręcalności roztworu sacharozy (+), gdyż w powstałej równomolowej mieszaninie cukrów fruktoza silniej skręca płaszczyznę polaryzacji w kierunku (-) niż glukoza (+) i cały roztwór przyjmuje skręcalność ujemną, czyli po reakcji znak skręcalności roztworu zmienia się na przeciwny (inwersja).
Wosk
Nazwa wosk nie określa jednego indywiduum chemicznego, lecz służy raczej do określenia wszystkich substancji i materiałów o właściwościach fizycznych zbliżonych do wosku pszczelego (np. wosk ziemny - węglowodory!!).
Wapno palone
Tlenek wapnia - CaO. Powstaje przez prażenie (palenie) węglanu wapnia CaCO3 (główny składnik wapienia), służy do wyrobu cementu oraz zaprawy murarskiej, która po pewnym czasie twardnieje na skutek reakcji:
CaO + CO2 (z powietrza) = CaCO3
Znajduje także zastosowanie w procesie otrzymywania cukru z buraków (proces defekacji).
Wapno gaszone
Produkt reakcji tlenku wapnia (wapna palonego) z wodą (gaszenie wapna palonego) CaO + H2O = Ca(OH)2
Zastosowanie analogiczne jak wapno palone - służy do wyrobu zaprawy murarskiej, która po pewnym czasie twardnieje na skutek reakcji Ca(OH)2 + CO2 (z powietrza) = CaCO3 + H2O, oraz cementu. Znajduje także zastosowanie w procesie otrzymywania cukru z buraków (proces defekacji).
Gips
Minerał, CaSO4.2H2O. Ogrzewany w temperaturze 80-140°C traci wodę, przechodząc w tzw. gips palony 2CaSO4.H2O. Gips palony znajduje zastosowanie praktyczne (gips handlowy), bowiem po zmieszaniu z wodą tworzy dość szybko krzepnącą masę, zwiększając jednocześnie swoją objętość (doskonały do odlewów i wypełniania ubytków) i wydzielając dość duże ilości ciepła.
Kreda
Węglan wapnia CaCO3; jako sól słabego kwasu węglowego wydziela dwutlenek węgla i wodę pod wpływem działania silniejszych kwasów, np. kwasu solnego.
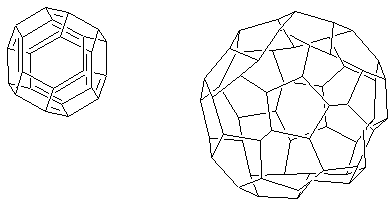
Alotropia węgla
Występowanie węgla w kilku różnych postaciach fizycznych: diament, grafit, fulereny, nanorurki, grafeny.
Diament - forma krystaliczna o hybrydyzacji sp3 (tetraedrycznej), najtwardszy minerał, nie przewodzi prądu elektrycznego (dokładniej: wykazuje właściwości półprzewodników)
Grafit, forma o hybrydyzacji sp2 (heksagonalny); tworzy płaszczyzny skondensowanych pierścieni aromatycznych, dość słabo powiązanych między sobą, miękki, przewodzi dobrze prąd elektryczny ("szczotki" węglowe w rotorach silników elektrycznych) ze względu na sekstety elektronów w układzie heksagonalnym atomów węgla (elektrony orbitali p)
Fulereny, wiązania podobne jak w graficie, tworzy jednak przestrzenne struktury przypominające piłkę futbolową:
Hybrydyzacja
Powstawanie nowych orbitali przez uśrednienie energii składowych orbitali różnego typu (najczęściej s i p)
sp3 - z połączenia i uśrednienia energii orbitalu s i trzech orbitali p otrzymujemy układ tetraedryczny, z jądrem węgla wewnątrz tetraedru i wiązaniami skierowanymi do jego czterech wierzchołków (teoretyczny kąt między wiązaniami 109,5°).
sp2 - z połączenia i uśrednienia energii orbitalu s i dwóch orbitali p otrzymujemy układ trzech zhybrydyzowanych orbitali ułożonych na płaszczyźnie (trzy punkty zawsze wyznaczają płaszczyznę) pod kątem 120° pomiędzy nimi. Pozostały, trzeci orbital p (nie biorący udziału w hybrydyzacji) jest prostopadły do płaszczyzny trzech zhybrydyzowanych. Niezhybrydyzowane orbitale p tworzą wiązanie typu π wiązania podwójnego.
sp - z połączenia i uśrednienia energii orbitalu s i orbitalu p otrzymujemy układ dwóch zhybrydyzowanych orbitali ułożonych liniowo (diagonalnie); pozostałe dwa orbitale p leżą w płaszczyźnie prostopadłej do linii orbitali sp i tworzą między sobą kąt prosty. Niezhybrydyzowane dwa orbitale p tworzą wiązania typu π wiązania potrójnego.
Wiązania π i σ
Wiązania typu σ — silne wiązania powstające przez liniowe (współosiowe) nałożenie orbitali zhybrydyzowanych lub orbitali s.
Wiązania typu π — słabe wiązania powstające z częściowego pokrycia się przestrzeni orbitali p (osie orbitali równoległe). Odpowiedzialne za właściwości wiązań wielokrotnych związków nienasyconych. Patrz też: Wykrywanie węglowodorów i Reguła Markownikowa
Reguła Markownikowa i Zajcewa
Ponieważ w większości przypadków podstawniki przy atomie węgla są bardziej elektroujemne niż wodór, każde zastąpienie wodoru innym podstawnikiem prowadzi do zwiększenia niedoboru ładunku ujemnego na węglu i tym samym zwiększenia polaryzacji wiązania C-H, a w konsekwencji ułatwienia odłączenia wodoru. Reguła Zajcewa - w reakcji eliminacji wodór zostanie odłączony od tego atomu węgla, który posiada mniej atomów wodoru.
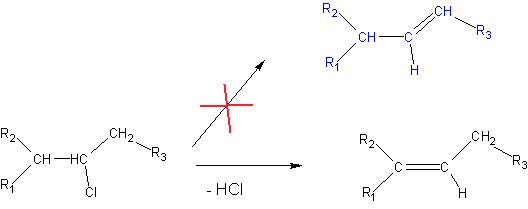
Im więcej atomów wodoru połączonych z danym węglem, tym mniej innych elektroujemnych podstawników, tym mniejszy niedobór ładunku na atomie węgla i łatwiejsze przyłączenie wodoru.
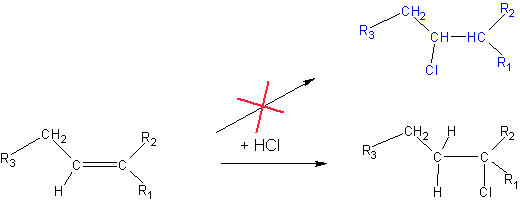
Reguła Markownikowa - w reakcji addycji wodór przyłącza się do atomu węgla zawierającego większą ilość atomów wodoru.
Wykrywanie węglowodorów nienasyconych
Opiera się na reakcjach charakterystycznych dla wiązań typu π (addycji, przyłączeniu). Należą tu reakcja z wodą bromową i kwaśnym, rozcieńczonym roztworem nadmanganianu potasu.
Woda bromowa wytrząsana z ciekłym węglowodorem nienasyconym odbarwia się, gdyż brom zostaje przyłączony (reakcja addycji) do wiązań wielokrotnych, a że jego stężenie w wodzie jest niewielkie, najczęściej następuje całkowite odbarwienie warstwy wodnej.
Fioletowy roztwór nadmanganianu potasu wytrząsany z węglowodorami nienasyconymi redukuje się i roztwór się odbarwia (reakcję przeprowadzamy w środowisku lekko zasadowym). Węglowodór pod utleniającym wpływem KMnO4 przechodzi w diol (alkohol dwuwodorotlenowy). Reakcję należy prowadzić ostrożnie, bowiem silny utleniacz jakim są jony nadmanganianowe może przeprowadzić reakcję utlenienia dalej, aż do kwasu (z przerwaniem wiązania podwójnego)
Fermentacja alkoholowa
Pod wpływem enzymu zymazy zawartego w drożdżach proste cukry: glukoza, fruktoza (składniki sacharozy) i mannoza ulegają biochemicznej przemianie prowadzącej do powstania alkoholu etylowego i CO2 wg reakcji:
Fermentację alkoholową można prowadzić także stosując jako substrat wielocukry (najczęściej skrobię, zawartą w ziemniakach lub zbożu), które przez enzymy zostają rozłożone na cukry proste, które następnie ulegają fermentacji.
W czasie fermentacji mogą powstawać w reakcjach ubocznych także niewielkie ilości innych związków (estrów, ketonów, kwasów organicznych).
Enzymy prowadzące fermentację zostają unieczynnione po osiągnięciu stężenia alkoholu etylowego około 15% (białka!). Aby otrzymać alkohol etylowy o wyższym stężeniu, oraz oddzielić go od pozostałych składników procesu fermentacji przeprowadza się wielokrotną destylację (rektyfikację), w wyniku której powstaje produkt zwany spirytusem rektyfikowanym.
Formalina
40% roztwór wodny aldehydu mrówkowego (metanalu), bezbarwnego gazu o charakterystycznym zapachu. Stosowana m.in. w garbarstwie i do konserwowania preparatów anatomicznych.
Konfiguracja D,L
Konfiguracja określa układ przestrzenny podstawników wokół węgla asymetrycznego. Przedstawienie przestrzennej konfiguracji trójwymiarowej cząsteczki na płaszczyźnie nie należy do rzeczy prostych. W celu uzyskania jednoznaczności w "płaskim" zapisie cząsteczek, przyjęto konwencję, zwaną projekcją Fischera, która przy założeniu, że atom asymetryczny leży w płaszczyźnie kartki, wiązania skierowane nad płaszczyznę (w kierunku obserwatora) nakazuje rysować w poziomie, zaś wiązania pisane pionowo oznaczają kierunek pod płaszczyznę kartki.
|
|
|
projekcja Fischera |
|
układ piramidy - hybrydyzacja sp3 |
|
|
|
Punktem odniesienia ("wzorcem") dla określenia konfiguracji D, L jest aldehyd glicerynowy. Aby określić konfigurację dowolnego związku, należy przeprowadzić myślowo przekształcenie grup aldehydu glicerynowego (czterech podstawników przy węglu asymetrycznym) tak, by bez rozrywania wiązań łączących te grupy z centrum asymetrii otrzymać oznaczany związek. Dany izomer oznaczanego związku ma taką konfigurację, jak wyjściowy aldehyd glicerynowy. Dla aldehydu glicerynowego arbitralnie określono konfiguracje D i L jak niżej:
|
—CHO |
|
|
|
—H |
|
|
|
—OH |
|
|
|
—CH2—OH |
|
|
|
aldehyd D - (+) - glicerynowy |
aldehyd L - (-) - glicerynowy |
|
|
|
|
|
|
|
|
|
Ponieważ taki sposób określania konfiguracji względnej D, L może prowadzić niekiedy do sprzecznych wyników, stosuje się także określanie konfiguracji bezwzględnej (R, S)
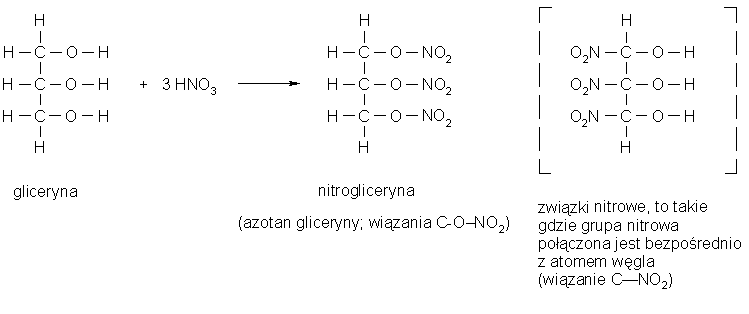
Nitrogliceryna
Nazwa nitrogliceryny powstała w momencie gdy nieznana była jeszcze jej struktura, a że otrzymano ją przez działanie stężonego kwasu azotowego na glicerynę sądzono, że jest to pochodna nitrowa. W rzeczywistości jest to ester gliceryny (alkohol) i kwasu azotowego:
Mieszanina nitrująca
Kwas azotowy reagując z stężonym kwasem siarkowym, który odciąga od niego cząsteczkę wody, wytwarza jon nitroniowy (NO2+), który łatwo reaguje - szczególnie z węglowodorami aromatycznymi - prowadząc do powstania związków nitrowych, tzn. takich, w których grupa nitrowa -NO2 jest połączona z atomem węgla przez bezpośrednie wiązanie węgla z azotem.
Rzędowość
Dla atomów węgla określona ilością połączeń bezpośrednich z innymi atomami węgla:
Rzędowość alkoholi określa rzędowość atomu węgla, z którym połączona jest grupa hydroksylowa.
alkohole I rzędowe utleniają się do aldehydów;
alkohole II rzędowe utleniają się do ketonów ;
Rzędowość amin określona jest ilością węgli połączonych z azotem grupy aminowej:
Laktamy
Cykliczne związki powstałe przez wewnętrzną kondensację (-H2O) alifatycznych γ i δ aminokwasów:
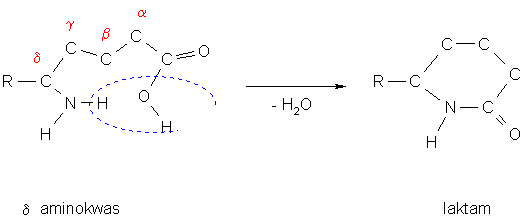
powstawanie szkieletu laktamu
Laktony
Wewnętrzne, cykliczne estry γ i δ hydroksykwasów
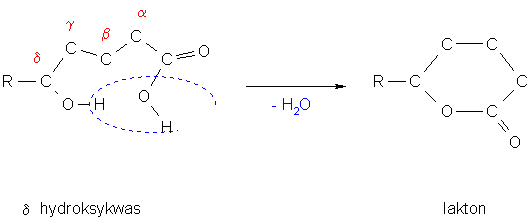
powstawanie szkieletu laktonu
Podstawniki I i II rodzaju
Klasyfikacja podstawników pierścienia aromatycznego oparta na kryterium elektroujemności podstawnika względem elektroujemności pierścienia aromatycznego.
Podstawniki I rodzaju to takie, których elektroujemność jest mniejsza od elektroujemności pierścienia i w związku z tym część ładunku ujemnego podstawnika zostaje przeniesiona do pierścienia aromatycznego (najczęściej główna część ładunku pochodzi z tzw. wolnych par elektronowych).
Podstawniki II rodzaju to takie, których elektroujemność jest większa od elektroujemności pierścienia i w związku z tym część ładunku ujemnego pierścienia aromatycznego zostaje przeniesiona do podstawnika.
Jak widać na powyższych schematach, dyslokacja ładunku ujemnego w cząsteczce zawierającej podstawiony pierścień aromatyczny prowadzi do wzrostu ładunku ujemnego w pozycjach o- lub p- (podstawniki I rodzaju), lub do zmniejszenia ładunku ujemnego w tych pozycjach (podstawniki II rodzaju). W tym drugim przypadku efektem wypadkowym jest względne zwiększenie ładunku ujemnego w pozycji m- (przez zmniejszenie ładunku w pozycjach pozostałych). Jedną z konsekwencji takiego rozłożenia ładunków w pierścieniu jest kierowanie się następnego podstawnika elektrofilowego w pozycje o- i p- w przypadku pierścienia z podstawnikiem I rodzaju lub w pozycję m-, gdy mamy do czynienia z pierścieniem podstawionym podstawnikiem II rodzaju (tam bowiem jest największa względna wartość ładunku ujemnego).
Reakcje kondensacji
Reakcje łączenia się dwóch cząsteczek w większą cząsteczkę, z jednoczesnym wydzieleniem prostej cząsteczki
(np. estryfikacja: kwas + alkohol = ester + woda), np.:
otrzymywanie estrów
powstawanie biuretu (dimocznika)
Polimery
Polimery (gr. poli - wiele, meres - części) są związkami wielkocząsteczkowymi, powstałymi przez połączenie wielu jednakowych cząsteczek (merów) - mówimy wówczas o polimerach, lub różnych cząsteczek (merów) - wówczas jest mowa o kopolimerach. Jeżeli reakcją otrzymywania polimeru jest reakcja kondensacji mówimy o polikondensacji. Najprostszą cząsteczką polimeru jest dimer (złożony z dwóch merów). Cząsteczki o stosunkowo niewielkim stopniu polimeryzacji (ilości merów w cząsteczce) nazywamy oligomerami. W przyrodzie występują polimery naturalne (skrobia, celuloza, polipeptydy,...). Polimery otrzymane przemysłowo nazywamy tworzywami sztucznymi (PCV, polietylen, sztuczny kauczuk, polistyren, poliuretan itp.). Właściwości fizyczne i chemiczne polimerów są zazwyczaj całkowicie inne niż tworzących ich merów. Substancjami łatwo polimeryzującymi są substancje zawierające wiązania wielokrotne.
Kopolimery
Polimer powstały z połączenia co najmniej dwóch różnych merów. Może być zbudowany wg określonej sekwencji występowania poszczególnych merów (uporządkowany) lub poszczególne mery łączą się ze sobą w przypadkowej kolejności.
Solwatacja
Odgrywa wielką rolę w procesie rozpuszczania substancji polarnych i dysocjacji elektrolitów. Pojedyncze cząsteczki bądź jony zostają w roztworze polarnym otoczone cząsteczkami rozpuszczalnika, które tworzą warstwę solwatacyjną, utrudniającą ponowne połączenie się jonów w cząsteczkę czy cząsteczek rozpuszczonych w kryształ.
Asocjacja
Związki, w cząsteczkach których występują silne centra ładunku ujemnego i dodatniego tworzą asocjaty, (nawet jeśli cząsteczka jako całość nie ma zbyt dużego momentu dipolowego, ze względu na niewielką odległość centrum ujemnego od dodatniego) często pozostające trwałymi nawet w roztworach o dużym rozcieńczeniu. Do związków silnie asocjujących należą głównie: woda, alkohole, fenole, kwasy karboksylowe. Powstawanie asocjatów w tych grupach związków manifestuje się znacznie wyższą temperaturą wrzenia, niż inne związki o podobnej masie cząsteczkowej, stanem skupienia i parametrami fizykochemicznymi.
Dekarboksylacja
Odłączenie od związku dwutlenku węgla, najczęściej pod wpływem temperatury (prażenie węglanów; ogrzewanie soli kwasów organicznych) lub w procesie elektrolizy soli i kwasów organicznych
Tautomeria
Zjawisko izomerii, polegające na istnieniu w równowadze dwóch form danego związku, powstających przez przemieszczenie się pojedynczego atomu w obrębie cząsteczki; np. keton-enol R1-CH2-CO-R2 ↔ R1-CH=C(OH)-R2
W reakcji przyłączenia wody do acetylenu otrzymać powinniśmy alkohol winylowy (enol - alkohol z grupą OH przy węglu z podwójnym wiązaniem); otrzymujemy natomiast aldehyd octowy. Dzieje się tak za sprawą zjawiska tautomerii - w tym przypadku zwanej ogólnie enolowo-ketonową:
przykład z acetylenem:
(enol)
Substytucja elektrofilowa i nukleofilowa
Substytucja (reakcja podstawienia) elektrofilowa SE występuje wówczas, gdy czynnik podstawiający się ma charakter kationu (np. jon nitroniowy NO2+ ) i "szuka" w cząsteczce miejsca o dużej gęstości ładunku ujemnego (jest elektrofilowny). W przypadku przeciwnym, gdy atakujący element ma nadmiar ładunku ujemnego i atakuje w cząsteczce miejsca o obniżonym ładunku ujemnym ("odsłonięte" jądro atomowe - nucleus) mówimy o substytucji nukleofilowej SN.
Reakcje charakterystyczne z CuSO4
Siarczan(VI) miedzi(II) bezwodny jest bezbarwny, uwodniony (CuSO4.8H2O) i w roztworach ma barwę niebieską. Najbardziej charakterystyczne reakcje to:
1. wypadanie czerwonego osadu tlenku miedzi(I) w wyniku reakcji redukcji zasadowego roztworu soli miedzi (de facto Cu(OH)2) przez aldehydy
2. powstawanie fioletowego zabarwienia pod wpływem reakcji ze związkami zawierającymi wiązanie peptydowe (wykrywanie białka, reakcja biuretowa)
3. reakcja z diolami (alkoholami dwuwodorotlenowymi); dwie grupy -OH leżące przy sąsiednich węglach (wicinalne) tworzą z cząsteczką CuSO4 addukt o charakterze kompleksu i fiołkowym zabarwieniu
Reakcja wykrywania skrobi
bardzo czuła i charakterystyczna reakcja, stosowana także przy miareczkowaniu w jodometrii. Minimalna ilość wolnego jodu z niewielką nawet ilością rozpuszczonej skrobi daje intensywne, niebieskie (przy większych stężeniach przechodzące w granatowe) zabarwienie roztworu.
Redukcja KMnO4
nadmanganian potasowy, jako silny utleniacz redukuje się w reakcjach z różnymi reduktorami, przy czym tworzy różne produkty redukcji, w zależności od pH przeprowadzonej reakcji.
W roztworach kwaśnych (najczęstszy przypadek) przechodzi w sól manganu 2+; w środowisku obojętnym redukuje się do Mn4+, wypadając z roztworu w postaci brunatnego osadu MnO2 (braunsztyn); w środowisku zasadowym redukuje się do zielonych soli manganianów Mn6+ (MnO42-) (w obecności nadmiaru KMnO4) lub do MnO2.
Lustro srebrowe
reakcja lustra srebrowego polega na redukcji zasadowego roztworu soli srebra do srebra metalicznego, które osiadając na szklanych ściankach probówki tworzy lustrzaną powłokę. Reakcja służy głównie do wykrywania aldehydów i cukrów redukujących (z grupy aldoz)
Wskaźnik uniwersalny
różne związki będące wskaźnikami pH (alkacymetrycznymi) przyjmują zabarwienie zależne od wartości pH. Wskaźnik uniwersalny (np. w postaci paska bibuły nasyconego roztworem odpowiednio dobranej mieszaniny wskaźników o różnym zakresie pH i kolorze zabarwienia) zmienia zabarwienie w sposób ciągły pozwalając, w przybliżeniu do 1 jednostki, określić pH badanego roztworu. Barwa wskaźnika zmienia się od ciemnoczerwonej dla roztworów silnie kwaśnych do żółtej dla bliskich obojętności po zielone i fioletowe dla silnie alkalicznych odczynów.
Barwa płomienia
sole niektórych pierwiastków pod wpływem wysokiej temperatury (np. po wprowadzeniu danej soli do płomienia palnika) zaczynają emitować światło o charakterystyczna dla siebie barwie, powodując zabarwienie płomienia. Np.:
Na - żółty Ca - ceglastoczerwony Ba - zielony K - fioletowy
Stopień dysocjacji
określenie, w postaci procentowej lub ułamka dziesiętnego, względnej ilości cząsteczek zdysocjowanych. Ze stałą dysocjacji łączy go prawo rozcieńczeń. Dla silnych elektrolitów wynosi zawsze 1, dla elektrolitów słabych zmienia się wraz z rozcieńczeniem i temperaturą. W rozcieńczeniach nieskończenie dużych także dla słabych elektrolitów wynosi 1.
Iloczyn jonowy wody
ponieważ stopień dysocjacji wody α jest bardzo mały (rzędu 0,0000002%), można przyjąć, że wartość stężenia molowego cząsteczek niezdysocjowanych jest stała (C) i wzór na stałą dysocjacji przekształcić następująco:
a ponieważ iloczyn dwóch stałych (stałej dysocjacji wody K i stałego praktycznie stężenia wody niezdysocjowanej C ~ 55,5 mol/l) też jest wartością stałą, wyrażenie to, zwane iloczynem jonowym wody, jest stałe w stałej temperaturze i dla 25°C wynosi 10-14
Ponieważ - z definicji - roztwór obojętny to taki, który ma jednakowe stężenie jonów wodorowych i wodorotlenowych, w temperaturze 25°C stężenie jonów wodorowych wynosi 10-7, czyli jego pH wynosi 7.
Iloczyn rozpuszczalności
Ponieważ iloczyn rozpuszczalności w danej temperaturze jest wartością stałą, zwiększając w roztworze stężenie jednego z jonów tworzących słabo rozpuszczalną sól, której ten iloczyn dotyczy, powodujemy wytrącanie drugiego jonu w postaci nierozpuszczalnego osadu. Tym sposobem możemy doprowadzić do praktycznie całkowitego usunięcia jednego z jonów z roztworu. Ma to praktyczne znaczenie np. w analizie wagowej, gdy wytrącając całkowicie jeden z jonów w postaci nierozpuszczalnego osadu możemy poprzez jego zważenie określić ilość (stężenie) jonu w roztworze.
Np. mieszając stechiometryczne ilości roztworów NaCl i AgNO3 powodujemy wypadnięcie z roztworu trudno rozpuszczalnego osadu AgCl, w roztworze jednak pozostanie jeszcze 1,3.10-5 mol/l jonów srebrowych (1,4 mg w litrze roztworu!). Jeżeli teraz do litra takiego roztworu dodamy 0,1 mola NaCl (jonów Cl- ) stężenie i ilość jonów srebrowych zmniejszy się około 10 000 razy!! W roztworze pozostanie tylko około 0,2 μg.
Jeżeli w roztworze mamy dwa aniony tworzące nierozpuszczalne (trudno rozpuszczalne) sole z tym samym kationem (np. jon srebrowy daje osad zarówno z jonem chlorkowym jak i dwuchromianowym) to w pierwszej kolejności wypada osad soli trudniej rozpuszczalnej (charakteryzującej się mniejszym iloczynem rozpuszczalności) i dopiero po praktycznie całkowitym usunięciu pierwszego anionu, kolejne porcje zawierające wspólny kation powodują wypadanie osadu drugiej, lepiej rozpuszczalnej soli (wyższy iloczyn rozpuszczalności).
Określenie miejsca podstawienia
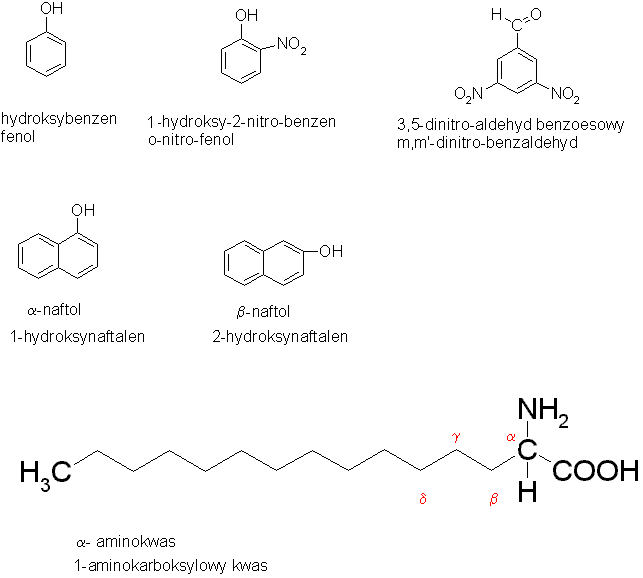
Określenie struktury izomerów odbywa się w zróżnicowany sposób, związany zarówno z ustaleniami IUPAC (nazewnictwo systematyczne), jak i z tradycją (określenia tradycyjne, historyczne, ogólnie stosowane).
Szczególnie mylące mogą być określenia izomeru przy pomocy greckich liter. Kolejne litery mogą zastępować kolejne liczby (jak w schematach powyżej), ale mogą również oznaczać dwie różne formy jak np. anomery glukozy.
Czasem poszczególne izomery mogą być nazywane określeniami potocznymi, jak np. alkohol tert- butylowy (t-butylowy) tzn. 2-metylo-2-propanol; alkohol izo- propylowy (i-propylowy) tzn. 2-propanol; czterochlorek węgla (tetrachlorometan), chloroform (trichlorometan) itp.
Chromian/dwuchromian potasu
sól kwasu chromowego(VI) K2CrO4 przechodzi w środowisku kwaśnym w dichromian(VI) (dwuchromian) potasu K2Cr2O7 zmieniając kolor z żółtego na pomarańczowy. Nie ulega przy tym zmianie stopień utlenienia chromu (+6) - nie jest to więc reakcja redoks!!
Dichromian potasu stosowany jest jako wskaźnik końca miareczkowania roztworu chlorków (Cl-) roztworem azotanu srebra (AgNO3). Wytrącający się w czasie miareczkowania biały osad chlorku srebra (AgCl) utrudnia zaobserwowanie końca miareczkowania, czyli momentu, od którego dodawane do roztworu krople roztworu AgNO3 nie powodują strącania osadu AgCl - bowiem wszystkie zawarte w roztworze jony Cl- zostały strącone.
Dodanie pod koniec miareczkowania niewielkiej ilości roztworu dwuchromianu powoduje, że w momencie wytrącenia z roztworu wszystkich jonów Cl- następna kropla azotanu srebra wytrąca czerwony osad dwuchromianu srebra, bardzo wyraźnie sygnalizując tym sposobem zakończenie miareczkowania. Ze względu na wartości iloczynu rozpuszczalności chlorku srebra i dwuchromianu srebra, ten ostatni może się wytrącić dopiero po praktycznie całkowitym wytrąceniu miareczkowanych jonów chlorkowych.
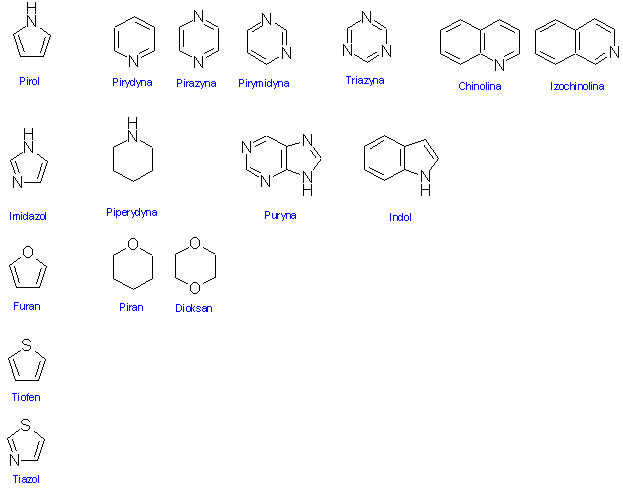
Związki pierścieniowe heterocykliczne
najważniejsze pierścienie heterocykliczne:
Wyszukiwarka
Podobne podstrony:
IZRAEL (WOS), WOS, WOK, Fizyka, Chemia i inne, WOK, WOS i PO
Modlitwa za kapłana, WOS, WOK, Fizyka, Chemia i inne, Religia
Pos±g Zeusa w Olimpi (WOK), WOS, WOK, Fizyka, Chemia i inne, WOK, WOS i PO
Zadanie (Fizyka), WOS, WOK, Fizyka, Chemia i inne, Fizyka
Nieodwracalnosc zjawisk i entropia (Fizyka), WOS, WOK, Fizyka, Chemia i inne, Fizyka
WOK (funkcje sztuki) i PO (bronie masowego razenia), WOS, WOK, Fizyka, Chemia i inne, WOK, WOS i PO
EPIGRAFIKA, Studia, matura, nauka i inne takie
matura BIBLIOGRAFIA, Inne
3. PROTISTY, MATURA, Biologia matura, notatki, 1. INNE ORGANIZMY (Notatki-BIOLOGIA)
Pisanie pracy naukowej, Studia, matura, nauka i inne takie
2004-12-01 - odp, Matura, matura, Chemia - Matura, Chemia - matura testy
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
alkohole - zadania, Matura, Chemia, zadania z organicznej
2002, matura 2002 Chemia rozszerzona arkusz2 odpowiedzi
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
więcej podobnych podstron