BOROWCE
Borowiec |
5B |
13Al |
31Ga |
49In |
81Tl |
Konfiguracja elektronowa ns2np1 |
[He] 2s22p1 |
[Ne] 3s23p1 |
[Ar] 4s24p1 |
[Kr] 5s25p1 |
[Xe] 6s26p1 |
E.I. [kJ·mol-1] |
800,6 |
577,6 |
578,8 |
558,4 |
589,3 |
Promień kowal. [pm] |
90 |
143 |
141 |
166,5 |
171 |
Promień jonowy [pm]2 |
25 |
53 |
61 |
76 |
89 |
Temp. topn. [oC] |
2300 |
660,4 |
29,8 |
156,6 |
304 |
Rozpowszech. litos. [%] |
1.10-3 |
7,45 |
2.10-3 |
1.10-5 |
3.10-4 |
Elekroujemność (Pauling) |
2,0 |
1,6 |
1,8 |
1,8 |
2,01 |
E3+(aq) + 3e = E(s) |
|
-1.66 |
-0.55 |
-0.33 |
0.743 |
-
1) Tl3+ 2)Dla E3+(Lk = 4) 3) Dla Tl+(aq) + e = Tl(s) E0 = -0.34 V
Główne stopnie utlenienia tych pierwiastków +3, (+1).
Mały promień jonowy oraz duży ładunek jonu powodują, że wiązania są w dużym stopniu kowalencyjne. Związki z deficytem elektronów.
Bor. Minerały: kwas borowy, w niektórych źródłach wulkanicznych. Kernit Na2B4O7.4H2O, boraks Na2B4O7.10H2O, kolemanit Ca2B6O11.5H2O.
Bor - otrzymywany przez redukcję:
B2O3 + 3Mg → 2B + 3MgO
Otrzymujemy brązowy proszek o czystości 98 %.
Czysty bor otrzymujemy przez termiczny rozkład BI3:
2BI3 → 3I2 + 2B
lub przez redukcję BCl3 (katalizator tantal, 900 oC):
2BCl3 + 3H2 → 6HCl + 2B
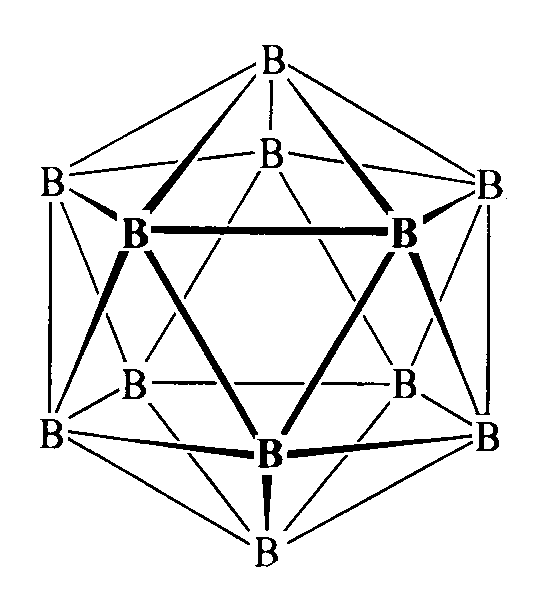
Bor tworzy trzy odmiany alotropowe, bor α (romboedryczny), bor β (romboedryczny) i bor tetragonalny. Kryształy kowalencyjne.
Odmiany te to (B12)n. Składają się z ikosaedrów B12 różnie połączonych.
Wyłącznie cechy niemetaliczne. Podobny do krzemu. Lk = 3 i lk = 4. Nie rozszerza oktetu. Tworząc trzy wiązania kowalencyjne nie osiąga konfiguracji oktetu. W związkach z lk = 3 (BX3) jest typowym kwasem Lewisa. Mało reaktywny. Silnie podgrzany spala się na powietrzu do tlenku boru (III). Roztwarza się w stężonym kwasie azotowym dając kwas borowy H3BO3 napisz reakcję.
Związki tlenowe boru.
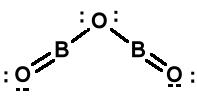
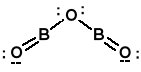
Tlenek boru (B2O3)n, biała szklista masa. Otrzymywanie przez odwodnienie kwasu borowego.
2H3BO3 → B2O3 + 3H2O
Wiązania kowalencyjne. Ciało stałe nie przewodzi prądu elektrycznego, także po stopieniu. W fazie gazowej monomeryczny B2O3.
Tlenek niemetalu. Łatwo reaguje z wodą
dając kwas borowy. Z alkaliami daje bora-
ny. Z alkoholami estry kwasu borowego.
B2O3 + 6C2H5OH 2B(OC2H5)3 + 3H2O
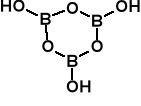
Kwas borowy H3BO3 Otrzymywany przez działanie na borany np. kernit silnym kwasem. Podaj odpowiednią reakcję dla boraksu.
Na2[B4O5(OH)4] · 2H2O + H2SO4 + H2O Na2SO4 + 4H3BO3
Krystaliczne ciało stałe. krystalizacja
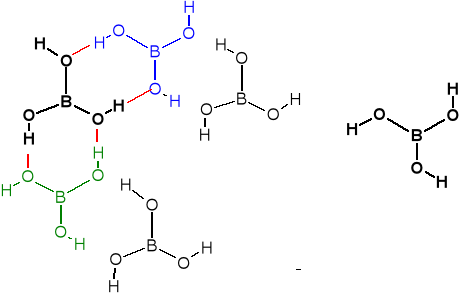
Warstwy poziome połą-
czone wiązaniami wodo-
rowymi.
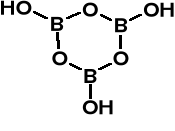
Odwadnianie prowadzi do kwasu α-metaborowego (HBO2)3, dalsze
odwodnienie prowadzi do (B2O3)n. Kryształy α-
HBO2 składają się z tych trimerów, połączonych
za pomocą wiązań wodorowych.
Są jeszcze inne (polimeryczne) modyfikacje: β-HBO2 (liniowe łańcuchy) i γ-HBO2 (struktura trójwymiarowa).
Właściwości kwasowe H3BO3. Słaby kwas jednozasadowy. Jest to raczej kwas Lewisa niż kwas Brønsted'a. K = 5,6 · 10-10. Dobrze rozpuszczalny.
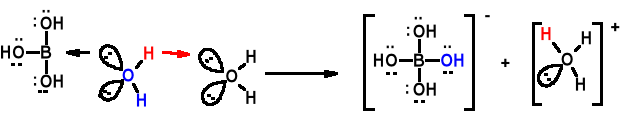
Podaj reakcję dysocjacji kwasu borowego we wodzie.
Badanie odczynu kwasu borowego. Trzeba mieć wodę destylowaną bardzo wysokiej czystości. Destylowaną w atmosferze bez CO2 i NH3 w aparaturze kwarcowej lub srebrnej.
Badamy błękitem bromotymolowym (kwaśny żółty - 6,0 pH 7,6 niebieski zasadowy). Barwa żółta.
Badamy drugi raz za pomocą oranżu metylowego (kwaśny czerwony - 3,2 pH 4,4 żółty zasadowy). Kolor żółty
Kwas borowy tworzy trwałe estry z 1,2-glikolami, np. glikolem etylenowym (HO-CH2-CH2-OH) lub gliceryną. Kompleksy te są silniejszymi kwasami niż H3BO3. Podobne Ka do kwasu octowego.
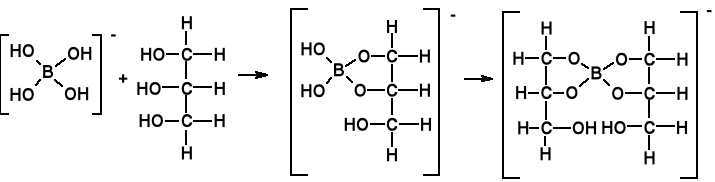
W obecności środków odwadniających (stężony kwas siarkowy) tworzy z alkoholami estry. H3BO3 + 3CH3OH → B(OCH3)3 + 3H2O
Ester ten pali się zielonym płomieniem.
Borany.
Proste sole np. Li[B(OH)4] ulegają w dużym stopniu hydrolizie i odczyn jest silnie alkaliczny. Odczyn soli pochodnych kwasów oligoborowych także alkaliczny. Boraks - fenoloftaleina czerwona.
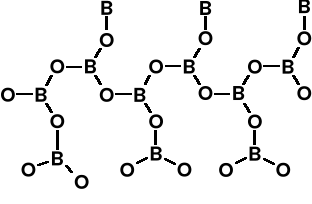
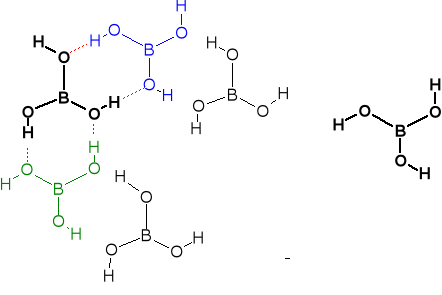
Większość soli i prawie wszystkie minerały boru to związki oksoboranowe, pochodzące od skondensowanych kwasów borowych. Zawierają one albo tetraedryczne układy BO4, albo trygonalne (płaskie) układy BO3.
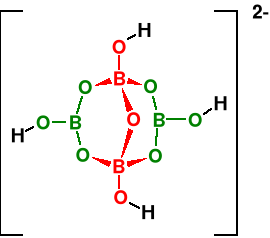
Minerał kernit Na2B4O7 · 4H2O =
Na2[B4O5(OH)4] · 2H2O. Anion ten ( w
boraksie lub kernicie zawiera 2 tetra-
edryczne jednostki [BO4] i 2 trygonalne
(płaskie) jednostki [BO3].
Najważniejszy minerał boraks Na2B4O7 · 10H2O = Na2[B4O5(OH)4]· 8H2O
Zastosowania: przemysł szklarski, analityka chemiczna, do lutowania, szkliwa i emalie oraz do produkcji peroksoboranów.
Halogenowe związki boru.
BF3 i BCl3 - gazy, BBr3 - ciecz, BI3 - ciało stałe. Płaskie monomeryczne cząsteczki.
B2O3 + 6HF → 3H2O + 2BF3
BF3 jest silnym kwasem Lewisa.
H3N: + BF3 → H3N:BF3
BF3 + HF → HBF4 - mocny kwas, znany tylko w roztworach.
Rozpuszczalność nadchloranów i fluoroboranów jest podobna.
BF3 ważny katalizator w reakcjach polimeryzacji i kondensacji związków organicznych (estryfikacja, Friedel-Crafts, polimeryzacja alkenów)
BCl3 łatwiej hydrolizuje niż BF3, jest także mocniejszym kwasem Lewisa, BCl3 + 3H2O → H3BO3 + 3HCl
Nie produkuje się go w bezpośredniej syntezie, lecz w reakcji poniżej.
B2O3 + 3C + 3Cl2 → 2BCl3 + 3CO
Związki boru z wodorem.
Borowodory (wg IUPAC borany)- zaliczamy do związków z deficytem elektronowym, ponieważ mamy więcej atomów ze sobą kowalencyjnie połączonych niż jest do dyspozycji par elektronowych. Są to związki o
specyficznych właściwościach. Pierwsze badania - Alfred Stock (Ka)
Nie ma monomerycznego BH3. Otrzymuje się jedynie jego dimer B2H6.
4BCl3 + 3LiAlH4 2B2H6 + 3LiAlCl4 (LiCl + AlCl3)
Przemysł: 2BF3 + 6NaH B2H6 + 6NaF (pod wysokim ciśnieniem)
Samozapalny na powietrzu. Gaz. Natychmiast hydrolizuje z wodą. Wydziela się wodór. Napisz reakcję hydrolizy diboranu.
Znane są addukty BH3 z zasadami Lewisa, n. p. H3B · OEt2, H3B · SMe2 i inne. Podaj wzory Lewisa tych adduktów.
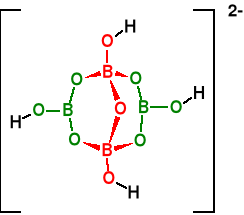
Istotnym adduktem jest BH4-
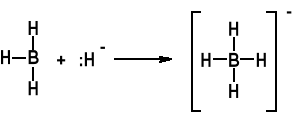
Ważny odczynnik NaBH4
B(OMe)3 + 4NaH NaBH4 + 3MeONa
Bezprądowe osadzanie metali, synteza
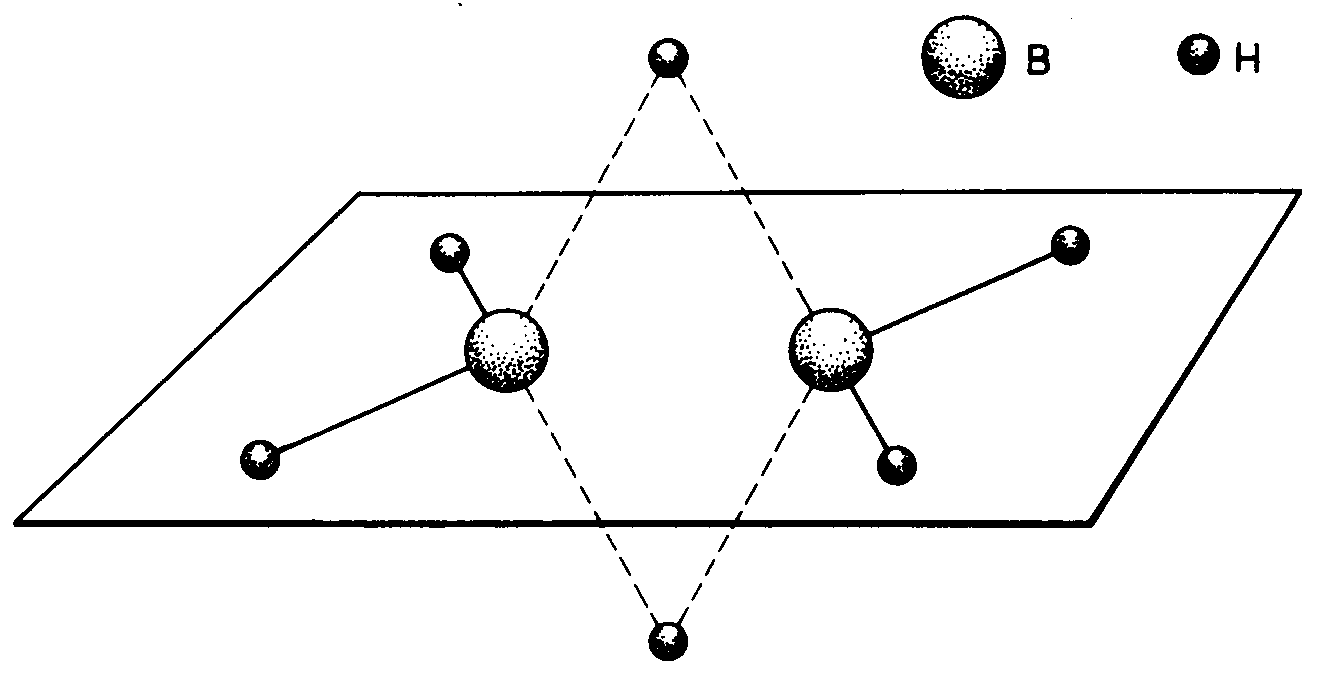
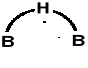
Opis wiązań w borowodorach - Lipscomb.
A B
Opis układu wiązań w B2H6: zupełnie inna budowa niż C2H6.
Dwa atomy boru o geometrii tetraedrycznej (sp3) i 6 atomów wodoru.
Razem 12e. 4 skrajne wiązania o symetrii σ(B-H) typu 1sH + sp3B
Liscomb oznacza je B—H
2 środkowe wiązania B—H—B: wiązania trójcentrowe przez nałożenie się (hybryda) sp3B1 + 1sH + sp3B2 obsadzone przez 1 parę elektronową.
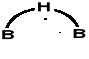
Wg Lipscomb'a i stąd obraz B (mostkowe wiązanie B-H-B)
Wiązanie B —H w trójcentrowym B-H-B
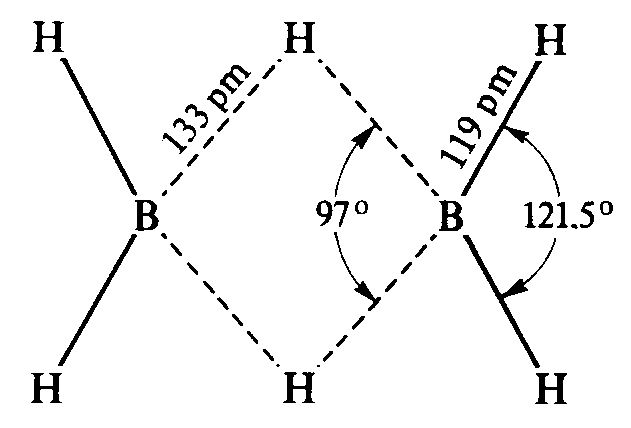
jest wyraźnie dłuższe niż zewnętrzne wią-
zanie σ(B-H).
GLIN
Bardzo rozpowszechniony, trzecie miejsce po tlenie i krzemie. Główny
składnik litosfery razem z tlenem i krzemem.
Minerały
Glinokrzemiany:
Skalenie (najbardziej rozpowszechnione glinokrzemiany): ortoklaz K[AlSi3O8],
Miki: muskowit [KAl2(OH)2][AlSi3O10]
Skalenie i miki stanowią składniki skał magmowych.
Materiały ilaste:
stanowiące produkty wietrzenia glinokrzemianów:
Kaolinit [Al2(OH)4][Si2O5] - przemysł ceramiczny, porcelana.
Montmorylonit, struktura warstwowa, napełniacz do polimerów.
Minerały tlenkowe:
Korund (rubin, szafir) Al2O3 , uwodniony Al(OH)3 hydrargilit, AlO(OH) - boksyt.
Inne ważne, Na3AlF6 - kriolit.
Produkcja glinu
1. Usuwanie zanieczyszczeń z boksytu (SiO2, tlenki żelaza)
Boksyt glinian sodu wodorotlenek tlenek
AlO(OH) a Na[Al(OH)4] b Al(OH)3 c Al2O3
metoda mokra NaOH około 160 oC
a) usuwanie SiO2 - wytrąca się Na2[Al2SiO6], usuwanie Fe2O3. Otrzymywanie glinianu sodu.
b) nasycanie glinianu sodu gazowym CO2 napisz reakcję
c) prażenie wodorotlenku glinu do 1200 ºC napisz reakcję
2. Elektroliza stopu Al2O3 (t.t. = 2323 oC ) z Na3[AlF6]( t.t. = 1000 oC)
Elektrody zbudowane są z grafitu.
Al2O3 → 2Al3+ + 3O2-
Anoda + 3O2- → 1½ O2 + 6e
C + ½O2 → CO
Katoda - 2Al3+ + 6e → 2Al
Srebrzysty metal, dobrze przewodzący prąd elektryczny. Ma olbrzymie
znaczenie techniczne. Stopy: duraluminium (2-5% Cu, 0,5-2% Mg, 0,5 -1,2% Mn i 0,2-1% Si), skleron (12 % Zn i 3% Cu), mangal (1,2% Mn)
Znakomite są stopy z dodatkiem litu (zycral)
Energicznie łączy się z tlenem
2Al + 1½ O2 → Al2O3 ΔHotw = - 1675 kJ·mol-1 pokaz
3Fe3O4 + 8Al → 4Al2O3 + 9Fe ΔHo = - 3396 kJ·mol-1 Goldschmidt
Fe2O3 + 2Al → Al2O3 + 2Fe Termit, aluminotermia pokaz
Mieszanina Na2O2 i Al (pył) zapala się pod wpływem wody.
3Na2O2 + 2Al + 2H2O → 2NaAlO2 + 4NaOH + * pokaz
Pasywacja - tworzenie cienkiej warstwy tlenków, także chrom i tytan.
Wegetacja glinowa, zniszczenie warstwy Al2O3.
2Al + 3HgCl2 → 3Hg↓ + 2AlCl3
Al tworzy z rtęcią stop zwany amalgamatem lub ortęcią.
2Al + 6H2O → 2Al(OH)3 + 3H2↑ pokaz
Reaguje z zasadami i z kwasami nieutleniającymi:
2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2 Właściwości
2Al + 6HCl 2AlCl3 + 3H2 amfoteryczne
Kwasy utleniające, stężony HNO3 i stężony H2SO4 pasywują powierzchnię glinu. Rozcieńczony H2SO4 i bardzo rozcieńczony HNO3 reagują.
2Al + 6HNO3 stęż. → Al2O3 + 6NO2↑ + 3H2O
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (Hg2+)
Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O (rozcieńczony)
Związki glinu z wodorem.
AlCl3 + 3LiH → 1/n (AlH3)n + 3LiCl
AlCl3 + 4LiH → Li[AlH4] + 4LiCl
Li[AlH4] + 4H2O → Al(OH)3 + LiOH + 4H2
Bardzo ważny odczynnik, Zastępuje wiązanie E - halogen wiązaniem E - wodór. Podaj reakcję chlorku fosforu (III) z Li[AlH4].
Tlenek i wodorotlenek glinu.
Tlenek - trudno topliwe ciało stałe, α -korund, bardzo mało reaktywny chemicznie. Aktywne tlenki glinu kalcynacja Al(OH)3 w 500-700 oC.
Wodorotlenek, bardzo słabe właściwości zasadowe i słabe kwasowe,
typowy amfoter.
Al2(SO4)3 + 6NH3 ⋅ H2O → 2Al(OH)3↓ + 3(NH4)2SO4
Galaretowaty osad.
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + NaOH → Na[Al(OH)4] powoli kondensuje
Na[Al(OH)4] + 2NaOH → Na3[Al(OH)6] nie kondensuje
Halogenki glinu. AlF3 - budowa jonowa. Trudno topliwy i trudno
rozpuszczalny. (AlCl3)n i (AlBr3)n - polimery molekularne, (nie jonowe), w stanie pary i w rozpuszczalnikach niepolarnych dimery.
(AlCl3)n t.t. = 190 °C, sublimuje pod obniżonym ciśnieniem.
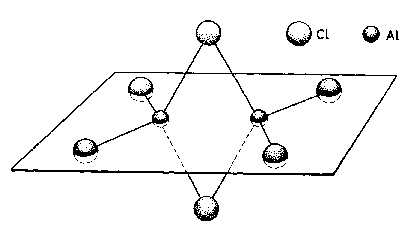
mostkujący Cl zasada Lewisa
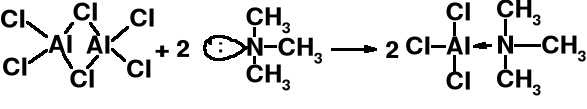
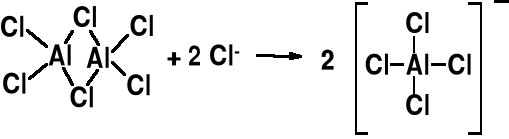
Silne kwasy Lewisa. Reagują z zasadami Lewisa np. (CH3)3N, H2O, Cl-. Katalizatory reakcji Friedel-Crafts.
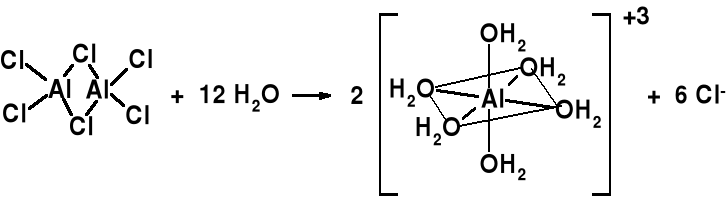
Z roztworu wodnego krystalizuje [Al(OH2)6]Cl3. Jon [Al(H2O)6]3+ zawarty jest w szeregu solach, jak np. azotany, chlorany (VII),
Siarczany. Odczyn takich soli glinu (III) - zdecydowanie kwaśny.
[Al(H2O)6]Cl3 [Al(H2O)5(OH)]Cl2 + HCl zapis cząsteczkowy
[Al(OH2)6]3+ + H2O [Al(OH2)5(OH)]2+ + H3O+ Ka = 1,12·10-5
Rozpuszczalne sole glinu: Chlorek, siarczan, azotan, chloran, octan.
Ważną solą jest Al2(SO4)3·18H2O. Papiernictwo, włókiennictwo.
Ałuny - sole o wzorze ogólnym M2SO4·M'2(SO4)3·24H2O - układ regularny np. K2SO4·Al2(SO4)3·24H2O.
GAL t.t.≅ 29,8 0C d = 5,9 g/cm3
Gal. Bardzo słabo rozpowszechniony w przyrodzie. Domieszki w blendzie cynkowej (ZnS) oraz w boksycie.
Niska temperatura topnienia. Do termometrów. Półprzewodnik GaAs.
Ga nie ulega utlenieniu na powietrzu w normalnych warunkach, ogrzewany daje Ga2O3. Metaliczny gal roztwarza się w kwasach i stężonych zasadach podobnie do glinu. Napisz odpowiednie reakcje.
Ga2O3 roztwarza się w kwasach i stężonych zasadach podobnie do glinu. Napisz odpowiednie reakcje.
GaF3 struktura jonowa.
(GaCl3)n (t.t. 78 oC) - polimer bardzo łatwo depolimeryzuje do dimeru. Silny kwas Lewisa 1/n (GaCl3)n + HCl → H[GaCl4]
Analogiczny akwajon w roztworze wodnym, hydrolizuje silniej niż glinowy. Jest to kwas średniej mocy, silniejszy niż [Al(OH2)6]3+
[Ga(OH2)6]3+ + H2O [Ga(OH2)5(OH)]2+ + H3O+ Ka = 2,5·10-3
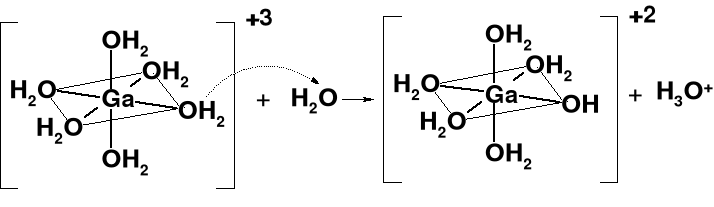
Oblicz pH 0,001M roztworu GaCl3.
Jeżeli kwas i zasada tworzące sól są bardzo słabe to sole takie ulegają w roztworze wodnym hydrolizie w bardzo dużym stopniu. Nie istnieją w roztworze wodnym nawet takie sole jak n. p. octan (dla glinu znany). Siarczek z pewnością we wodzie nie istnieje.
2Ga + 3S → Ga2S3 we wodzie Ga2S3 + 6H2O → 2Ga(OH)3 + 3H2S
Wodorotlenek galu ma właściwości amfoteryczne, podobnie jak glin.
Napisz przykładowe reakcje ilustrujące amfoteryczne właściwości tego związku.
Barwienie płomienia; Sole galu, zwłaszcza lotny GaCl3 barwią płomień palnika gazowego na kolor fioletowy.
IND - t.t. = 156,20C = 429,3K d = 7,31 g/cm3
Przy przeróbce blendy cynkowej.
In nie ulega utlenieniu na powietrzu w normalnych warunkach.
Ogrzany spala się do tlenku In2O3.
Właściwości halogenków indu (III) podobne do halogenków galu (III).
Wodorotlenek In(OH)3 właściwości amfoteryczne
In2(SO4)3 + 6NH3⋅H2O → 2In(OH)3↓ + 3 (NH4)2SO4 In(OH)3 + 3HCl st. → InCl3 + 3H2O
In(OH)3 + KOH st. → K[In(OH)4]
Sole indu, analogicznie jak sole glinu w roztworach wodnych ulegają hydrolizie:
[In(OH2)6]3+ + H2O [In(OH2)5(OH)]2+ + H3O+ Ka = 2,0·10-4
Barwienie płomienia; Sole indu barwią płomień palnika gazowego na kolor niebieskofioletowy. Badamy w strefie utleniającej płomienia.
TAL. tt. = 303,5 0C = 576,6K d = 11,83g/cm3
Tal - domieszki w pirycie. Twardość, barwa i tt. są podobne jak dla ołowiu.
Tl ulega utlenieniu na powietrzu w normalnych warunkach, czasami przechowuje się go pod naftą. Tal wystepuje w związkach na stopniu +1 i +3
Spalanie daje mieszaninę Tl2O3 i Tl2O. Łatwo roztwarza się w kwasie azotowym, zaś trudno w kwasie solnym i siarkowym.
Efekt nieczynnej pary elektronowej 6s2 6p1. Często tylko 6p1 tworzy wiązanie.
Związki Tl(III)
Tlenek brunatny, tylko właściwości zasadowe, słabe. Silnie ogrzewany
Tl2O3 O2 + Tl2O (czarny higroskopijny). Nie ma Tl(OH)3.
Halogenki TlX3 są bardzo różne od halogenków pozostałych metali z grupy borowców. TlCl3 silnie ogrzewany rozpada się na TlCl i Cl2. Jeszcze mniej trwały jest TlBr3.
Z wody krystalizują trwałe TlX3·4H2O (X = Cl i Br)
TlCl3: Tl2O3 + 6 HCl → 2 TlCl3 + 3 H2O Krystalizuje TlCl3·4H2O.
Napisz reakcję odwodnienia tego związku chlorkiem tionylu SOCl2.
Otrzymywanie związków talu (III) przez utlenienie związków talu (I).
2Tl+ + 2H2O2 + 2OH- → Tl2O3↓ + 3H2O brunatny
Związki talu (I), rozpuszczalne TlF, TlNO3, Tl2SO4, TlClO4
r (Tl+)= 154 pm, przypominają z jednej strony potas, r (K+) = 144 pm, wodorotlenek (żółty) - silna zasada rozpuszczalna we wodzie, węglan i siarczan także rozpuszczalne.
Z drugiej strony srebro (I), r (Ag+) = 127 pm, fluorek - rozpuszczalny, chlorek, bromek i jodek - nierozpuszczalne, siarczek oraz tlenek - nierozpuszczalne. TlCl - światłoczuły.
Strącanie siarczku talu (I) czarny
Tl2SO4 + (NH4)2S*) → Tl2S↓ + (NH4)2SO4
Siarczek talu (I) roztwarza się w HNO3; nie roztwarza się w Na2S i w CH3COOH. Napisz reakcję roztwarzania Tl2S w HNO3.
2. Strącanie halogenków talu (I)
Tl+ + HCl + H2O → TlCl↓ + H3O + biały, TlBr też biały.
Tl+ + I- → TlI ↓ żółty
Barwienie płomienia; Sole talu barwią płomień palnika gazowego na kolor zielony (szmaragdowozielony)
Związki talu są silnie trujące. Trucizna na szczury, środki na wypadanie włosów. Szkła optyczne. Wyposażenie do spektrometrów IR (TlI).
Mały promień jonowy oraz duży ładunek jonu powodują, że wiązania
E(hal)3 są w dużym stopniu kowalencyjne, niemniej Al, Ga, In i Tl tworzą w roztworach wodnych hydratowane jony E3+. W miarę wzrostu liczby atomowej wzrasta trwałość stopnia utlenienia (+1) - efekt biernej pary elektronowej.
1
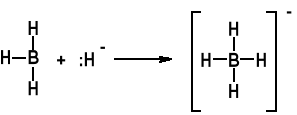
Wyszukiwarka
Podobne podstrony:
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
7-makroukłady TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
6-VSEPR TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
więcej podobnych podstron