ODDZIAŁYWANIA MIĘDZYCZĄSTECZKOWE
Gazy nawet typu He lub H2 można skroplić i nawet zestalić.
Woda H2O (m. cz. = 18) jest cieczą, H2S (m. cz. = 34) jest gazem.
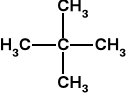
n-pentan C5H12 CH3-CH2-CH2-CH2-CH3 t. w. = 36 o C
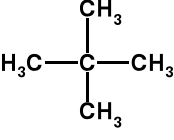
2,2-dimetylopropan C5H12 t. w. = 10 o C
ta sama masa cząsteczkowa co n-pentan
Jakie oddziaływania mają miejsce między cząsteczkami i co z nich wynika?
Typy oddziaływań międzycząsteczkowych
Siły dyspersyjne Londona (Van der Waalsa)
Typowa energia ~ 2 KJ · mol-1.
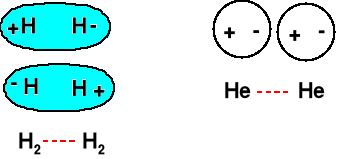
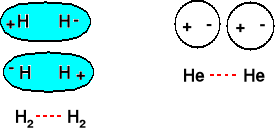
Nawet całkowicie niepolarne cząsteczki (N2, H2) i pojedyncze atomy (He, Ne) dają się skroplić lub zestalić.
Kiedy mówimy, że jakaś cząsteczka jest niepolarna, to rozumiemy, że uśredniony moment dipolowy wynosi 0. Ale on się zmienia w czasie. Przyczyna - fluktuacje chmur elektronowych.
Dwa chwilowe dipole się przyciągają. Ulegają temu oddziaływaniu wszystkie cząsteczki.
Oddziaływania najsłabsze,
ale addytywne. Dla długich
łańcuchów dość duże.
Im więcej elektronów w cząsteczce tym tego typu oddziaływania silniejsze. F2 - gaz, Cl2 - gaz, Br2 - ciecz, I2 - ciało stałe.
n-pentan C5H12 ruchliwa ciecz, n-pentadekan C15H32 - olej,
n-oktadekan C18H38 - woskowate ciało stałe.
Kształt cząsteczki - im bardziej „kulista” cząsteczka tym oddziaływania słabsze.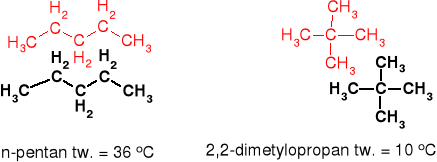
Oddziaływania dipol-dipol, dla substancji polarnych, trwałe ładunki cząstkowe sąsiednich cząsteczek oddziaływają między sobą.
Typowa energia ~ 2 KJ · mol-1. Jeżeli cząsteczki rotują (faza gazowa) to tylko ~ 0,3 KJ · mol-1. Skraplanie i zestalanie gazów polarnych jest częściowo spowodowane tym oddziaływaniem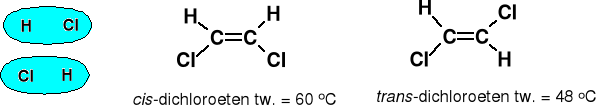
Oddziaływania dipol-dipol indukowany, oddziaływania raczej słabe, ale np. „ luźne związki CH4 z wodą ”, hydraty gazów szlachetnych (stosunkowo trwałe). Często ciecze i ciała stałe są utrzymywane razem przez te wszystkie siły razem. Nazywa się je wtedy siłami van der Waals'a.
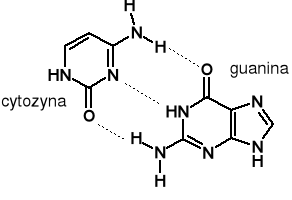
Wiązania wodorowe. Jest utworzone przez atom wodoru między dwoma małymi elektroujemnymi atomami (N, O i F)
Typowa energia ~ 20 KJ · mol-1. Najsilniejsze z oddziaływań międzycząsteczkowych. Ale entalpia wiązania H2 = 436 KJ · mol-1.
Temp. wrzenia (o C) - miara oddziaływań międzycząsteczkowych
HF (19,5), HCl (-84,2), HBr (-67,1), HI (-35,1)
H2O (100), H2S (-60,1), H2Se (-41,3), H2Te (-4,1).
NH3 (-34,5), PH3 (-87,7), AsH3 (-62,4), SbH3 (-18,4).
CH4 (-161,5), SiH4 (-118,8), GeH4 (-88,1), SnH4 (-52,5).
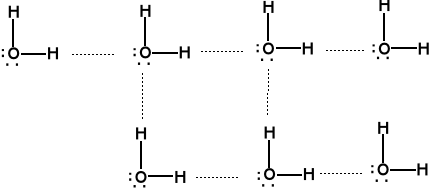
Woda - skomplikowany układ wiązań wodorowych
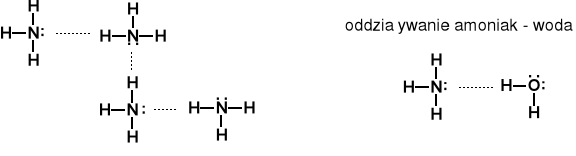
Podobnie amoniak
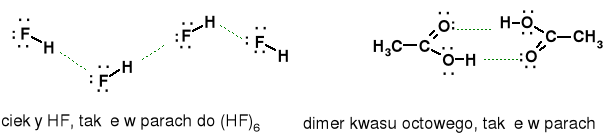
dobra rozpuszczalność HF we wodzie i alkoholu we wodzie.

Alk. etylowy (M.cz. 46) tw.=78,3 oC eter met. (M.cz. 46) tw.=-24 oC
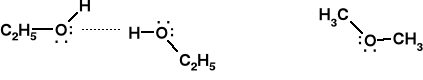
Przykłady biologiczne: drewno, białka, łańcuch DNA
Ciecze i CIAŁA STAŁE
Ciecze; atomy jony lub cząsteczki są blisko siebie, ściśliwość cieczy jest niewielka, ale oddziaływania międzycząsteczkowe pozwalają na niezależny ruch cząsteczek, jonów lub atomów wobec siebie.
Lepkość cieczy - wynik oddziaływań międzycząsteczkowych.
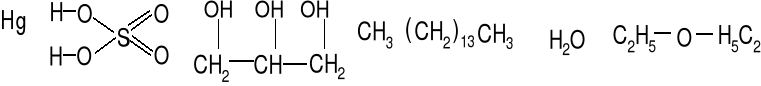
Rtęć, kwas siarkowy, gliceryna, pentadekan, woda, eter metylowy
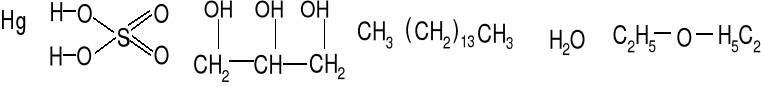
Napięcie powierzchniowe wynika z niezrównoważenia sił międzycząsteczkowych przy powierzchni cieczy (siły kapilarne, menisk).
Siły adhezji: oddziaływanie powierzchnia - cząsteczki w cieczy.
Siły kohezji: oddziaływanie cząsteczki w cieczy - cząsteczki w cieczy.

Ciała stałe; atomy jony lub cząsteczki są blisko siebie, oddziaływania międzycząsteczkowe nie pozwalają na niezależny ruch cząsteczek, jonów lub atomów wobec siebie. Ciała stałe dzielą się na:
bezpostaciowe (amorficzne) np. szkło, kauczuk, smalec, szkło kwarcowe.. Atomy, jony lub cząsteczki są rozmieszczone bezładnie.
krystaliczne np. chlorek sodu, metale, siarka rombowa, fosfor czarny, naftalen, kwarc. Atomy, jony lub cząsteczki są rozmieszczone w sposób uporządkowany tworząc sieć krystaliczną. Wykazują płaskie powierzchnie zwane ścianami kryształu.
ciekłe kryształy, właściwości pośrednie między cieczą a ciałem krystalicznym.
Ciała krystaliczne; podział ze względu na oddziaływania międzycząsteczkowe scalające kryształ.
Metale, scalone przez wiązanie metaliczne, pierwiastki bloków s, p i d. K, Ba, Au, Al., Fe, Pt. Kowalne, ciągliwe, przewodniki ciepła i prądu elektrycznego.
Jonowe, scalone przez przyciąganie się anionów i kationów. Sole, tlenki, wodorotlenki. NaCl, BaO, KOH, Twarde, sztywne, kruche, wysokie temperatury topnienia i wrzenia. Stopione oraz rozpuszczone we wodzie przewodzą prąd elektryczny.
Kowalencyjne, usieciowane przez oddziaływania kowalencyjne w całej objętości kryształu. Diament, kwarc, bor. Twarde, sztywne, kruche, wysokie temperatury topnienia i wrzenia, nierozpuszczalne we wodzie. W stanie stopionym nie przewodzą prądu elektrycznego
Molekularne, usieciowane przez oddziaływania międzycząsteczkowe typu dyspersyjne, dipol - dipol lub wiązanie wodorowe. P4, I2, lód, naftalen. Stosunkowo niskie temperatury topnienia i wrzenia, kruche.
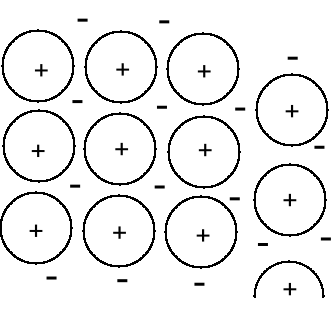
Metale.
Sieć przestrzenna zbudowana jest z jonów metalu otoczonych morzem elektronów, stąd połysk, kowalność, przewodnictwo elektronowe.
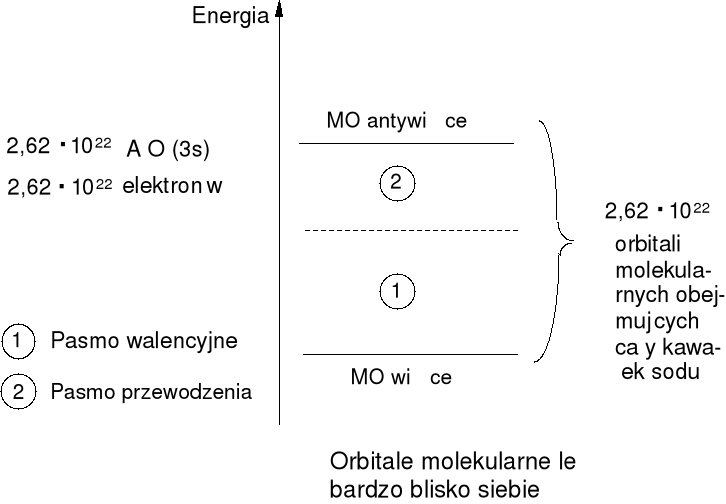
Pasmowa teoria ciała stałego.
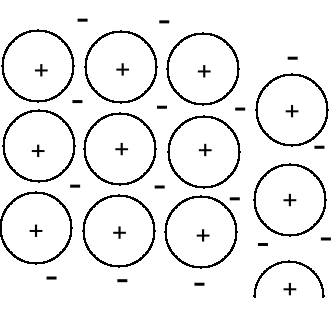
Jest to zastosowanie teorii orbitali molekularnych do makrocząsteczek. Rozpatrzmy ”cząsteczkę” składającą się z 1g sodu ( 1 mol Na = 23g) - 2,62 · 1022 atomów sodu co daje 2,62 · 1022 orbitali atomowych 3s z obsadzeniem 2,62 · 1022 elektronów. Tworzymy 2,62 · 1022 orbitale
molekularne, tylko około połowa obsadzona jest przez pary elektronowe.
![]()
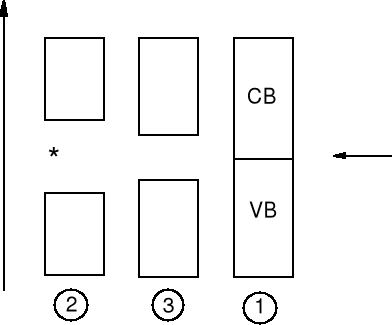
Przewodniki, izolatory, półprzewodniki
CB - pasmo przewodzenia
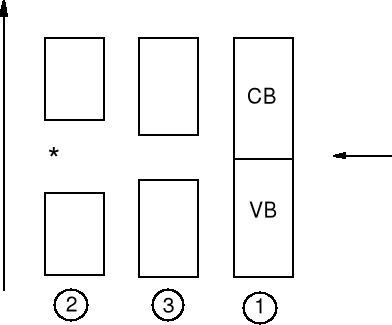
(conductivity band)
poziom Fermiego
(najwyższy poziom
obsadzony)
![]()
VB - pasmo walencyjne
(valence band)
Domieszkowanie półprzewodników, n arsen, p bor.
8
![]()
Wyszukiwarka
Podobne podstrony:
3-Wiązania TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
1-Wyklad TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
4-Wodór TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
6-VSEPR TECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
8-tlen, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
13-fluorowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
9-termochemiaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
10-wodaTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
11-dysocjacjaCHEM, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
15-azotowceTECHa, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
19-litowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
18-berylowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
17-borowceTECH, Technologia chemiczna PG, Chemia, I ROK, WYKŁADY, WYKŁADY
Konspekt2, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Konspekt3, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Konspekt1, Technoligia Chemiczna PWR, Chemia fizyczna, Wykład
Tłuszcze poniedziałek 12.00, Technologia chemiczna PG, Technologia Chemiczna PG, Sprawozdania IV rok
więcej podobnych podstron